Коллаген — Collagen — qaz.wiki
Структурный белок
Молекула тропоколлагена: три левых проколлагена (красный, зеленый, синий) соединяются, образуя правосторонний тройной спиральный тропоколлаген.Коллаген ( ɒ л ə dʒ ə п / ) является основным структурным белком во внеклеточном матриксе найдены в различных тела соединительной ткани . Как основной компонент соединительной ткани, это самый распространенный белок у млекопитающих, составляющий от 25% до 35% всего белка в организме. Коллаген состоит из аминокислот, связанных вместе, образуя тройную спираль удлиненных фибрилл, известную как спираль коллагена . В основном он содержится в соединительной ткани, такой как хрящи , кости , сухожилия , связки и кожа .
В зависимости от степени минерализации коллагеновые ткани могут быть жесткими (кость), податливыми (сухожилия) или иметь градиент от жесткого к податливому (хрящ). Коллаген также богат роговицей , кровеносными сосудами , кишечником , межпозвоночными дисками и дентином зубов.
Название « коллаген»
Типы
Более 90% коллагена в организме человека — это коллаген I типа . Однако по состоянию на 2011 год 28 типов коллагена были идентифицированы, описаны и разделены на несколько групп в зависимости от структуры, которую они образуют. Все типы содержат как минимум одну тройную спираль . Количество типов показывает разнообразную функциональность коллагена.
Все типы содержат как минимум одну тройную спираль . Количество типов показывает разнообразную функциональность коллагена.
- Фибриллярные (Тип I, II, III, V, XI)
- Нефибриллярный
- FACIT (фибриллы Associated Коллагенная с Прерванной Тройной Спиралью) (тип IX, XII, XIV, XIX, XXI)
- Короткая цепь (Тип VIII, X)
- Базальная мембрана (Тип IV)
- Мультиплексин (множественные домены тройной спирали с прерываниями) (тип XV, XVIII)
- MACIT (ассоциированные с мембраной коллагены с прерывистой тройной спиралью) (Тип XIII, XVII)
- Формирование микрофибрилл (Тип VI)
- Заякоренные фибриллы (Тип VII)
Пять наиболее распространенных типов:
Медицинское использование
Сердечные приложения
Коллагеновый скелет сердца, который включает четыре кольца сердечных клапанов , гистологически, эластично и однозначно связан с сердечной мышцей. Каркас сердца включает также разделяющие перегородки камер сердца — межжелудочковую перегородку и атриовентрикулярную перегородку . Вклад коллагена в измерение сердечной деятельности в целом представляет собой непрерывную крутящую силу, противоположную жидкостной механике артериального давления, исходящего из сердца. Коллагеновая структура, которая отделяет верхние камеры сердца от нижних камер, представляет собой непроницаемую мембрану, которая исключает как кровь, так и электрические импульсы с помощью обычных физиологических средств. При поддержке коллагена фибрилляция предсердий никогда не переходит в фибрилляцию желудочков . Коллаген наслоен различной плотности с гладкой мышечной массой. Масса, распределение, возраст и плотность коллагена — все это способствует податливости, необходимой для движения крови вперед и назад. Отдельные створки сердечных клапанов складываются в форму с помощью специального коллагена под переменным давлением . Постепенное отложение кальция в коллагене является естественной функцией старения. Кальцинированные точки в коллагеновых матрицах демонстрируют контраст в движущемся отображении крови и мышц, что позволяет методам технологии визуализации сердца достигать соотношений, по существу указывающих на поступление крови ( сердечный ввод ) и вывод крови ( сердечный выброс ).
Вклад коллагена в измерение сердечной деятельности в целом представляет собой непрерывную крутящую силу, противоположную жидкостной механике артериального давления, исходящего из сердца. Коллагеновая структура, которая отделяет верхние камеры сердца от нижних камер, представляет собой непроницаемую мембрану, которая исключает как кровь, так и электрические импульсы с помощью обычных физиологических средств. При поддержке коллагена фибрилляция предсердий никогда не переходит в фибрилляцию желудочков . Коллаген наслоен различной плотности с гладкой мышечной массой. Масса, распределение, возраст и плотность коллагена — все это способствует податливости, необходимой для движения крови вперед и назад. Отдельные створки сердечных клапанов складываются в форму с помощью специального коллагена под переменным давлением . Постепенное отложение кальция в коллагене является естественной функцией старения. Кальцинированные точки в коллагеновых матрицах демонстрируют контраст в движущемся отображении крови и мышц, что позволяет методам технологии визуализации сердца достигать соотношений, по существу указывающих на поступление крови ( сердечный ввод ) и вывод крови ( сердечный выброс ).
Косметическая хирургия
Коллаген широко используется в косметической хирургии в качестве лечебного средства для ожоговых пациентов при реконструкции костей и в различных стоматологических, ортопедических и хирургических целях. Коллаген человека и крупного рогатого скота широко используется в качестве кожных наполнителей для лечения морщин и старения кожи. Некоторые интересные места:
- При косметическом использовании есть вероятность аллергических реакций, вызывающих длительное покраснение; однако это может быть практически устранено простым и незаметным тестированием пластыря перед использованием в косметических целях.
- Большую часть медицинского коллагена получают из молодняка крупного рогатого скота (крупного рогатого скота) от сертифицированных животных, не содержащих BSE . Большинство производителей используют животных-доноров либо из «закрытых стад», либо из стран, в которых никогда не было зарегистрировано случаев BSE, таких как Австралия, Бразилия и Новая Зеландия.

Костные трансплантаты
Поскольку скелет формирует структуру тела, жизненно важно, чтобы он сохранял свою силу даже после переломов и травм. Коллаген используется при трансплантации костей, поскольку он имеет тройную спиральную структуру, что делает его очень прочной молекулой. Он идеально подходит для лечения костей, так как не нарушает структурную целостность скелета. Тройная спиральная структура коллагена предотвращает его расщепление ферментами, обеспечивает адгезию клеток и важна для правильной сборки внеклеточного матрикса.
Регенерация тканей
Коллагеновые каркасы используются для регенерации тканей, будь то губки, тонкие листы, гели или волокна. Коллаген обладает благоприятными свойствами для регенерации тканей, такими как структура пор, проницаемость, гидрофильность и стабильность in vivo. Коллагеновые каркасы также способствуют отложению клеток, таких как остеобласты и фибробласты , и, будучи вставленными, способствуют нормальному росту.
Реконструктивное хирургическое использование
Коллагены широко используются в создании искусственных заменителей кожи, используемых при лечении тяжелых ожогов и ран. Эти коллагены могут быть получены из коровьего, конского, свиного или даже человеческого происхождения; и иногда используются в сочетании с силиконами , гликозаминогликанами , фибробластами , факторами роста и другими веществами.
Лечение раны
Коллаген — один из ключевых природных ресурсов организма и компонент кожной ткани, который может принести пользу на всех этапах заживления ран . Когда коллаген становится доступным для ложа раны, может произойти закрытие. Таким образом, можно избежать ухудшения состояния раны, за которым иногда могут следовать такие процедуры, как ампутация.
Коллаген — это натуральный продукт, поэтому он используется в качестве натуральной повязки на рану и обладает свойствами, которых нет у искусственных повязок. Он устойчив к бактериям, что имеет жизненно важное значение для перевязки ран.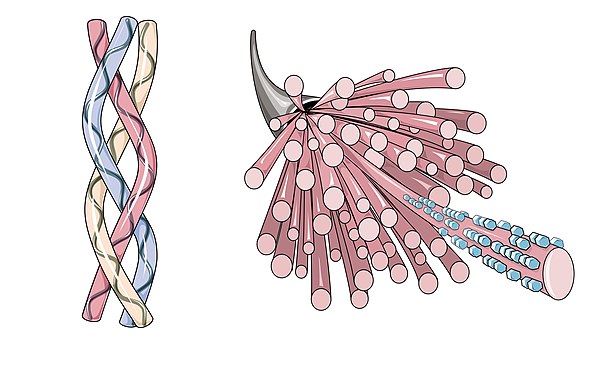
На протяжении четырех этапов заживления ран коллаген выполняет следующие функции при заживлении ран:
- Направляющая функция: коллагеновые волокна служат для направления фибробластов. Фибробласты мигрируют по матрице соединительной ткани.
- Хемотаксические свойства: большая площадь поверхности коллагеновых волокон может привлекать фиброгенные клетки, которые помогают в заживлении.
- Зарождение ядра : коллаген в присутствии определенных нейтральных молекул соли может действовать как зародышеобразователь, вызывая образование фибриллярных структур. Коллагеновая повязка на рану может служить ориентиром для определения нового отложения коллагена и роста капилляров.
- Гемостатические свойства: тромбоциты крови взаимодействуют с коллагеном, образуя гемостатическую пробку.

Фундаментальные исследования
Химия
Белок коллагена состоит из тройной спирали, которая обычно состоит из двух идентичных цепей (α1) и дополнительной цепи, которая немного отличается по своему химическому составу (α2). Аминокислотный состав коллагена нетипичен для белков, особенно в отношении высокого содержания в нем гидроксипролина . Наиболее распространенные мотивы в аминокислотной последовательности коллагена являются глицин — пролин -X и глицин-Х-гидроксипролин, где Х обозначает любую аминокислоту, кроме глицина , пролина или гидроксипролина . Приведен средний аминокислотный состав кожи рыб и млекопитающих.
Синтез
Сначала собирается трехмерная цепочечная структура, основными компонентами которой являются аминокислоты глицин и пролин. Это еще не коллаген, а его предшественник проколлаген. Затем проколлаген модифицируется путем добавления гидроксильных групп к аминокислотам пролину и лизину . Этот этап важен для более позднего гликозилирования и формирования структуры тройной спирали коллагена. Поскольку ферменты гидроксилазы, которые выполняют эти реакции, требуют витамина С в качестве кофактора, длительный дефицит этого витамина приводит к нарушению синтеза коллагена и цинге . Эти реакции гидроксилирования катализируются двумя разными ферментами: пролил-4-гидроксилазой и лизил-гидроксилазой. Реакция потребляет одну молекулу аскорбата на гидроксилирование. Синтез коллагена происходит внутри и вне клетки. Здесь обсуждается образование коллагена, в результате которого образуется фибриллярный коллаген (наиболее распространенная форма). Сетчатый коллаген, который часто участвует в формировании систем фильтрации, является другой формой коллагена. Все типы коллагенов представляют собой тройные спирали, и разница заключается в составе альфа-пептидов, созданных на этапе 2.
Это еще не коллаген, а его предшественник проколлаген. Затем проколлаген модифицируется путем добавления гидроксильных групп к аминокислотам пролину и лизину . Этот этап важен для более позднего гликозилирования и формирования структуры тройной спирали коллагена. Поскольку ферменты гидроксилазы, которые выполняют эти реакции, требуют витамина С в качестве кофактора, длительный дефицит этого витамина приводит к нарушению синтеза коллагена и цинге . Эти реакции гидроксилирования катализируются двумя разными ферментами: пролил-4-гидроксилазой и лизил-гидроксилазой. Реакция потребляет одну молекулу аскорбата на гидроксилирование. Синтез коллагена происходит внутри и вне клетки. Здесь обсуждается образование коллагена, в результате которого образуется фибриллярный коллаген (наиболее распространенная форма). Сетчатый коллаген, который часто участвует в формировании систем фильтрации, является другой формой коллагена. Все типы коллагенов представляют собой тройные спирали, и разница заключается в составе альфа-пептидов, созданных на этапе 2.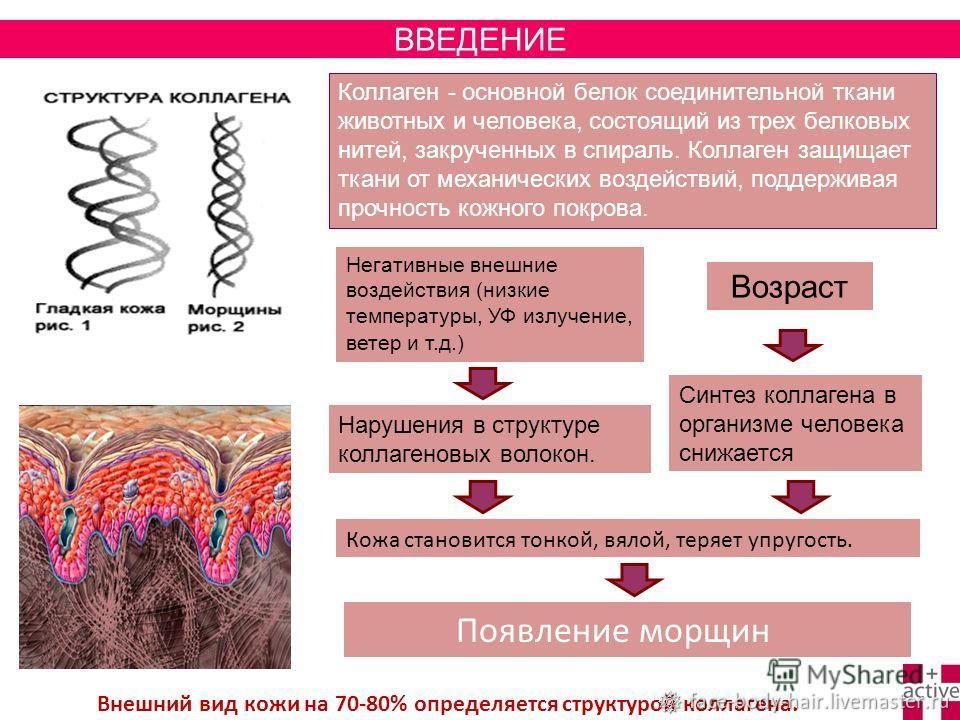
- Транскрипция мРНК : с образованием коллагена связаны около 44 генов, каждый из которых кодирует определенную последовательность мРНК и обычно имеет префикс « COL ». Начало синтеза коллагена начинается с включения генов, которые связаны с образованием определенного альфа-пептида (обычно альфа 1, 2 или 3).
- Формирование пре-пропептида : как только последняя мРНК выходит из ядра клетки и попадает в цитоплазму, она связывается с рибосомными субъединицами, и происходит процесс трансляции. Ранняя / первая часть нового пептида известна как сигнальная последовательность. Сигнальная последовательность на N-конце пептида распознается частицей распознавания сигнала на эндоплазматическом ретикулуме, которая будет отвечать за направление пре-пропептида в эндоплазматический ретикулум. Следовательно, как только синтез нового пептида завершается, он попадает непосредственно в эндоплазматический ретикулум для посттрансляционного процессинга.
 Сейчас он известен как препроколлаген.
Сейчас он известен как препроколлаген. - Пре-пропептид на проколлаген : происходят три модификации пре-пропептида, ведущие к образованию альфа-пептида:
- Сигнальный пептид на N-конце удаляется, и теперь молекула известна как пропептид (не проколлаген).
- Гидроксилирование лизинов и пролинов на пропептиде ферментами «пролилгидроксилаза» и «лизилгидроксилаза» (с образованием гидроксипролина и гидроксилизина) происходит, чтобы способствовать сшиванию альфа-пептидов. Этот ферментативный этап требует витамина С в качестве кофактора. При цинге отсутствие гидроксилирования пролинов и лизинов вызывает более рыхлую тройную спираль (которая образована тремя альфа-пептидами).
- Гликозилирование происходит путем добавления мономеров глюкозы или галактозы к гидроксильным группам, которые были помещены на лизины, но не на пролины.
- Как только эти модификации произошли, три из гидроксилированных и гликозилированных пропептидов скручиваются в тройную спираль, образуя проколлаген.
 У проколлагена еще есть раскрученные концы, которые позже будут обрезаны. На этом этапе проколлаген упаковывается в везикулу переноса, предназначенную для аппарата Гольджи.
У проколлагена еще есть раскрученные концы, которые позже будут обрезаны. На этом этапе проколлаген упаковывается в везикулу переноса, предназначенную для аппарата Гольджи.
- Модификация аппарата Гольджи : в аппарате Гольджи проколлаген проходит последнюю посттрансляционную модификацию перед тем, как секретируется из клетки. На этом этапе добавляются олигосахариды (а не моносахариды, как на этапе 3), а затем проколлаген упаковывается в секреторный пузырь, предназначенный для внеклеточного пространства.
- Образование тропоколлагена . Оказавшись вне клетки, мембраносвязанные ферменты, известные как коллагеновые пептидазы, удаляют «свободные концы» молекулы проколлагена. То, что осталось, известно как тропоколлаген. Дефекты на этом этапе вызывают одну из многих коллагенопатий, известных как синдром Элерса-Данлоса . Этот этап отсутствует при синтезе типа III, типа фибриллярного коллагена.
- Образование фибриллы коллагена : лизилоксидаза , внеклеточный медьзависимый фермент, производит заключительный этап в пути синтеза коллагена.
 Этот фермент действует на лизины и гидроксилизины, продуцируя альдегидные группы, которые в конечном итоге претерпевают ковалентную связь между молекулами тропоколлагена. Этот полимер тропоколлогена известен как фибрилла коллагена.
Этот фермент действует на лизины и гидроксилизины, продуцируя альдегидные группы, которые в конечном итоге претерпевают ковалентную связь между молекулами тропоколлагена. Этот полимер тропоколлогена известен как фибрилла коллагена.
Аминокислоты
Коллаген имеет необычный аминокислотный состав и последовательность:
- Глицин содержится почти в каждом третьем остатке .
- Пролин составляет около 17% коллагена.
- Коллаген содержит две необычные производные аминокислоты, которые не вставляются непосредственно во время трансляции . Эти аминокислоты находятся в определенных местах относительно глицина и посттрансляционно модифицируются различными ферментами, оба из которых требуют витамина С в качестве кофактора .
Кортизол стимулирует расщепление (кожного) коллагена на аминокислоты.
Образование коллагена I
Большинство коллагена образуется аналогичным образом, но для типа I характерен следующий процесс:
- Внутри клетки
- Два типа альфа-цепей — альфа-1 и альфа 2, образуются во время трансляции на рибосомах вдоль грубого эндоплазматического ретикулума (RER).
 Эти пептидные цепи, известные как препроколлаген, имеют регистрирующие пептиды на каждом конце и сигнальный пептид .
Эти пептидные цепи, известные как препроколлаген, имеют регистрирующие пептиды на каждом конце и сигнальный пептид . - Полипептидные цепи высвобождаются в просвет RER.
- Сигнальные пептиды расщепляются внутри RER, и теперь эти цепи известны как про-альфа-цепи.
- Гидроксилирование из лизина и пролина аминокислоты происходит внутри просвета. Этот процесс зависит от аскорбиновой кислоты (витамина С) и потребляет ее в качестве кофактора .
- Происходит гликозилирование определенных остатков гидроксилизина.
- Тройная альфа-спиральная структура формируется внутри эндоплазматического ретикулума из двух цепей альфа-1 и одной цепи альфа-2.
- Проколлаген доставляется в аппарат Гольджи , где он упаковывается и секретируется во внеклеточное пространство посредством экзоцитоза .
- Два типа альфа-цепей — альфа-1 и альфа 2, образуются во время трансляции на рибосомах вдоль грубого эндоплазматического ретикулума (RER).
- Вне камеры
- Регистрационные пептиды расщепляются, и тропоколлаген образуется проколлагеновой пептидазой .

- Множественные молекулы тропоколлагена образуют фибриллы коллагена посредством ковалентного сшивания ( альдольная реакция ) лизилоксидазой, которая связывает остатки гидроксилизина и лизина. Множественные коллагеновые фибриллы образуют коллагеновые волокна.
- Коллаген может быть прикреплен к клеточным мембранам через несколько типов белков, включая фибронектин , ламинин , фибулин и интегрин .
- Регистрационные пептиды расщепляются, и тропоколлаген образуется проколлагеновой пептидазой .
Синтетический патогенез
Дефицит витамина С вызывает цингу , серьезное и болезненное заболевание, при котором дефектный коллаген препятствует образованию прочной соединительной ткани . Десны портятся и кровоточат, с потерей зубов; кожа меняет цвет, а раны не заживают. До 18 века это состояние было печально известно среди длительных военных, особенно военно-морских, экспедиций, во время которых участников лишали продуктов, содержащих витамин С.
Аутоиммунное заболевание , такое как волчанка или ревматоидный артрит может атаковать здоровые волокна коллагена.
Многие бактерии и вирусы выделяют факторы вирулентности , такие как фермент коллагеназа , который разрушает коллаген или препятствует его производству.
Молекулярная структура
Одна молекула коллагена, тропоколлаген, используется для образования более крупных агрегатов коллагена, таких как фибриллы. Он имеет длину примерно 300 нм и диаметр 1,5 нм и состоит из трех полипептидных цепей (называемых альфа-пептидами, см. Шаг 2), каждая из которых имеет конформацию левой спирали — это не следует путать с правая альфа-спираль . Эти три левые спирали скручены вместе в правую тройную спираль или «суперспираль», кооперативную четвертичную структуру, стабилизированную множеством водородных связей . С коллагеном I типа и, возможно, со всеми фибриллярными коллагенами, если не со всеми коллагенами, каждая тройная спираль объединяется в правостороннюю суперспираль, называемую микрофибриллами коллагена. Каждая микрофибрилла пересекается с соседними микрофибриллами до такой степени, что можно предположить, что они индивидуально нестабильны, хотя внутри коллагеновых фибрилл они настолько упорядочены, что являются кристаллическими.
Отличительной особенностью коллагена является регулярное расположение аминокислот в каждой из трех цепей этих субъединиц коллагена. Последовательность часто следует схеме Gly — Pro -X или Gly-X- Hyp , где X может быть любым из различных других аминокислотных остатков. Пролин или гидроксипролин составляют около 1/6 всей последовательности. Поскольку на долю глицина приходится 1/3 последовательности, это означает, что примерно половина последовательности коллагена не является глицином, пролином или гидроксипролином, факт, который часто упускается из виду из-за отвлечения внимания необычным характером GX 1 X 2 альфа-пептидов коллагена. Высокое содержание глицина в коллагене важно для стабилизации коллагеновой спирали, поскольку это позволяет очень тесную ассоциацию коллагеновых волокон внутри молекулы, облегчая водородные связи и образование межмолекулярных поперечных связей. Такое регулярное повторение и высокое содержание глицина обнаруживается только в нескольких других волокнистых белках, таких как фиброин шелка .
Такое регулярное повторение и высокое содержание глицина обнаруживается только в нескольких других волокнистых белках, таких как фиброин шелка .
Коллаген — это не только структурный белок. Благодаря своей ключевой роли в определении клеточного фенотипа, клеточной адгезии, регуляции тканей и инфраструктуры, многие участки его небогатых пролином областей играют роль ассоциации / регуляции клеток или матрикса. Относительно высокое содержание пролиновых и гидроксипролиновых колец с их геометрически ограниченными карбоксильными и (вторичными) аминогруппами , а также большое количество глицина объясняют тенденцию отдельных полипептидных цепей спонтанно образовывать левые спирали без какой-либо внутрицепной водородная связь.
Поскольку глицин является самой маленькой аминокислотой без боковой цепи, он играет уникальную роль в волокнистых структурных белках. В коллагене Gly требуется в каждой третьей позиции, потому что сборка тройной спирали помещает этот остаток во внутреннюю часть (ось) спирали, где нет места для большей боковой группы, чем одиночный атом водорода глицина . По той же причине кольца Pro и Hyp должны быть направлены наружу. Эти две аминокислоты помогают стабилизировать тройную спираль — Hyp даже больше, чем Pro; их более низкая концентрация требуется у таких животных, как рыбы, температура тела которых ниже, чем у большинства теплокровных животных. Более низкое содержание пролина и гидроксипролина характерно для холодноводных, но не для теплопроводных рыб; последние, как правило, имеют такое же содержание пролина и гидроксипролина, что и млекопитающие. Более низкое содержание пролина и гидрокспролина в холодноводных рыбах и других пойкилотермных животных приводит к тому, что их коллаген имеет более низкую термостабильность, чем коллаген млекопитающих. Эта более низкая термическая стабильность означает, что желатин, полученный из рыбьего коллагена, не подходит для многих пищевых и промышленных применений.
По той же причине кольца Pro и Hyp должны быть направлены наружу. Эти две аминокислоты помогают стабилизировать тройную спираль — Hyp даже больше, чем Pro; их более низкая концентрация требуется у таких животных, как рыбы, температура тела которых ниже, чем у большинства теплокровных животных. Более низкое содержание пролина и гидроксипролина характерно для холодноводных, но не для теплопроводных рыб; последние, как правило, имеют такое же содержание пролина и гидроксипролина, что и млекопитающие. Более низкое содержание пролина и гидрокспролина в холодноводных рыбах и других пойкилотермных животных приводит к тому, что их коллаген имеет более низкую термостабильность, чем коллаген млекопитающих. Эта более низкая термическая стабильность означает, что желатин, полученный из рыбьего коллагена, не подходит для многих пищевых и промышленных применений.
Субъединицы тропоколлагена спонтанно самоорганизуются с регулярно смещенными концами в еще более крупные массивы во внеклеточных пространствах тканей. Дополнительная сборка фибрилл направляется фибробластами, которые откладывают полностью сформированные фибриллы из фибрипозиторов. В фибриллярных коллагенах молекулы смещены относительно соседних молекул примерно на 67 нм (единица, которая обозначается как «D» и изменяется в зависимости от состояния гидратации агрегата). В каждом повторе D-периода микрофибриллы есть часть, содержащая пять молекул в поперечном сечении, называемая «перекрытием», и часть, содержащая только четыре молекулы, называемая «разрывом». Эти области перекрытия и зазора сохраняются, когда микрофибриллы собираются в фибриллы, и, таким образом, их можно увидеть с помощью электронной микроскопии. Тройные спиральные тропоколлагены в микрофибриллах расположены в виде квазигексагональной упаковки.
Дополнительная сборка фибрилл направляется фибробластами, которые откладывают полностью сформированные фибриллы из фибрипозиторов. В фибриллярных коллагенах молекулы смещены относительно соседних молекул примерно на 67 нм (единица, которая обозначается как «D» и изменяется в зависимости от состояния гидратации агрегата). В каждом повторе D-периода микрофибриллы есть часть, содержащая пять молекул в поперечном сечении, называемая «перекрытием», и часть, содержащая только четыре молекулы, называемая «разрывом». Эти области перекрытия и зазора сохраняются, когда микрофибриллы собираются в фибриллы, и, таким образом, их можно увидеть с помощью электронной микроскопии. Тройные спиральные тропоколлагены в микрофибриллах расположены в виде квазигексагональной упаковки.
Существует некоторое ковалентное сшивание внутри тройных спиралей и различное количество ковалентных сшивок между спиралями тропоколлагена, образующими хорошо организованные агрегаты (такие как фибриллы). Более крупные фибриллярные пучки образуются с помощью нескольких разных классов белков (включая разные типы коллагена), гликопротеинов и протеогликанов, чтобы сформировать разные типы зрелых тканей из альтернативных комбинаций одних и тех же ключевых игроков. Нерастворимость коллагена была препятствием для изучения мономерного коллагена, пока не было обнаружено, что тропоколлаген из молодых животных может быть извлечен из-за того, что он еще не полностью сшит . Однако успехи в методах микроскопии (например, электронной микроскопии (ЭМ) и атомно-силовой микроскопии (АСМ)) и дифракции рентгеновских лучей позволили исследователям получать все более подробные изображения структуры коллагена in situ . Эти более поздние достижения особенно важны для лучшего понимания того, каким образом структура коллагена влияет на коммуникацию клетка-клетка и клетка-матрица, и как ткани строятся в процессе роста и восстановления и изменяются в процессе развития и болезни. Например, с помощью наноиндентирования на основе АСМ было показано, что единичное коллагеновое волокно представляет собой гетерогенный материал в осевом направлении со значительно различными механическими свойствами в его зазорах и областях перекрытия, что коррелирует с его различными молекулярными организациями в этих двух областях.
Коллагеновые фибриллы / агрегаты расположены в различных комбинациях и концентрациях в различных тканях для обеспечения различных свойств ткани. В кости целые тройные спирали коллагена расположены в параллельном шахматном порядке. Зазоры в 40 нм между концами субъединиц тропоколлагена (примерно равные области зазора), вероятно, служат центрами зародышеобразования для осаждения длинных твердых и мелких кристаллов минерального компонента, которым является гидроксилапатит (приблизительно) Ca 10 (OH) 2 (ЗП 4 ) 6 . Коллаген I типа придает костям прочность на разрыв .
Сопутствующие расстройства
Заболевания, связанные с коллагеном, чаще всего возникают из-за генетических дефектов или недостатка питания, которые влияют на биосинтез, сборку, посттрансляционную модификацию, секрецию или другие процессы, участвующие в нормальном производстве коллагена.
| Тип | Заметки | Ген (ы) | Расстройства |
| я | Это самый распространенный коллаген в организме человека. Он присутствует в рубцовой ткани, конечном продукте, когда ткань заживает путем восстановления. Он обнаружен в сухожилиях , коже, стенках артерий, роговице, эндомизии, окружающем мышечные волокна, фиброзно- хрящевой ткани и органической части костей и зубов. | COL1A1 , COL1A2 | Несовершенный остеогенез , синдром Элерса-Данлоса , инфантильный кортикальный гиперостоз, известный как болезнь Каффи |
| II | Гиалиновый хрящ составляет 50% всего хрящевого белка. Стекловидное тело глаза. | COL2A1 | Коллагенопатия II и XI типов |
| III | Это коллаген грануляционной ткани, который быстро вырабатывается молодыми фибробластами до того, как будет синтезирован более прочный коллаген I типа. Ретикулярное волокно . Также содержится в стенках артерий, коже, кишечнике и матке. | COL3A1 | Синдром Элерса-Данлоса , контрактура Дюпюитрена |
| IV | Базальная пластинка ; хрусталик глаза . Кроме того, служит в качестве части системы фильтрации в капиллярах и клубочки из нефрона в почках . | COL4A1 , COL4A2 , COL4A3 , COL4A4 , COL4A5 , COL4A6 | Alport синдром , синдром Гудпасчера |
| V | Наиболее интерстициальная ткань, ассоциированная. с типом I, связанным с плацентой | COL5A1 , COL5A2 , COL5A3 | Синдром Элерса-Данлоса (классический) |
| VI | Наиболее интерстициальная ткань, ассоциированная. с типом I | COL6A1 , COL6A2 , COL6A3 , COL6A5 | Ульрих миопатия , Bethlem миопатия , атопический дерматит |
| VII | Формирует закрепляющие фибриллы в дермоэпидермальных соединениях | COL7A1 | Дистрофический буллезный эпидермолиз |
| VIII | Некоторые эндотелиальные клетки | COL8A1 , COL8A2 | Задняя полиморфная дистрофия роговицы 2 |
| IX | FACIT коллаген , хрящ, доц. с фибриллами типа II и XI | COL9A1 , COL9A2 , COL9A3 | EDM2 и EDM3 |
| Икс | Гипертрофический и минерализующий хрящ | COL10A1 | Метафизарная дисплазия Шмида |
| XI | Хрящ | COL11A1 , COL11A2 | Коллагенопатия II и XI типов |
| XII | Коллаген FACIT , взаимодействует с типом I, содержащим фибриллы, декорин и гликозаминогликаны. | COL12A1 | — |
| XIII | Трансмембранный коллаген взаимодействует с интегрином a1b1, фибронектином и компонентами базальных мембран, такими как нидоген и перлекан . | COL13A1 | — |
| XIV | Коллаген FACIT, также известный как ундулин | COL14A1 | — |
| XV | — | COL15A1 | — |
| XVI | — | COL16A1 | — |
| XVII | Трансмембранный коллаген, также известный как BP180, белок 180 кДа | COL17A1 | Буллезный пемфигоид и некоторые формы буллезного узлового эпидермолиза |
| XVIII | Источник эндостатина | COL18A1 | — |
| XIX | Коллаген FACIT | COL19A1 | — |
| XX | — | COL20A1 | — |
| XXI | Коллаген FACIT | COL21A1 | — |
| XXII | — | COL22A1 | — |
| XXIII | Коллаген MACIT | COL23A1 | — |
| XXIV | — | COL24A1 | — |
| XXV | — | COL25A1 | — |
| XXVI | — | EMID2 | — |
| XXVII | — | COL27A1 | — |
| XXVIII | — | COL28A1 | — |
| XXIX | Эпидермальный коллаген | COL29A1 | Атопический дерматит |
Помимо вышеупомянутых нарушений, при склеродермии происходит чрезмерное отложение коллагена .
Болезни
Тысяча мутаций выявлена в 12 из более чем 20 типов коллагена. Эти мутации могут приводить к различным заболеваниям на тканевом уровне.
Несовершенный остеогенез — вызван мутацией в коллагене 1 типа , доминантным аутосомным заболеванием, приводит к слабым костям и неправильной соединительной ткани, некоторые случаи могут быть легкими, а другие могут быть летальными. В легких случаях уровень коллагена 1 типа снижен, в тяжелых случаях — структурные дефекты коллагена.
Хондродисплазия — заболевание скелета, которое, как считается, вызвано мутацией в коллагене 2 типа , для подтверждения этого проводятся дальнейшие исследования.
Синдром Элерса-Данлоса — известны тринадцать различных типов этого расстройства, которые приводят к деформации соединительной ткани. Некоторые из более редких типов могут привести к летальному исходу и привести к разрыву артерий. Каждый синдром вызван разными мутациями. Например, сосудистый тип (vEDS) этого заболевания вызван мутацией коллагена 3 типа .
Синдром Альпорта — может передаваться генетически, обычно как Х-сцепленная доминантная, но также как аутосомно-доминантное и аутосомно-рецессивное заболевание, у больных есть проблемы с почками и глазами, потеря слуха также может развиться в детстве или подростковом возрасте.
Синдром Кноблоха — вызван мутацией в гене COL18A1 , который кодирует выработку коллагена XVIII. Пациенты обращаются с выпячиванием ткани головного мозга и дегенерацией сетчатки; человек, члены семьи которого страдают этим расстройством, подвергается повышенному риску его развития, поскольку существует наследственная связь.
Характеристики
Коллаген — один из длинных волокнистых структурных белков , функции которого сильно отличаются от функций глобулярных белков , таких как ферменты . Плотные пучки коллагена, называемые коллагеновыми волокнами, являются основным компонентом внеклеточного матрикса, который поддерживает большинство тканей и придает клеточную структуру извне, но коллаген также находится внутри некоторых клеток. Коллаген обладает большой прочностью на разрыв и является основным компонентом фасций , хрящей , связок , сухожилий , костей и кожи. Наряду с эластином и мягким кератином он отвечает за прочность и эластичность кожи, а его разрушение приводит к появлению морщин , сопровождающих старение . Он укрепляет кровеносные сосуды и играет роль в развитии тканей . Он присутствует в роговице и хрусталике глаза в кристаллической форме. Это может быть один из самых распространенных белков в летописи окаменелостей, учитывая, что он, по-видимому, часто окаменяет даже в костях мезозоя и палеозоя .
Использует
Салями и коллагеновая оболочка (внизу), в которой она пришла.Коллаген имеет множество применений, от пищевых продуктов до медицинских. Например, он используется в косметической хирургии и хирургии ожогов . Он широко используется в виде коллагеновых оболочек для колбас.
Если коллаген подвергается достаточной денатурации , например, при нагревании, три цепи тропоколлагена частично или полностью разделяются на глобулярные домены, содержащие вторичную структуру, отличную от нормальной полипролина коллагена II (PPII), например случайные спирали . Этот процесс описывает образование желатина , который используется во многих продуктах питания, включая ароматизированные желатиновые десерты . Помимо продуктов питания, желатин используется в фармацевтической, косметической и фотографической промышленности. Он также используется как пищевая добавка .
От греческого слова «клей», колла , слово «коллаген» означает « производитель клея » и относится к раннему процессу кипячения кожи и сухожилий лошадей и других животных для получения клея. Коллагеновый клей использовался египтянами около 4000 лет назад, а коренные американцы использовали его для изготовления луков около 1500 лет назад. Самый старый клей в мире, углерод от как более чем 8000 лет, было обнаружено, что коллаген используется в качестве защитного покрытия на веревочных корзинах и вышитые ткани , и держать посуду вместе; также крест-накрест на человеческих черепах . Коллаген обычно превращается в желатин, но выживает в сухих условиях. Клеи для животных термопластичны , снова размягчаются при повторном нагревании, поэтому они все еще используются при изготовлении музыкальных инструментов, таких как прекрасные скрипки и гитары, которые, возможно, придется снова открывать для ремонта — применение несовместимо с жесткими синтетическими пластиковыми клеями, которые являются прочными. Сухожилия и шкуры животных, в том числе кожа, тысячелетиями использовались для изготовления полезных изделий.
Gelatin- резорцин — формальдегид клей (и с формальдегидом заменен менее токсичен пентандиалом и ethanedial ) был использован для ремонта экспериментальных надрезов в кроличьем легких .
Адаптация и диверсификация
Эволюция коллагенов была фундаментальным шагом в ранней эволюции животных , поддерживая многоклеточные формы животных. Коллагены — это самые распространенные белки у позвоночных , составляющие около 30% всех белков в организме человека. В зависимости от их молекулярной структуры белки коллагена делятся на два основных класса — фибриллообразующие (или фибриллярные ) коллагены и нефибриллообразующие ( нефибриллярные ) коллагены, которые далее делятся на 28 различных типов (по состоянию на 2017 год), на основе индивидуальных структур и функций, которые белок выполняет в организме. Фибриллярный коллаген, образующий трехмерные каркасы в различных тканях и органах , произошел от одного общего предка в ходе эволюции . Нефибриллярный коллаген является основным поддерживающим компонентом внеклеточного матрикса .
Морфология фибриллярного и не фибриллярный коллаген типа стал дифференцируется в процессе дивергентной эволюции . Эти два типа коллагена возникли в результате различных мутаций и событий дупликации генов, которые эволюционировали до нынешних 28 типов белков коллагена, обеспечивающих диверсификацию поддерживающих коллаген структур в организме, таких как скелет , который сформирован из альфа-коллагена (обозначается как альфа). ген. Фибриллярный коллаген был заимствован во время эволюционной адаптации из существующих генов путем естественного отбора для создания новых структур органов и тканей, что сделало возможным появление эволюционирующих видов с улучшенными возможностями.
История
Молекулярные и упаковочные структуры коллагена ускользали от ученых на протяжении десятилетий исследований. Первые свидетельства того, что он обладает регулярной структурой на молекулярном уровне, были представлены в середине 1930-х годов. С того времени исследования были сосредоточены на конформации мономера коллагена , в результате чего было получено несколько конкурирующих моделей, хотя и правильно учитывались конформация каждой отдельной пептидной цепи. Трехспиральная модель «Мадраса» предоставила точную модель четвертичной структуры коллагена. Эта модель была подтверждена дальнейшими исследованиями, показавшими более высокое разрешение в конце 20 века.
Структура упаковки коллагена не была определена в такой же степени за пределами фибриллярных типов коллагена, хотя давно известно, что она гексагональная. Как и в случае с его мономерной структурой, несколько противоречивых моделей утверждали, что либо упаковка молекул коллагена «пластинчатая», либо микрофибриллярная . Микрофибриллярная структура коллагеновых фибрилл в сухожилиях, роговице и хрящах была визуализирована непосредственно с помощью электронной микроскопии в конце 20-го и начале 21-го веков. Микрофибриллярная структура сухожилия хвоста была смоделирована как наиболее близкая к наблюдаемой структуре, хотя она чрезмерно упрощала топологическую прогрессию соседних молекул коллагена и, таким образом, не предсказывала правильную конформацию прерывистой D-периодической пентамерной структуры, называемой микрофибриллами .
Смотрите также
Рекомендации
Коллаген — Википедия
Структурный белок
Молекула тропоколлагена: три левых проколлагена (красный, зеленый, синий) соединяются, образуя правосторонний тройной спиральный тропоколлаген.Коллаген () является основным структурным белок в внеклеточный матрикс найдено в различных телах соединительной ткани. Являясь основным компонентом соединительной ткани, это самый распространенный белок у млекопитающих,[1] составляя от 25% до 35% содержания белка в организме. Коллаген состоит из аминокислоты связаны вместе, чтобы сформировать тройная спираль удлиненных фибрилла[2] известный как коллагеновая спираль. В основном встречается в соединительная ткань Такие как хрящ, кости, сухожилия, связки, и кожа.
В зависимости от степени минерализацияколлагеновые ткани могут быть жесткими (кость), податливыми (сухожилия) или иметь градиент от жесткого к податливому (хрящ). Коллаген также богат роговица, кровеносный сосуд, то кишка, межпозвоночные диски, а дентин в зубах.[3] В мышечная ткань, он служит основным компонентом эндомизий. Коллаген составляет от одного до двух процентов мышечной ткани и составляет 6% от веса сильных сухожильных мышц.[4] В фибробласт это наиболее распространенная клетка, которая производит коллаген. Желатин, который используется в пище и промышленности, это коллаген, который необратимо гидролизованный.[5] Коллаген имеет множество медицинских применений при лечении заболеваний костей и кожи.
Название коллаген происходит от греческого κόλλα (Колла), смысл «клей», и суффикс -γέν, -gen, что означает «производство».[6][7] Это относится к раннему использованию соединения в процессе создания клея путем кипячения кожи и сухожилия из лошади и другие животные.
Типы
Более 90% коллагена в тело человека является коллаген I типа.[8] Однако по состоянию на 2011 год 30 типов коллагена были идентифицированы, описаны и разделены на несколько групп в зависимости от структуры, которую они образуют:[9] Все типы содержат хотя бы один тройная спираль.[9] Количество типов показывает разнообразную функциональность коллагена.[10]
- Фибрилла (Тип I, II, III, V, XI)
- Нефибриллярный
- ФАСИТ (Ассоциированные с фибриллами коллагены с прерывистыми тройными спиралями) (Тип IX, XII, XIV, XIX, XXI)
- Короткая цепь (Тип VIII, X)
- Базальная мембрана (Тип IV)
- Мультиплексин (Множественные домены Triple Helix с прерываниями) (Тип XV, XVIII)
- MACIT (ассоциированные с мембраной коллагены с прерывистой тройной спиралью) (Тип XIII, XVII)
- Формирование микрофибрилл (Тип VI)
- Якорные фибриллы (Тип VII)
Пять наиболее распространенных типов:
Медицинское использование
Сердечные приложения
Коллагеновый сердечный скелет который включает четыре сердечный клапан кольца, гистологически, эластично и однозначно связывается с сердечной мышцей. Каркас сердца также включает в себя разделительные перегородки камер сердца — межжелудочковая перегородка и атриовентрикулярная перегородка. Вклад коллагена в сердечная деятельность в целом представляет собой непрерывную крутящую силу, противоположную механика жидкости из кровь давление, исходящее из сердца. Коллагеновая структура, которая отделяет верхние камеры сердца от нижних камер, представляет собой непроницаемую мембрану, которая исключает как кровь, так и электрические импульсы с помощью обычных физиологических средств. При поддержке коллагена, мерцательная аритмия никогда не ухудшается до мерцание желудочков. Коллаген состоит из слоев различной плотности с гладкой мышечной массой. Масса, распределение, возраст и плотность коллагена — все это способствует согласие требуется для перемещения крови вперед и назад. Отдельные створки сердечного клапана складываются в форму с помощью специального коллагена при различных условиях. давление. Постепенный кальций отложение в коллагене происходит как естественная функция старения. Кальцинированные точки в коллагеновых матрицах показывают контраст в движущемся отображении крови и мышц, что позволяет использовать методы визуализация сердца технология для достижения соотношений, по сути, заявляющих кровь в (сердечный ввод) и кровь (сердечный выброс). Патология коллагеновой основы сердца понимается в категории заболевание соединительной ткани.
Косметическая хирургия
Коллаген широко используется в косметической хирургии в качестве лечебного средства для ожоговых пациентов при реконструкции костей и в самых разных стоматологических, ортопедических и хирургических целях. Коллаген человека и крупного рогатого скота широко используется в качестве кожных наполнителей для лечения морщин и старения кожи.[11] Вот некоторые интересные места:
- При использовании в косметических целях существует вероятность возникновения аллергических реакций, вызывающих продолжительное покраснение; однако это можно практически исключить простыми и незаметными патч-тестирование перед косметическим использованием.
- Большинство медицинского коллагена получают из молодняка крупного рогатого скота, сертифицированного BSE-бесплатные животные. Большинство производителей используют животных-доноров либо из «закрытых стад», либо из стран, в которых никогда не было зарегистрировано случаев BSE, таких как Австралия, Бразилия и Новая Зеландия.
Костные трансплантаты
Поскольку скелет формирует структуру тела, жизненно важно, чтобы он сохранял свою силу даже после переломов и травм. Коллаген используется при трансплантации костей, поскольку он имеет тройную спиральную структуру, что делает его очень прочной молекулой. Он идеально подходит для лечения костей, так как не нарушает структурную целостность скелета. Тройная спиральная структура коллагена предотвращает его расщепление ферментами, обеспечивает адгезию клеток и важна для правильной сборки внеклеточного матрикса.[12]
Регенерация тканей
Коллагеновые каркасы используются для регенерации тканей в губках, тонких пластинах или гелях. Коллаген обладает необходимыми свойствами для регенерации тканей, такими как структура пор, проницаемость, гидрофильность и стабильность in vivo. Коллагеновые каркасы также идеально подходят для отложения таких клеток, как остеобласты и фибробласты, и после введения в ткань может продолжаться нормальный рост.[13]
Реконструктивное хирургическое использование
Коллагены широко используются при создании искусственная кожа заменители, используемые в лечении тяжелых ожоги и раны.[14][15] Эти коллагены могут быть получены из коровьего, конского, свиного или даже человеческого происхождения; и иногда используются в сочетании с силиконы, гликозаминогликаны, фибробласты, факторы роста и другие вещества.
Лечение раны
Коллаген — один из ключевых природных ресурсов организма и компонент кожной ткани, который может принести пользу на всех этапах лечение раны.[16] Когда коллаген становится доступным для ложа раны, может произойти закрытие. Таким образом, можно избежать ухудшения состояния раны, за которым иногда могут следовать такие процедуры, как ампутация.
Коллаген — это натуральный продукт, поэтому он используется в качестве натуральной перевязки для ран и обладает свойствами, которых нет у искусственных перевязочных материалов. Он устойчив к бактериям, что имеет жизненно важное значение для перевязки ран. Это помогает сохранить стерильность раны благодаря своей естественной способности бороться с инфекциями. Когда коллаген используется как повязка от ожогов, здоровый грануляционная ткань может очень быстро образовываться над ожогом, помогая ему быстро зажить.[17]
На протяжении 4 фаз заживления ран коллаген выполняет следующие функции при заживлении ран:
- Направляющая функция: коллагеновые волокна служат для направления фибробластов. Фибробласты мигрируют по матрице соединительной ткани.
- Хемотаксические свойства: большая площадь поверхности коллагеновых волокон может привлекать фиброгенные клетки, которые помогают в заживлении.
- Зарождение зародышей: коллаген в присутствии определенных нейтральных молекул соли может действовать как зародышеобразователь, вызывая образование фибриллярных структур. Коллагеновая повязка на рану может служить ориентиром для определения нового отложения коллагена и роста капилляров.
- Кровоостанавливающие свойства: кровь. тромбоциты взаимодействуют с коллагеном, образуя гемостатическую пробку.
Фундаментальные исследования
Коллаген используется в лабораторные исследования за культура клеток, изучая поведение клеток и клеточные взаимодействия с внеклеточная среда.[18]
Химия
Белок коллагена состоит из тройной спирали, которая обычно состоит из двух идентичных цепей (α1) и дополнительной цепи, которая немного отличается по своему химическому составу (α2).[19] Аминокислотный состав коллагена нетипичен для белков, особенно в отношении его высокой гидроксипролин содержание. Наиболее распространенными мотивами в аминокислотной последовательности коллагена являются глицин-пролин-X и глицин-X-гидроксипролин, где X представляет собой любую аминокислоту, кроме глицина, пролина или гидроксипролина. Приведен средний аминокислотный состав кожи рыб и млекопитающих.[19]
Синтез
Сначала собирается трехмерная цепочечная структура, основными компонентами которой являются аминокислоты глицин и пролин. Это еще не коллаген, а его предшественник проколлаген. Затем проколлаген модифицируется путем добавления гидроксил группы аминокислот пролин и лизин. Этот шаг важен на будущее гликозилирование и формирование тройной спиральной структуры коллагена. Поскольку ферменты гидроксилазы, которые выполняют эти реакции, требуют Витамин С как кофактор, длительный дефицит этого витамина приводит к нарушению синтеза коллагена и цинга.[20] Эти реакции гидроксилирования катализируются двумя разными ферментами: пролил-4-гидроксилазой.[21] и лизилгидроксилаза. В реакции требуется одна молекула аскорбата на гидроксилирование.[22]Синтез коллагена происходит внутри и вне клетки. Здесь обсуждается образование коллагена, в результате которого образуется фибриллярный коллаген (наиболее распространенная форма). Сетчатый коллаген, который часто участвует в формировании систем фильтрации, является другой формой коллагена. Все типы коллагенов представляют собой тройные спирали, а различия заключаются в составе альфа-пептидов, созданных на этапе 2.
- Транскрипция мРНК: Около 44 генов связаны с образованием коллагена, каждый из которых кодирует определенную последовательность мРНК и обычно имеет «COL«Префикс». Начало синтеза коллагена начинается с включения генов, которые связаны с образованием определенного альфа-пептида (обычно альфа 1, 2 или 3).
- Образование пре-пропептида: Как только последняя мРНК выходит из ядра клетки и попадает в цитоплазму, она связывается с рибосомными субъединицами, и происходит процесс трансляции. Ранняя / первая часть нового пептида известна как сигнальная последовательность. Последовательность сигналов на N-концевой пептида распознается частица распознавания сигнала на эндоплазматическом ретикулуме, который будет отвечать за направление пре-пропептид в эндоплазматический ретикулум. Следовательно, как только синтез нового пептида завершается, он попадает непосредственно в эндоплазматический ретикулум для посттрансляционного процессинга. Сейчас он известен как препроколлаген.
- Пре-пропептид к проколлагену: Происходят три модификации пре-пропептида, приводящие к образованию альфа-пептида:
- Сигнальный пептид на N-конце удаляется, и теперь молекула известна как пропептид (не проколлаген).
- Гидроксилирование лизинов и пролинов на пропептиде ферментами «пролилгидроксилаза» и «лизилгидроксилаза» (с образованием гидроксипролина и гидроксилизина) происходит, чтобы способствовать сшиванию альфа-пептидов. Этот ферментативный этап требует Витамин С в качестве кофактора. В цингаотсутствие гидроксилирования пролинов и лизинов вызывает более рыхлую тройную спираль (которая образована тремя альфа-пептидами).
- Гликозилирование происходит путем добавления мономеров глюкозы или галактозы к гидроксильным группам, которые были помещены на лизины, но не на пролины.
- Как только эти модификации произошли, три из гидроксилированных и гликозилированных пропептидов скручиваются в тройную спираль, образуя проколлаген. У проколлагена еще есть раскрученные концы, которые позже будут обрезаны. На этом этапе проколлаген упаковывается в везикулу переноса, предназначенную для аппарата Гольджи.
- Модификация аппарата Гольджи: В аппарате Гольджи проколлаген проходит последнюю посттрансляционную модификацию перед тем, как секретируется из клетки. На этом этапе добавляются олигосахариды (а не моносахариды, как на этапе 3), а затем проколлаген упаковывается в секреторный пузырь, предназначенный для внеклеточного пространства.
- Образование тропоколлагена: Оказавшись вне клетки, мембранные ферменты, известные как коллагеновые пептидазы, удаляют «свободные концы» молекулы проколлагена. То, что осталось, известно как тропоколлаген. Дефекты на этом этапе вызывают одну из многих коллагенопатий, известных как Синдром Элерса-Данлоса. Этот этап отсутствует при синтезе типа III, типа фибриллярного коллагена.
- Образование фибриллы коллагена: лизилоксидазавнеклеточный медьзависимый фермент, производит заключительный этап в пути синтеза коллагена. Этот фермент действует на лизины и гидроксилизины, продуцируя альдегидные группы, которые в конечном итоге претерпевают ковалентную связь между молекулами тропоколлагена. Этот полимер тропоколлогена известен как фибрилла коллагена.
Аминокислоты
Коллаген имеет необычный аминокислота состав и последовательность:
- Глицин встречается почти в каждом третьем остаток.
- Пролин составляет около 17% коллагена.
- Коллаген содержит две необычные производные аминокислоты, не вставленные непосредственно во время перевод. Эти аминокислоты находятся в определенных местах относительно глицина и посттрансляционно модифицируются разными ферментами, оба из которых требуют Витамин С как кофактор.
Кортизол стимулирует деградация коллагена (кожи) на аминокислоты.[23]
Образование коллагена I
Большинство коллагена образуется аналогичным образом, но для типа I характерен следующий процесс:
- Внутри клетки
- При этом образуются два типа альфа-цепей — альфа-1 и альфа 2. перевод на рибосомах вдоль шероховатой эндоплазматической сети (RER). Эти пептидные цепи, известные как препроколлаген, имеют регистрационные пептиды на каждом конце и сигнальный пептид.[24]
- Полипептидные цепи высвобождаются в просвет RER.
- Сигнальные пептиды расщепляются внутри RER, и теперь эти цепи известны как про-альфа-цепи.
- Гидроксилирование из лизин и пролин аминокислоты находится внутри просвета. Этот процесс зависит от аскорбиновая кислота (витамин С) как кофактор.
- Гликозилирование специфических остатков гидроксилизина.
- Тройная альфа-спиральная структура формируется внутри эндоплазматической сети из двух цепей альфа-1 и одной цепи альфа-2.
- Проколлаген отправляется аппарат Гольджи, где он упаковывается и секретируется экзоцитоз.
- Вне камеры
- Регистрационные пептиды расщепляются, а тропоколлаген образуется проколлаген пептидаза.
- Множественные молекулы тропоколлагена образуют фибриллы коллагена посредством ковалентного поперечного сшивания (альдольная реакция) к лизилоксидаза который связывает остатки гидроксилизина и лизина. Множественные коллагеновые волокна образуют коллагеновые волокна.
- Коллаген может быть прикреплен к клеточным мембранам через несколько типов белков, включая фибронектин, ламинин, фибулин и интегрин.
Синтетический патогенез
Причины дефицита витамина С цинга, серьезное и болезненное заболевание, при котором дефектный коллаген препятствует образованию сильных соединительная ткань. Десны ухудшаются и кровоточат, с потерей зубов; обесцвечивание кожи и раны не лечить. До 18 века это состояние было печально известно среди длительных военных, особенно военно-морских, экспедиций, во время которых участников лишали продуктов, содержащих витамин С.
An аутоиммунное заболевание Такие как Красная волчанка или же ревматоидный артрит[25] может атаковать здоровые волокна коллагена.
Многие бактерии и вирусы выделяют факторы вирулентности, например, фермент коллагеназа, который разрушает коллаген или препятствует его производству.
Молекулярная структура
Одна молекула коллагена, тропоколлаген, используется для образования более крупных агрегатов коллагена, таких как фибриллы. Это примерно 300нм длиной и диаметром 1,5 нм, состоит из трех полипептид нити (называемые альфа-пептидами, см. шаг 2), каждая из которых имеет конформацию левой спираль — не следует путать с правшей альфа спираль. Эти три левые спирали скручены вместе в правую тройную спираль или «суперспираль», кооперативную четвертичная структура стабилизируется многими водородные связи. С коллагеном I типа и, возможно, всеми фибриллярными коллагенами, если не всеми коллагенами, каждая тройная спираль объединяется в правостороннюю суперспираль, называемую микрофибриллами коллагена. Каждая микрофибрилла переплетенный с соседними микрофибриллами до такой степени, что можно предположить, что они индивидуально нестабильны, хотя внутри коллагеновых фибрилл они настолько упорядочены, что являются кристаллическими.
Три полипептиды спираль для образования тропоколлагена. Затем многие тропоколлагены связываются вместе, образуя фибриллы, а многие из них затем образуют волокна.Отличительная черта коллагена — регулярное расположение аминокислоты в каждой из трех цепей этих субъединиц коллагена. Последовательность часто следует шаблону Gly-Pro-X или Gly-X-Hyp, где X может быть любым из различных других аминокислотных остатков.[19] Пролин или гидроксипролин составляют около 1/6 всей последовательности. Поскольку на долю глицина приходится 1/3 последовательности, это означает, что примерно половина последовательности коллагена не является глицином, пролином или гидроксипролином, что часто упускается из-за отвлечения необычного GX.1Икс2 характер альфа-пептидов коллагена. Высокое содержание глицина в коллагене важно для стабилизации коллагеновой спирали, поскольку это позволяет очень тесную ассоциацию коллагеновых волокон внутри молекулы, облегчая водородные связи и образование межмолекулярных поперечных связей.[19] Такое регулярное повторение и высокое содержание глицина обнаруживается только в нескольких других волокнистых белках, таких как шелк фиброин.
Коллаген — это не только структурный белок. Из-за своей ключевой роли в определении клеточного фенотипа, клеточной адгезии, регуляции тканей и инфраструктуры многие участки его небогатых пролином областей играют роль ассоциации / регуляции клеток или матрикса. Относительно высокое содержание пролиновых и гидроксипролиновых колец с их геометрически ограниченными карбоксил и (вторичный) амино- групп, наряду с богатым содержанием глицина, объясняет тенденцию отдельных полипептидных цепей спонтанно образовывать левые спирали без какой-либо внутрицепочечной водородной связи.
Поскольку глицин — самая маленькая аминокислота без боковой цепи, он играет уникальную роль в волокнистых структурных белках. В коллагене Gly требуется в каждой третьей позиции, потому что сборка тройной спирали помещает этот остаток во внутреннюю часть (ось) спирали, где нет места для большей боковой группы, чем одиночная группа глицина. атом водорода. По той же причине кольца Pro и Hyp должны быть направлены наружу. Эти две аминокислоты помогают стабилизировать тройную спираль — Hyp даже больше, чем Pro; их более низкая концентрация требуется у таких животных, как рыбы, чей температура тела ниже, чем у большинства теплокровных животных. Более низкое содержание пролина и гидроксипролина характерно для холодноводных, но не для теплопроводных рыб; последние, как правило, имеют такое же содержание пролина и гидроксипролина, что и млекопитающие.[19] Более низкое содержание пролина и гидрокспролина в холодноводных и других рыбах. пойкилотерм животных приводит к тому, что их коллаген имеет более низкую термостабильность, чем коллаген млекопитающих.[19] Эта более низкая термическая стабильность означает, что желатин полученный из рыбного коллагена, не подходит для многих пищевых и промышленных применений.
Тропоколлаген подразделения спонтанно самостоятельно собрать, с регулярно смещенными концами, в еще большие массивы в внеклеточный пространства тканей.[26][27] Дополнительную сборку фибрилл направляют фибробласты, которые откладывают полностью сформированные фибриллы из фибрипозиторов. В фибриллярных коллагенах молекулы смещены относительно соседних молекул примерно на 67нм (единица, которая упоминается как «D» и изменяется в зависимости от состояния гидратации агрегата). В каждом повторении D-периода микрофибриллы есть часть, содержащая пять молекул в поперечном сечении, называемая «перекрытием», и часть, содержащая только четыре молекулы, называемая «разрывом».[28] Эти области перекрытия и зазора сохраняются, когда микрофибриллы собираются в фибриллы, и, таким образом, их можно увидеть с помощью электронной микроскопии. Тройные спиральные тропоколлагены в микрофибриллах расположены в виде квазигексагональной упаковки.[28][29]
D-период коллагеновых фибрилл дает видимые полосы 67 нм при наблюдении под электронной микроскопией.Существует некоторое ковалентный сшивание внутри тройных спиралей и различное количество ковалентных сшивок между спиралями тропоколлагена, образующими хорошо организованные агрегаты (такие как фибриллы).[30] Более крупные фибриллярные пучки формируются с помощью нескольких разных классов белков (включая разные типы коллагена), гликопротеинов и протеогликанов, чтобы сформировать разные типы зрелых тканей из альтернативных комбинаций одних и тех же ключевых игроков.[27] Коллагена нерастворимость был препятствием для изучения мономерного коллагена, пока не было обнаружено, что тропоколлаген из молодых животных может быть извлечен, поскольку он еще не полностью сшитый. Однако достижения в области методов микроскопии (например, электронной микроскопии (ЭМ) и атомно-силовой микроскопии (АСМ)) и дифракции рентгеновских лучей позволили исследователям получать все более подробные изображения структуры коллагена. на месте.[31] Эти более поздние достижения особенно важны для лучшего понимания того, каким образом структура коллагена влияет на коммуникацию клетка-клетка и клетка-матрица и как ткани строятся в процессе роста и восстановления и изменяются в процессе развития и болезни.[32][33] Например, с помощью наноиндентирования на основе АСМ было показано, что отдельная фибрилла коллагена представляет собой гетерогенный материал в осевом направлении со значительно разными механическими свойствами в областях зазора и перекрытия, что коррелирует с его различной молекулярной организацией в этих двух областях.[34]
Коллагеновые фибриллы / агрегаты расположены в различных комбинациях и концентрациях в различных тканях для обеспечения различных свойств ткани. В кости целые тройные спирали коллагена лежат в параллельном шахматном порядке. Зазоры в 40 нм между концами субъединиц тропоколлагена (примерно равные области зазора), вероятно, служат центрами зародышеобразования для отложения длинных твердых и мелких кристаллов минерального компонента, которым является гидроксилапатит (примерно) Ca10(ОЙ)2(PO4)6.[35] Коллаген I типа придает костям предел прочности.
Сопутствующие расстройства
Заболевания, связанные с коллагеном, чаще всего возникают из-за генетических дефектов или недостатка питания, которые влияют на биосинтез, сборку, посттрансляционную модификацию, секрецию или другие процессы, участвующие в нормальном производстве коллагена.
| Тип | Примечания | Ген (ы) | Расстройства |
| я | Это самый распространенный коллаген в организме человека. Он присутствует в рубцовая ткань, конечный продукт, когда ткань лечит по ремонту. Он находится в сухожилия, кожа, стенки артерии, роговица, эндомизий окружающие мышечные волокна, хрящевую ткань и органическую часть костей и зубов. | COL1A1, COL1A2 | Несовершенный остеогенез, Синдром Элерса-Данлоса, инфантильный кортикальный гиперостоз также известна как болезнь Каффи |
| II | Гиалиновые хрящи, составляет 50% всего хрящевого белка. Стекловидное тело глаза. | COL2A1 | Коллагенопатия II и XI типов |
| III | Это коллаген грануляционная ткань и быстро вырабатывается молодыми фибробластами до того, как синтезируется более прочный коллаген I типа. Ретикулярное волокно. Также содержится в стенках артерий, коже, кишечнике и матке. | COL3A1 | Синдром Элерса-Данлоса, Контрактура Дюпюитрена |
| IV | Базальная пластинка; линза глаза. Также служит частью системы фильтрации в капилляры и клубочки из нефрон в почка. | COL4A1, COL4A2, COL4A3, COL4A4, COL4A5, COL4A6 | Синдром Альпорта, Синдром Гудпастура |
| V | Наиболее интерстициальная ткань, ассоциированная. с типом I, связанным с плацента | COL5A1, COL5A2, COL5A3 | Синдром Элерса-Данлоса (классический) |
| VI | Наиболее интерстициальная ткань, ассоциированная. с типом I | COL6A1, COL6A2, COL6A3, COL6A5 | Миопатия Ульриха, Бетлемская миопатия, атопический дерматит[36] |
| VII | Формы закрепление фибрилл в дермоэпидермальные соединения | COL7A1 | Дистрофический буллезный эпидермолиз |
| VIII | Немного эндотелиальный клетки | COL8A1, COL8A2 | Задняя полиморфная дистрофия роговицы 2 |
| IX | Коллаген FACIT, хрящ, доц. с фибриллами типа II и XI | COL9A1, COL9A2, COL9A3 | EDM2 и EDM3 |
| Икс | Гипертрофический и минерализация хрящ | COL10A1 | Метафизарная дисплазия Шмида |
| XI | Хрящ | COL11A1, COL11A2 | Коллагенопатия II и XI типов |
| XII | Коллаген FACIT, взаимодействует с фибриллами I типа, декорин и гликозаминогликаны | COL12A1 | – |
| XIII | Трансмембранный коллаген, взаимодействует с интегрином a1b1, фибронектин и компоненты базальных мембран, такие как нидоген и перлекан. | COL13A1 | – |
| XIV | Коллаген FACIT, также известный как ундулин | COL14A1 | – |
| XV | – | COL15A1 | – |
| XVI | – | COL16A1 | – |
| XVII | Трансмембранный коллаген, также известный как BP180, белок 180 кДа | COL17A1 | Буллезный пемфигоид и некоторые формы узловых буллезный эпидермолиз |
| XVIII | Источник эндостатин | COL18A1 | – |
| XIX | Коллаген FACIT | COL19A1 | – |
| XX | – | COL20A1 | – |
| XXI | Коллаген FACIT | COL21A1 | – |
| XXII | – | COL22A1 | – |
| XXIII | Коллаген MACIT | COL23A1 | – |
| XXIV | – | COL24A1 | – |
| XXV | – | COL25A1 | – |
| XXVI | – | EMID2 | – |
| XXVII | – | COL27A1 | – |
| XXVIII | – | COL28A1 | – |
| XXIX | Эпидермальный коллаген | COL29A1 | Атопический дерматит[37] |
В дополнение к вышеупомянутым нарушениям, чрезмерное отложение коллагена происходит в склеродермия.
Болезни
Тысяча мутаций обнаружена в 12 из более чем 20 типов коллагена. Эти мутации могут приводить к различным заболеваниям на тканевом уровне.[38]
Несовершенный остеогенез — Вызвано мутацией в коллаген 1 типа, доминирующее аутосомное заболевание, приводит к слабости костей и неправильной соединительной ткани, некоторые случаи могут быть легкими, а другие могут быть летальными. В легких случаях уровень коллагена 1 типа снижен, в тяжелых случаях — структурные дефекты коллагена.[39]
Хондродисплазии — Расстройство скелета, предположительно вызванное мутацией в коллаген 2 типа, для подтверждения этого проводятся дальнейшие исследования.[40]
Синдром Элерса-Данлоса — Известно тринадцать различных типов этого заболевания, которые приводят к деформации соединительной ткани.[41] Некоторые из более редких типов могут привести к летальному исходу и привести к разрыву артерий. Каждый синдром вызван разными мутациями. Например, сосудистый тип (vEDS) этого заболевания вызван мутацией в коллаген 3 типа.[42]
Синдром Альпорта — Может передаваться генетически, обычно как Х-сцепленный доминантный тип, но также как аутосомно-доминантное и аутосомно-рецессивное заболевание, у больных есть проблемы с почками и глазами, потеря слуха также может развиться в детстве или подростковом возрасте.[43]
Синдром Кноблоха — Вызвано мутацией в COL18A1 ген, кодирующий выработку коллагена XVIII. Пациенты обращаются с выпячиванием ткани мозга и дегенерацией сетчатки; человек, члены семьи которого страдают этим заболеванием, подвергается повышенному риску его развития, поскольку существует наследственная связь.[38]
Характеристики
Коллаген — один из длинных, волокнистые структурные белки чьи функции сильно отличаются от функций глобулярные белки, Такие как ферменты. Жесткие пучки коллагена, называемые коллагеновые волокна являются основным компонентом внеклеточный матрикс который поддерживает большинство тканей и придает клеткам структуру снаружи, но коллаген также находится внутри некоторых клеток. Коллаген имеет отличный предел прочности, и является основным компонентом фасция, хрящ, связки, сухожилия, кость и кожа.[44][45] Вместе с эластин и мягкий кератин, он отвечает за кожа прочность и эластичность, а его деградация приводит к морщины которые сопровождают старение.[11] Укрепляет кровеносный сосуд и играет роль в ткань разработка. Он присутствует в роговица и объектив глаз в кристаллический форма. Это может быть один из самых распространенных белков в летописи окаменелостей, учитывая, что он, по-видимому, часто окаменелость, даже в костях из Мезозойский и Палеозой.[46]
Использует
Салями и коллагеновая оболочка (внизу) она пришлаКоллаген имеет множество применений, от пищевых продуктов до медицинских. Например, он используется в косметическая хирургия и ожоговая хирургия. Широко используется в виде коллагена. оболочки для колбас.[47][48]
Если коллаген подвержен достаточному денатурация, например при нагревании три цепи тропоколлагена частично или полностью разделяются на глобулярные домены, содержащие вторичную структуру, отличную от нормальной полипролина коллагена II (PPII), например случайные катушки. Этот процесс описывает формирование желатин, который используется во многих еда, в том числе ароматизированные желатиновые десерты. Помимо продуктов питания, желатин используется в фармацевтической, косметической и фотографической промышленности. Он также используется как пищевая добавка.
От греческого слова «клей», Колласлово коллаген означает «клей производитель «и относится к раннему процессу кипячения кожи и сухожилия из лошади и другие животные для получения клея. Коллагеновый клей был использован Египтяне около 4000 лет назад, и Коренные американцы использовал это в Луки около 1500 лет назад. Самый старый клей в мире, углеродный коллаген, которому более 8000 лет, использовался в качестве защитной подкладки на веревочных корзинах и вышитый ткани, и держать посуда вместе; также в украшениях крест-накрест на человеческие черепа.[49] Коллаген обычно превращается в желатин, но выживает в сухих условиях. Клеи для животных термопласт, снова размягчающиеся при повторном нагревании, поэтому они все еще используются при приготовлении музыкальные инструменты например, хорошо скрипки и гитары, который, возможно, придется снова открыть для ремонта — приложение несовместимо с жестким, синтетический пластик клеи, которые являются прочными. Сухожилия и шкуры животных, в том числе натуральная кожа, тысячелетиями использовались для создания полезных статей.
Желатин-резорцин-формальдегид клей (с заменой формальдегида менее токсичным пентандиалом и этандиальный) использовался для ремонта экспериментальных разрезов в кролик легкие.[50]
Адаптация и диверсификация
Эволюция коллагенов была фундаментальным шагом в раннем эволюция животных, поддерживающие многоклеточные формы животных.[51] Коллагены являются наиболее распространенными белками в позвоночные, составляя около 30% всех белков в организме человека.[52][53][54] По своей молекулярной структуре белки коллагена делятся на два основных класса — фибриллообразующие (или фибриллярный) коллагены и нефибриллообразующие (нефибриллярный) коллагены, которые далее делятся на 28 различных типов (по состоянию на 2017 год) в зависимости от индивидуальных структур и функций, которые белок выполняет в организме.[53][54] Фибриллярный коллаген, производящий трехмерный каркасы в разных тканях и органы, полученный из одного общего предок в течение эволюция.[53][55] Нефибриллярный коллаген является основным поддерживающим компонентом внеклеточный матрикс.[54]
В морфология фибриллярного и нефибриллярного типов коллагена дифференцировались во время дивергентная эволюция.[54] Эти два типа коллагена возникли из разных мутация и дупликация гена события, которые развились до нынешних 28 типов белков коллагена, обеспечивающих диверсификацию поддерживающих коллаген структур в организме, таких как скелет, который образован из альфа (обозначается как α) гена коллагена.[53][55] Фибриллярный коллаген был кооптированы в процессе эволюции приспособление из существующих генов естественный отбор для создания новых структур органов и тканей, способствующих появлению эволюционирующих видов с улучшенными способностями.[53][55]
История
Молекулярные и упаковочные структуры коллагена ускользали от ученых на протяжении десятилетий исследований. Первое свидетельство того, что он обладает регулярной структурой на молекулярном уровне, было представлено в середине 1930-х годов.[56][57] С того времени исследования были сосредоточены на конформации коллагена. мономер, создавая несколько конкурирующих моделей, но правильно обрабатывая конформацию каждой отдельной пептидной цепи. Трехспиральная модель «Мадраса» представила точную модель четвертичная структура в коллагене.[58][59][60] Эта модель была подтверждена дальнейшими исследованиями, показывающими более высокое разрешение в конце 20 век.[61][62][63][64]
Структура упаковки коллагена не была определена в такой же степени за пределами фибриллярный типы коллагена, хотя давно известно, что он гексагональный.[29][65][66] Как и в случае с его мономерной структурой, несколько противоречащих друг другу моделей утверждали, что либо упаковка молекул коллагена является «листовой», либо микрофибрилла. Orgel, Joseph (2009). «On the packing structure of collagen: response to Okuyama et al.’s comment on Microfibrillar structure of type I collagen in situ». Acta Crystallographica Раздел D. D65 (9): 1009. Дои:10.1107/S0907444909028741.
| Викискладе есть медиафайлы по теме Коллаген. |
Преимущества добавок с коллагеном — Блог
Автор: Эрик Мадрид, доктор медицины
В этой статье:
Мышцы, кости, кожа и сухожилия в основном состоят из коллагена — самого распространенного типа белка в организме человека. Если быть точнее, коллаген составляет 30–35 процентов от всего белка в организме человека. Коллагеновый белок также известен как соединительная ткань и отвечает за стабилизацию состояния нашей кожи и обеспечение движения и гибкости суставов. Кроме того, коллаген обеспечивает эластичность нашей кожи. Исследования показывают, что добавки с коллагеном имеют много преимуществ, к числу которых относится уменьшение лицевых морщин и избавление от целлюлита. Я рассмотрю эти вопросы ниже в данной статье.
По мере того как мы стареем, наша кожа утрачивает свою эластичность и становится все более морщинистой. Это обусловлено множеством причин. Сниженная способность вырабатывать коллаген является одной из них, но стрессовые факторы жизни и окислительное повреждение также играют значительную роль. Люди с более высоким содержанием меланина в коже в большей степени защищены от ультрафиолетовых лучей солнечного света и повреждений от ультрафиолета. Я называю этот феномен «меланозащитой». В то же время люди с более низким уровнем меланина подвергаются более высокому риску получения солнечных повреждений и повышенному риску преждевременного старения.
Добавки с коллагеном, как правило, состоят из следующих аминокислот, которые ученые разделяют на три категории:
- Незаменимые аминокислоты. Этот тип аминокислот нужно получать с пищей, поскольку они не вырабатываются организмом. К числу таких аминокислот относятся лизин, серин, треонин, лейцин, валин, фенилаланин, метионин, изолейцин, гистидин и гидроксилизин.
- Условно-незаменимые аминокислоты. Этот тип аминокислот организм обычно может вырабатывать самостоятельно, но в состоянии физического стресса он не способен выработать достаточный объем данных кислот. Поэтому в данной ситуации может быть полезен прием пищевых добавок. К их числу относится глицин, пролин, глютамин (глютаминовая кислота), аланин и тирозин.
- Неосновные аминокислоты. Этот тип аминокислот очень важен для организма, но они были названы неосновными, поскольку организм способен самостоятельно вырабатывать их. Потребление этих аминокислот в рационе питания не является обязательным, но такое потребление НЕ вредно. К числу данных аминокислот относятся гидроксипролин, аргинин, а также аспарагиновая кислота.
Различные производители коллагена используют разные источники для изготовления своего продукта. В то время как некоторые используют части тела быков (коров), другие извлекают коллаген из рыбы. California Gold Nutrition использует высококачественный коллаген из морских источников, идеально подходящий пескетарианцам, то есть тем людям, которые не употребляют мяса, но едят рыбу.
Коллагеновые добавки содержат широкий перечень аминокислот, необходимых для роста волос, поддержания здоровья кожи и сухожилий, а также здоровья костей. Коллаген отлично подойдет тем людям, которые хотят получать должный объем аминокислот только в составе добавок без глютена и молочных продуктов. Тяжелоатлеты часто используют коллагеновые добавки для обеспечения максимального роста своих мышц. Иногда они также применяют порошковый сывороточный белок.
Типы коллагена в организмеУченые выявили по крайней мере 28 типов коллагена. Однако 90 процентов коллагена в организме человека относятся к типам 1, 2, 3 и 5.
- Коллаген типа 1 входит в состав сухожилий, органов и костей. Коллаген типа 1 — это 80–90 процентов коллагена в нашем организме.
- Коллаген типа 2 входит в состав хрящей коленей, плеч и других суставов.
- Коллаген типа 3 — это основной тип хряща ретикулярных волокон. Он обычно встречается там же, где и коллаген типа 1.
- Коллаген типа 5 образует волосы и присутствует на поверхности кожи.
Уровни коллагена начинают уменьшаться в возрасте после тридцати пяти лет. Хотя мы не можем остановить время, есть некоторые виды поведения, которые характерны для многих людей и ускоряют потерю коллагена и впоследствии старение. Курение — это основной вид поведения человека, который приводит к разрушению коллагена или потере его организмом. Это основная причина, по которой курильщики часто выглядят старше своего фактического возраста. Кроме того, наш коллаген также разрушается под чрезмерным воздействием солнечного света и при частых солнечных ожогах, а также при использовании рациона питания с высоким содержанием сахара и низким содержанием антиоксидантов.
Продукты питания, которые увеличивают выработку коллагенаВ то время как прием добавок может обеспечить получение человеком достаточного количества коллагена, есть также ряд мер в области питания, которые человек может предпринять, чтобы оптимизировать выработку коллагена. Ким Д’Эон, диетолог со специализацией на холистическом питании, рекомендует список продуктов, которые могут помочь организму человека вырабатывать больше коллагена.
- Богатые витамином А продукты, такие как морковь, сладкий картофель, абрикосы и яйца.
- Зеленые листовые овощи, такие как капуста, шпинат и брокколи
- Лук, поскольку он богат серой, которая играет важную роль при формировании хряща.
- Чеснок, который также богат серой и играет важную роль при выработке хряща.
- Голубика, обеспечивающая антиоксидантную защиту.
- Малина, обеспечивающая антиоксидантную защиту.
- Апельсины, богатые витамином С, который необходим для производства коллагена.
- Болгарский перец, характеризующийся высоким содержанием витамина С, который необходим для выработки коллагена.
- Клубника, которая богата витамином С, необходимым для выработки коллагена.
- Орехи, такие как миндаль и грецкие орехи, бобовые культуры и семена, которые также содержат много аминокислот.
- Костный бульон, содержащий много аминокислот, являющихся строительными блоками коллагена.
Научные исследования показали, что дополнительный прием коллагена может быть полезен для оптимального здоровья суставов и помогает укреплять кости. Здоровая диета и физическая активность также имеют решающее значение для здоровья суставов.
АртритОстеоартрит возникает в результате разрушения хряща в суставах. Согласно оценкам, от него страдают более 250 миллионов людей по всему миру. В попытке избежать приема рецептурных лекарств, которые имеют потенциальные побочные эффекты, многие люди принимают натуральные добавки от артрита в целях уменьшения боли, связанной с воспалением. Возможно, мы сможем помочь восстановить коллаген и предотвратить потерю хряща?
Исследование 2017 года с использованием животной модели показало, что добавки с коллагеном не только уменьшили воспаление суставов, но и предотвратили потерю хряща в них.
ОстеопорозПо мере старения человека его кости становятся тоньше. Врач ставит диагноз остеопороз в случаях, когда плотность костной ткани меньше, чем ожидается для возраста данного человека. Чтобы определить наличие данного заболевания, врач направляет пациента на анализ плотности костной ткани. Люди с остеопорозом подвержены повышенному риску переломов костей, которые чаще всего представляет собой риск переломов бедра при случайном падении. К числу факторов риска возникновения остеопороза относятся курение и нехватка витамина D. Данному заболеванию также больше подвержены женщины в возрасте от 65 лет.
Согласно результатам исследований на животных моделях, коллаген может помочь увеличить прочность костей. Исследование 2005 года свидетельствует об увеличении прочности костей при приеме добавки с коллагеном.
Прочность сухожилийСухожилия — это толстые волокнистые шнуры из коллагена. Сухожилия связывают мышцы с костями и отвечают за движение. Обеспечение прочности сухожилий играет важную роль в предотвращении травм. Травмы сухожилий распространены среди спортсменов и любителей заниматься спортом по выходным. Согласно данным исследования 2005 года, добавки с коллагеном повышают прочность сухожилий, а исследование 2016 года показало, что они также могут помочь увеличить толщину ахиллового сухожилия у животных моделей.
Здоровье кожиСогласно оценкам, женщины по всему миру тратят 382 миллиарда долларов США на косметику и косметические принадлежности. Большинство из этих товаров обладают низкой эффективностью при устранении признаков старения, хотя некоторые из них действительно защищают от солнечных повреждений. Чтобы избежать воздействия химических веществ и токсинов, многие люди выбирают природные косметические продукты и мыло. Однако вопрос заключается в том, как мы можем улучшить нашу кожу и изнутри?
Исследования показывают, что коллагеновые добавки имеют многочисленные преимущества для кожи. В соответствии с данными исследований, пероральные коллагеновые добавки могут быть полезными людям с целлюлитом и морщинами. Они также могут улучшить рост волос и ногтей. Согласно оценкам, примерно в возрасте тридцати пяти лет мы начинаем терять около одного процента коллагена нашего тела в год, что обуславливает важность приема добавок с коллагеном.
Меньше целлюлита?Целлюлит — это патологическое состояние, которое люди пытались устранить на протяжении десятилетий. В двойном слепом плацебо-контролируемом исследовании 2015 года был сделан вывод, что «… долгосрочная терапия с пероральным приемом БПК (биоактивные пептиды коллагена) приводит к улучшению симптомов целлюлита и оказывает положительное влияние на здоровье кожи». В этом исследовании женщины принимали коллаген в течение минимум 6 месяцев. Улучшения были отмечены уже через 3 месяца.
Уменьшение количества лицевых морщинПо данным исследования 2014 года «Клиническое вмешательство при старении» прием добавок с коллагеном помогает уменьшить число морщин на коже. Кроме того, двойное слепое плацебо-контролируемое исследование, проведенное в 2014 году, показало улучшение эластичности кожи испытуемых, которые принимали 2500 мг коллагена в день в течение восьми недель, по сравнению с теми испытуемыми, которые принимали таблетку плацебо. Другое исследование 2012 года показало улучшение состояния морщин и снижение сухости кожи при приеме 1000 мг коллагена в течение 12 недель.
В результатах исследования 2016 года, опубликованных в Journal of Science of Food and Agriculture («Журнал науки продуктов питания и сельского хозяйства»), содержится вывод о том, что пероральный прием коллагена «привел к большему улучшению состояния при лицевых кожных заболеваниях, в том числе недостаточной влажности и эластичности кожи лица, наличия морщин и шероховатостей».
Продление жизниВ исследовании 2008 года сделан следующий вывод: «Эти результаты свидетельствуют о том, что коллагеновый пептид полезно принимать в качестве пищевой добавки для подавления УФ-В-индуцированного повреждения кожи и фотостарения». В итогах исследования 2015 года, опубликованных в Journal of Cosmetic Dermatology («Журнал косметической дерматологии»), сообщается, что с помощью приема пероральных добавок с коллагеном удалось добиться аналогичного результата. Исследователи пришли к выводу, что «Пероральные добавки с коллагеновыми пептидами эффективно улучшают признаки кожи, связанные со старением».
Рост ногтей и волосСильные ногти и здоровые волосы — это показатель общего хорошего состояния здоровья. Исследование 2017 года, опубликованное в Journal of Cosmetic Dermatology («Журнал косметической дерматологии») показало, что прием добавки с 2500 мг коллагена привел к 12-процентному увеличения скорости роста ногтей и 42-процентному снижению числа случаев сломанных ногтей. Кроме того, четыре из пяти испытуемых согласились с тем, что их общий внешний вид ногтей улучшился.
Прочие преимуществаИсследования показывают, что коллаген также может быть полезен тем, кто стремится улучшить здоровье своего кишечника. Коллаген может принести пользу и в виде оптимизации сердечного здоровья.
Синдром повышенной проницаемости кишечникаКоллаген помогает поддерживать здоровье кишечника. Основная причина этого — высокое содержание аминокислоты глютамина или глутаминовой кислоты в пероральных коллагеновых добавках. Глютамин обеспечивает «пищу» для здоровых бактерий в нашем кишечнике. Узнайте больше о синдроме повышенной проницаемости кишечника и других способах оптимизации здоровья кишечника.
Сердечно-сосудистое здоровьеБольшая часть кровеносных сосудов состоит из коллагена, в частности, коллагена типа IV. Витамин С, лизин и пролин — это ключевые компоненты, необходимые для формирования здорового коллагена. В 1989 году двукратный лауреат Нобелевской премии Лайнус Полинг предложил Единую теорию заболеваний сердечно-сосудистой системы человека. Он предположил, что достаточное количество витамина С, пролина и лизина может помочь сохранить прочность артерий и предотвратить атеросклероз. Коллагеновые добавки содержат эти важные питательные вещества.
ДобавкиВ Интернете предлагаются пероральные коллагеновые добавки с различными рецептурами. Некоторые из них изготавливаются из частей тела быков (коров), в то время как другие производятся из морских источников (рыбы). Я рекомендую принимать по крайней мере 3000–5000 мг коллагена в день. Также следует подумать о дополнительном приеме 1000–2000 мг витамина С, чтобы оптимизировать концентрацию и формирование коллагена.
Ссылки:
- https://en.wikipedia.org/wiki/Collagen
- Dar Q-A, Schott EM, Catheline SE, et al. Daily oral consumption of hydrolyzed type 1 collagen is chondroprotective and anti-inflammatory in murine posttraumatic osteoarthritis. Agarwal S, ed. PLoS ONE. 2017;12(4):e0174705. doi:10.1371/journal.pone.0174705.
- J Agric Food Chem. 2010 Jan 27;58(2):835-41. doi: 10.1021/jf9031487.
- Nutrition. 2005 Nov-Dec;21(11-12):1120-6.
- J Nutr Sci Vitaminol (Tokyo). 2005 Jun;51(3):169-74.
- Fusini F, Bisicchia S, Bottegoni C, Gigante A, Zanchini F, Busilacchi A. Nutraceutical supplement in the management of tendinopathies: a systematic review. Muscles, Ligaments and Tendons Journal. 2016;6(1):48-57. doi:10.11138/mltj/2016.6.1.048.
- https://www.self.com/story/amount-of-money-women-spend-on-beauty-products
- Schunck M, Zague V, Oesser S, Proksch E. Dietary Supplementation with Specific Collagen Peptides Has a Body Mass Index-Dependent Beneficial Effect on Cellulite Morphology. Journal of Medicinal Food. 2015;18(12):1340-1348. doi:10.1089/jmf.2015.0022.
- Borumand M, Sibilla S. Daily consumption of the collagen supplement Pure Gold Collagen® reduces visible signs of aging. Clinical Interventions in Aging. 2014;9:1747-1758. doi:10.2147/CIA.S65939.
- Skin Pharmacol Physiol. 2014;27(1):47-55. doi: 10.1159/000351376. Epub 2013 Aug 14.
- Schwartz SR, Park J. Ingestion of BioCell Collagen®, a novel hydrolyzed chicken sternal cartilage extract; enhanced blood microcirculation and reduced facial aging signs. Clinical Interventions in Aging. 2012;7:267-273. doi:10.2147/CIA.S32836.
- Inoue, N., Sugihara, F. and Wang, X. (2016), Ingestion of bioactive collagen hydrolysates enhance facial skin moisture and elasticity and reduce facial ageing signs in a randomised double-blind placebo-controlled clinical study. J. Sci. Food Agric., 96: 4077–4081. doi:10.1002/jsfa.7606
- Midori TANAKA, Yoh-ichi KOYAMA & Yoshihiro NOMURA (2009) Effects of Collagen Peptide Ingestion on UV-B-Induced Skin Damage, Bioscience, Biotechnology, and Biochemistry, 73:4, 930-932, DOI: 10.1271/bbb.80649
- Asserin, J., Lati, E., Shioya, T. and Prawitt, J. (2015), The effect of oral collagen peptide supplementation on skin moisture and the dermal collagen network: evidence from an ex vivo model and randomized, placebo-controlled clinical trials. J Cosmet Dermatol, 14: 291–301. doi:10.1111/jocd.12174
- https://nutritionreview.org/2013/04/collagen-connection/
Автор этой статьи — врач Эрик Мадрид, член Американского совета по вопросам интегративной и холистической медицины, имеющий сертификаты Американского совета по вопросам семейной медицины и Американского совета по вопросам интегративной и холистической медицины. Он является автором книги «Назначение витамина D, исцеляющая энергия солнца». Эрик Мадрид закончил медицинский институт в Государственном университете Огайо. Он является партнером Rancho Family Medical Group и ведет прием пациентов в Менифи, Калифорния. Больше информации о докторе Мадриде здесь.
Продукция, представленная в статье
Поделиться этой статьей
Коллаген — это… Что такое Коллаген?
Коллаге́н — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у многоклеточных животных; отсутствует у растений, бактерий, вирусов, простейших и грибов.[1] Это основной компонент соединительной ткани и самый распространённый протеин у млекопитающих,[2] составляющий от 25% до 35% протеинов во всём теле.
История исследования
Учёные десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянную структуру на молекулярном уровне, было представлено в середине 30-х годов прошлого века. С того времени много выдающихся учёных, включая Нобелевских лауреатов, таких как Фрэнсис Крик, Лайнус Полинг, Александр Рич, Ада Йонат, Хелен Берман, Вилеайнур Рамачандран работали над строением мономера коллагена.
Несколько противоречащих друг другу моделей (несмотря на известную структуру каждой отдельной пептидной цепи) дали дорогу для создания троично-спиральной модели, объяснившей четвертичную структуру молекулы коллагена.
Свойства
Продуктом денатурации коллагена является желатин. Температура денатурации макромолекулы коллагена близка к температуре фибриллогенеза. Это свойство молекулы коллагена делает её максимально чувствительной к мутационным заменам.
Структура
Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген[3]. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм.
Для первичной структуры белка характерно высокое содержание глицина, низкое содержание серосодержащих аминокислот и отсутствие триптофана. Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21 % от общего числа остатков приходится на 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин[4]. Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трёх перечисленных[3].
Коллаген существует в нескольких формах. Основная структура всех типов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных треххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет.
Фибриллярная структура
Тропоколлаген (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещенными на определённое расстояние концами, образуя в межклеточном веществе более крупные структуры. В фибриллярных коллагенах молекулы смещены относительно друг друга примерно на 67нм (единица, которая обозначается буквой «D» и меняется в зависимости от состояния гидратации вещества). В целом каждый D -период содержит четыре целых и часть пятой молекулы коллагена. Величина 300 нм, поделенная на 67 нм (300:67) не дают целого числа и длина молекулы коллагена разделена на непостоянные по величине отрезки D. Следовательно, в разрезе каждого повтора D -периода микрофибриллы есть часть, состоящая из пяти молекул называемая «перекрытие», и часть, состоящая из четырёх молекул — «разрыв». Тропоколлагены к тому же скомпонованы в шестиугольную или псевдошестиугольную (в поперечном разрезе) конструкцию, в каждой области «перекрытия» и «разрыва».
Внутри тропоколлагенов существует ковалентная связь между цепями, а также некоторое непостоянное количество данных связей между самими тропоколагеновыми спиралями, образующими хорошо организованные структуры (например, фибриллы). Более толстые пучки фибрилл формируются с помощью белков нескольких других классов, включая другие типы коллагенов, гликопротеины, протеогликаны, использующихся для формирования различных типов тканей из разных комбинаций одних и тех же основных белков. Нерастворимость коллагена была препятствием к изучению мономера коллагена, до того момента как было обнаружено, что возможно извлечь тропоколлаген молодого животного, поскольку он ещё не образовал сильных связей с другими субъединицами фибриллы. Тем не менее, усовершествование микроскопов и рентгеновских аппаратов облегчили исследования, появлялось все больше подробных изображений структуры молекулы коллагена. Эти поздние открытия очень важны для лучшего понимания того, как структура коллагена влияет на связи между клетками и межклеточным веществом, как ткани меняются во время роста и регенерации, как они меняются во время эмбрионального развития и при патологии.
Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена. Коллагеновые волокна — это пучки фибрилл.
Использование
Пищевая промышленность
С точки зрения питания, коллаген и желатин являются белками низкого качества, так как они не содержат всех незаменимых аминокислот, необходимых человеку — это неполноценные белки. Производители основанных на коллагене пищевых добавок утверждают, что их продукты могут улучшить качество кожи и ногтей, а также здоровье суставов.[источник не указан 928 дней]
Относительно дешёвые, часто предлагаемые сегодня на рынке под видом источника свободных аминокислот гидролизаты коллагена не всегда способны удовлетворить потребности человека в свободных аминокислотах, так как эти продукты не содержат готовые к усвоению аминокислоты, а является лишь частично “переваренными” экстрактами суставных тканей млекопитающих, птиц или обитателей моря. Например, гидролизаты коллагена почти полностью лишены аминокислоты L-глютамина, не отличающейся стойкостью к термическому воздействию и долгому хранению сырья, большая часть глютамина и разрушается уже на первых этапах хранения и переработки сырья, имеющийся небольшой остаток практически полностью распадается во время термической экстракции хрящевой ткани.
Наиболее качественными источниками аминокислот являются препараты, содержащие так называемые “свободные аминокислоты”. Так как именно свободные аминокислоты являются практически готовыми к усвоению, организму принимающего человека не нужно тратить время, пищеварительные ферменты и энергию на их переваривание. Они способны в кратчайшие сроки поступить в кровь, и будучи доставленными ею к местам, нуждающимся в дополнительном синтезе коллагена, тут же включаются в его формирование.[источник не указан 664 дня]
Косметические средства
Коллаген входит в состав косметических средств для :
- Образования воздухопроницаемого, влагоудерживающго слоя на поверхности кожи, обладающего пластифицирующими (разглаживающими) свойствами, со свойствами влажного компресса;
- Пролонгирования действия экстрактов, масел и др. в составе косметических композиций;
- Придания блеска волосам, создания коллагенового (защитного) слоя на поверхности волос.
Научные исследования
В 2005 году учёным удалось выделить коллаген из сохранившихся мягких тканей тираннозавра[5] и использовать его химический состав как ещё одно доказательство родства динозавров с современными птицами[6].
Научные исследования в медицине
Синтез коллагена — сложный ферментативный многостадийный процесс, который должен быть обеспечен достаточным количеством витаминов и минеральных элементов. Синтез протекает в фибробласте и ряд стадий вне фибробласта. Важный момент в синтезе — реакции гидроксилирования, которые открывают путь дальнейшим модификациям, необходимым для созревания коллагена. Катализируют реакции гидроксилирования специфические ферменты. Так, образование 4-оксипролина катализирует пролингидроксилаза, в активном центре которой находится железо. Фермент активен в том случае, если железо находится в двухвалентной форме, что обеспечивается аскорбиновой кислотой (витамин С). Дефицит аскорбиновой кислоты нарушает процесс гидроксилирования, что влияет на дальнейшие стадии синтеза коллагена- гликозилирование, отщепление N- и С-концевых пептидов и др. В результате синтезируется аномальный коллаген, более рыхлый. Эти изменения лежат в основе развития цинги.
Типы коллагена
В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации — интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является существование 1 или более доменов, содержащих тройную спираль и присутствие их во внеклеточном матриксе. Более 90 % всего коллагена высших организмов приходится на коллагены I, II,III и IV типов.
| Разновидности коллагена | Типы |
|---|---|
| Фибриллярные коллагены | I, II, III, V, XI, XXIV, XXVII |
| Фибрилл-ассоциированные коллагены (FACIT) | IX, XII, XIV, XVI, XIX, XX, XXI, XXII |
| Коллагены, формирующие филаменты- бусины (beaded filament forming) | VI |
| Сетеобразующие коллагены | IV, VIII, X |
| Коллаген, формирующий якорные фибриллы | VII |
| Трансмембранные коллагены | XIII, XVII, XXIII, XXV/CLAC-P |
| Другие коллагены | XXVIII, XV, XVIII |
Кроме белков коллагенов существует множество белков, содержащих в своей структуре домен с тройной коллагеновой спиралью[7][8]. И, тем не менее, они не позиционируются как коллагены, а только как «коллагено-подобные». К большой группе коллагено-подобных белков относятся подкомпонент C1q комплемента, C1q подобный фактор, адипонектин, колектины и фиколины, концевая структура ацетилхолинестаразы, три макрофаговых рецептора, эктодисплазин и EMILIN. Эти белки, так же как и коллагены, играют структурную и регуляторную роль.
Коллаген первого типа, самый архетипичный, является тримерным белком, собирающимся в тройные спирали без разрывов, самособирающимся в фибриллы и обладающим наибольшей механической прочностью. Между тем, все остальные коллагены отличаются от него в одном или нескольких аспектах. Некоторые коллагены имеют разрывы в тройной спирали и не обязательно собираются в фибриллы.
| Тип коллагена | Гены | Молекулы | Органы | Ассоциированные болезни |
|---|---|---|---|---|
| I | COL1A1 COL1A2 | α1(I)2α2(I), α1(I)3 | Повсеместно в мягких и твёрдых тканях, в коже, костях | Синдром Элерса-Данлоса, остеогенез, ревматизм, синдром Марфана, дисплазии |
| II | COL2A1 | α1(II)3 + см тип XI | Хрящи, стекловидное тело, межпозвоночные диски | Коллагенопатия II и XI типа, синдром Стиклера, ахондрогенез |
| III | COL3A1 | α1(III)3 | Мягкие ткани и полые органы | Синдром Элерса-Данлоса, фибромышечная дисплазия, аневризма аорты |
| IV | COL4A1 COL4A2 COL4A3 COL4A4 COL4A5 COL4A6 | α1(IV)2α2(IV), другие непонятно | Базальные мембраны | Синдром Альпорта, синдроме Гудпасчера |
| V | COL5A1 COL5A2 COL5A3 | α1(V)2α2(V), α1(V)α2(V)α3(V) + см тип XI | Мягкие ткани, плацента, сосуды, хорион | Синдром Элерса-Данлоса |
| VI | COL6A1 COL6A2 COL6A3 COL6A4 COL6A5 COL6A6 | α1(VI)α2(VI)α3(VI) | Микрофибриллы в мягких тканях и хрящах | Миопатия Ульриха, миопатия Бэтлема, атопический дерматит |
| VII | COL7A1 | α1(VII)3 | Прикрепительные фибриллы в связке кожи и эпидермия | Буллезный эпидермолиз |
| VIII | COL8A1 COL8A2 | α1(VIII)α2(VIII) | Роговица, эндотелий | Дистрофия роговицы |
| IX | COL9A1 COL9A2 COL9A3 | α1(IX)α2(IX)α3(IX) | Хрящи, стекловидное тело | Синдром Стиклера, остеоартрит, эпифизарная дисплазия |
| X | COL10A1 | α1(X)3 | Гипертрофическая зона области роста | Метафизарная дисплазия Шмида |
| XI | COL11A1 COL11A2 | α1(XI)α2(XI)α1(II), α1(XI)α2(V)α1(II) | Хрящи, стекловидно тело | Коллагенопатия II и XI типов, остеопороз |
| XII | COL12A1 | α1(XII)3 | Мягкие ткани | Повреждения сухожилий |
| XIII | COL13A1 | α1(XIII)3 | Поверхность клеток, эпительные клетки | |
| XIV | COL14A1 | α1(IV)3 | Мягкие ткани | |
| XV | COL15A1 | α1(XV)3 | Эндотелиальные клетки | карцинома |
| XVI | COL16A1 | α1(XVI)3 | Повсеместно | |
| XVII | COL17A1 | α1(XVII)3 | Поверхность эпидермальных клеток | Буллезный эпидермиолиз, пузырчатка |
| XVIII | COL18A1 | α1(XVIII)3 | Эндотелиальные клетки | |
| XIX | COL19A1 | α1(XIX)3 | Повсеместно | Меланома, карцинома |
| XX | COL20A1 | α1(XX)3 | Выделен из куриного эмбриона | |
| XXI | COL21A1 | α1(XXI)3 | Кровеносные сосуды | |
| XXII | COL22A1 | α1(XXII)3 | Только в местах мышечно-сухожильных соединений | |
| XXIII | COL23A1 | α1(XXIII)3 | Опухолевые клетки | |
| XXIV | COL24A1 | α1(XXIV)3 | Формирующиеся кости | Остеохондроз |
| XXV | COL25A1 | α1(XXV)3 | Атеросклеротические бляшки | Болезнь Альцгеймера |
| XXVI | COL26A1=EMID2 | α1(XXVI)3 | Половые органы | |
| XXVII | COL27A1 | α1(XXVII)3 | Мягкие ткани | |
| XXVIII | COL28A1 | α1(XXVIII)3 | Нервная система |
Медицинские аспекты
Нарушения синтеза коллагена лежат в основе таких наследственных заболеваний, как дерматоспораксис у животных, латиризм (характерна разболтанность суставов, привычные вывихи), синдром Элерса-Данлоса (до 14 типов проявлений), несовершенный остеогенез (болезнь «стеклянного человека», врожденный рахит, врожденная ломкость костей), болезнь Марфана.
Характерным проявлением этих заболеваний является повреждение связочного аппарата, хрящей, костной системы, наличие пороков сердечных клапанов.
Болезни коллагена, в том числе так называемые коллагенозы, возникают из-за множества причин. Это может быть из-за мутации в гене, приводящей к изменению формы коллагеновой молекулы, или ошибки в пострансляционной модификации коллагена. Также болезни могут быть вызваны недостатком или «неправильной работой» ферментов, вовлеченных в биосинтез коллагена — дефицит ферментов гидроксилирования (пролин-, лизингидроксилазы), гликозилтрансфераз, N-проколлагеновой и С-проколлагеновой пептидаз, лизилоксидаз с последующим нарушением поперечных сшивок, дефицит меди, витаминов В6, C. При приобретённых болезнях, таких как цинга, восстановление баланса ферментов до нормального может привести к полному излечению.
Практически любая генная мутация, ведет к утрате или изменению функций коллагена, что, в свою очередь, отражается на свойствах тканей и органов. Генные мутации в коллагеновом домене могут привести к изменению формы тройной спирали, путём вставки/делеции аминокислоты или замены Gly на другое основание. Мутации в неколлагеновых доменах могут привести к неправильной сборке α-цепей в надмолекулярные структуры (фибриллы или сети), что также ведет к утрате функций. Мутантные a-цепи способны образовывать трех-спиральный комплекс с нормальными a-цепями. В большинстве случаев, такие комплексы не стабильны и быстро разрушаются, однако такая молекула может и нормально выполнять свою роль, если не затронуты функционально важные области. Большинство болезней, вызванных мутациями в коллагеновых генах, являются доминантными.
Примечания
Ссылки
Бьюти-википедия: как работает космецевтика Joёlle Ciocco
Бренд Joëlle Ciocco появился более 40 лет назад. Его создательница — французский косметолог и биохимик Жоэль Сиокко. Чем знаменита марка и с каких средств начать знакомство? Рассказываем в нашем новом материале.Большую часть жизни Жоэль, основательница бренда Joëlle Ciocco, изучала биохимию растений и в результате запустила свой космецевтический бренд на основе растительных ингредиентов. Она разработала метод Epidermologie®, который рассматривает кожу как экосистему.
Жоэль Сиокко убеждена: сколько людей на Земле — столько и типов кожи. При оценке ее состояния важны следующие факторы: генетика — то, что дано природой; память — то, что накопилось в результате неблагоприятных воздействий внешних и внутренних факторов; реальная картина — то, что происходит с кожей в данный момент. Для диагностики состояния кожи косметологу, работающему на косметике Joëlle Ciocco, не нужны какие-то специальные средства и приборы: pH, например, можно определить по реакции на очищающий лосьон.
«40 лет назад я поняла, что кожа каждого человека уникально и чрезвычайно уязвима. Не всегда правильный выбор косметических средств, а также городское загрязнение нарушают естественные защитные функции вашей кожи, в связи с чем она стареет быстрее», — рассказывает Жоэль. «Это привело меня к запуску концепции Epidermologie®. В лаборатории я разрабатываю косметические средства, которые учитывают наилучшие условия для баланса естественной микрофлоры кожи, а также методы лечения, подходящие для нее после нанесения мягкого очищающего молочка Lait Onctueux Capital.
К слову, очищению Мадам Сиокко уделяет самое пристальное внимание. Она считает, что пока вы не наладите процесс очищения, нет смысла покупать дорогой крем: он просто не сработает должным образом на загрязненной коже.
Очищающее молочко Lait Onctueux Capital — самый культовый продукт марки. С него и началось создание бренда. Если посмотреть на состав средства, то ему могут позавидовать многие кремы: масло жожоба, масло сладкого миндаля, витамины Е и F, экстракты хвоща полевого, календулы, арники, эфирное масло семян нероли. Молочко обеспечивает самое мягкое и деликатное очищение. Оно успокаивает, восстанавливает дыхательную функцию кожи, нормализует обменные процессы, обладает противовоспалительным и антиоксидантным эффектами, повышает иммунную защиту кожи.
«Я советую своим клиентам поделиться несколькими каплями очищающего средства для лица с детьми. Даже если они не пользуются косметикой, то, как и все, находятся в контакте с внешними факторами — такими, как загрязнение окружающей среды или бактерии, что нарушают микробиом кожи», — говорит Жоэль.
Регенерирующая маска с прополисом Masque Propolis — еще один бестселлер бренда. В составе — экстракт прополиса для укрепления и поддержания экосистемы кожи с его естественной иммунной защитой, экстракт алтея, витамин E и цветок риса — для глубокого очищения и успокаивающего эффекта. Это средство нормализует работу сальных желез, сужает поры, обладает противовоспалительным действием, увлажняет и улучшает защитную функцию кожи. Рекомендуется для всех типов (особенно для жирной и чувствительной). Маска настолько деликатно работает, что его можно использовать и при куперозе, и на воспаленных участках при акне.
Лосьон Lotion Lactée — хит Joëlle Ciocco. Это самый универсальный продукт. Он подходит для любого типа кожи (даже для чувствительной) и при любом ее состоянии. В составе — натуральные биомолочные ферменты и морской коллаген. Lotion Lactée обладает выраженным увлажняющим и противовоспалительным эффектом, успокаивает и смягчает, восстанавливает pH. Кроме того, он уменьшает раздражение после бритья. Это лосьон, который приносит покой вашей коже.
Философия бренда базируется на еще одном важном принципе — не использовать ничего чуждого человеческому организму. В составе каждого продукта — максимально эффективное сочетание растительных экстрактов в высоких концентрациях и оптимальных пропорциях. Косметика не содержит синтетических ингредиентов, а также компонентов животного происхождения.
Какие знаковые ингредиенты используются в космецевтике Joëlle Ciocco?
Кремний — это ключевой компонент в косметике Joëlle Ciocco. Он способствует регенерации клеток, то есть обновлению кожи. В линейке продуктов Joëlle Ciocco он представлен либо в виде экстракта хвоща полевого (например, в очищающем молочке для чувствительной кожи лица и шеи Lait Onctueux Capital), либо в чистом виде как органический кремний (например, в молочном лосьоне для лица Lotion Lactée и креме для лица и шеи Cytokine).
Шафран, входящий в состав крем La Crème Des Crèmes, является самой дорогой пряностью в мире, которая используется с античных времен и ценится за свои антиоксидантные свойства. Производство этого крема требует «ювелирной» работы, чтобы сохранить все целебные свойства рылец шафрана, очень хрупких и ценных.
Экстракт морских водорослей Ulva Lactuca обладает омолаживающим действием: он стимулирует синтез коллагена, а значит улучшает эластичность и упругость кожи. Этот ингредиент, например, есть в растительном лосьоне Lotion Aromatique.
В Joëlle Ciocco продумано все до мелочей. Чтобы продукт не окислялся при контакте с воздухом, оставался качественным, стерильным и активным до последней капли, его расфасовывают в «безвоздушные» помповые флаконы. Еще Жоэль придумала легендарные авторские методики скульптурного и буккального массажей для лица — все направлено на то, чтобы получить максимум от космецевтики Joëlle Ciocco.
Поделиться статьейКоллаген в виде ириски — пить или не пить, есть или не есть и в каком возрасте начинать
В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами (Википедия). В Neocell Beauty Bursts «Изысканный коллаген» 2 вида коллагена 1 и 3 типа которые восстанавливают кожу, Гиалуроновая кислота в качестве гидратора кожи и Витамин C как усилитель синтеза коллагена.Этот вид конфетно-ирисочного коллагена практически полностью съела моя 21 летняя дочка сластёна.
В посте о разнице этого вкусного коллагена и популярного California Gold Nutrition.
Neocell, Beauty Bursts, изысканный коллаген, мягкие жевательные таблетки, супер фруктовый пунш, 60 мягких жевательных таблеток $16.95
Описание от Производителя
— Не содержит лактозы
— Не содержит глютен
— Не содержит искусственных компонентов
— 2000 мг коллагена
— Пищевая добавка
— Коллаген типа 1 и 3 для упругой, гладкой кожи и для сильных волос и ногтей
— Гиалуроновая кислота для увлажнения и обновления кожи
— Полностью натуральная формула с превосходным ароматомЕще никогда не было так легко или вкусно иметь красивую и светящуюся кожу. Восхитительные и изысканные мягкие жевательные конфеты NeoCell Beauty Bursts содействуют более высокой степени абсорбации питательных веществ. Коллаген типа 1 и 3 является протеином красоты тела и укрепляет кожу, волосы и ногти. Гиалуроновая кислота известна как «природный увлажнитель» и она увлажняет кожу. Витамин С необходим для повышения количества коллагена в коже. В совокупности эти три питательных вещества красоты работают вместе для создания красивой кожи изнутри.
Рекомендации по Применению
Принимать по 2-4 жевательные таблетки ежедневно.Что имеем на самом деле — жевательные ириски с неким фруктово-ягодным вкусом, который вот так явно и не назвать гранатовым (на фотогафии упаковки гранат). Жуются хорошо, не жёсткие, а именно жевательные. Оставляют приятное «конфетное» послевкусие.Чем отличаются жевательный коллаген Neocell и рыбный пептидный California Gold Nutrition
— тем, что в жевательном только 2 вида коллагена, которые «нацеленны» в основном только на кожу и ногти. California Gold Nutrition работает дополнительно является активным «строительным материалом» для суставов и связок, Производитель вежливо умалчивает какие именно типы коллагена в составе, в совокупности его 5,000 мг , в Neocell 2000 мг но они именно целенаправленные.
— в количестве гиалуроновой кислоты (для увлажнения кожи) в Neocell 20 мг, то есть в 3 раза меньше чем в California Gold Nutrition где 60мг
— витамина С такое же соотношение Neocell 20 мг и California Gold Nutrition 60мг
— в California Gold Nutrition дополнительно есть аминокислоты из которых так же строятся наши клетки и коллаген
— California Gold Nutrition при пересчёте на дозы приёма получиется дешевле почти в 2 раза.
Информация из Википедии
Коллаген 1 типа — находится повсеместно в мягких и твёрдых тканях, в коже, костях, роговице глаза, в склере, в стенке артерий и др.
Коллаген 3 типа — находится в дерме кожи плода, стенках крупных кровеносных сосудов, ретикулярных волокнах органов кроветворения.
Я по себе не смогла отследить изменения поскольку съела всего ничего, наверное не больше 6-7 штук, остальное дочке досталось. Когда я его принесла домой и показала, то конечно же мне как всегда было сказано что то в духе «мне ничего не надо», но судя по тому что конфетки начали разбегаться довольно быстро, я поняла что лучше оставлю этот вариант для неё у меня 2 других есть, которые она ни в какую даже пробовать не хочет.
Выводы после съедения всех вкусных ирисок Neocell — работать коллаген начинает довольно быстро дней через 10 можно было с уверенностью сказать что это хороший и рабочий вариант. Видимые результаты были на ногтях рук — дочка любительница нарощенного френча и и прочих устойчивых покрытий, которые сильно портят ногтевую пластину. Ногти за 10 дней из мягких (свойственных ей от природы и плюс испорченных) превратились конечно не в ногти Россомахи, но очень хорошо уплотнились к завершению упаковки я в очереной раз услышала, что она русалка и что пора стричься, но в этот раз не услышала, что волосы у неё секутся. Так же не проявилось её сильная летная сухость пяток. Дочка съедала по 2 ириски в день, иногда забывала. Производитель рекомндует 2-4 шт в день.
При том, что коллаген от California Gold Nutrition сильно дешевле, уговаривать дочку его пить я не стану — она молодая, генетика хорошая, видимых показаний типа сухости кожи у неё нет. Чуть поскрипывают колени и побаливает спина, но это при наличии 3 х летнего ребёнка почти нормально (хотя помочь организму мини дозами мне кажется не помешало бы). Девушке 21 год, достаточно взрослая чтобы понимать и принимать запросы организма, пусть сама решает. Я же за последнее время стала поклонником коллагена, мой организм и кожа совершенно явно выглядят лучше.
Пить или не пить коллаген — конечно каждый решает для себя. Если у Вас полноценный рацион, прекрасная генетика, Вы не заниметесь спортом (на который так же нужно больше коллагена чем при банальной активности) и Вам до 20 лет, то наверное коллаген не нужен. Считается что женский организм формируется полностью до 18-20 лет и дальше начинается обратный отсчёт.
Конечно же мы все разные у всех разный генетический код с разным врождённым синтезем коллагена. Есть даже заболевание синдром Элерса—Данлоса при котром замедляется выработка коллагена, одним из таких людей является 26 летняя девушка с ником sarageurts в Инстаграмме. Вот одно из её фото, остальные можно посмотреть и восхититься тем, что она не запирается дома, а ведёт очень активную жизнь.
Пост о коллагене California Gold Nutrition — Самый популярный в нашем сообществе коллаген California Gold Nutrition
Коллаген с маслом примулы вечерней и куркумой — Irwin Naturals Коллаген
Мои посты в сообществе можно прочитать по ссылке
*** Ссылка в посте содержит реферальный код LHL059
Коллаген или желатин в чем разница и что лучше?
Хотите увеличить потребление белка, при этом получить дополнительные преимущества, такие как улучшение кожи, поддержка суставов и связок и многое другое? Посмотрите за пределы стандартного сывороточного белка и рассмотрите коллаген, желатин и гидролизат коллагена.
Скорее всего Вам, интересно, в чем же различие между коллагеном и желатином
Коллаген и желатин
Чтобы понять что такое желатин, мы должны разобраться с коллагеном. Коллаген является основным белком в соединительной ткани, коже и костях. На самом деле, у вас больше коллагена в организме, чем любого другого типа белка — он составляет 25-35% от всего белка в организме! Недостаток коллагена может вызвать широкий спектр проблем — от морщин до снижения упругости суставов.
Коллаген является мощным источником аминокислот. Хотя он является не полноценным, коллагена содержит впечатляющий профиль незаменимых аминокислот, обеспечивая 18 из 20 аминокислот.
К сожалению, мы часто выбрасываем часть пищи, которая содержит коллаген: шкуру, сухожилия, кости, мембраны и другие соединительные ткани в мясе. Поэтому вместо того, чтобы получить коллаген, мы можем съесть желатин.
Желатин — это просто приготовленная форма коллагена и это один из лучших и наиболее удобных способов употребления важных аминокислот из коллагена.
Но как насчет гидролизата коллагена?
Гидролизат коллагена (иногда называют гидролизованным коллагеном) представляет собой просто желатин, который подвергается более интенсивной обработке, чтобы разбить белки на более мелкие кусочки. Они (коллаген и гидролизат коллагена) имеют одинаковые аминокислотные профили и производятся из одного сырья, но по-разному реагируют на жидкости. В основном, единственное существенное различие между ними заключается в том, как вы используете их на кухне. Поскольку размер белка в гидролизате коллагена меньше, некоторым людям его легче усваивать.
Возможно, вам интересно — имеет ли значение, если ваш желатин производится из курицы, свинины, говядины или рыбы? Да, аминокислотный профиль немного отличаются, но не значительно. Если Вам необходима более высокая дозировка определенной аминокислоты, посмотрите на этикетки состав для сравнения. Но если нет нужды в конкретной аминокислоте, которую вы ищете, можно использовать любой желатин!
Есть ли другие способы получить коллаген?
- Непосредственно из сырья
Есть различные пути получения коллагена и желатина! Желатин получают из костей и хрящей животных, не так ли? Так костный бульон, который сделан из костей животных — это один из способов получить желатина, не покупая порошок.
Ты не привязан к кухне, чтобы получить коллаген! Вы можете получить преимущества коллагена приобретая добавки.
Если вы будете просматривать каталог коллагеновых добавок, вы заметите, что многие бренды указывают тип коллагена, который используется в их продукте. Так в чем разница?
Существует много различных типов коллагена (были идентифицированы 28), но типичные типы I, II и III являются наиболее распространенными. В приведенной ниже таблице будут показаны различия.
Если Вы покупаете чистый желатин или гидролизат коллагена, вам не нужно беспокоиться о типах коллагена. Коллаген типов I, II, III и далее — это с небольшим округление одно и тоже и особой разницы ваш организм не ощутит.
Надеемся, что детальный разбор поможет Вам избежать путаницы!
Основное руководство по коллагену — включая гидролизованный коллаген, пептиды коллагена и желатин
В продуктах питания коллаген содержится в основном в «лишних кусочках» и более жестких порезах. Например, в говядине больше всего коллагена содержится в костях, хрящах, связках и коже. Поскольку мы не садимся и не пережевываем какую-либо из этих частей на обед, нам нужен способ извлечения коллагена — или, точнее, извлечения составных частей коллагена, чтобы наши тела могли повторно собирать коллаген в нашей системе.Именно здесь появляется процесс «гидролиза», который просто определяется как процесс разрушения или отсоединения полимера, в нашем случае коллагена.
Шаг 1: Варка костей для приготовления костного бульона = частичный гидролиз
Когда вы медленно готовите кости для приготовления бульона, как мы это делали в видео в этой статье блога (ССЫЛКА НА СТАТЬЮ БЛОГА), коллаген, извлекаемый из костей, находится в форме желатина. Желатин — это более простой тип коллагена, состоящий из четырех основных аминокислот (пролина, глицина, глутамина и аланина).Белковая структура желатина позволяет ему превращаться в гель при охлаждении. Вот как Jell-O получает свое фирменное покачивание. А поскольку в процессе кипячения коллаген не полностью разрушается, а просто извлекается более простая форма белка, мы частично гидролизовали коллаген. Некоторые добавки, представленные на рынке, используют желатин, сушат его и превращают в порошок или таблетку.
Шаг 2: Полностью гидролизованный коллаген
Если вы дополнительно расщепите желатин, разделив его на гораздо меньшие группы аминокислот, называемых «пептидами», вы «полностью гидролизуете» коллаген.Существует множество методов полного гидролиза, и все они имеют комбинацию физических, химических или ферментативных обработок.
Например, один метод извлечения коллагена из говяжьей шкуры включает следующее: сначала шкуры помещают в яму для известковой суспензии на срок до трех месяцев, что ослабляет коллагеновые связи. Затем шкуры промывают для удаления извести, а коллаген экстрагируют кипящей водой. Извлеченный коллаген концентрируется в испарителе, сушится с помощью барабанных сушилок и измельчается для получения порошка, который обычно продается как добавка коллагена.(4) Ферментативный гидролиз также широко используется с использованием ферментов класса протеаз. (7)
Считайте полностью гидролизованный коллаген полностью предварительно переваренным, что делает его более доступным для нашего организма. Конечный результат часто называют гидролизатом коллагена или иногда пептидами коллагена, оба относятся к одному и тому же.
В отличие от желатина, пептиды коллагена не образуют гель и могут растворяться как в теплой, так и в холодной воде. Исследования показали, что когда мы потребляем отдельные пептиды, они непосредственно всасываются в кровоток и накапливаются в наших костях, коже и суставах (2).
Коллаген— Википедия, Бесплатная энциклопедия
Найти Коллаген Из Википедии, свободной энциклопедии. Коллаген / ˈkɒlədʒɨn / представляет собой группу природных белков
Просмотры 19 Загрузки 2 Размер файла 275KB
Отчет DMCA / Copyright
СКАЧАТЬ ФАЙЛ
Рекомендовать историиПредварительный просмотр цитирования
Поиск
Коллаген Из Википедии, свободной энциклопедии
Коллаген / ˈkɒlədʒɨn / — это группа белков природного происхождения, обнаруженных у животных, особенно в плоти и соединительной ткани млекопитающих.[1] Это основной компонент соединительной ткани и самый распространенный белок у млекопитающих [2], составляющий от 25% до 35% от общего содержания белка в организме. Коллаген в форме удлиненных фибрилл в основном содержится в фиброзных тканях, таких как сухожилия, связки и кожа, а также в большом количестве в роговице, хрящах, костях, кровеносных сосудах, кишечнике и межпозвоночном диске. В мышечной ткани он служит основным компонентом эндомизия. Коллаген составляет от одного до двух процентов мышечной ткани и составляет 6% веса сильных сухожильных мышц.[3] Желатин, который используется в пище и промышленности, представляет собой необратимо гидролизованный коллаген.
Содержание 1 История и предыстория 2 Молекулярная структура 3 Фибриллярная структура 4 Типы и ассоциированные нарушения 5 Окрашивание 6 Синтез 6.1 Аминокислоты 6.2 Образование коллагена I 6.3 Синтетический патогенез 7 Использование 7.1 Промышленное использование 8 Медицинское применение 8.1 Сердечное применение 8.2 Косметическая хирургия 8.3 Реконструктивное хирургическое использование 8.4 При лечении ран использует 9 летописи окаменелостей 10 Искусство 11 См. Также 12 Ссылки 13 Внешние ссылки
История и предыстория
Тропоколлаген, тройная спираль
На протяжении десятилетий исследований молекулярные и упаковочные структуры коллагена ускользали от ученых.Первое свидетельство того, что он обладает регулярной структурой на молекулярном уровне, было представлено в середине 1930-х годов [4] [5]. С того времени многие выдающиеся ученые, в том числе лауреаты Нобелевской премии Крик, Полинг, Рич и Йонат и другие, в том числе Бродский, Берман и Рамачандран, сосредоточились на конформации мономера коллагена. Несколько конкурирующих моделей, хотя и правильно описывающих конформацию каждой отдельной пептидной цепи, уступили место трехспиральной модели «Мадраса», которая предоставила по существу правильную модель четвертичной структуры молекулы [6] [7] [8], хотя это модель еще требовала доработки.[9] [10] [11] [12] Структура упаковки коллагена не была определена в той же степени за пределами фибриллярных типов коллагена, хотя давно известно, что она гексагональная … или квазигексагональная. [ 13] [14] [15] Как и в случае с его мономерной структурой, несколько противоречивых моделей утверждали, что либо упаковка молекул коллагена «пластинчатая», либо микрофибриллярная. [16] [17] Микрофибриллярная структура коллагеновых фибрилл в сухожилиях, роговице и хрящах была непосредственно отображена с помощью электронной микроскопии.[18] [19] [20] В 2006 году микрофибриллярная структура сухожилия взрослого человека, описанная Фрейзером, Миллером и Вессом (среди прочих), была подтверждена как наиболее близкая к наблюдаемой структуре, хотя она упрощала топологическую прогрессию соседние молекулы коллагена и, следовательно, не предсказали правильную конформацию прерывистой D-периодической пентамерной структуры, называемой просто: микрофибрилла. [21]
Молекулярная структура Молекула тропоколлагена или коллагена представляет собой субъединицу более крупных агрегатов коллагена, таких как фибриллы.При длине около 300 нм и диаметре 1,5 нм он состоит из трех полипептидных нитей (называемых альфа-цепями), каждая из которых имеет конформацию левой спирали (ее название не следует путать с обычно встречающейся альфа-спиралью, правосторонняя структура). Эти три левые спирали скручены вместе в правую спиральную спираль, тройную спираль или «суперспираль», кооперативную четвертичную структуру, стабилизированную многочисленными водородными связями. С коллагеном типа I и, возможно, со всеми фибриллярными коллагенами, если не со всеми коллагенами, каждая тройная спираль объединяется в правостороннюю суперспираль, называемую микрофибриллами коллагена.Каждая микрофибрилла пересекается с соседними микрофибриллами до такой степени, что можно предположить, что они индивидуально нестабильны, хотя внутри коллагеновых фибрилл они настолько упорядочены, что являются кристаллическими. Отличительной особенностью коллагена является регулярное расположение аминокислот в каждой из трех цепей этих субъединиц коллагена. Последовательность часто следует схеме Gly-Pro-X или Gly-X-Hyp, где X может быть любым из различных других аминокислотных остатков. Пролин или гидроксипролин составляют около 1/6 всей последовательности.Поскольку на долю глицина приходится 1/3 последовательности, это означает, что примерно половина последовательности коллагена не является глицином, пролином или гидроксипролином, факт, который часто упускается из виду из-за отвлечения внимания необычным характером GX1X2 альфа-пептидов коллагена. Такое регулярное повторение и высокое содержание глицина обнаруживается только в нескольких других волокнистых белках, таких как фиброин шелка. Около 75-80% шелка состоит (приблизительно) -Gly-Ala-Gly-Ala- с 10% серина, а эластин богат глицином, пролином и аланином (Ala), боковая группа которого представляет собой небольшую инертную метильную группу. .Такой высокий уровень глицина и регулярные повторы никогда не встречаются в глобулярных белках, за исключением очень коротких участков их последовательности. Химически реактивные боковые группы не нужны в структурных белках, так как они есть в ферментах и транспортных белках; однако коллаген — это не только структурный белок. Благодаря своей ключевой роли в определении клеточного фенотипа, клеточной адгезии, регуляции ткани и инфраструктуры, многие участки ее небогатых пролином областей играют роль ассоциации / регуляции клеток или матрикса.Относительно высокое содержание пролиновых и гидроксипролиновых колец с их геометрически ограниченными карбоксильными и (вторичными) аминогруппами, а также большое количество глицина объясняют тенденцию отдельных полипептидных цепей спонтанно образовывать левые спирали без какой-либо внутрицепной водородная связь. Поскольку глицин является самой маленькой аминокислотой без боковой цепи, он играет уникальную роль в волокнистых структурных белках. В коллагене Gly требуется в каждой третьей позиции, потому что сборка тройной спирали помещает этот остаток во внутреннюю часть (ось) спирали
, где нет места для большей боковой группы, чем одиночный атом водорода глицина.По той же причине кольца Pro и Hyp должны быть направлены наружу. Эти две аминокислоты помогают стабилизировать тройную спираль — Hyp даже больше, чем Pro; их более низкая концентрация требуется у таких животных, как рыбы, температура тела которых ниже, чем у большинства теплокровных животных.
Фибриллярная структура Субъединицы тропоколлагена спонтанно самоорганизуются с равномерно смещенными концами в еще более крупные массивы во внеклеточных пространствах тканей. [22] [23] В фибриллярных коллагенах молекулы разнесены друг от друга примерно на 67 нм (единица, которая обозначается как «D» и изменяется в зависимости от состояния гидратации агрегата).Каждый D-период содержит четыре плюс одна фракция молекул коллагена, потому что 300 нм, разделенные на 67 нм, не дают целого числа (длина молекулы коллагена, деленная на ступенчатое расстояние D). Следовательно, в каждом повторении D-периода микрофибриллы есть часть, содержащая пять молекул в поперечном сечении, называемая «перекрытием», и часть, содержащая только четыре молекулы, называемая «разрывом» [21]. Тройные спирали также расположены в виде гексагональной или квазигексагональной решетки в поперечном сечении как в области зазора, так и в области перекрытия.[13] [21] Существует некоторое ковалентное сшивание внутри тройных спиралей и различное количество ковалентных сшивок между спиралями тропоколлагена, образующими хорошо организованные агрегаты (такие как фибриллы). [24] Более крупные фибриллярные пучки формируются с помощью нескольких различных классов белков (включая разные типы коллагена), гликопротеинов и протеогликанов, чтобы сформировать разные типы зрелых тканей из альтернативных комбинаций одних и тех же ключевых игроков. [23] Нерастворимость коллагена была препятствием для изучения мономерного коллагена, пока не было обнаружено, что тропоколлаген из молодых животных может быть извлечен, поскольку он еще не полностью сшит.Однако достижения в области методов микроскопии (электронная микроскопия (ЭМ) и атомно-силовая микроскопия (АСМ)) и дифракция рентгеновских лучей позволили исследователям получать все более подробные изображения структуры коллагена in situ. Эти более поздние достижения особенно важны для лучшего понимания того, каким образом структура коллагена влияет на коммуникацию между клетками и клеточным матриксом, и как ткани строятся в процессе роста и восстановления и изменяются в процессе развития и болезни. [25] [26] Например, с помощью наноиндентирования на основе АСМ было показано, что отдельная фибрилла коллагена представляет собой гетерогенный материал в осевом направлении со значительно разными механическими свойствами в областях зазора и перекрытия, что коррелирует с его различной молекулярной организацией в этих двух областях.[27] Коллагеновые фибриллы представляют собой полукристаллические агрегаты молекул коллагена. Коллагеновые волокна представляют собой пучки фибрилл. Фибриллы / агрегаты коллагена расположены в различных комбинациях и концентрациях в различных тканях для обеспечения различных свойств ткани. В кости целые тройные спирали коллагена расположены в параллельном шахматном порядке. Промежутки в 40 нм между концами субъединиц тропоколлагена (примерно равные области зазора), вероятно, служат центрами зародышеобразования для осаждения длинных твердых и мелких кристаллов минерального компонента, которым (примерно) является гидроксиапатит, Ca10 (PO4) 6. (ОН) 2 с некоторым количеством фосфата.Таким образом, некоторые виды хрящей превращаются в кости. Коллаген I типа придает костям прочность на разрыв.
Типы и связанные с ними нарушения Коллаген встречается во многих частях тела. Однако более 90% коллагена в организме относится к первому типу. [28] На сегодняшний день идентифицировано и описано 28 типов коллагена. Пять наиболее распространенных типов: Коллаген I: кожа, сухожилие, сосудистая лигатура, органы, кость (основной компонент кости)
Коллаген II: хрящ (основной компонент хряща) Коллаген III: сетчатый (основной компонент ретикулярных волокон), обычно встречается рядом с типом I.Коллаген IV: образует основы базальной мембраны клетки Коллаген V: поверхности клеток, волосы и плацента Заболевания, связанные с коллагеном, чаще всего возникают из-за генетических дефектов или недостатка питательных веществ, которые влияют на биосинтез, сборку, посттрансляционную модификацию, секрецию или другие процессы, участвующие в нормальном коллагене производство. Тип
Примечания
Ген (ы)
I
Это самый распространенный коллаген в организме человека. Он присутствует в рубцовой ткани, конечном продукте восстановления тканей.Это COL1A1, COL1A2, обнаруженные в сухожилиях, коже, стенках артерий, эндомизии миофибрилл, фиброхряще и органической части костей и зубов.
несовершенный остеогенез, синдром Элерса – Данлоса, детский кортикальный гиперостоз, известный как болезнь Каффи
II
Гиалиновый хрящ составляет 50% всего хрящевого белка. COL2A1 Стекловидное тело глаза.
Коллагенопатия, типы II и XI
III
Это коллаген грануляционной ткани, который быстро вырабатывается молодыми фибробластами до того, как синтезируется более жесткий коллаген типа I COL3A1.Ретикулярное волокно. Также обнаруживается в стенках артерий, коже, кишечнике и матке
Синдром Элерса-Данлоса, контрактура Дюпюитрена
базальная пластинка; хрусталик глаза. Также служит частью фильтрации COL4A1, COL4A2, COL4A3, COL4A4, COL4A5,
Расстройства
Синдром Альпорта,
, IV
,
,
система в капиллярах почек COL4A6 и почечных клубочков.
В
наиболее интерстициальная ткань, ассоциированная.с типом I, ассоциированным с плацентой
VI
самой интерстициальной ткани, ассоциированной. с типом I
VII
образует закрепляющие фибриллы в дермо-эпидермальных соединениях
,
,
г., синдром Гудпастура
COL5A1, COL5A2, COL5A3
A2COL60002, COL60002 Classical, COL60002, синдром Элерса-Данлос6Миопатия Ульриха и миопатия Бетлема
COL7A1
Буллезный эпидермолиз dystrophica
COL8A1, COL8A2
Задняя полиморфная дистрофия роговицы 2
000VIII хрящевые клеткис фибриллами COL9A1, COL9A2, COL9A3 типа II и XI
— EDM2 и EDM3
X
гипертрофический и COL10A1 минерализующий хрящ
Дисплазия метафизов Шмида
XI
XI хрящ
XI
XI
XI
Коллаген FACIT, взаимодействует с COL12A1 типа I, содержащим фибриллы, декорин и гликозаминогликаны.
—
XIII
Трансмембранный коллаген, взаимодействует с интегрином a1b1, фибронектином и компонентами базальных мембран, такими как нидоген и перлекан.
COL13A1
—
XIV
Коллаген FACIT
COL14A1
—
COL11A1, COL11A2
XV
—
000
000
000
000
000
000000000
000000
000
000 и некоторые формы соединительного буллезного эпидермолиза
XVII
трансмембранный коллаген, также известный как COL17A1 как BP180, белок 180 кДа
XVIII
источник эндостатина COL18A1
—
XIX
—
XIX
XIX
XX
—
COL20A1
—
XXI
Коллаген FACIT
COL21A1
—
XXII
—
000000 XXII—
000COL22A1 —
XXIV
—
COL24A1
—
XX V
—
COL25A1
—
XXVI
—
EMID2
—
XXVII —
COL27A1
—
XXVIII2000 XXVIII http: // www.ncbi.nlm.nih.gov/sites/entrez? db = gene & cmd = Retrieve & dopt = Graphics & list_uids = 256076) дерматит [29]эпидермальный коллаген
В дополнение к вышеупомянутым нарушениям при склеродермии происходит чрезмерное отложение коллагена.
Окрашивание В гистологии коллаген ярко-эозинофильный (розовый) на стандартных предметных стеклах H&E. Краситель метиловый фиолетовый можно использовать для окрашивания коллагена в образцах тканей. Краситель метиловый синий также можно использовать для окрашивания коллагена, при необходимости доступны иммуногистохимические красители.Лучшее пятно для дифференциации коллагена от других волокон — трихромное пятно Массона.
Синтез Аминокислоты Коллаген имеет необычный аминокислотный состав и последовательность: глицин (Gly) находится почти в каждом третьем остатке
Пролин (Pro) составляет около 17% коллагена. перевод. Эти аминокислоты находятся в определенных местах относительно глицина и посттрансляционно модифицируются различными ферментами, оба из которых требуют витамина С в качестве кофактора.Гидроксипролин (Hyp), производный от пролина. Гидроксилизин (Hyl), полученный из лизина (Lys). В зависимости от типа коллагена различное количество гидроксилизинов гликозилировано (в основном с присоединенными дисахаридами). Кортизол стимулирует расщепление (кожного) коллагена на аминокислоты. [30]
Образование коллагена I Большинство коллагенов образуется сходным образом, но для типа I характерен следующий процесс: 1. Внутри клетки 1. Два типа пептидных цепей образуются во время трансляции на рибосомах вдоль шероховатого эндоплазматического ретикулума (RER): Действие альфа-1 и альфа-2 цепей лизилоксидазы.Эти пептидные цепи (известные как препроколлаген) имеют регистрирующие пептиды на каждом конце и сигнальный пептид. 2. Полипептидные цепи высвобождаются в просвет RER. 3. Сигнальные пептиды расщепляются внутри RER, и теперь эти цепи известны как про-альфа-цепи. 4. Внутри просвета происходит гидроксилирование аминокислот лизина и пролина. Этот процесс зависит от кофактора аскорбиновой кислоты (витамина С). 5. Происходит гликозилирование определенных остатков гидроксилизина. 6. Тройная спиральная структура формируется внутри эндоплазматической сети из каждых двух цепей альфа-1 и одной цепи альфа-2.7. Проколлаген доставляется в аппарат Гольджи, где он упаковывается и секретируется путем экзоцитоза. 2. Вне клетки 1. Регистрационные пептиды расщепляются, а тропоколлаген образуется проколлагеновой пептидазой. 2. Множественные молекулы тропоколлагена образуют фибриллы коллагена посредством ковалентного сшивания (альдольная реакция) лизилоксидазой, которая связывает остатки гидроксилизина и лизина. Множественные коллагеновые фибриллы образуют коллагеновые волокна. 3. Коллаген может быть прикреплен к клеточным мембранам через несколько типов белков, включая фибронектин и интегрин.
Синтетический патогенез Дефицит витамина С вызывает цингу, серьезное и болезненное заболевание, при котором дефектный коллаген препятствует образованию прочной соединительной ткани. Десны портятся и кровоточат, с потерей зубов; кожа меняет цвет, а раны не заживают. До восемнадцатого века это состояние было печально известно среди длительных военных, особенно военно-морских, экспедиций
gy, gg, во время которых участники лишались продуктов, содержащих витамин C.
y, p
y
,
Аутоиммунный такие заболевания, как красная волчанка или ревматоидный артрит [31], могут поражать здоровые коллагеновые волокна.Многие бактерии и вирусы обладают факторами вирулентности, которые разрушают коллаген или препятствуют его производству.
Использование Коллаген — один из длинных волокнистых структурных белков, функции которого сильно отличаются от функций глобулярных белков, таких как ферменты. Плотные пучки коллагена, называемые коллагеновыми волокнами, являются основным компонентом внеклеточного матрикса, который поддерживает большинство тканей и придает клеточную структуру извне, но коллаген также находится внутри некоторых клеток. Коллаген обладает большой прочностью на разрыв и является основным компонентом фасций, хрящей, связок, сухожилий, костей и кожи.[32] [33] Наряду с мягким кератином, он отвечает за прочность и эластичность кожи, а его разрушение приводит к появлению морщин, которые сопровождают старение. [34] [35] Он укрепляет кровеносные сосуды и играет роль в развитии тканей. Он присутствует в роговице и хрусталике глаза в кристаллической форме. Он также используется в косметической хирургии и хирургии ожогов. Гидролизованный коллаген может играть важную роль в регулировании веса, поскольку в качестве белка его можно выгодно использовать из-за его насыщающей способности.
Промышленное использование Если коллаген достаточно денатурирован, напримерграмм. при нагревании три цепи тропоколлагена частично или полностью разделяются на глобулярные домены, содержащие вторичную структуру, отличную от нормальной полипролина коллагена II (PPII), например случайные катушки. Этот процесс описывает образование желатина, который используется во многих пищевых продуктах, включая ароматизированные желатиновые десерты. Помимо продуктов питания, желатин использовался в фармацевтической, косметической и фотографической промышленности. [36] С точки зрения питания, коллаген и желатин являются единственным источником белка низкого качества, поскольку они не содержат всех незаменимых аминокислот в тех пропорциях, которые требуются человеческому организму, — они не являются «полноценными белками» (в соответствии с определением пищи. наука, а не то, что они частично структурированы).Производители пищевых добавок на основе коллагена заявляют, что их продукты могут улучшить качество кожи и ногтей, а также здоровье суставов. Однако основные научные исследования не показали убедительных доказательств в поддержку этих утверждений. [Необходима цитата] Люди с проблемами в этих областях с большей вероятностью будут страдать от других основных заболеваний (таких как нормальное старение, сухая кожа, артрит и т. Д.). чем просто дефицит белка. От греческого слова «клей», колла, слово «коллаген» означает «производитель клея» и относится к раннему процессу кипячения кожи и сухожилий лошадей и других животных для получения клея.Коллагеновый клей использовался египтянами около 4000 лет назад, а коренные американцы использовали его для изготовления луков около 1500 лет назад. Самый старый клей в мире, возраст которого насчитывает более 8000 лет, оказался коллагеном — он использовался в качестве защитной подкладки на веревочных корзинах и вышитых тканях, а также для скрепления посуды; также в орнаментах крест-накрест на человеческих черепах. [37] Коллаген обычно превращается в желатин, но выживает из-за засухи. Клеи для животных термопластичны, снова размягчаются при повторном нагревании, и поэтому они все еще используются при изготовлении музыкальных инструментов, таких как прекрасные скрипки и гитары, которые, возможно, придется снова открывать для ремонта — применение несовместимо с жесткими синтетическими пластиковыми клеями, которые являются долговечными.Сухожилия и шкуры животных, в том числе кожа, тысячелетиями использовались для изготовления полезных предметов. Желатин-резорцин-формальдегидный клей (с заменой формальдегида менее токсичным пентандиалом и этандиалом) использовался для заживления экспериментальных разрезов в легких кролика. [38]
Медицинское применение
Применение в кардиологии Четыре плотных коллагеновых клапанных кольца, центральное тело сердца и сердечный скелет сердца гистологически связаны с миокардом. Вклад коллагена в работу сердца в целом представляет собой важный, уникальный и движущийся прочный якорь, противоположный жидкостному механизму крови в сердце.Эта структура представляет собой непроницаемый брандмауэр, который исключает как кровь, так и электрическое влияние (кроме анатомических каналов) от верхних к нижним камерам сердца. В качестве доказательства можно утверждать, что фибрилляция предсердий почти никогда не переходит в фибрилляцию желудочков. Индивидуальные створки клапана удерживаются в форме паруса коллагеном под переменным давлением. Отложение кальция в коллагене происходит как естественное следствие старения. Фиксированные точки, богатые кальцием, в движущемся отображении крови и мышц позволяют современным технологиям визуализации сердца достигать соотношений, в основном указывающих кровь на входе в сердце и кровь на выходе из сердца.Специализированная визуализация, такая как подсчет кальция, иллюстрирует полезность этой методологии, особенно у стареющих пациентов, подверженных патологии коллагеновой основы.
Косметическая хирургия Коллаген широко используется в косметической хирургии в качестве лечебного средства для ожоговых пациентов при реконструкции костей и в различных стоматологических, ортопедических и хирургических целях. Как человеческий, так и бычий коллаген широко используется в качестве кожных наполнителей для лечения морщин и старения кожи. [35] Некоторые интересные места: 1.при косметическом применении есть вероятность возникновения аллергических реакций, вызывающих длительное покраснение; тем не менее, это может быть практически устранено простым и незаметным тестированием пластыря перед использованием в косметических целях, и 2. большая часть медицинского коллагена получена из молодняка крупного рогатого скота (крупного рогатого скота) от сертифицированных животных, свободных от губчатой энцефалопатии крупного рогатого скота. Большинство производителей используют животных-доноров либо из «закрытых стад», либо из стран, в которых никогда не было зарегистрировано случаев BSE, таких как Австралия, Бразилия и Новая Зеландия.3. Свиная (свиная) ткань также широко используется для производства коллагенового листа для различных хирургических целей. 4. Альтернативы использованию собственного жира, гиалуроновой кислоты или полиакриламидных гелей, которые легко доступны.
Использование в реконструктивной хирургии Коллагены широко используются в создании искусственных заменителей кожи, используемых при лечении тяжелых ожогов. Эти коллагены могут быть получены из источников крупного рогатого скота, лошади или свиньи и даже человека и иногда используются в сочетании с силиконами, гликозаминогликанами, фибробластами, факторами роста и другими веществами.Коллаген также продается в виде таблеток в коммерческих целях в качестве добавки для улучшения подвижности суставов с плохими рекомендациями [39]. Поскольку белки перед всасыванием расщепляются на аминокислоты, коллаген, принимаемый перорально, не может повлиять на соединительную ткань в организме, за исключением эффекта отдельных аминокислотных добавок. Хотя он не может всасываться через кожу, в настоящее время коллаген используется в качестве основного ингредиента для некоторых косметических средств. [40] Коллаген также часто используется в научных исследованиях для культивирования клеток, изучения поведения клеток и клеточных взаимодействий с внеклеточной средой.[41] Такие поставщики, как Trevigen (http://www.trevigen.com/angiocell/cultrex.php), производят крысиный и бычий коллаген I и мышиный коллаген IV.
Wound Care Management использует
Коллаген — один из ключевых природных ресурсов организма и компонент кожной ткани, который может принести пользу на всех этапах процесса заживления ран. Когда коллаген становится доступным для ложа раны, может произойти закрытие. Таким образом, можно избежать ухудшения состояния раны, за которым иногда могут следовать такие процедуры, как ампутация. На протяжении 4 фаз заживления ран коллаген выполняет следующие функции при заживлении ран: • Управляющая функция: волокна коллагена служат для направления фибробластов.Фибробласты мигрируют по матрице соединительной ткани. • Хемотаксические свойства: большая площадь поверхности коллагеновых волокон может привлекать фиброгенные клетки, которые помогают в заживлении. • Зарождение ядра: коллаген в присутствии определенных нейтральных молекул соли может действовать как зародышеобразователь, вызывая образование фибриллярных структур. Коллагеновая повязка на рану может служить ориентиром для определения нового отложения коллагена и роста капилляров. • Гемостатические свойства: тромбоциты крови взаимодействуют с коллагеном, образуя гемостатическую пробку.
Летопись окаменелостей Поскольку для синтеза коллагена требуется высокий уровень атмосферного кислорода, сложные животные, возможно, не смогли бы развиваться, пока атмосфера не стала достаточно кислородной для синтеза коллагена. [42] Происхождение коллагена могло способствовать формированию кутикулы, оболочки и мышц. Однако сохранение коллагена в летописи окаменелостей очень мало [43]. Появляется все больше свидетельств — которые остаются спорными — что коллаген сохранился в образцах динозавров, датированных 80 миллионами лет назад.[44] Также стоит отметить актинофибриллы, волокна коллагена, присутствующие на крыльях птерозавров.
Искусство Джулиан Фосс-Андреа создал скульптуры из бамбука и нержавеющей стали на основе структуры коллагена. Его работа «Unraveling Collagen», по его словам, является «метафорой старения и роста». [45] [46]
См. Также Гидролизованный коллаген, распространенная форма, в которой коллаген продается в качестве добавки. Животный клей Желатин Волокнистый белок Остеоид, коллагеносодержащий компонент кости
Скульптура Джулиана Фосс-Андреэ «Распадающийся коллаген» (2005 г.), нержавеющая сталь, высота 11 футов 3 дюйма (3.Söderhäll, C .; Marenholz, I .; Кершер, Т .; Рюшендорф, Ф; Rüschendorf, F .; Esparza-Gordillo, J .; и др., C; Mayr, G et al. (2007). «Варианты нового гена эпидермального коллагена (COL29A1) связаны с атопическим дерматитом». PLoS Biology 5 (9): e242. DOI: 10.1371 / journal.pbio.0050242 (http://dx.doi.org/10.1371%2Fjournal.pbio.0050242). PMC 1971127 (http://www.pubmedcentral.gov/articlerender.fcgi?tool=pmcentrez&artid=1971127). PMID 17850181 (http://www. Houck J C; Sharma V K; Patel Y M; Гладнер Дж. А. (1968) «Индукция коллагенолитических и протеолитических
30.
31.
32. 33.
34. 35. 36. 37.
38.
39. 40.
41. 42. 43. 44.
45.
46.
Houck, JC; Шарма, В. К .; Patel, Y.M .; Гладнер, Дж. А. (1968). Индукция коллагенолитической и протеолитической активности противовоспалительными препаратами в коже и фибробластах ». Биохимическая фармакология 17 (10): 2081-2090. doi: 10.1016 / 0006-2952 (68)
-2 (http://dx.doi.org /10.1016%2F0006-2952%2868%29-2). PMID 4301453 (http: // www.Швейцер, Х. .; Zheng, W. .; Орган, Л. .; Avci, R. .; Суо, З. .; Фреймарк, М. .; Лебле, С. .; Дункан, Б. и другие.; Вэнься Чжэн, 1 Крис Л. Орган, 3 Реджеп Авчи, 4 Чжийонг Суо, 4 Лиза М. Фреймарк, 5 Валери С. Леблеу, 6,7 Майкл Б. Дункан, 6,7 Мэтью Г. Вандер Хайден, 8 Джон М. Невеу, 9 Уильям С. Лейн, 9 Джон С. Коттрелл, 10 Джон Р. Хорнер, 11 Льюис К. Кэнтли, 5,12 Рагу Каллури, 6,7,13 Джон М. Асара5,14, * (май 2009 г.). «Биомолекулярная характеристика и белковые последовательности кампанского гадрозавра B. Canadensis».Интервью с J. Voss-Andreae «Seeing Under the Surface» в Seed Magazine (http://seedmagazine.com/news/2006/05/seeing_below_the_surface.php)Внешние ссылки The Collagen Protein (http://macromoleculeinsights.com) /collagen.php) Вариант ассортимента коллагеновых продуктов (http://sstwo-mall.com) 12 типов коллагена (http://themedicalbiochemistrypage.org/extracellularmatrix.html) База данных мутаций коллагена типа I и типа III (http: / /www.le.ac.uk/genetics/collagen/) Science.dirbix Collagen (http: // science.dirbix.com/biology/collagen) Калькулятор стабильности коллагена (http://compbio.cs.princeton.edu/csc/) Компьютерная анимация сборки коллагенов типа I и типа IV (http://www.mc. vanderbilt.edu/cmb/collagen/) Интерфейс интегрин-коллаген, PMAP (http://www.youtube.com/watch?v=_a8q2OWrdvM) (Карта протеолиза) — анимационная модель связывания интегрин-коллаген, PMAP (http: / /www.youtube.com/watch?v=8BMFqRmbbes) (Карта протеолиза) — элемент анимационного атома коллагена и интегрина, PMAP (http://www.youtube.com / watch? v = 8L3a7oqQPRY) (Карта протеолиза) — анимация Получено с «http://en.wikipedia.org/wiki/Collagen» Категории: Структурные белки | Пищевые загустители | Интегрины | Collagens Последнее изменение этой страницы: 31 августа 2011 г., 06:08. Текст доступен по лицензии Creative Commons Attribution-ShareAlike; могут применяться дополнительные условия. См. Подробности в Условиях использования. Wikipedia® является зарегистрированным товарным знаком некоммерческой организации Wikimedia Foundation, Inc.
Большая кошка — Википедия | WordDisk
Термин « большая кошка » обычно используется для обозначения любого из пяти ныне живущих представителей рода Panthera , а именно льва, тигра, ягуара, леопарда и снежного барса, а также гепарда, не являющегося пантерией. и пума.[1] [2] За исключением последних трех, эти виды могут рычать.
Несмотря на огромные различия в размерах, разные виды кошек очень похожи как по строению, так и по поведению, за исключением гепарда, который значительно отличается от других больших и маленьких кошек. Все кошки — плотоядные животные, а некоторые — эффективные хищники. [3] Их родные ареалы включают Америку, Африку и Азию; ареал леопарда распространяется также на европейскую часть России.
Рев
Способность рычать исходит от удлиненной и специально адаптированной гортани и подъязычной кости.[4] Гортань прикреплена к подъязычной кости, которая свисает с ряда костей. Эта последовательность костей, от которых свисает подъязычная кость, — это тимпанхояльная, стилогальная, эпигиальная и цератогиальная; они расположены в нижней челюсти и черепе. [5] В гортани есть голосовые складки, которые образуют структуру, необходимую для растяжения связок до длины, создающей эффект грохота. Эта ткань состоит из толстого коллагена и эластичного волокна, которое становится более плотным по мере приближения к эпителиальной слизистой оболочке [6]. Когда эта большая подушечка складывается, она создает низкую собственную частоту, вызывая вибрацию хрящевых стенок гортани.Когда он начинает вибрировать, звук переходит от высокого к низкому сопротивлению воздуха, что и вызывает рев.
Гортань у льва самая длинная, что дает ему самый сильный рык. Рев в хороших условиях слышен на расстоянии 8 и даже 10 км. [7] Все пять дошедших до нас представителей рода Panthera содержат эту удлиненную подъязычную кость, но из-за различий в гортани снежный барс не может рычать. В отличие от ревущих кошек в их семье, снежный барс отличается отсутствием большой подушечки из фиброэластичной ткани, обеспечивающей большую голосовую складку.
Угрозы
Основные угрозы для больших кошек зависят от географического положения, но в первую очередь это разрушение среды обитания и браконьерство. В Африке на многих крупных кошек охотятся скотоводы или государственные служащие по контролю за животными. Существуют определенные охраняемые территории, где обитают большие и исключительно заметные популяции африканских леопардов, львов и гепардов, такие как Ботсванский Чобе, Кенийский Масаи Мара и Танзанийский Серенгети. Скорее, именно за пределами этих заповедников охота представляет собой доминирующую угрозу для крупных хищников.[8]
В Соединенных Штатах 19 штатов запретили владение большими кошками и другими опасными экзотическими животными в качестве домашних животных, а Закон о безопасности диких животных в неволе запрещает продажу и транспортировку этих животных между штатами [9]. Первоначальный Закон о безопасности диких животных в неволе (CWSA) был подписан 19 декабря 2003 г. [10] Для решения проблем, связанных с ростом торговли некоторыми видами крупных кошек, правила CWSA были усилены законом, принятым 17 сентября 2007 г. [11] В этих правилах рассматриваются следующие виды крупных кошек: лев, тигр, леопард, снежный барс, дымчатый леопард, гепард, ягуар, пума и любой гибрид этих видов (лигер, тигон и т. Д.)). Частная собственность не запрещена, но закон запрещает перевозку, продажу или покупку таких животных в межгосударственной или иностранной торговле. Хотя эти правила, по-видимому, обеспечивают прочную правовую основу для контроля торговли с крупными кошками, международные организации, такие как Всемирный фонд дикой природы (WWF), призвали США к дальнейшему укреплению этих законов. WWF обеспокоен тем, что недостатки в существующих правилах США могут непреднамеренно способствовать подпитке черного рынка частей тигра.[12]
Сохранение
Приют для животных предоставляет животным убежище, чтобы они могли жить своей естественной жизнью в защищенной среде. Обычно эти приюты для животных — это организации, которые предоставляют приют большим кошкам, частные владельцы которых больше не могут или не хотят заботиться о своих больших кошках. Однако использование слова приют в названии организации само по себе не гарантирует, что это настоящий приют для животных в смысле убежища. Чтобы быть принятыми Службой охраны рыбных ресурсов и диких животных США (FWS) в качестве добросовестного заповедника для животных и иметь право на освобождение от запрета на межгосударственное перемещение больших кошек в соответствии с Законом о безопасности диких животных в неволе (CWSA), организации должны соответствовать требованиям следующие критерии: [13]
- Должна быть некоммерческой организацией, освобожденной от налогообложения согласно разделу 501 (а) Налогового кодекса
- Нельзя заниматься коммерческой торговлей крупными видами кошек, включая их потомство, части и изделия из них
- Нельзя разводить больших кошек
- Запрещается прямой контакт между большими кошками и публикой на их объектах
- Необходимо вести учет операций с застрахованными кошками
- Должен разрешать службе инспектировать свои помещения, записи и животных в разумные часы
Виды
- Семья Felidae
- Подсемейство Pantherinae
- Род Panthera
- Тигр, Panthera tigris (Азия)
- Lion, Panthera leo (Африка к югу от Сахары, лес Гир в Индии; исчез в бывшем ареале Юго-Восточной Европы, Ближнего Востока и большей части Азии)
- Jaguar, Panthera onca (Америка, от юго-запада США до северной Аргентины)
- Леопард, Panthera pardus (Азия, Африка и европейская часть России) [14]
- Снежный барс, Panthera uncia (син. Uncia uncia — горы Центральной и Южной Азии)
- Род Panthera
- Подсемейство Felinae
- Подсемейство Pantherinae
Evolution
По оценкам, предки большинства больших кошек отделились от Felinae около 6,37 миллиона лет назад. [15] Felinae, с другой стороны, включает в себя в основном кошек маленького и среднего размера, включая домашних кошек, а также некоторых более крупных кошек, таких как пума и гепард. [16]
Исследование 2010 года, опубликованное в журнале Molecular Phylogenetics and Evolution , дало понимание точных эволюционных взаимоотношений больших кошек.[17] Исследование показывает, что снежный барс и тигр являются родственными видами, а лев, леопард и ягуар более тесно связаны друг с другом. Тигр и снежный барс отделились от предков больших кошек примерно на 3,9 млн лет. Затем тигр превратился в уникальный вид к концу эпохи плиоцена, примерно 3,2 млн лет назад. Предки льва, леопарда и ягуара отделились от других крупных кошек в возрасте 4,3–3,8 млн лет. Между 3,6–2,5 млн лет назад ягуар отошел от предка львов и леопардов.Львы и леопарды отделились друг от друга примерно через 2 млн лет [18]. Самая ранняя окаменелость большой кошки, Panthera blytheae , датируемая 4,1–5,95 млн лет назад, была обнаружена на юго-западе Тибета [19].
Диапазон веса
Диапазон веса, представленного этим видом, велик. Внизу взрослые снежные барсы обычно весят от 22 до 55 кг (от 49 до 121 фунтов), а исключительная особь достигает 75 кг (165 фунтов). [20] [21]
Самцы и самки львов обычно весят 150–249,5 кг (331–550 фунтов) и 110–182 кг (243–401 фунт) соответственно [22] [23], а самцы и самки тигров 100–306 кг (220–675 фунтов). ) и 75–167 кг (165–368 фунтов) соответственно.[24] Исключительно тяжелые самцы львов и тигров превышают 306 кг (675 фунтов) в дикой местности, [25] [26] и весят около 1000 фунтов (450 кг) в неволе. [25] [27]
Лигр, гибрид льва и тигра, может вырасти намного больше, чем его родительский вид. В частности, сообщается, что лигр по имени «Нук» весил более 550 кг (1210 фунтов). [28] [29]
См. Также
Ссылки
- Дэвис, Б.В., Ли, Г. и Мерфи, В.Дж. (2010). «Суперматрица и методы дерева видов разрешают филогенетические отношения внутри больших кошек, Panthera (Carnivora: Felidae)». Молекулярная филогенетика и эволюция . 56 (1): 64−76. DOI: 10.1016 / j.ympev.2010.01.036. PMID 20138224. CS1 maint: использует параметр авторов (ссылка)
- Turner, Alan; Антон, Маурисио (1997). Большие кошки и их ископаемые родственники (Иллюстрированное издание). Издательство Колумбийского университета. С. 79–81. ISBN 9780231102285 .OCLC 34283113.
- Balme, G. (2005). Подсчет кошек. Архивировано 13 сентября 2015 года в Wayback Machine. Africa Geographic 13: 36-43.
- Weissengruber, GE; Дж. Форстенпойнтнер; G Peters; Kübber-Heiss; WT Fitch (сентябрь 2002 г.). «Подъязычный аппарат и глотка у льва (Panthera leo), ягуара (Panthera onca), тигра (Panthera tigris), гепарда (Acinonyx jubatus), лигера (Panthera leo × Panthera tigris), тигра (Panthera tigris) x Panthera le домашняя кошка (Felis silvestris f.catus) ». Journal of Anatomy . 201 (3): 195–209. doi: 10.1046 / j.1469-7580.2002.00088.x. PMC 1570911. PMID 12363272.
- Hast, MH (апрель 1989). «Глотка ревущих и не рычащих кошек». Journal of Anatomy . 163 : 117–121. ISSN 0021-8782. PMC 1256521. PMID 2606766.
- Erickson-DiRenzo, Elizabeth; Сивасанкар, М. Прити; Тибо, Сьюзан Л. (2014-12-15). «Полезность анализов жизнеспособности клеток для использования с ex vivo эпителиальной тканью голосовых складок». Ларингоскоп . 125 (5): E180 – E185. DOI: 10.1002 / lary.25100. ISSN 0023-852X. PMC 4414688. PMID 25511412.
- Кэти Дарлинг (1 января 2000 г.). Львов . Публикации Лернера. ISBN 978-1-57505-404-9 .
- Хантер, Люк (июнь 2004 г.). «Плотоядные животные в кризисе: большие кошки» (PDF). Africa Geographic : 28–41. Архивировано из оригинального (PDF) 15 апреля 2010 года.
- Pacelle, Wayne.«Закон о безопасности диких животных в неволе: хорошее начало для запрета экзотики в качестве домашних животных». Гуманное общество Соединенных Штатов. Архивировано 19 апреля 2007 года. Проверено 1 апреля 2007 г.
- Служба рыболовства и дикой природы США
- Федеральный регистр Конгресса США
- Американские 5 000 американских тигров на заднем дворе летят бомба замедленного действия, заявляет WWF, Дэвид Браун, National Geographic, News Watch, 21 октября 2010 г.
- Закон о безопасности диких животных в неволе — что нужно знать владельцам крупных кошек, U.S. Служба охраны рыбных ресурсов и диких животных, Управление по поддержанию правопорядка.
- Хорозян И.Г., Геннадий Ф., Барышников Г.Ф. и Абрамов А.В. (2006). Таксономический статус леопарда, Panthera pardus (Carnivora, Felidae) на Кавказе и прилегающих территориях Архивировано 3 марта 2016 года на Wayback Machine. Российский журнал териологии 5 (1): 41–52.
- Джозеф Стромберг (12 ноября 2013 г.). «Этот ископаемый череп, обнаруженный в Тибете, — самая старая из когда-либо найденных больших кошек». Смитсоновский институт .
- Wozencraft, W.C. (2005). «Отряд Хищников». In Wilson, D.E .; Ридер, Д.М. (ред.). Виды млекопитающих мира: таксономический и географический справочник (3-е изд.). Издательство Университета Джона Хопкинса. С. 532–545. ISBN 978-0-8018-8221-0 . OCLC 62265494. , ,
- , Davis, Brian W .; Ли, Банда и Мерфи, Уильям Дж. (2010). «Суперматрица и методы дерева видов разрешают филогенетические отношения внутри больших кошек, Panthera (Carnivora: Felidae)». Молекулярная филогенетика и эволюция . 56 (1): 64–76. DOI: 10.1016 / j.ympev.2010.01.036. PMID 20138224.
- «Выявлено древнее происхождение тигра». BBC News . 2010-02-12. Проверено 26 апреля 2010.
- З. Джек Ценг; Сяомин Ван; Грэм Дж. Слейтер; Гэри Т. Такеучи; Цян Ли; Хуан Лю; Гуанпу Се (7 января 2014 г.). «Гималайские окаменелости древнейшей из известных пантерин свидетельствуют о древнем происхождении больших кошек». Труды Королевского общества B . 281 (1774): 20132686. DOI: 10.1098 / rspb.2013.2686. PMC 3843846. PMID 24225466.
- Sunquist, M .; Санквист, Ф. (2002). «Снежный барс». Дикие кошки мира . Чикаго: Издательство Чикагского университета. С. 377–394. ISBN 978-0-226-77999-7 .
- Бойтани Л. (1984). Руководство Саймона и Шустера по млекопитающим . Саймон и Шустер, Touchstone Books. ISBN 978-0-671-42805-1 .
- Новелл, Кристин; Джексон, Питер (1996). Дикие кошки: обзор состояния и план действий по сохранению (PDF). Гланд, Швейцария: Группа специалистов по кошкам МСОП / SSC. С. 1–334. ISBN 978-2-8317-0045-8 .
- Новак, Рональд М. (1999). Млекопитающие Уокера . Балтимор: Издательство Университета Джона Хопкинса. ISBN 978-0-8018-5789-8 .
- Мазак В. (1981). « Panthera tigris » (PDF). Виды млекопитающих . 152 (152): 1–8.DOI: 10,2307 / 3504004. JSTOR 3504004. Архивировано из оригинального (PDF) 9 марта 2012 года.
- Wood, G. L. (1983). Книга рекордов и подвигов животных Гиннеса . Стерлинг Паблишинг. ISBN 978-0-85112-235-9 .
- «Восточноафриканский деловой дайджест», University Press of Africa, при участии Национальной торгово-промышленной палаты Кении, , 1963, извлечено 18 марта 2018 г.
- «Девятнадцатый век и после». 130 . Издательская компания Леонарда Скотта. 1941. Проверено 17 марта 2018.
- «Лигр — встречайте самую большую кошку в мире». Факты о Лигере . Проверено 17 июля 2016.
- «Лигровый уголок — профиль Лигера». Мир Лигера . Проверено 23 апреля 2018.
Дополнительная литература
The Persistent Entity Wiki: Фукоза
Гликомикс
Описание
Фукоза — это гексозный сахар с химической формулой C6h22O5.Он обнаружен на N-связанных гликанах на поверхности клеток млекопитающих и растений.
Обсуждение
Фукоза является антигеном H (o).
Пищевая фукоза легко всасывается из тонкого кишечника. В исследовании на здоровых добровольцах пероральное введение фукозы в дозе 50-100 мг / кг массы тела (что эквивалентно 3,5-7,0 г на человека весом 150 фунтов) увеличивало концентрацию фукозы в сыворотке, которая достигала максимального значения 110-210? моль / л через 60 минут. Затем фукоза удалялась из сыворотки с полупериодом 100 минут.Спустя 24 часа фукоза в сыворотке все еще превышала базальный уровень. В исследовании на крысах период полувыведения фукозы из сыворотки составлял 110-140 минут; через 1 час около 39% пероральной дозы появилось в выдыхаемом CO2, 13-24% было обнаружено в фекалиях и содержимом желудочно-кишечного тракта и 0,3% присутствовало в сыворотке. Абсорбированная фукоза широко включается либо непосредственно, либо после метаболизма в гликопротеины. Неабсорбированная фукоза метаболизируется кишечными бактериями.
Безопасность
Безопасность
Фукоза, по-видимому, относительно безопасна при многократном применении в высоких ежедневных пероральных дозах.Например, когда фукоза вводилась с пищей перорально в суточных дозах до 492 мг / кг массы тела (эквивалент> 34 граммов на 150 фунтов человека) в течение 277 дней для лечения редкого наследственного нарушения адгезии лейкоцитов. дефицит, никаких значительных побочных эффектов не сообщалось. Единственные отдаленно связанные исследования оральной токсичности в научной литературе включали животных, принимавших диету, состоящую из 20% фукозы, количества, значительно превышающего любую диетическую дозу. В этих исследованиях наблюдалось обратимое снижение скорости нервной проводимости и снижение выработки коллагена в культивируемых эндотелиальных клетках микрососудов головного мозга, полученных от животных, получавших фукозу.Релевантность этих результатов для возможного подобного эффекта у людей, однако, полностью неизвестна, особенно на основании чрезвычайно высоких доз фукозы, данных in vitro и метаболических различий у людей.
На самом деле, несколько исследований приема фукозы показали полезные биологические эффекты. Например, известно, что фукоза является модулятором иммунной системы. Также было показано, что он имеет терапевтическое значение при лечении или профилактике инфекций дыхательных путей и в подавлении роста и метастазирования рака.Кроме того, фукоза, по-видимому, играет благотворную роль в здоровье новорожденных, поскольку было обнаружено, что концентрации фукозосодержащих гликопротеинов в материнской моче заметно увеличиваются на последних стадиях беременности и во время кормления грудью. Более того, ни в одном из этих исследований не сообщалось о значительной токсичности лечения фукозой.
Links
Юконские волки пережили исчезновение ледникового периода благодаря изменениям в их рационе | Палеонтология
Серые волки ( Canis lupus ) с территории Юкон, Канада, пережили вымирание в конце последнего ледникового периода, адаптируя свой рацион на протяжении тысяч лет — из-за того, что в первую очередь полагались на лошадей ( Equus sp.) в плейстоцене, лосям ( Alces alces ) и карибу ( Rangifer tarandus ) сегодня.
Серые волки сбили лошадь в мамонтовой степи Берингии в позднем плейстоцене, около 25000 лет назад. Изображение предоставлено Юлиусом Чотони.
Группа исследователей, возглавляемая доктором Даниэль Фрейзер из Канадского музея природы, Карлтонского университета и Смитсоновского национального музея естественной истории, исследовала, изменились ли рационы серых волков Юкона с плейстоцена (50 000–26 000 лет назад) на диеты последнее время.
«Мы можем изучить изменения в диете, исследуя характер износа зубов и химические следы в волчьих костях», — сказала Зои Лэндри, студентка Карлтонского университета.
«Они могут многое рассказать нам о том, как ело животное и что оно ело на протяжении всей своей жизни, примерно за несколько недель до смерти».
Доктор Фрейзер, Лэндри и их коллеги полагались на установленные модели, которые могут определять пищевое поведение животного путем изучения микроскопических структур износа на его зубах.
Царапины указывают на то, что волк ел плоть, в то время как наличие ям указывает на то, что он жевал и грыз кости, вероятно, как падальщик.
Анализ показал, что царапины преобладали как на древних, так и на современных зубах волка, а это означает, что волки продолжали выживать в качестве основных хищников, охотясь на свою добычу.
Их современная диета хорошо известна; Рацион древних волков оценивался по соотношению изотопов углерода и азота, извлеченных из коллагена в костях.Относительные уровни изотопов можно сравнить с установленными показателями для конкретных видов.
Результаты показали, что лошади, вымершие в плейстоцене, составляли около половины рациона серых волков. Около 15% приходилось на карибу и овец Далла, с добавлением некоторых мамонтов.
В то время древние волки сосуществовали с другими крупными хищниками, такими как ятаганские кошки и короткомордые медведи.
Окончательное исчезновение этих хищников могло дать волкам больше возможностей для перехода к новым видам добычи.
«Это действительно история выживания и адаптации ледникового периода, а также создания вида в направлении современной формы с точки зрения экологической адаптации», — сказал д-р Грант Зазула, палеонтолог из Программы палеонтологии правительства Юкона.
Работа группы была опубликована в журнале Palaeogeography, Palaeoclimatology, Palaeoecology .
_____
Зои Ландри и др. . 2021. Реконструкция диеты и свидетельства перемещения добычи в плейстоцене и недавних серых волков ( Canis lupus ) с территории Юкон. Палеогеография, палеоклиматология, палеоэкология 571: 110368; DOI: 10.1016 / j.palaeo.2021.110368
Смеситель для субгармоник
Пара активных I / Q-смесителей на субгармонических частотах 5–6 ГГц была спроектирована и изготовлена для использования в приемниках прямого преобразования для диапазонов нелицензированной национальной информационной инфраструктуры (U-NII). Конструкция включает смесители для субгармоник I и Q и цепь формирования гетеродина. Все цепи полностью дифференциальные и рассчитаны на работу от источника питания 3,3 В.Каждый смеситель потребляет 5 мА тока. A … Общие вопросы | 0113 2407986. Магазин. Аксессуары. Дексейверы. DJ Decksavers; Наушники. Наушники DJ; Studio Headphones
14 июля 2020 г. · Квадратурный смеситель на субгармонике гетеродина потребляет 824 мкВт мощности при напряжении питания 0,8 В. Предлагаемый смеситель сравнивается с существующими смесителями на субгармонике. Сравнение показывает, что предлагаемый смеситель на субгармонике дает хорошие показатели. Здесь он показан подключенным к усилителю мощностью 120 Вт, который установлен поверх него.Этот трансвертер может выдавать около 25 Вт самостоятельно и работает от 12 В, что делает его пригодным для портативного обслуживания.
В данной статье представлен приемник субгармоник на диоде Шоттки на частоте 150 ГГц, основанный на антенне с двойным свернутым пазом (DFS) с питанием из копланарного волновода. Антенна DFS размещена на протяженной полусферической линзе кремниевой подложки с высоким удельным сопротивлением для достижения высокой направленности и высокой степени связи с эффективностью гауссова луча. Миниатюрный микшер на субгармонических сигналах MMIC с диапазоном частот 38–48 ГГц Вэй-Чиен Чен, Ши-Ю Чен, Дженг-Хан Цай, Тянь-Вей Хуанг и Хуэй Ван, факультет электротехники и аспирантский институт инженерии связи, Национальный университет Тайваня, Тайбэй, Тайвань 106, Р.O.C. ˘̀˴˼˿ˍʳ̇̊˻̈˴́˺˓˶˶ˁ˸˸ˁ́̇̈ˁ˸˷̈ˁ̇̊ʳ Аннотация — миниатюрный смеситель с субгармонической накачкой на частотах 38-48 ГГц …
На протяжении всего исследования использовались преимущества недавняя разработка усовершенствованных средств автоматизированного проектирования, которые подходят для моделирования как линейных, так и нелинейных частей субмиллиметрового смесителя, для разработки и изготовления встроенного смесителя с фиксированной настройкой на частоте 183 ГГц. разделительные смесители, цепи гетеродина и промежуточной частоты разрабатываются для поддержки системы ALMA Band 2 + 3. Цепь гетеродина и управление пользовательским интерфейсом были сконструированы и протестированы с использованием смесителя субгармоник с двойной боковой полосой, изготовленного по схеме RAL.Следующим этапом разработки является интеграция микшеров с разделением боковых полос и использование
ReGain Audio Gain Assistant, которое делает именно то, что написано на банке. Применяйте фиксированные значения уровня в дБ к линейкам каналов легко и эффективно, без необходимости использовать фейдеры или регуляторы, чтобы получить именно ту величину шага, которую вы хотите. 14 июля 2020 г. · Мастер-осциллятор, субгармонический и прямоугольный фузз-тон имеют регуляторы громкости в разделе голосового микшера. Используйте их, чтобы смешать три голоса по вкусу.Уровень — это мастер-громкость, определяющая общий выходной уровень эффекта.
Что такое коллаген? | Живая наука
Коллаген относится к семейству белков, которые являются основным структурным компонентом соединительных тканей, таких как кожа и хрящи, согласно Йельскому университету.
Вещество составляет около трети всего белка в организме человека, больше, чем любой другой тип белка в организме по массе. Существует 28 различных типов коллагена, каждый из которых классифицируется на основе его аминокислотного состава.По данным Healthline, около 90% коллагена в организме относится к типу 1, который содержится в коже, сухожилиях, внутренних органах и органических частях костей. Подавляющее большинство остающегося в организме коллагена состоит из следующих типов:
- Тип 2: находится в хрящах.
- Тип 3: Обнаруживается в костном мозге и лимфоидных тканях.
- Тип 4: Обнаруживается в базальной мембране (тонкие пласты коллагена, которые окружают большинство типов тканей).
- Тип 5: Найден в волосах и на поверхности клеток.
Откуда берется коллаген?
Организм естественным образом вырабатывает собственный коллаген, расщепляя пищевой белок на аминокислоты. По словам Шеннон Уэстон, диетолога Школы общественного здравоохранения Техасского университета в Хьюстоне, аминокислоты создают различные типы белка в организме, включая коллаген.
Вы получаете определенные строительные блоки для коллагена, употребляя сбалансированную диету, состоящую из продуктов, богатых белком (например, курицу, говядину, яйца, молочные продукты, бобовые, орехи и цельнозерновые продукты) и разнообразных свежих продуктов, согласно Кливленду. Клиника.По словам Уэстон, диета с высоким содержанием свежих овощей и фруктов обладает дополнительным преимуществом, так как содержит антиоксиданты, которые защищают организм от окислительного стресса, который может разрушать коллаген. По ее словам, способность организма вырабатывать коллаген естественным образом снижается с возрастом, но чрезмерное пребывание на солнце, курение и неправильное питание также могут препятствовать выработке коллагена.
Здоровая диета дает вашему организму все материалы, необходимые для выработки коллагена. (Изображение предоставлено Shutterstock)Коллаген для лечения
Артрит заставляет коллаген в суставах разрушаться быстрее, чем он может быть восполнен, что приводит к боли в суставах и снижению подвижности.Ученые экспериментируют с введением коллагена для лечения артрита с 1980-х годов, сказала Брук Рассел, микробиолог и профессор Техасского института биологических наук и технологий A&M в Хьюстоне. Но этот метод не всегда оказывался эффективным, сказала она.
Коллагеновые добавки помогают пациентам с остеоартритом в небольшом количестве клинических испытаний, но коллаген, по-видимому, не более эффективен, чем ведущий препарат для лечения ревматоидного артрита.(Изображение предоставлено Shutterstock)Исследование 2017 года, опубликованное в Journal of Arthritis, показало, что пероральные добавки с коллагеном помогли облегчить боль у пациентов с остеоартритом, но коллаген не был более эффективным, чем существующие ведущие лекарственные препараты для лечения ревматоидного артрита. Исследование 2016 года, опубликованное в журнале Nutrition Journal, также показало, что добавки коллагена помогают облегчить боль у пациентов с остеоартритом.
Однако, по данным Arthritis Foundation, коллаген вряд ли начнет восстанавливаться, чтобы полностью вылечить артрит, даже после приема пероральных добавок.С другой стороны, согласно исследованию 2018 года, опубликованному в журнале PLOS One, хирургическое введение коллагена в суставы, страдающие артритом, может оказаться многообещающим методом лечения артрита.
Согласно исследованию, опубликованному в журнале BioMedical Engineering OnLine, коллаген более эффективен для лечения ран и используется для этого более 2000 лет. Коллаген применяется местно, часто вместе с другими структурными белками и антибиотиками, для ускорения заживления и предотвращения инфекции.
Например, в обзоре 2014 года, опубликованном в журнале Biopolymers, описывается, как коллагеновую губку или гель можно положить на сильный ожог. Губка позволяет коже поддерживать влажную среду, защищая ее от инфекций, а коллаген действует как каркас для регенерации клеток и производства нового коллагена.
Эксперты рекомендуют придерживаться здоровой диеты и ежедневно использовать солнцезащитный крем и увлажняющие кремы, а не принимать добавки с коллагеном. (Изображение предоставлено Shutterstock)Стоит ли принимать добавки с коллагеном?
Коллаген — популярный ингредиент в пероральных добавках и кремах для местного применения, но мало научных данных, подтверждающих эффективность такого лечения.Согласно Healthline, некоторые добавки с коллагеном утверждают, что они могут улучшить здоровье кожи, облегчить боль в суставах, предотвратить потерю костной массы, увеличить мышечную массу, укрепить здоровье сердца, увеличить прочность волос и ногтей, улучшить здоровье кишечника и мозга и помочь похудеть.
Хотя было показано, что местный коллаген полезен для лечения ран, «мало, если таковые имеются, доказанных доказательств того, что прием этих добавок имеет реальную медицинскую пользу для волос, ногтей или кожи», — сказала д-р Аделаида Хеберт, профессор. дерматологии и директор детской дерматологии в Научном центре здоровья Техасского университета в Хьюстоне.По словам Хеберта, ежедневное использование солнцезащитного крема и увлажняющего крема с ретиноидами, ретинолом, керамидами или салициловой кислотой (в зависимости от потребностей человека) — более эффективный способ сохранить кожу здоровой.
«Скептически относитесь к заявлениям о пользе для здоровья, связанным с дополнительным коллагеном», — повторил Уэстон. «Наука не полностью изучила все эти предполагаемые преимущества». Кроме того, по ее словам, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) не регулирует прием коллагеновых добавок с той же строгостью, что и лекарства. Это означает, что производителям коллагеновых добавок не нужно доказывать, что добавки эффективны или безопасны, прежде чем выпускать их на рынок.
Связано: Витамины из продуктов питания, а не добавок, увеличивают продолжительность жизни
Коллаген во многих добавках (который, как правило, поступает из животных источников, таких как кости коровы или кожа рыбы), подвергся высокой переработке, сказал Рассел. . Это разрушает структуру коллагена, расщепляя его на пептиды, которые представляют собой короткие цепочки аминокислот. Полученный продукт называется гидролизованным коллагеном, который растворим в воде и поэтому его легче включить в лосьон или легче высушить и положить в таблетку.
При рассмотрении вопроса о приеме коллагеновой добавки важно в первую очередь учитывать то, как ваша диета и образ жизни влияют на выработку коллагена в вашем организме. «Добавление добавок к неправильному питанию и образу жизни не принесет никакой пользы для здоровья», — сказал Уэстон. «Сосредоточьтесь на факторах образа жизни и сбалансированной диете и откажитесь от добавок».
Дополнительные ресурсы:
.
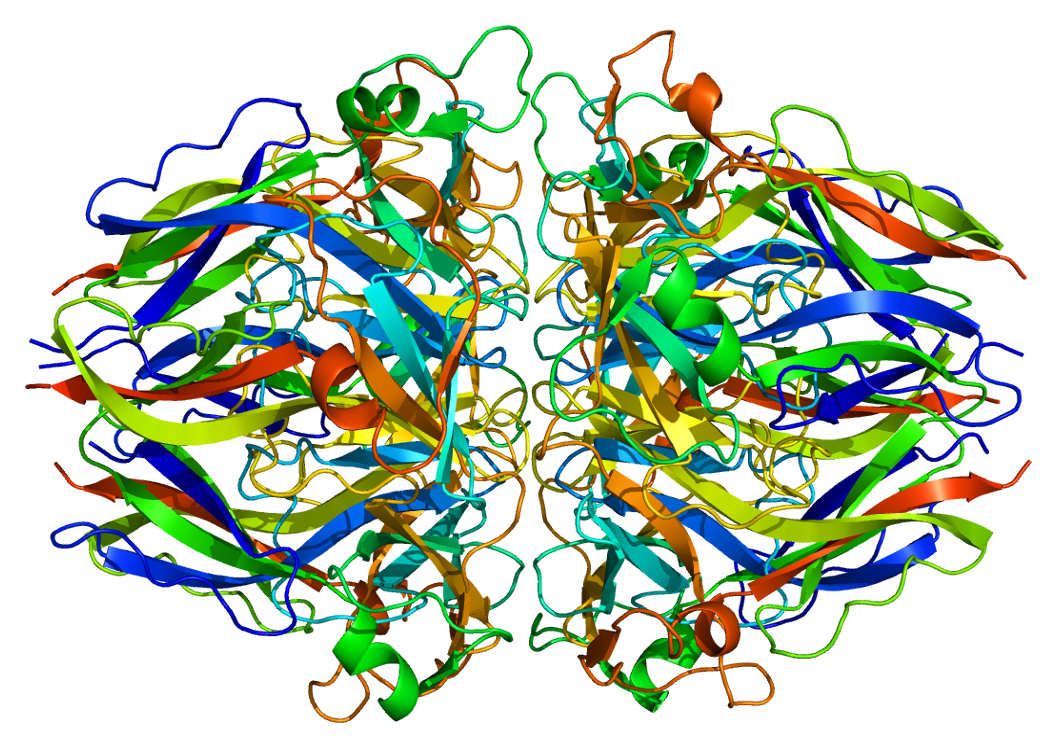
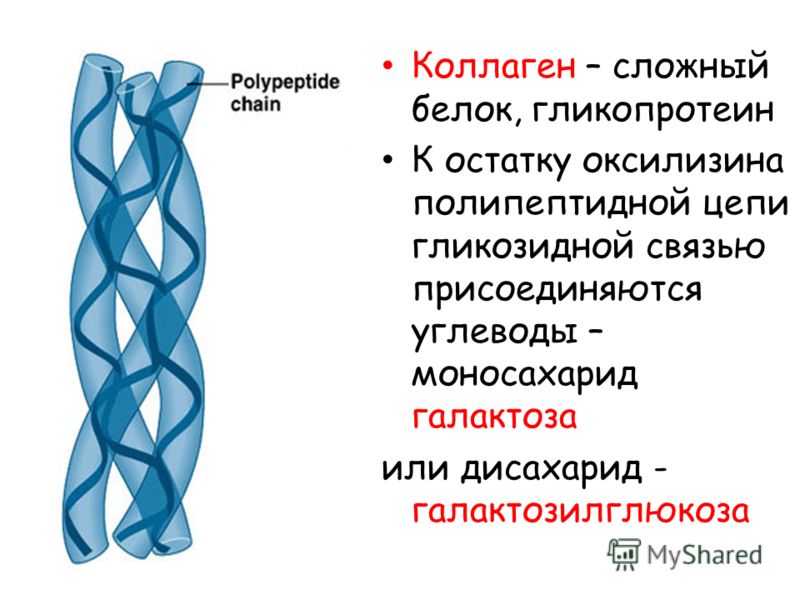
 Сейчас он известен как препроколлаген.
Сейчас он известен как препроколлаген. У проколлагена еще есть раскрученные концы, которые позже будут обрезаны. На этом этапе проколлаген упаковывается в везикулу переноса, предназначенную для аппарата Гольджи.
У проколлагена еще есть раскрученные концы, которые позже будут обрезаны. На этом этапе проколлаген упаковывается в везикулу переноса, предназначенную для аппарата Гольджи. Этот фермент действует на лизины и гидроксилизины, продуцируя альдегидные группы, которые в конечном итоге претерпевают ковалентную связь между молекулами тропоколлагена. Этот полимер тропоколлогена известен как фибрилла коллагена.
Этот фермент действует на лизины и гидроксилизины, продуцируя альдегидные группы, которые в конечном итоге претерпевают ковалентную связь между молекулами тропоколлагена. Этот полимер тропоколлогена известен как фибрилла коллагена. Эти пептидные цепи, известные как препроколлаген, имеют регистрирующие пептиды на каждом конце и сигнальный пептид .
Эти пептидные цепи, известные как препроколлаген, имеют регистрирующие пептиды на каждом конце и сигнальный пептид .