Гликогенез — Справочник химика 21
Гликогенез. Конечные продукты пищеварения углеводов — глюкоза, фруктоза и галактоза — диффундируют из пищеварительного тракта в воротную вену и попадают затем в печень. В результате различных превращений, протекающих с участием [c.382]
Опишите кратко гликогенез и гликогенолиз. Где происходят эти процессы [c.358]
Синтез гликогена (гликогенез) [c.322]
Гликогенез происходит в печени и в клетках мышц, как показано на схеме [c.327]
Снижение уровня сахара в крови, регуляция углеводного обмена, влияние на белковый и липидный обмен Повышение уровня сахара в крови стимуляцией гликогенеза в печени [c.239]
При отравлении стимулируется гликогенолиз и угнетается гликогенез, что обусловливает гипергликемию. Содержание Л. в печеночной ткани значительно снижается, угнетается активность альдолазы, активируется лактатдегидрогеназа, уменьшается концентрация пировиноградной кислоты, увеличивается уровень молочной кислоты.
Избыток глюкозы накапливается в организме в виде гликогена, который образуется в результате процесса, называемого гликогенезом. Остатки глюкозы (х= 12—18) конденсируются с выделением молекул воды, образуя гликоген по общей схеме
Цикл Кори. Гликогенез, гликогенолиз, гликолиз и лимоннокислый цикл связаны между собой (фиг. 105). Вся совокупность этих взаимоотношений называется циклом Кори. [c.383]
Поддерживание определенного уровня сахара крови — глюкозная толерантность — зависит от строгой регуляции интенсивности гликогенолиза, гликогенеза и окисления глюкозы. [c. 388]
388]
Две первые стадии гликогенолиза обратны двум последним стадиям гликогенеза. Глюкоза поступает в кровь из печени, так как в печени содержится основное количество фосфорилазы — фермента, катализирующего гидролиз гликогена. В мышечных клетках гликоген не гидролизуется, так как содержание в них фосфорилазы очень незначительно.
Сахарный диабет — это болезнь, вызываемая недостаточностью инсулина в организме. Экспериментальные данные показывают, что инсулин регулирует скорость проникновения глюкозы внутрь клеток и защищает гексокиназу от ингибиторов (специфических ядов), благодаря чему глюкоза может быть фосфорилирована в глюкозо-6- сфат. Это одна из важнейших реакций гликогенеза. [c.352]
Низкое содержание сахара в крови может быть обусловлено чрезмерным гликогенезом, недостаточным глико-генолизом или какими-либо другими причинами, к которым относятся
Избыточная глюкоза, поступившая при всасывании, откладывается в печени в виде запасного гликогена.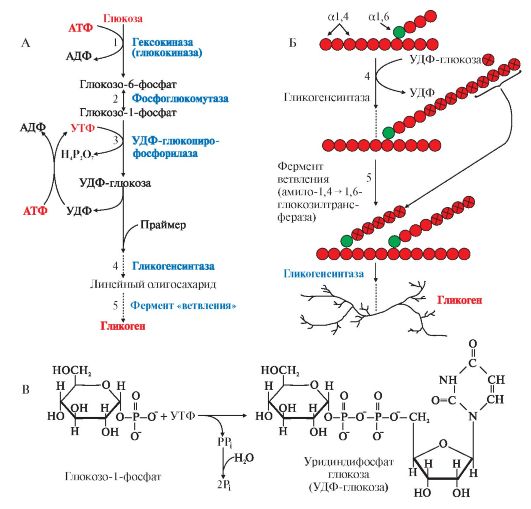 В нормальных условиях этот орган содержит около 100 г гликогена, но его может накапливаться и до 400 г. Гликоген печени легко превращается в глюкозу, поэтому он является резервом, за счет которого организм получает глюкозу, если ее содержание в крови падает ниже нормального. Образование гликогена из глюкозы называется гликогенезом, а превращение гликогена в глюкозу — гликогенолизом. Мышцы также способны накапливать глюкозу в виде гликогена, но мышечный гликоген превращается в глюкозу не так легко, как гликоген печени.
В нормальных условиях этот орган содержит около 100 г гликогена, но его может накапливаться и до 400 г. Гликоген печени легко превращается в глюкозу, поэтому он является резервом, за счет которого организм получает глюкозу, если ее содержание в крови падает ниже нормального. Образование гликогена из глюкозы называется гликогенезом, а превращение гликогена в глюкозу — гликогенолизом. Мышцы также способны накапливать глюкозу в виде гликогена, но мышечный гликоген превращается в глюкозу не так легко, как гликоген печени.
Гликогенез. Процесс гликогенеза — это не простое превращение глюкозы в гликоген. Как мы видели [c.365]
В норме примерно половина поглощенной глюкозы вступает на путь гликолиза и превращается в энергию, другая половина запасается в виде жиров или гликогена. В отсутствие инсулина ослабевает интенсивность гликолиза и замедляются анаболические процессы гликогенеза и липогенеза.
Эффекты глюкагона, как правило, противоположны эффектам инсулина. Если инсулин способствует запасанию энергии, стимулируя гликогенез, липогенез и синтез белка, то глюкагон, стимулируя гликогенолиз и липолиз, вызывает быструю мобилизацию источников потенциальной энергии с образованием глюкозы и жирных кислот соответственно. Глюкагон— наиболее активный стимулятор глюконеогенеза кроме того, он обладает и кетогенным действием. [c.264]
Глюкозо-6-фосфат занимает важное положение в области стыковки ряда метаболических путей (гликолиз, глюконеогенез, пентозофосфатный путь, гликогенез и гликогенолиз) (рис. 18.2). В ходе гликолиза он превращается во фруктозо-6-фосфат при участии фос гексозоизомеразы, при этом происходит альдо-кето-изомеризация. Фермент действует только на а-аномер глюкозо-6-фосфата
МЕХАНИЗМЫ КОНТРОЛЯ ГЛИКОГЕНОЛИЗА И ГЛИКОГЕНЕЗА [c.192]
Рнс. 22. 5. Регуляция гликогенолиза и гликогенеза сАМР-зависимой протеинкиназой. При увеличении концентрации сАМР стимулируются реакции, ведущие к запуску гликогенолиза (они показаны жирными стрелками), и ингибируются реакции, ведущие к его торможению (показаны пунктирными стрелками). При уменьшении концентрации сАМ Р под действием фосфодиэстеразы возникает противоположная ситуация и в итоге стимулируется гликогенез
5. Регуляция гликогенолиза и гликогенеза сАМР-зависимой протеинкиназой. При увеличении концентрации сАМР стимулируются реакции, ведущие к запуску гликогенолиза (они показаны жирными стрелками), и ингибируются реакции, ведущие к его торможению (показаны пунктирными стрелками). При уменьшении концентрации сАМ Р под действием фосфодиэстеразы возникает противоположная ситуация и в итоге стимулируется гликогенез
Ранее предполагали, что процессы расщепления являются обращением процессов синтеза (например, гликогенолиз и гликогенез), а синтез жирных кислот рассматривали как процесс, обратный их окислению. [c.231]
Образование гликогена из углеводов называется гликогенезом, а из неуглеводного материала (аминокислот, глицерина и т. д.)—гликонеогенезом. В организме протекают и противоположные им процессы гликогенолиз — расщепление гликогена до глюкозы, а гликолиз — более глубокий распад до пировиноградной кислоты. [c.82]
Процессы гликолиза и гликогенеза регулируются гормонами адреналином, инсулином, глюкагоном.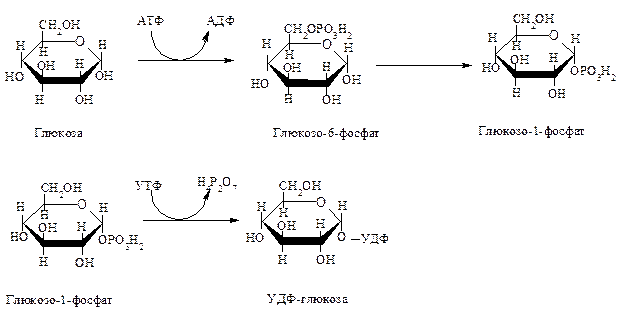 Адреналин, выделяющийся в надпочечниках, стимулирует реакции гликолиза и снижает скорость гликогеногенеза, при этом улучшается снабжение мышц энергией. Инсулин, вьвделя-ющийся В-клетками островков Лангерганса в поджелудочной железе, усиливает транспорт глюкозы внутрь клеток, из-за чего снижается содержание глюкозы в крови и усиливается синтез гликогена. В ответ на низкое содержание глюкозы в крови адреналин стимулирует выделение в А-клетках островков Лангерганса гормона глюкагона, который стимулирует глюкогенез в печени, в результате образуется большое количество глюкозы, которая поступает в кровь и затем переносится в другие ткани.
Адреналин, выделяющийся в надпочечниках, стимулирует реакции гликолиза и снижает скорость гликогеногенеза, при этом улучшается снабжение мышц энергией. Инсулин, вьвделя-ющийся В-клетками островков Лангерганса в поджелудочной железе, усиливает транспорт глюкозы внутрь клеток, из-за чего снижается содержание глюкозы в крови и усиливается синтез гликогена. В ответ на низкое содержание глюкозы в крови адреналин стимулирует выделение в А-клетках островков Лангерганса гормона глюкагона, который стимулирует глюкогенез в печени, в результате образуется большое количество глюкозы, которая поступает в кровь и затем переносится в другие ткани.
И 25°), она происходит только при распаде гликогена и не связана с гликогенезом, т. е. с процессом ресинтеза гликогена. Гликогенез происходит и тогда, когда отношение [Фн]/[Глюкозо-1-фосфат] достигает 300, а также при некоторых наследственных нарушениях обмена, нри которых фосфорилаза вообще отсутствует. Кроме того, в присутствии адреналина, который, как только что упоминалось, стимулирует активность фосфорилазы, происходит распад, а не синтез гликогена.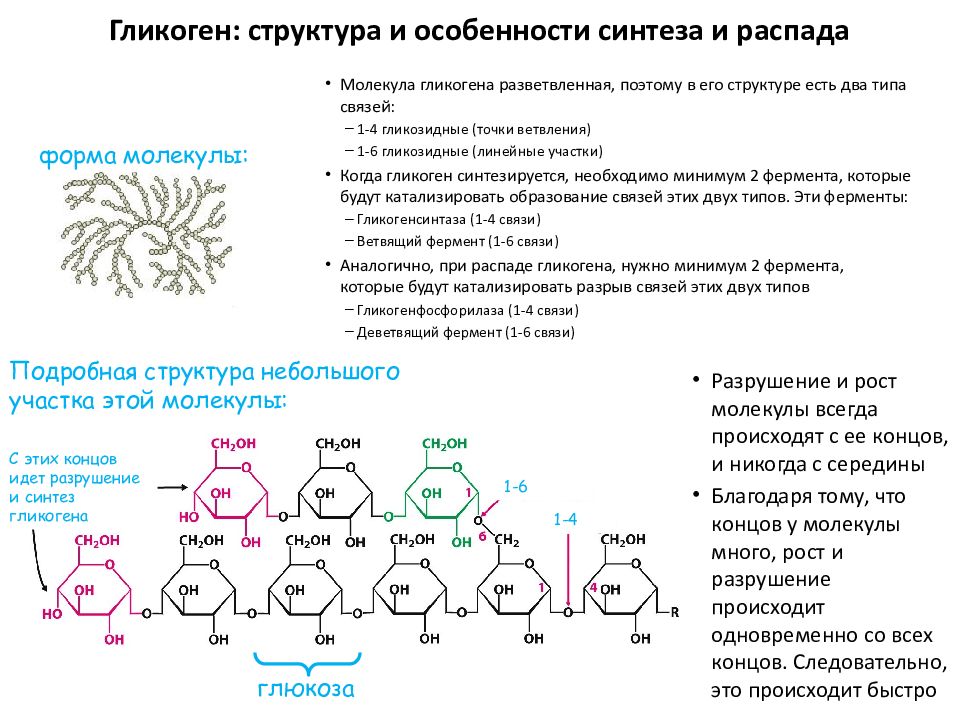
Инсулин снижает уровень глюкозы в крови двумя путями ) способствуя ее проникновению в клетки и 2) активируя гликогенез в печени и мышцах. В отсутствие инсулина некоторый избыток глюкозы выводится почка.ми (гликозурня). [c.388]
Рнс. 19.1. Схема гликогенеза и гликогенолиза в печени. На включение одной молекулы глюкозы в состав гликогена расходуются две высокоэнергетические фосфатные связи. 0 сгимуляция — ингибирование. Инсулин понижает уровень сАМР только в том случае, если повьииение уровня сАМР было вызвано глюкагоном или адреналином, т.е. по отношению к последним инсулин выступает как антагонист.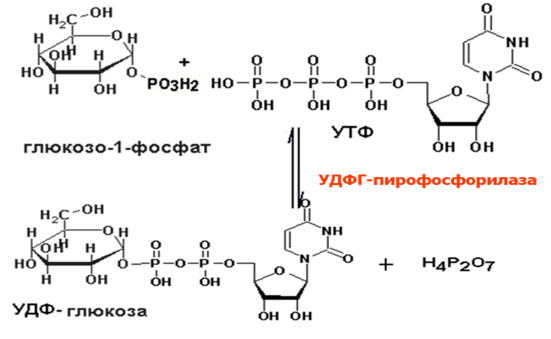
В процессе гликогенеза клетки забирают глюкозу из крови, а печень восполняет недостаток глюкозы посредством гликогеноли- [c.328]
В. Влияние на образование глюкозы (глюконеогенез). Влияние инсулина на транспорт глюкозы, гликолиз и гликогенез проявляется за считанные секун- [c.256]
Регуляция метаболизма гликогена осушествляется путем изменения активностей гликогенсинтазы и фосфорилазы (эти активности контролируются субстратами аллостерически, а также регулируются гормонами). Повышение концентрации сАМР приводит к активации фосфорилазы под действием киназы фосфорилазы и одновременно к переходу гликогенсинтазы в неактивную форму (см. гл. 19) в обоих процессах участвует сАМР-зависимая про-теинкиназа. Таким образом, при ингибировании гликогенолиза усиливается гликогенез, а при ингибировании последнего усиливается гликогенолиз. Важное значение для регуляции метаболизма гликогена имеет то обстоятельство, что дефосфорилирование фосфорилазы а, киназы фосфорилазы и гликогенсин- [c.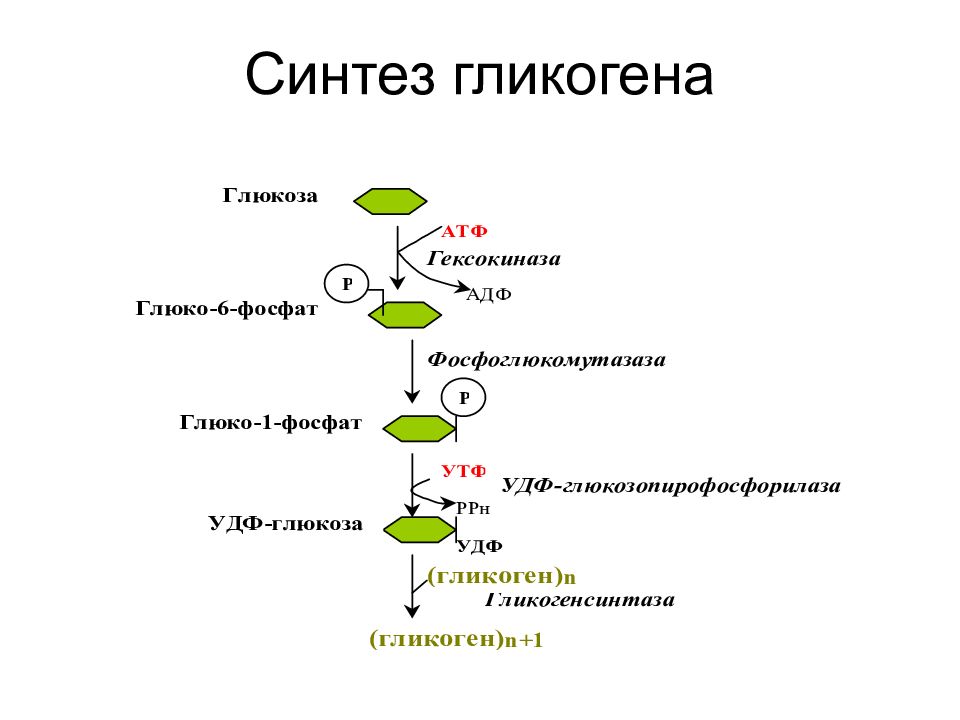 219]
219]
Описаны гликогенозы, связанные с недостаточностью фосфорилазы в печени (гликогеноз VI типа), недостаточностью фосфофруктокиназы в мышцах и эритроцитах (гликогенез VII типа болезнь Таруи), а также гликогеноз, обусловленный недостаточностью киназы фосфорилазы. Сообщалось также о случаях недостаточности аденилаткичазы и сАМР-зависимой протеинкиназы. [c.195]
Глюкуроновая кислота образуется из глюкозы по пути уроновых кислот в результате реакций, приведенных на рис. 21.1. Глюкозо-6-фосфат превращается в глюкозо-1-фосфат, который затем взаимодействует с уридинтрифосфатом (UTP) с образованием активного нуклеотида уридиндифосфатглюкозы (UDP-глюкозы). Последнюю реакцию катализирует фермент UDP-глюкозопирофосфорилаза. Реакции, предшествующие этой стадии, характерны для процесса гликогенеза в печени (см. рис. 19.1). UDP-глюкоза окисляется по С-6 с образованием глюкуро-ната, причем процесс протекает в две стадии.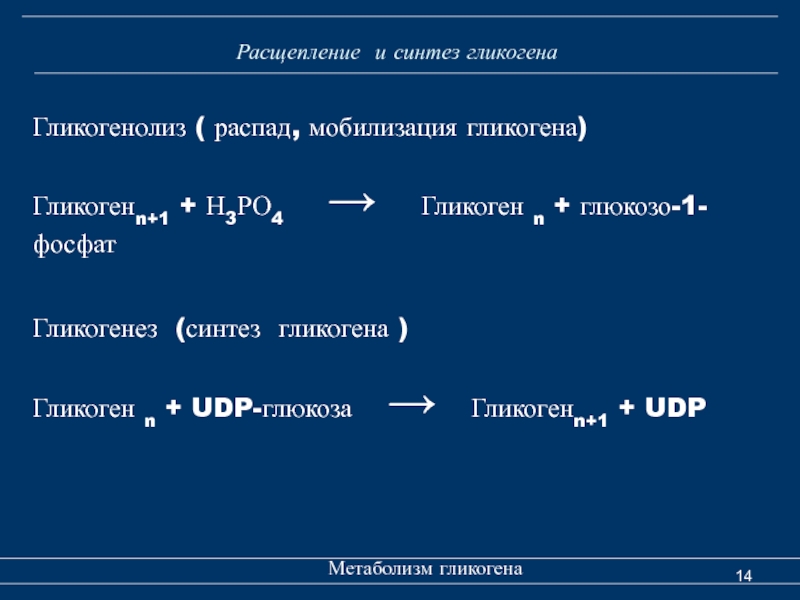 Продуктом стадии окисления, катализируемой NAD-зависимой UDP-глюкозодегидрогеназой, является UDP-глюкуронат. [c.205]
Продуктом стадии окисления, катализируемой NAD-зависимой UDP-глюкозодегидрогеназой, является UDP-глюкуронат. [c.205]
Гликогенез — gaz.wiki
Гликогенез — это процесс синтеза гликогена , при котором молекулы глюкозы добавляются к цепям гликогена для хранения. Этот процесс активируется в периоды отдыха после цикла Кори в печени , а также активируется инсулином в ответ на высокий уровень глюкозы .
- Глюкоза превращается в глюкозо-6-фосфат под действием глюкокиназы или гексокиназы с превращением АТФ в АДФ.
- Глюкозо-6-фосфат превращается в глюкозо-1-фосфат под действием фосфоглюкомутазы , проходя через обязательный промежуточный глюкозо-1,6-бисфосфат .
- Глюкозо-1-фосфат превращается в UDP-глюкозу под действием фермента UDP-глюкозопирофосфорилазы . Пирофосфат образуется, который затем гидролизуют пирофосфатазы на две молекулы фосфата.
- Фермент гликогенин необходим для создания первоначальных коротких цепей гликогена, которые затем удлиняются и разветвляются другими ферментами гликогенеза.
 Гликогенин , гомодимер, имеет остаток тирозина на каждой субъединице, который служит якорем для восстанавливающего конца гликогена. Первоначально около семи молекул UDP-глюкозы добавляются гликогенином к каждому остатку тирозина, образуя α (1 → 4) связи.
Гликогенин , гомодимер, имеет остаток тирозина на каждой субъединице, который служит якорем для восстанавливающего конца гликогена. Первоначально около семи молекул UDP-глюкозы добавляются гликогенином к каждому остатку тирозина, образуя α (1 → 4) связи. - После образования цепи из семи мономеров глюкозы гликогенсинтаза связывается с растущей цепью гликогена и добавляет UDP-глюкозу к 4-гидроксильной группе остатка глюкозила на невосстанавливающем конце цепи гликогена, образуя больше α (1 → 4) облигации в процессе.
- Разветвления образуются ферментом разветвления гликогена (также известным как амило-α (1: 4) → α (1: 6) трансгликозилаза), который переносит конец цепи на более раннюю часть через гликозидную связь α-1: 6, образуя ветви, которые в дальнейшем растут за счет добавления большего количества гликозидных единиц α-1: 4.
Гликогенез реагирует на гормональный контроль.
Одной из основных форм контроля является разнообразное фосфорилирование гликогенсинтазы и гликогенфосфорилазы. Это регулируется ферментами под контролем гормональной активности, которая, в свою очередь, регулируется многими факторами. Таким образом, существует множество различных возможных эффекторов по сравнению с аллостерическими системами регуляции.
Это регулируется ферментами под контролем гормональной активности, которая, в свою очередь, регулируется многими факторами. Таким образом, существует множество различных возможных эффекторов по сравнению с аллостерическими системами регуляции.
Гликогенфосфорилаза активируется фосфорилированием, тогда как гликогенсинтаза ингибируется.
Гликогенфосфорилаза превращается из своей менее активной формы «b» в активную форму «a» под действием фермента фосфорилазы киназы. Этот последний фермент сам активируется протеинкиназой А и дезактивируется фосфопротеинфосфатазой-1.
Сама протеинкиназа А активируется гормоном адреналином. Адреналин связывается с рецепторным белком, который активирует аденилатциклазу. Последний фермент вызывает образование циклического АМФ из АТФ ; две молекулы циклического АМФ связываются с регуляторной субъединицей протеинкиназы A, которая активирует ее, позволяя каталитической субъединице протеинкиназы A диссоциировать от сборки и фосфорилировать другие белки.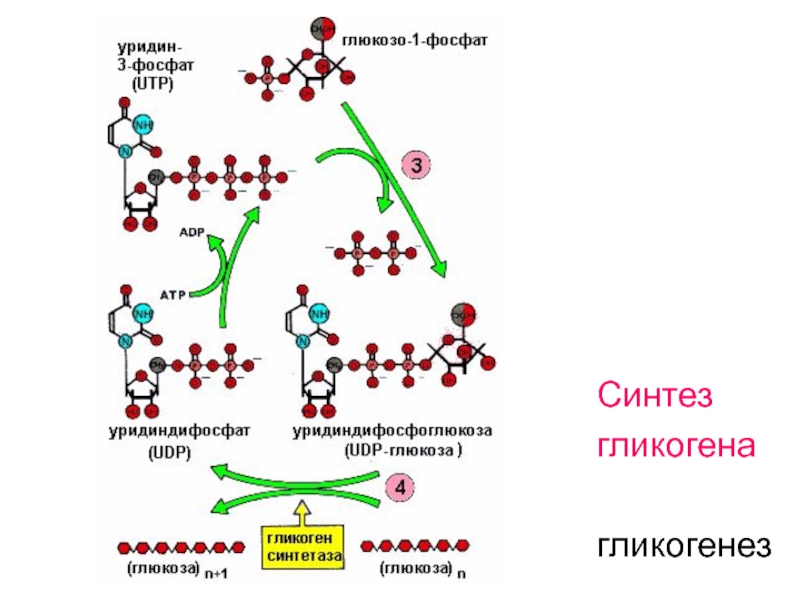
Возвращаясь к гликогенфосфорилазе, менее активная форма «b» может сама активироваться без конформационных изменений. 5’АМР действует как аллостерический активатор, тогда как АТФ является ингибитором, как уже было замечено с контролем фосфофруктокиназы , помогая изменять скорость потока в ответ на потребность в энергии.
Адреналин не только активирует гликогенфосфорилазу, но также ингибирует гликогенсинтазу. Это усиливает эффект активации гликогенфосфорилазы. Это ингибирование достигается с помощью аналогичного механизма, так как протеинкиназа А фосфорилирует фермент, что снижает его активность. Это называется координированным взаимным контролем. Обратитесь к гликолизу для получения дополнительной информации о регуляции гликогенеза.
Ионы кальция или циклический АМФ (цАМФ) действуют как вторичные посредники. Это пример отрицательного контроля. Ионы кальция активируют киназу фосфорилазы. Это активирует гликогенфосфорилазу и ингибирует гликогенсинтазу.
— обмен гликогена — Биохимия
Мобилизация гликогена (гликогенолиз)
Резервы гликогена используются по-разному в зависимости от функциональных особенностей клетки.
Гликоген печени расщепляется при снижении концентрации глюкозы в крови, прежде всего при кратком голодании между приемами пищи. Через 12-18 часов голодания запасы гликогена в печени полностью истощаются. Также распад гликогена в печени происходит при мышечной нагрузке под влиянием адреналина и, если развивается рабочая гипогликемия, глюкагона.
В мышцах количество гликогена снижается обычно только во время физической нагрузки – длительной и/или напряженной. Гликоген здесь используется для обеспечения глюкозой самих миоцитов. Таким образом, мышцы, как впрочем и остальные органы, используют гликоген только для собственных нужд.
Мобилизация (распад) гликогена или гликогенолиз активируется при недостатке свободной глюкозы в клетке, а значит и в крови (голодание, мышечная работа). При этом уровень глюкозы крови «целенаправленно» поддерживает только печень, в которой имеется глюкозо-6-фосфатаза, гидролизующая фосфатный эфир глюкозы.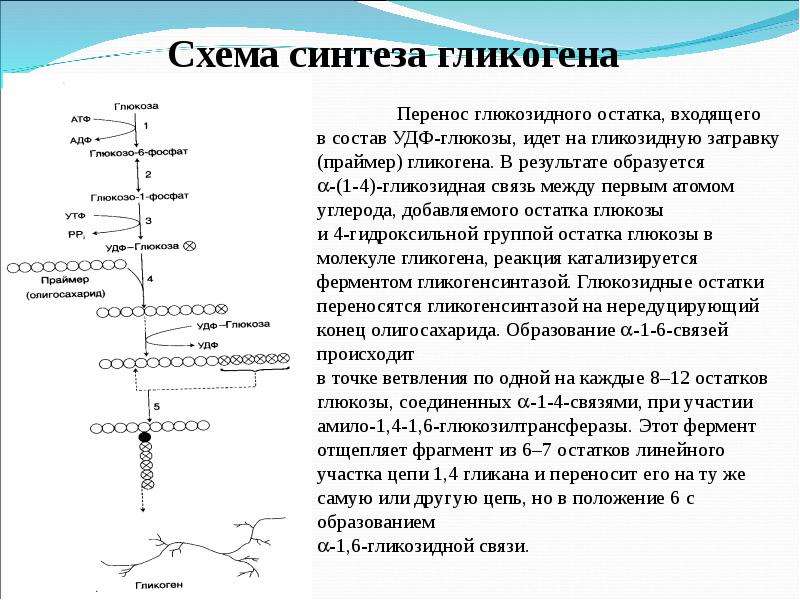 Образуемая в гепатоците свободная глюкоза выходит через плазматическую мембрану в кровь.
Образуемая в гепатоците свободная глюкоза выходит через плазматическую мембрану в кровь.
В гликогенолизе непосредственно участвуют три фермента:
1. Фосфорилаза гликогена (кофермент пиридоксальфосфат) – расщепляет α-1,4-гликозидные связи с образованием глюкозо-1-фосфата. Фермент работает до тех пор, пока до точки ветвления (α1,6-связи) не останется 4 остатка глюкозы.
Роль фосфорилазы при мобилизации гликогена
2. α(1,4)-α(1,4)-Глюкантрансфераза – фермент, переносящий фрагмент из трех остатков глюкозы на другую цепь с образованием новой α1,4-гликозидной связи. При этом на прежнем месте остается один остаток глюкозы и «открытая» доступная α1,6-гликозидная связь.
3. Амило-α1,6-глюкозидаза, («деветвящий» фермент) – гидролизует α1,6-гликозидную связь с высвобождением свободной (нефосфорилированной) глюкозы. В результате образуется цепь без ветвлений, вновь служащая субстратом для фосфорилазы.
Роль ферментов в расщеплении гликогена
Таким образом, при мобилизации гликогена образуется свободная глюкоза и глюкозо-1-фосфат (изомеризующийся в глюкозо-6-фосфат), и их судьба различна в зависимости от органа.
Синтез гликогена
Гликоген способен синтезироваться почти во всех тканях, но наибольшие запасы гликогена находятся в печени и скелетных мышцах. Накопление гликогена в мышцах отмечается в период восстановления после нагрузки, особенно при приеме богатой углеводами пищи. В печени синтез гликогена происходит только после еды, при гипергликемии. Это объясняется особенностями печеночной гексокиназы (глюкокиназы), которая имеет низкое сродство к глюкозе и может работать только при ее высоких концентрациях, при нормальных концентрациях глюкозы в крови ее захват печенью не производится.
Непосредственно синтез гликогена осуществляют следующие ферменты:
1. Фосфоглюкомутаза – превращает глюкозо-6-фосфат в глюкозо-1-фосфат;
2. Глюкозо-1-фосфат-уридилтрансфераза – фермент, осуществляющий ключевую реакцию синтеза. Необратимость этой реакции обеспечивается гидролизом образующегося дифосфата;
Глюкозо-1-фосфат-уридилтрансфераза – фермент, осуществляющий ключевую реакцию синтеза. Необратимость этой реакции обеспечивается гидролизом образующегося дифосфата;
Реакции синтеза УДФ-глюкозы
3. Гликогенсинтаза – образует α1,4-гликозидные связи и удлиняет гликогеновую цепочку, присоединяя активированный С1 УДФ-глюкозы к С4 концевого остатка гликогена;
Химизм реакции гликогенсинтазы
4. Амило-α1,4-α1,6-гликозилтрансфераза,»гликоген-ветвящий» фермент – переносит фрагмент с минимальной длиной в 6 остатков глюкозы на соседнюю цепь с образованием α1,6-гликозидной связи.
Роль гликогенсинтазы и гликозилтрансферазы в синтезе гликогена
ГЛИКОГЕНЕЗ это
Читать PDF304.92 кб
Клиническое значение цитохимического теста на гликоген в определении эффективности терапии бактериал
Бадретдинова Ф.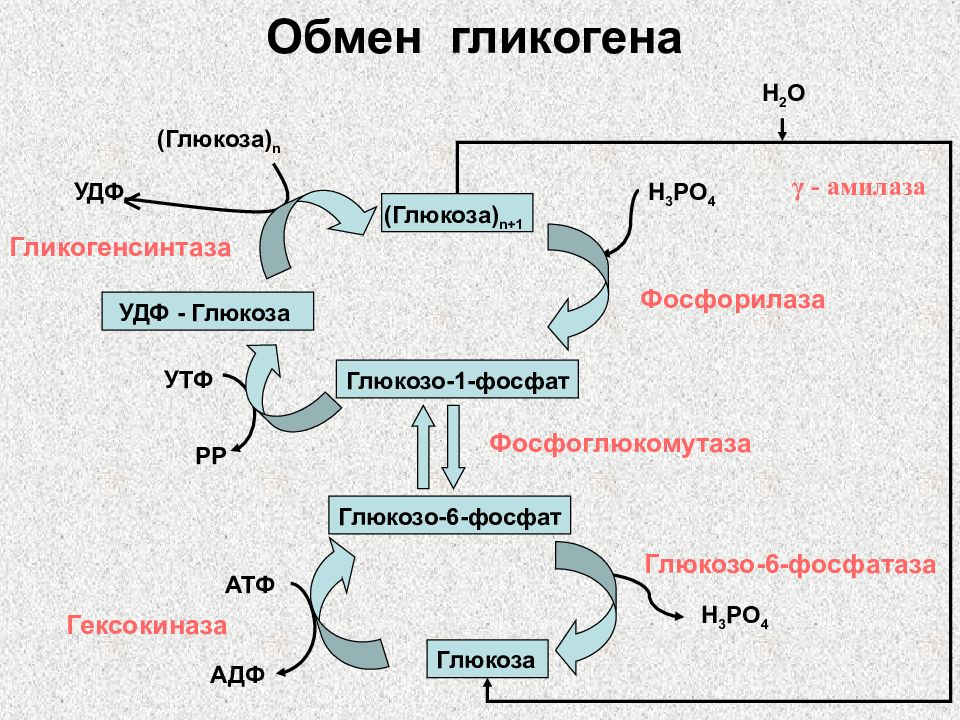 Ф., Каюмов Ф. А., Шейда Л. А.
Ф., Каюмов Ф. А., Шейда Л. А.
Для выявления бактериального вагиноза и контроля лечения у 53 больныхпроводили рН-метрию вагинального содержимого, аминный тест, исследования вагинальных мазков на «ключевые клетки».
Читать PDF725.76 кб
Гликоген в скелетни мускули, миокард и черен дроб на плъхове, третирани с Flutamide
Ф. Гергинска, С. Делчев, К. Георгиева, И. Коева, М. Шишманова, О. Горансон
Читать PDF455.65 кб
СОСТОЯНИЕ ГЛИКОГЕН-СИНТЕЗИРУЮЩЕЙ ФУНКЦИИ ПЕЧЕНИ КРЫС ПРИ АЛЛОКСАН-ИНДУЦИРОВАННОМ САХАРНОМ ДИАБЕТЕ И
Айзман Роман Иделевич, Гайдарова Анна Павловна
Целью работы является изучение влияния порошка корневища куркумы, его основного действующего компонента куркумина и антиоксиданта селенофана на содержание гликогена в печени крыс с экспериментальной моделью сахарного диабета.
34.28 кб
Цитохимическое определение гликогена при заболеваниях шейки матки у женщин
Богдасаров А. Ю., Родкина Р. А., Давидян Л. Ю., Олейникова Д. В.
Читать PDF293.37 кб
Влияние озонирования на содержание гликогена в гепатоцитах и лимфобластах в печени мышей линии AKR
Помаскин О. Б., Иванов С. В., Перминов А. С.
Читать PDF110.79 кб
Витаминный статус у детей с болезнями накопления гликогена
Зубович А.И., Прохорова И.В., Строкова Т.В., Багаева М.Э., Сурков А.Г., Павловская Е.В., Сокольников А.А.
Читать PDF114.35 кб
Витаминный статус у детей с болезнями накопления гликогена
Зубович А.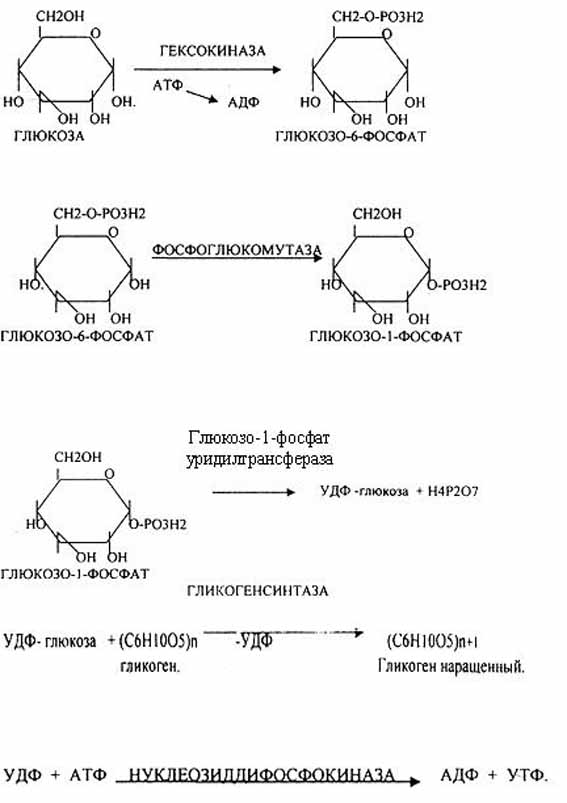 И., Прохорова И.В., Строкова Т.В., Багаева М.Э., Сурков А.Г., Павловская Е.В., Сокольников А.А.
И., Прохорова И.В., Строкова Т.В., Багаева М.Э., Сурков А.Г., Павловская Е.В., Сокольников А.А.
542.39 кб
Гликогеновая болезнь и сахарный диабет типа 1
Титович Е. В., Щербачева Л. Н.
Читать PDF125.89 кб
Влияние фонового резонансного излучения на уровень гликогена в печени при хронической описторхозной
Поддубная О. А., Белобородова Э. И., Левицкий Е. Ф.
Хронический описторхоз паразитарное заболевание человека с признаками снижения реактивности организма. Один из способов оценки реактивности заключается в качественном и количественном анализе гликогена в клетках печени.
Читать PDF1.03 мб
Качественные и количественные показатели содержания гликогена в печени крыс в динамике развития токс
Лебедева Е. И., Мяделец О. Д.
И., Мяделец О. Д.
Целью исследования явилось определение содержания и распределения гликогена в печени крыс в динамике развития токсического цирроза.
Читать PDF2.53 мб
Гистохимические исследования распределения гликогена в органах и тканях Opisthorchis felineus, взяты
Начева Л.В., Бибик О.И., Нестерок Ю.А.
Гистохимические исследования показывают, что после действия антигельминтиков: азинокса и сочетания мебендазола с празиквантелем гликоген исчезает из паренхимы и общая реакция на присутствие углеводов резко снижается.
Читать PDF565.93 кб
Опыт применения транзиентной эластографии печени у детей с гликогеновой болезнью
Сурков А. Н., Намазова-баранова Л. С., Потапов А. С.
Читать PDF596.
 01 кб
01 кбКачество жизни и клинико-лабораторные параллели у детей с гликогеновой болезнью
Черников В. В., Сурков А. Н., Потапов А. С., Винярская И. В.
Читать PDF22.48 мб
Клинические проявления в дебюте печеночных форм гликогеновой болезни
Прохорова И.В., Строкова Т.В., Сурков А.Г., Багаева М.Э., Павловская Е.В., Зубович А.И., Васильева Е.А.
Читать PDF0.00 байт
Cодержание гликогена в клетках моноцитарного ростка костного мозга и периферической крови
Комарова Татьяна Михайловна
Проведено исследование влияния экспериментального поражения печени матери токсического генеза на морфофункциональные особенности становления моноцитов в костном мозге потомства.
Значение гликогенеза и гликогенолиза.

Гликогенез – это внутриклеточный синтез гликогена;
Гликогенолиз – это внутриклеточный распад гликогена.
Гликоген – мышц и печени выполняет разную функцию: Мышц – резерв синтеза АТФ внутри мышечной ткани, а печени – резерв глюкозы для поддержания концетрации глюкозы в циркуляции крови.
Регуляция углеводного обмена.
Регуляция углеводного обмена происходит за счет регуляции действия ферментов катализирующих бóльшую часть реакций. Изменения могут быть достигнуты в результати торможения или активации.
Избыток субстрата, поступающего в клетку инициирует синтез новых молекул фермента, необходимого для метаболизма этого субстрата. Накопление продуктов метаболизма субстрата в клетке приводит к торможению биосинтеза фермента. Прежде всего нейрогуморальная регуляция углеводного обмена является прежде всего концентрация глюкозы в крови. Важную роль в углеводного обмена является выделение в кровь различных гормонов в основном : поджелудочной железы, надпочечников, щитовидной железы. Гормон поджелудочной железы глюкогон – повышает концентрацию глюкозы в крови действуя на клетки через цАМФ. цАМФ – угнетает фермент синтеза гликогена и стимулирует активность фосфорилазы и распад гликогена в печени.
Гормон поджелудочной железы глюкогон – повышает концентрацию глюкозы в крови действуя на клетки через цАМФ. цАМФ – угнетает фермент синтеза гликогена и стимулирует активность фосфорилазы и распад гликогена в печени.
Нарушение углеводного обмена
В случаях неполноценного кормления, а также при различных заболеваниях наблюдается нарушение обмена веществ, в том числе углеводного. Ряд нарушений углеводного обмена связан с – стрессами, генетическими заболеваниями, непереносимостью ряда ферментов, а именно лактозы, сахарозы.
Нарушение углеводного обмена наблюдается при сахарном диабете у собак 7-9лет, кошек старше 6 лет. При сахарном диабете нарушается поступление глюкозы в клетки, что и приводит к гипергликемии. Причина этого заключается в или неспособности поджелудочной железы вырабатывать инсулин в кровь, или неспособность инсулина связываться с соответствующими рецепторами и переносить глюкозу в клетки, с последующим фосфорилированием. Нарушение углеводного обмена при диабете ведет к нарушению жирового и белкового обмена. Для диагностики диабета используют пробу с углеводной нагрузкой. Собаке вводят орально суспензию крахмала и в течении 2-ух каждые 30 минут определяют концентрацию глюкозы в крови. При отсутствии диабета в течении 2-ух часов показатели стабилизируются. Гипергликемия отмечается при лечении : глюкокортикойдами, лихорадке и возбуждении животного.
Нарушение углеводного обмена при диабете ведет к нарушению жирового и белкового обмена. Для диагностики диабета используют пробу с углеводной нагрузкой. Собаке вводят орально суспензию крахмала и в течении 2-ух каждые 30 минут определяют концентрацию глюкозы в крови. При отсутствии диабета в течении 2-ух часов показатели стабилизируются. Гипергликемия отмечается при лечении : глюкокортикойдами, лихорадке и возбуждении животного.
Узнать еще:
Гликогенез и гликогенолиз в печени. Роль печени в поддержании нормального уровня глюкозы в крови.
Гликогенез — биохимическая реакция, протекающая главным образом в печени и мышцах, во время которой глюкоза превращается в гликоген.
-Прежде всего глюкоза подвергается фосфорилированию при участии фермента гексокиназы, а в печени—и глюкокиназы. Далее глюкозо-6-фосфат под влиянием фермента фосфоглюкомутазы переходит в глюкозо-1-фос-фат:
-Образовавшийся глюкозо-1-фосфат уже непосредственно вовлекается в синтез гликогена.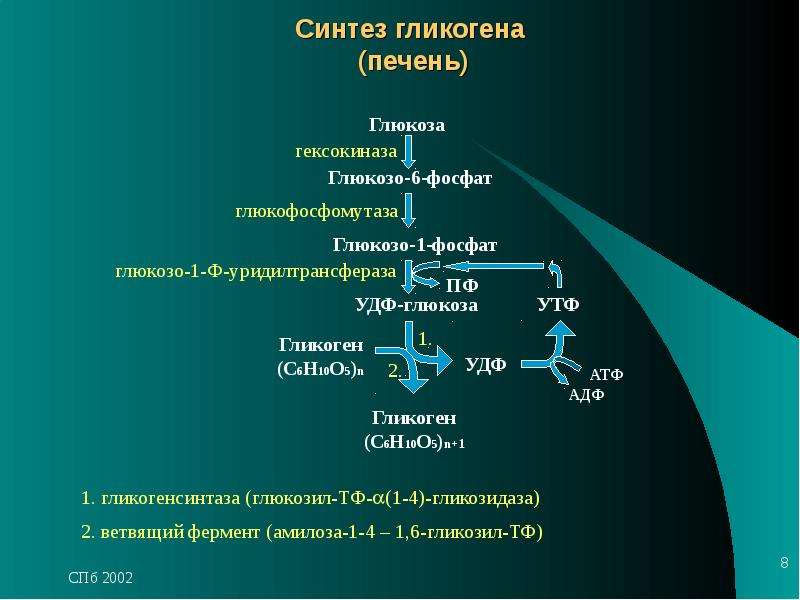
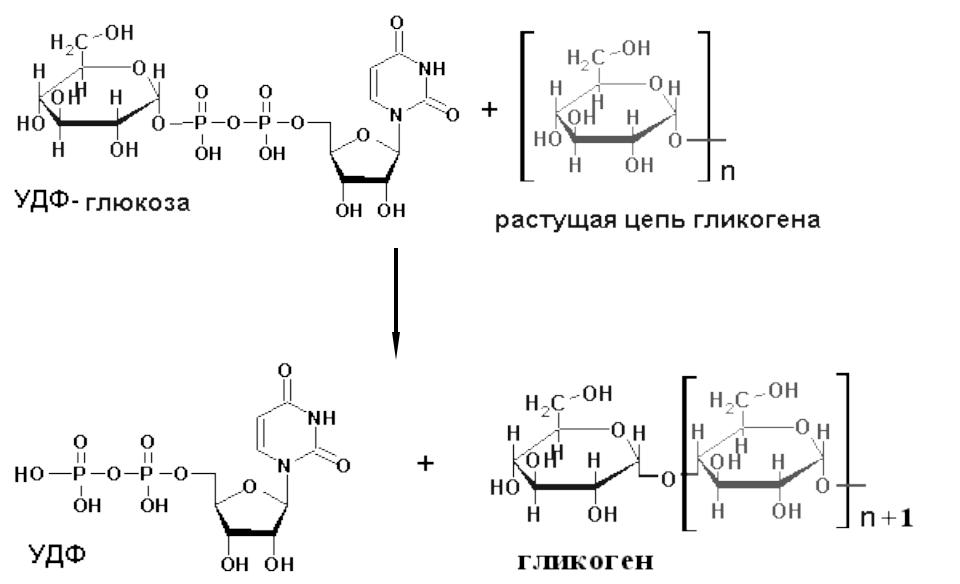
— На первой стадии синтеза глюкозо-1-фосфат вступает во взаимодействие с УТФ (уридинтрифосфат), образуя уридиндифосфатглюкозу (УДФ-глюкоза) и пирофосфат. Данная реакция катализируется ферментом глюкозо-1-фосфат-уридилилтрансферазой (УДФГ-пирофосфорилаза).
-На второй стадии — стадии образования гликогена — происходит перенос глюкозного остатка, входящего в состав УДФ-глюкозы, на глюкозидную цепь гликогена («затравочное» количество). При этом образуется α-(1, 4) -связь между первым атомом углерода добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозы цепи. Эта реакция катализируется ферментом гликогенсинтазой. Необходимо еще раз подчеркнуть, что реакция, катализируемая гликогенсинтазой, возможна только при условии, что полисахаридная цепь уже содержит более 4 остатков D-глюкозы.
-Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ, и таким образом весь цикл превращений глюкозо-1-фосфата начинается сначала.
Гликогенолиз — это распад гликогена. Гликогенолиз происходит непрерывно, и за счет этого поддерживается постоянная концентрация глюкозы в крови в промежутках между приемами пищи.
Гликогенолиз происходит непрерывно, и за счет этого поддерживается постоянная концентрация глюкозы в крови в промежутках между приемами пищи.
-Гликогенолиз может осуществляться либо путем гидролиза (под действием ферментов амилаз), либо фосфоролиза.
-Фосфоролиз является основным путем распада гликогена, его катализирует фермент гликогенфосфорилаза, относящийся к классу трансфераз. Фосфорилазы переводят полисахариды из запасной формы в метаболически активную. Гликогенфосфорилаза отщепляет остатки глюкозы от полигликозидной цепи гликогена и переносит их на молекулу фосфорной кислоты с образованием глкжозо-1-фосфата:
Глюкозо-1-фосфат быстро изомеризуется, превращаясь в глюкозо-6-фосфат под действием фосфоглюкомутазы:
На данном этапе заканчивается распад гликогена в мышечной ткани.
В печени из глюкозо-6-фосфата происходит образование свободной глюкозы под влиянием глюкозо-6-фосфатазы. Данный фермент катализирует гидролитическое отщепление фосфата:
Гликогенез и его роль Синтез гликогена (гликогенез)
Прежде всего глюкоза подвергается фосфорилированию при участии фермента гексокиназы, а в печени – и глюкокиназы. Далее глюкозо-6-фосфат под влиянием фермента фосфоглюкомутазы переходит в глюкозо-1-фос-фат:
Далее глюкозо-6-фосфат под влиянием фермента фосфоглюкомутазы переходит в глюкозо-1-фос-фат:
Образовавшийся глюкозо-1-фосфат уже непосредственно вовлекается в синтез гликогена. На первой стадии синтеза глюкозо-1-фосфат вступает во взаимодействие с УТФ (уридинтрифосфат), образуя уридиндифосфатглю-козу (УДФ-глюкоза) и пирофосфат. Данная реакция катализируется ферментом глюкозо-1-фосфат-уридилилтрансферазой (УДФГ-пирофосфорила-за):
Глюкозо-1-фосфат + УТФ < = > УДФ-глюкоза + Пирофосфат.
На второй стадии – стадии обр-ния гликогена – происходит перенос глюкозного остатка, входящего в состав УДФ-глюкозы, на глюкозидную цепь гликогена. При этом обр-тся α-(1–>4)-связь между первым атомом углер добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозы цепи. Эта реакция катализируется ферментом гликогенсинтазой. Необходимо еще раз подчеркнуть, что реакция, катализируемая гликогенсинтазой, возможна только при условии, что полисахаридная цепь уже содержит более 4 остатков D-глю-козы.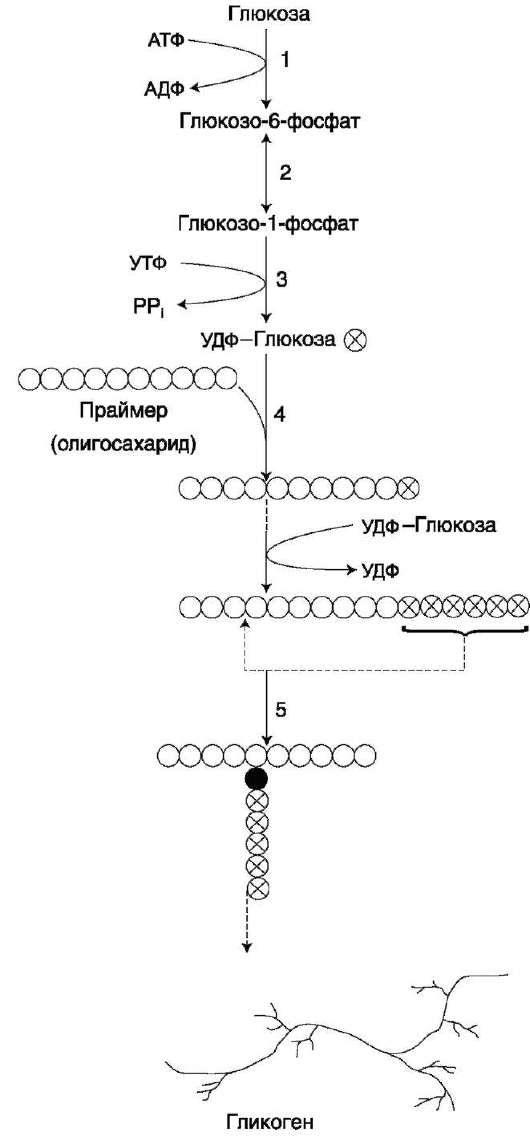
Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ, и таким образом весь цикл превращений глюкозо-1-фосфата начинается сначала.
В целом образование α-1,4-глюкозидной ветви («амилозной» ветви) гликогена можно представить в виде следующей схемы:
Установлено, что гликогенсинтаза не способна кат-вать обр-ние α-(1–>6)-связи, имеющейся в точках ветвления гликогена. Этот проц кат-рует спец фермент, получивший название гли-когенветвящего фермента, или амило-(1–>4)–>(1–>6)-трансглюкозидазы. Последний катализирует перенос концевого олигосахаридного фрагмента, состоящего из 6 или 7 остатков глюкозы, с нередуцирующего конца одной из боковых цепей, насчитывающей не менее 11 остатков, на 6-гидроксиль-ную группу остатка глюкозы той же или другой цепи гликогена. В результате образуется новая боковая цепь.
Ветвление повышает раст-сть гликогена. Кроме того, благодаря ветвлению создается большое кол-во невосст-вающих концевых остатков, к-рые явл местами действия гликогенфосфорилазы и гликогенсинтазы.
Т.об., ветвление увеличивает скорость синтеза и расщепления гликогена.
Благодаря способности к отложению гликогена (главным образом в печени и мышцах и в меньшей степени в других органах и тканях) создаются условия для накопления в норме некоторого резерва углеводов. При повышении энерготрат в организме в результате возбуждения ЦНС обычно происходят усиление распада гликогена и образование глюкозы.
Билет 25
Гликофосфолипиды
Гликолипиды широко представлены в тканях, особенно в нервной ткани, в частности в мозге. Главной формой гликолипидов в животных тканях явл гликосфинголипиды. Последние содержат церамид, состоящий из спирта сфингозина и остатка жирной к-ты, и один или несколько остатков сахаров.
Простейшими гликосфинголипидами явл галактозилцерамиды и глюкозилцерамиды.
Галактозилцерамиды – главные сфинголипиды мозга и других нервных тканей, но в небольших количествах встречаются и во многих других тканях.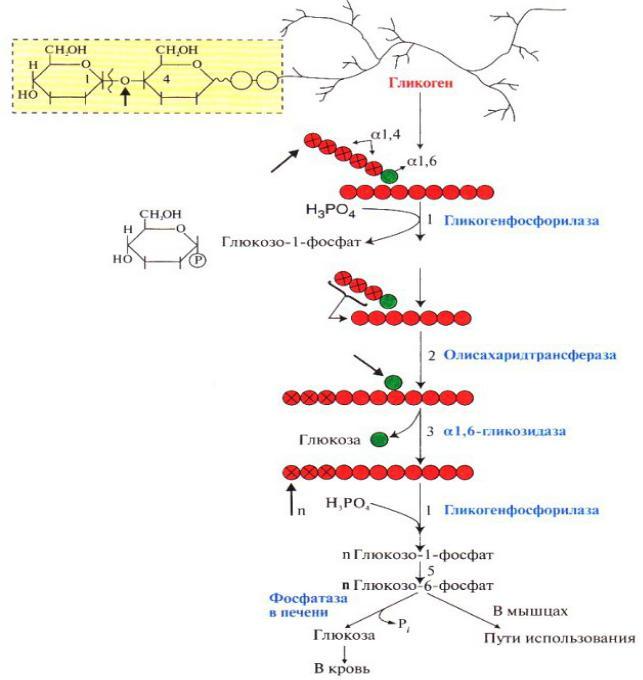 В состав галактозилцерамидов входит гексоза (обычно это D-галактоза), к-рая связана эфирной связью с гидроксильной группой аминоспирта сфингозина. Кроме того, в составе галактозилцерамида имеется жирная к-та. Чаще всего это лигноцериновая, нервоновая или це-реброновая к-та, т.е. ЖКы, имеющие 24 углеродных атома.
В состав галактозилцерамидов входит гексоза (обычно это D-галактоза), к-рая связана эфирной связью с гидроксильной группой аминоспирта сфингозина. Кроме того, в составе галактозилцерамида имеется жирная к-та. Чаще всего это лигноцериновая, нервоновая или це-реброновая к-та, т.е. ЖКы, имеющие 24 углеродных атома.
Сущ-ют сульфогалактозилцерамиды, к-рые отлич от га-лактозилцерамидов наличием остатка серной к-ты, присоединенного к 3-ему углеродному атому гексозы. В мозге млекопит сульфогалактозилцерамиды в осн нах в белом в-ве, при этом содержание их в мозге намного ниже, чем галактозилцерамидов.
Глюкозилцерамиды – простые гликосфинголипиды, представлены в тканях, отличных от нервной, причем главным образом глюкозил-церамидами. В небольших количествах они имеются в ткани мозга. В отличие от галактозилцерамидов у них вместо остатка галактозы им-ся остаток глюкозы.
Более сложными гликосфинголипидами явл ганглиозиды, образующиеся из гликозилцерамидов. Ганглиозиды дополнительно содержат одну или несколько мол-л сиаловой к-ты. В тканях человека доминирующей сиаловой к-той явл нейраминовая. Кроме того, вместо остатка глюкозы они чаще содержат сложный олигосахарид. Ганглиозиды в больших количествах находятся в нервной ткани. Они, по-видимому, выполняют рецепторные и другие функции. Одним из простейших ганглиозидов явл гематозид, выделенный из стромы эритроцитов. Он содержит церамид (ацилсфингозин), одну мол-лу глюкозы, одну мол-лу N-ацетилнейраминовой к-ты.
Ганглиозиды дополнительно содержат одну или несколько мол-л сиаловой к-ты. В тканях человека доминирующей сиаловой к-той явл нейраминовая. Кроме того, вместо остатка глюкозы они чаще содержат сложный олигосахарид. Ганглиозиды в больших количествах находятся в нервной ткани. Они, по-видимому, выполняют рецепторные и другие функции. Одним из простейших ганглиозидов явл гематозид, выделенный из стромы эритроцитов. Он содержит церамид (ацилсфингозин), одну мол-лу глюкозы, одну мол-лу N-ацетилнейраминовой к-ты.
ГЛИКОЛИПИДЫ, соед., построенные из липидного и УГного фрагментов, соединенных ковалентной связью. Гликолипиды широко распространены в природе (они обнаружены в животных, растениях и микроорг-мах) и охватывают разнородные по стр-ре соединения.
В зависимости от природы липидной части гликолипиды можно разделить на четыре группы: 1) гликозилдиглицериды, липидная часть к-рых представляет собой остаток глицерина, ацилированный в положения 1 и 2 высшими жирными к-тами; 2) гликосфинголипиды, в к-рых липидным фрагментом явл церамид-остаток высшего аминоспирта (сфингозинового основания), N-ацилированного высшей жирной к-той; 3) полипренилфосфатсахара, у к-рых липидная часть мол-лы представляет собой остаток полипренола Н(СН2С(СН3)=СНСН2)nОН; 4) гликолипиды микроорг-мов, в состав к-рых входят остатки высших жирных к-т, ацилирующих остатки Сахаров или неУГных компонентов мол-лы.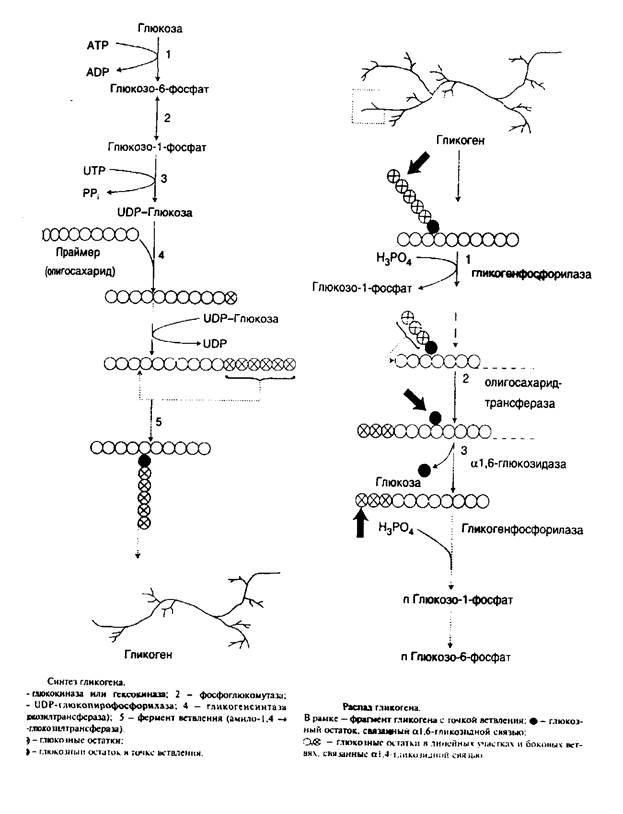
Подавляющее большинство гликолипидов относится к первым двум группам и явл важными компонентами мембран.
Гликолипиды микроорг-мов включают обширную группу соед., сильно различающихся по строению и св-вам (напр, липид А-компонент липополисах-дов грам-отрицат. бактерий, отвечающ за их эндотоксич. св-ва.
Несмотря на большое разнообразие стр-р, гликолипиды обладают нек-рыми общими св-вами. Гликолипиды явл ПАВ. Благодаря присутствию длинных алифатич. цепочек, они могут раств. в нек-рых орг. р-рителях (напр., в бутаноле, смеси хлороформа и метанола), а наличие УГной части придает им р-римость в воде, возрастающую с увеличением длины УГной цепи. Выбор способов выделения гликолипидов из ткани и разделение их на классы зависит от полярности исследуемых гликолипидов.
Биохимия, гликогенез — StatPearls — Книжная полка NCBI
Введение
Гликоген, основная форма хранения глюкозы и первичный источник неокислительной глюкозы для скелетных мышц и печени, вносит значительный вклад в свою деградацию, поддерживая нормальный уровень глюкозы в крови и обеспечивая топливо для сокращения мышц.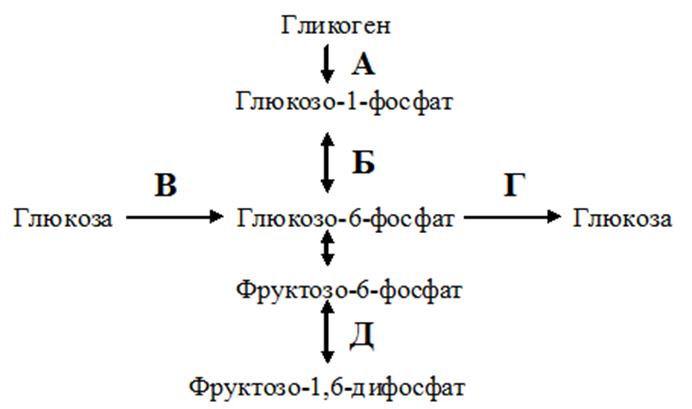 Что касается цитозольной деградации, основные ферменты, участвующие в распаде гликогена, представляют собой гликогенфосфорилазу и фермент разветвления.Гликогенфосфорилаза заботится о разрыве связей в линейной цепи, тогда как фермент разветвления переносит остатки глюкозы в линейную цепь для разрушения разветвлений. Оба фермента работают в скелетных мышцах и печени. Поскольку скелетные мышцы могут использовать фосфорилированную форму глюкозы в качестве топлива, для них не требуется глюкозо-6-фосфатаза.
Что касается цитозольной деградации, основные ферменты, участвующие в распаде гликогена, представляют собой гликогенфосфорилазу и фермент разветвления.Гликогенфосфорилаза заботится о разрыве связей в линейной цепи, тогда как фермент разветвления переносит остатки глюкозы в линейную цепь для разрушения разветвлений. Оба фермента работают в скелетных мышцах и печени. Поскольку скелетные мышцы могут использовать фосфорилированную форму глюкозы в качестве топлива, для них не требуется глюкозо-6-фосфатаза.
С другой стороны, печени требуется глюкозо-6-фосфатаза для дефосфорилирования глюкозы и экспорта глюкозы за пределы клетки. Что касается лизосомальной деградации, кислая альфа-глюкозидаза отвечает за гликогенолиз.Дефицит любого из этих ферментов проявляется в виде уникальных болезненных состояний. Большинство изменений в цитозольной деградации вызывают болезни накопления гликогена, включая болезнь фон Гирке, болезнь Кори и болезнь Херса. Нарушение лизосомальной деградации может привести к болезни Помпе. Нарушение роли гликогенолиза в нервном функционировании проявляется в проявлении болезни Лафора. Обнаружение изменений гликогенолиза может быть сделано в основном с помощью анализа ДНК и электронной микроскопии с помощью биопсии печени и скелетных мышц.
Основы
Гликоген существует из предшественников глюкозы, полученных из недавно потребленных углеводов или глюконеогенных предшественников, включая лактат и аланин. Гликогенолиз — это просто процесс, участвующий в расщеплении гликогена для использования в качестве источника энергии, главным образом в скелетных мышцах и печени. Распад гликогена происходит двумя разными путями в зависимости от местоположения. Что касается скелетных мышц, деградация гликогена приводит к образованию глюкозо-1-фосфата, и мышцы сами по себе используют его в качестве топлива для сокращения.Гликогенолиз в скелетных мышцах происходит в условиях физической активности. С другой стороны, гликогенолиз печени генерирует глюкозу для экспорта в кровоток. Стимулом для гликогенолиза печени является недостаток питания с соответствующим увеличением гормонов, таких как глюкагон. [1]
Проблемы, вызывающие озабоченность
Из-за жизненно важной роли, которую распад гликогена играет в нормальной физиологии, включая поддержание уровня глюкозы в крови и сокращение мышц во время активности, нарушения гликогенолиза вызывают патофизиологические состояния.Хотя исследователи изучали роль гликогена, определенная информация не совсем понятна. Например, неясна конкретная роль гликогена в сокращении мышц или способ переноса гликогена в лизосомы.
Клеточный
Гликогенолиз, расщепление гликогена, происходит в двух клеточных участках: цитозоле и лизосоме. Различные ферменты осуществляют расщепление гликогена в этих клеточных участках. При разложении гликогена в качестве топлива используется глюкоза или глюкозо-1-фосфат.В скелетных мышцах захват глюкозы опосредуется транспортерами GLUT1 (лежащими на плазматической мембране) и GLUT4 (лежащими внутри внутриклеточных накопительных везикул). В цитозоле гликогенфосфорилаза сильно активируется АМФ для мышечной ткани. Что касается печени, глюкагон активирует гликогенфосфорилазу за счет увеличения циклического АМФ. Деградация гликогена в лизосомах опосредуется кислой альфа-глюкозидазой через аутофагические вакуоли, которые захватывают часть цитоплазмы и сливаются с органеллами, вмещая содержимое.Конкретные механизмы получают дальнейшее объяснение в следующих разделах. [2]
Молекулярный
Гликоген — это разветвленный полимер глюкозы. Глюкоза хранится в клетках в виде полимеров, что увеличивает растворимость, занимает меньше места и обеспечивает быструю мобилизацию. Запас гликогена в гепатоците соответствует расчетной концентрации глюкозы 400 мМ. И наоборот, вклад нерастворимого гликогена в осмолярность цитозоля в 40 миллионов раз меньше, чем вклад 40 мМ глюкозы.Следовательно, если бы полимерная форма гликогена не существовала, осмолярность цитозоля была бы достаточно высокой, чтобы вызвать проникновение воды в клетку посредством осмоса и привести к лизису клетки. Гликоген приводит к более высокой растворимости, в основном из-за образования разветвлений. С другой стороны, большая часть полимера образует альфа-1-4 гликозидные связи, которые организуются в цепочки, разветвление происходит через каждые 4-8 мономеров глюкозы через альфа-1-6 гликозидные связи. Такое расположение приводит к классической организации гликогена, называемого бета-частицами, с самогликозилирующим белком, называемым гликогенином, в ядре.[3]
Важно понимать конформацию гликогена, потому что гликогенолиз включает в себя распад этого полимера на мономеры глюкозы с помощью отдельных ферментов, которые катализируют распад разветвлений и цепей гликогена.
Функция
Распад гликогена происходит во время голодания или при низком соотношении инсулина и глюкагона. Основные запасы энергии для организма — это гликоген и липиды. В то время как липиды приводят к большему количеству молекул АТФ после окисления, гликогенолиз приводит к меньшему количеству молекул АТФ.Однако существуют два существенных преимущества метаболизма гликогена. Первое преимущество соответствует быстрой мобилизации гликогена для удовлетворения метаболических потребностей. Возможна быстрая мобилизация, поскольку ферменты гликогенолиза могут прикрепляться к многочисленным ветвям гликогена и начинать одновременный гидролиз. Второе преимущество заключается в выработке энергии в условиях отложений с низким содержанием липидов, например, при анорексии [3].
Количественно гликоген больше присутствует в скелетных мышцах, чем в печени.Тем не менее гликогенолиз играет важную роль в обеих тканях. В печени метаболизм гликогена играет жизненно важную роль во время голодания, приводя к выработке печеночной глюкозы для поддержания нормального уровня глюкозы в крови и поддержки потребностей в топливе других тканей. С другой стороны, полное проявление гликогена в скелетных мышцах указывает на критическую функцию, которую гликоген играет в скелетных мышцах с точки зрения быстрого образования АТФ. Существует тесная взаимосвязь между хранением гликогена в скелетных мышцах и сопротивлением усталости.Способность мышцы тренироваться в течение первых 30 минут активности, несмотря на обилие других источников энергии, таких как липиды, серьезно ухудшается, когда уровень гликогена в скелетных мышцах снижается. Истощение гликогена приводит к утомлению, потому что мышца не может обеспечить скелетным мышцам достаточное количество энергии для возбуждения и сокращения. Вероятная причина вращается вокруг роли гликогена в высвобождении кальция из саркоплазматической сети. [4] [5]
Помимо обеспечения энергией, гликогенолиз может привести к образованию прекурсоров для участия в окислительных реакциях пентозофосфатного пути, помогая генерировать НАДФН, который необходим для синтеза жирных кислот и производства пентозофосфатов, которые необходимы для синтез РНК и ДНК.[3]
Механизм
Гликогенолиз может происходить двумя путями. В то время как первый путь вращается вокруг цитозольной деградации за счет синхронизированного действия гликогенфосфорилазы и фермента, расщепляющего гликоген, второй путь вращается вокруг лизосомальной деградации с помощью фермента альфа-глюкозидазы.
В соответствии с цитозольной деградацией, гликогенфосфорилаза, фермент, ограничивающий скорость гликогенолиза, расщепляет концевой остаток глюкозы, связанный с ответвлением гликогена, при этом замещая фосфорильную группу на связь альфа 1-4.Четыре остатка перед альфа-связью 1-6, соответствующие разветвлению, фермент разветвления гликогена катализирует перенос трех из четырех оставшихся остатков глюкозы в конец другой цепи гликогена, где они снова могут разлагаться гликогенфосфорилазой. Другими словами, разрыв альфа-1-4 гликозидных связей, присутствующих в линейных цепях, катализируется гликогенфосфорилазой, а добавление фосфатной группы в позицию один приводит к образованию глюкозо-1-фосфата. Активность гликогенфосфорилазы модулируется аллостерически и фосфорилированием.Производство гликогена, наоборот, подавляет деградацию гликогена. Затем фосфоглюкомутаза отвечает за превращение глюкозо-1-фосфата в глюкозо-6-фосфат посредством реакции изомеризации, которая не требует энергии. С другой стороны, фермент разветвления имеет дело с альфа-связями 1-6 и переносит ответвление на конец полимера, чтобы гликогенфосфорилаза могла продолжать работать с ним. В большинстве тканей глюкозо-6-фосфат используется внутри организма для гликолиза и выработки энергии путем преобразования в пируват, действуя как критически важный промежуточный продукт метаболизма для других путей, включая цикл TCA, синтез жирных кислот, цикл Кори и цикл аланина.Тем не менее, в глюконеогенных органах, таких как печень, почки и кишечник, глюкозо-6-фосфат необходимо дефосфорилировать до глюкозы с помощью фермента глюкозо-6-фосфатазы, чтобы он мог переноситься из ER в интерстициальную космос. Соответствует деградации лизосомального гликогена, основного фермента, участвующего в кислой мальтазе. Предполагается, что гидролиз гликогена до глюкозы, катализируемый кислой альфа-глюкозидазой, служит защитным механизмом для печени от высоких концентраций гликогена.Из общего количества гликогенолиза, происходящего в скелетных мышцах, только 5% деградации гликогена происходит в лизосомах. Что касается гликогенолиза печени, только 10% происходит в лизосомах. [6] [5] [7]
Тестирование
Визуализация молекул гликогена не может быть сделана с помощью световой микроскопии, вместо этого требуется электронная микроскопия. Гистологическое окрашивание и использование световой микроскопии позволит визуализировать только конгломераты частиц гликогена. Молекулы гликогена сами по себе требуют электронной микроскопии.В зависимости от собранного образца ткани гликоген описывается как бета-частицы, похожие на розетки, или более крупные альфа-частицы. Бета-частицы, похожие на розетки, находятся на мышцах, тогда как альфа-частицы, которые представляют собой просто агрегаты бета-частиц, находятся в печени. Бета-частицы соответствуют типичной конфигурации гликогена со средней длиной цепи из 13 остатков, состоящей из внутренних цепей с точками ветвления и внешних цепей без точек ветвления. Встроенный метод гистологического окрашивания — Period Acid Schiff.Однако существуют определенные недостатки этого метода, в том числе отсутствие специфичности и общая несовместимость с методами иммунофлуоресценции. Таким образом, теперь доступен новый метод обнаружения гликогена в клетках, в котором возобновляемый рекомбинантный белок, содержащий углеводсвязывающий модуль из белка 1 крахмал-связывающего домена (Stbd1), впоследствии используется для проведения иммуноферментного анализа [1]. ] [8]
Что касается тестирования на болезни накопления гликогена, современные методы, использующие анализ мутаций ДНК, устранили необходимость выполнять биопсию печени.Этот диагностический тест, например, применяется к болезни фон Гирке и болезни Кори. Диагностические тесты на болезнь Помпе включают анализ активности кислой мальтазы в лейкоцитах или фибробластах. Биопсия мышцы, показывающая вакуолизированную миопатию с чрезмерным накоплением лизосомального гликогена, также может служить диагностическим тестом для болезни Помпе. [5]
Скорость гликогенолиза — это разница между скоростью производства глюкозы и абсолютным глюконеогенезом. Уровни глюконеогенеза определяются с использованием методов, включая радиоактивные и стабильные изотопы.Количественная оценка гликогенолиза также возможна с помощью спектроскопии ядерного магнитного резонанса. [9]
Патофизиология
Нарушения гликогенолиза могут приводить к множеству заболеваний, включая болезни накопления гликогена (GSD), лизосомные болезни накопления и прогрессирующую миоклоническую эпилепсию Lafora. Нарушения гликогенолиза часто приводят к дисфункции органов, включая печень, скелетные мышцы, мозг и почки. В зависимости от пораженного фермента гликогенолиза возможен определенный спектр синдромов.
Нарушение гликогенолиза может привести к заболеваниям накопления гликогена, таким как болезнь фон Гирке, наиболее распространенная GSD. GSD типа I действует из-за дефицита глюкозо-6-фосфатазы, ответственной за дефосфорилирование глюкозо-6-фосфата, так что глюкоза может транспортироваться за пределы клетки для регулирования уровня глюкозы в крови и использования топлива в других тканях за пределами печени. Нарушение способности вырабатывать глюкозу в результате гликогенолиза приводит к тяжелой гипогликемии, гиперурикемии и повышению уровня молочной кислоты и триглицеридов.Из-за отложения жира у пациентов появляется округлое лицо, похожее на куклу. Без лечения у пациентов с этим заболеванием наблюдались задержка развития, гепатомегалия, аномальный отек и задержка моторного развития. Из-за накопления гликогена в почках могут развиться долгосрочные осложнения, приводящие к нефропатии, хроническому заболеванию почек и раку почек. Основная форма лечения пациентов с болезнью фон Гирке — поддерживать нормальный уровень глюкозы, избегая гипогликемии за счет частого кормления.[5] [10]
В то время как расщепление гликогена фосфорилазой и расщепляющим ферментом может происходить в цитозоле, гликоген также разрушается через лизосомный путь, что приводит к лизосомной болезни накопления, называемой болезнью Помпе (болезнь накопления гликогена типа II). При болезни Помпе развилась мутация лизосомальной альфа-глюкозидазы, также называемой кислой мальтазой. В результате гликоген накапливается в лизосоме и ее пузырьках, что приводит к летальному исходу, включая кардиомиопатию и мышечную гипотонию.Точный путь, по которому гликоген транспортируется в лизосомы, все еще неизвестен, но предполагается, что это происходит через макроаутофагию, при которой поглощение груза внутри двухмембранных везикул, называемых аутофагосомами, сливается с лизосомами. [1]
Болезнь накопления гликогена Тип III, также называемая болезнью Кори, возникает из-за дефицита фермента, разветвляющего гликоген. В результате это заболевание проявляется накоплением аномального гликогена, поскольку гликогенолиз останавливается, когда гликогенфосфорилаза встречает точку ветвления.В этом случае гликоген считается ненормальным, поскольку он отражает очень короткие внешние цепи. Пациенты с болезнью Кори имеют кетотическую гипогликемию и гепатомегалию. В редких случаях это может привести к циррозу печени и гепатоцеллюлярной карциноме [5].
Болезнь накопления гликогена Тип V (болезнь Макардла) развивается из-за дефицита гликогенфосфорилазы в скелетных мышцах. Другими словами, при этом заболевании печень щадит. Пациенты демонстрируют непереносимость физических упражнений, мышечную слабость, спазмы и боли.Уровень креатинкиназы повышается, и может присутствовать миоглобинурия. Типичным для этого заболевания является явление, называемое «второе дыхание», когда пациенты могут возобновить упражнения после короткого отдыха. Прием сахарозы перед тренировкой может помочь облегчить симптомы, поскольку она становится источником энергии во время тренировки, прежде чем прибегать к запасам гликогена. При дефиците гликогенфосфорилазы в печени развивается другое заболевание — GSD типа VI. У нее нормальный уровень креатинкиназы и мочевой кислоты.Пациенты обращаются с задержкой роста и увеличением печени. Гиперлипидемия и кетотическая гипогликемия могут быть обычным явлением. [5]
При прогрессирующей миоклонической эпилепсии Lafora повышенное фосфорилирование гликогена присутствует в нескольких тканях, что приводит к токсичности и гибели клеток в нейронах. Симптомы включают атаксию, судороги, миоклонус и деменцию. Присутствие более высоких уровней фосфорилирования в гликогене приводит к образованию более длинных цепей и нерегулярных точек разветвления, которые делают полимер нерастворимым и устойчивым к деградации.В результате у пациентов с этим заболеванием образуется конгломерат телец включения, называемых тельцами Лафоры. [5]
Клиническая значимость
Важность гликогенолиза демонстрируется через мутации в деградации гликогена, ведущие к генетическим нарушениям у человека, и через неспособность скелетных мышц справляться с физическим стрессом при дефиците гликогена.
Непрерывное образование / обзорные вопросы
Рисунок
Гликогенез. Изображение предоставлено: https: // commons.wikimedia.org/wiki/File:Glycogenesis.png
Метаболизм гликогена — AMBOSS
Последнее обновление: 9 июня 2021 г.
Резюме
Гликоген — это важный сложный полимер, состоящий из нескольких цепей молекул глюкозы. Он присутствует во всех типах клеток, за исключением эритроцитов. Большая часть гликогена в организме хранится в печени и скелетных мышцах. Полностью восполненные запасы гликогена могут обеспечивать уровень глюкозы в крови примерно на 12–48 часов во время голодания.Метаболизм гликогена в первую очередь регулируется инсулином, глюкагоном и адреналином. Инсулин увеличивает гликогенез и снижает гликогенолиз в печени и мышцах; глюкагон и адреналин снижают гликогенез в печени и усиливают гликогенолиз в печени и мышцах.
Обзор
- Функция: гликоген является наиболее важной средой для хранения углеводов в организме и содержится в цитозольных гранулах.
- Общее хранение гликогена: ∼ 400–450 г (обеспечивает глюкозу на 12–48 часов)
- Химическая структура
- Разветвленный полимер, состоящий из нескольких связанных цепей глюкозы
- Разветвления: α-1,6-гликозидные связи
- Связи: α-1,4-гликозидные связи
Окрашивание периодической кислотой – Шиффа — это иммуногистохимический метод, используемый для визуализации полисахаридов, таких как гликоген.
Гликогенез
2.) Начальное образование цепи
- Гликогенин
- Фермент, состоящий из гомодимерного белка, который находится в основе каждой единицы гликогена и является отправной точкой синтеза гликогена.
- Катализирует образование коротких цепей гликогена путем полимеризации нескольких молекул UDP-глюкозы.
3.) Удлинение цепи
Ферментом, определяющим скорость гликогенеза, является гликогенсинтаза.
4.) Разветвление цепей гликогена
- Фермент разветвления: фермент с активностью глюкозилтрансферазы, который вводит разветвления в цепь гликогена, чтобы обеспечить дальнейшее удлинение цепи во многих участках комплекса гликогена
- Катализирует образование α-1,6-гликозидных связей: гидролизует цепь из 6 единиц глюкозы от исходной цепи → присоединение молекул к атому C6 другой единицы глюкозы в исходной цепи
- Ветви вводятся не менее чем на 4 единицы глюкозы друг от друга.
Последовательность синтеза гликогена, начиная с глюкозы: Glc → Glc-6-P → Glc-1-P → UDP-Glc → гликоген
Гликогенолиз
1.) Высвобождение глюкозы
- Расщепление α-1,4-гликозидных связей: гликогенфосфорилаза (кофактор витамина B6) отщепляет глюкозу-1-P; через фосфорную реакцию до тех пор, пока на ответвлении не останется 4 концевых остатка глюкозы (так называемый предельный декстрин).
- Разрыв α-1,6-гликозидных связей
- Ферменты разветвления: фермент, обладающий глюкозилтрансферазной, а также глюкозидазной активностью
- Первый шаг: гликозилтрансфераза; (или 4-α-D-глюканотрансфераза): переносит 3 из 4 оставшихся остатков глюкозы ветви в соседнюю ветвь
- Второй этап: глюкозидаза (или амило-α-1,6-глюкозидаза): отщепляет оставшееся звено глюкозы (связь альфа-1,6) от ветви; через гидролитическую реакцию → высвобождение нефосфорилированных свободных молекул глюкозы и линейной цепи гликогена
- Ферменты разветвления: фермент, обладающий глюкозилтрансферазной, а также глюкозидазной активностью
Часть гликогена не разлагается гликогенфосфорилазой и ферментами разветвления, а в лизосомах — лизосомальной альфа-глюкозидазой.Дефицит этого фермента приводит к болезни Помпе (болезнь накопления гликогена II).
Болезнь Кори представляет собой тип нарушения накопления гликогена (тип III), вызванный дефицитом фермента, расщепляющего ответвления гликогена (α-1,6-глюкозидазы).
Болезнь Макардла — болезнь накопления гликогена, характеризующаяся дефицитом гликогенфосфорилазы в скелетных мышцах.
2) Утилизация глюкозы
После гликогенолиза фосфоглюкомутаза (изомераза) превращает глюкозу-1-P в глюкозу-6-P
- В мышцах
- Мгновенный метаболизм глюкозы-6-P во время упражнений (гликолиз)
- Гексокиназа: превращает свободную глюкозу в глюкозу-6-P
- В печени: глюкозо-6-фосфатаза: глюкоза-6-P → свободная глюкоза → высвобождение в системный кровоток → повышение уровня глюкозы в сыворотке.
Ферментом, определяющим скорость гликогенолиза, является гликогенфосфорилаза.
Болезни накопления гликогена вызваны унаследованной недостаточностью ферментов гликогенолиза, что приводит к накоплению нормального или патологически структурированного гликогена в клетках скелетных мышц и печени, основных запасах гликогена в организме.
Регламент
Повышенное содержание фосфата в клетках является сигналом голодания: все ферменты, повышающие уровень сахара в крови, активны в их фосфорилированной форме!
Гормональная регуляция
Инсулин стимулирует накопление липидов, белков и гликогена.
Гликогенсинтаза стимулируется глюкозо-6-фосфатом, инсулином и кортизолом. Он ингибируется адреналином и глюкагоном.
Аллостерическая / негормональная регуляция
- Сокращение мышц увеличивает уровень внутриклеточного кальция → ↑ кальмодулин
Эти регуляторные процессы происходят только в скелетных мышцах, но не в печени.
Клиническое значение
Ссылки
- Глюкозо-6-фосфат (по фосфоглюкомутазе ) -> Глюкозо-1-фосфат
- Глюкозо-1-фосфат + UTP (по UDP-глюкозопирофосфорилаза ) — > UDP-глюкоза + PPi
- PPi + H 2 O -> 2Pi
- UDP-глюкоза + гликоген n (по гликогенсинтазе ) -> гликоген n + 1 + UDP
- UDP + ATP -> UTP + ADP
- гликоген
- глюкоза
- инсулин
- Гликогенез
- Этимология
- Гликогенез = глюкоза + генезис
- Гликоза = старый термин для глюкозы
- Генезис = поколение / создание
Резюме - Гликогенез хранит избыток сахара в виде гликогена
- Позволяет организму накапливать топливо для подготовки к будущим энергетическим потребностям
- Гликоген является формой хранения глюкозы
- Гликоген — разветвленный полимер
- Молекулы глюкозы связаны в прямых цепях альфа-1,4-связями
- Точки ветвления от этих прямых цепей связаны альфа-1,6-связями
- Гликоген — разветвленный полимер
- Расположение
- Гликоген в основном находится в печени , и скелетные мышцы
- Печень: для поддержания в крови уровней глюкозы
- Скелетные мышцы: для выполнения физических упражнений
- Гликоген хранится в цитоплазме клеток в виде гранул
- Гликоген в основном находится в печени , и скелетные мышцы
- Этапы реакции
- глюкоза- 6-фосфат → [фосфоглюко мутаза ] глюкозо-1-фосфат
- Фосфоглюкомутаза является изомеразой (реакция изомеризации)
- исходный субстрат глюкозо-6-фосфат продуцируется на первой стадии гликолиза 9002
- 90 Глюкозо-1-фосфат + UTP → [UDP-глюкозопирофосфорилаза] UDP-глюкоза + PPi
- 1 UTP = 1 ATP (энергетически)
- Эта энергия используется для производства высокой энергии UDP-глюкоза
- PPi (пирофосфат) быстро метаболизируется с образованием двух Pi (неорганических фосфатов)
- Это d ускоряет реакцию (принцип Ле Шатлье)
- 1 UTP = 1 ATP (энергетически)
- UDP-глюкоза → [гликогенсинтаза] гликоген альфа-1,4-связи
- Гликогенсинтаза «синтезирует» альфа-1,4-связи с прямой цепью
- Гликоген синтезируется из UDP-глюкозы — глюкозы, которая была «заряжена» энергией от UTP
- Необратимый (основной этап регуляции)
- Гликоген альфа-1,4-связь → [разветвляющий фермент] гликоген альфа -1,6-связь
- Фермент разветвления катализирует образование гликогеновых ответвлений
- Разрывает связь альфа-1,4 прямой цепи
- Присоединяет фрагмент к стороне цепи с альфа-1 , 6, связь
- Фермент разветвления катализирует образование гликогеновых ответвлений
- Регламент
- Регулируется в зависимости от потребности в энергии
- Гликогенез происходит при избыточной энергии / высоком уровне глюкозы в крови
- Реакция гликогенсинтазы является первичным регуляторным этапом
- Гликогенез ускоряется (активация)
- низкая потребность в энергии
- Глюкозо-6-фосфат, инсулин
- Присутствует, когда в организме много высоких Энергетические молекулы
- Глюкозо-6-фосфат, инсулин
- низкая потребность в энергии
- Гликогенез замедляется (ингибирование)
- высокая потребность в энергии
- Адреналин, глюкагон
- присутствуют, когда организм испытывает недостаток энергии или нуждается в большем количестве
- Адреналин, глюкагон
- высокая потребность в энергии
- Регулируется в зависимости от потребности в энергии
- глюкоза- 6-фосфат → [фосфоглюко мутаза ] глюкозо-1-фосфат
определение гликогенеза по The Free Dictionary
Некоторые из них связаны с иммунным ответом, глюконеогенезом, гликогенолизом и гликогенезом.С другой стороны, задокументировано высвобождение экзосом в эхинококкоз протоэсколексом и зародышевым слоем (в этих структурах были идентифицированы ассоциированные факторы вирулентности). Как только глюкоза попадает в мышцу, она немедленно превращается в глюкозо-6-фосфат, катализируемый HK, а глюкозо-6-фосфат направляется в основные пути гликогенеза в качестве гликогена или гликолиза в качестве энергии [27,29]. Было показано, что регулируемая инсулином экспрессия генов способствует гликолизу, гликогенезу, липогенезу (жирные кислоты биосинтез) и глюконеогенез (производство глюкозы) в печени.У пациентов с AI нарушены глюконеогенез и печеночный гликогенез; следовательно, гипогликемия может быть связана с кетозом. При введении нормальным или диабетическим крысам они уменьшают гипергликемию дозозависимым образом и способствуют мышечному гликогенезу [59]. Считается, что пектин индуцирует активность протеинкиназы в головном мозге и поджелудочной железе, в то время как уменьшение его в печени; следовательно, высвобождение инсулина и гликогенез увеличиваются, в то время как гликонеогенез снижается (26). Гликогенез подавляется из-за снижения низкого отрицательного баланса азота и использования аминокислот вместе с поглощением глюкозы.Повышение уровня кортизола в сыворотке крови в зимние месяцы можно отнести к усилению катаболических процессов, таких как гликогенез, протеолиз и липолиз (Abilay et al., Предыдущие исследования показали, что экспрессия miR-152-3p значительно подавляется в печени db. / db мышей и мышей, получавших диету с высоким содержанием жиров, и ингибирование miR-152-3p вызывало нарушение гликогенеза в гепатоцитах [21]. Кроме того, обогащенная среда способствовала изменениям морфологических фенотипов астроцитов, которые казались более длинными и разветвленными [25, 26], стимулируя нейрогенез и гликогенез [66], увеличивая сеть клеток, иммуномеченных GFAP [63].Повышает экспрессию GS для гликогенеза. Активизирует GLUT1 и GLUT4 для транспорта глюкозы, GK и CS для глюкозы ACO, CPT1a и MCAD для β-окисления в скелетных мышцах. Более того, этот элемент активирует также ферменты, участвующие в гликолизе и гликогенезе, а также в метаболизме липидов [ 5].Высокий уровень глюкозы снижает гликогенез в печени путем подавления микроРНК ‑ 152
Введение
Инсулинорезистентность — это состояние ослабленной или пониженная чувствительность к инсулину, при которой нормальная экспрессия уровни инсулина не могут вызвать нормальный инсулиновый ответ в печень, жировая ткань и мышечные клетки.Инсулин играет важную роль фактор патогенеза диабета 2 типа и метаболических синдром. Метаболизм глюкозы в печени строго контролируется циркулирующий инсулин из-за его ингибирующего действия на глюконеогенез и стимулирующие эффекты на гликогенез в печень. При инсулинорезистентных состояниях синтез гликогена в печени снижается. нарушены, что приводит к увеличению выработки глюкозы (1).
Сигнализация инсулина необходима для поддержания гомеостаза глюкозы в печени. В стабильных состояниях гликогенсинтаза (GS) фосфорилируется активированной киназой гликогенсинтазы 3. (GSK-3), который вызывает угнетение синтеза гликогена.В путь фосфоинозитид-3 киназы (PI3K) / AKT активируется, когда гепатоциты реагируют на инсулин, что приводит к фосфорилированию ГСК-3 и инактивация ГСК. Это приводит к генерации синтез гликогена через активированный GS (2–4). Гипергликемия рассматривается как следствие недостаточного инсулина. секреция и инсулинорезистентность. Несколько исследований выявили что гипергликемия может привести к явному улучшению инсулина сопротивление в печени (5). Глюкотоксичность — основная причина дисфункции β-клеток, которая может приводить к к нарушению сигнального действия инсулина или инсулинорезистентности в печень, что соответствует снижению уровня гликогена в гепатоциты.
MicroRNAs (miRNAs) представляют собой класс некодирующих 18–25 нуклеотидные молекулы эндогенной РНК, которые действуют как специфический ген сайленсеры для регуляции экспрессии целевого гена в посттранскрипционный уровень путем спаривания оснований с 3 ‘нетранслируемым область целевой мРНК. Многочисленные исследования показали, что miRNA играют важную регулирующую роль в различных метаболических процессах. заболевания, включая сахарный диабет, ожирение и нарушение обмена веществ. синдром. miR-375, miR-29, miR-9 и Let-7 были ранее связаны с регулированием секреции инсулина (6).miR-375 и miR-124a дополнительно имеют было показано, что он участвует в развитии островков поджелудочной железы (7) и дифференцировке β-клеток (8). Хотя сообщалось, что miR-181 может участвовать в развитии инсулинорезистентности посредством регуляция экспрессии сиртуина 1 на уровне трансляции в гепатоцитах механизмы миРНК, участвующих в печеночной инсулинорезистентность остается неизвестной (9).
Было выявлено снижение уровня miR-152 в ускоряют рост опухолей некоторых типов (10).Сообщалось, что ДНК метилтрансфераза-1 (DNMT-1) является мишенью для miR-152 и функционирует в поддержании метилирования ДНК (8,11,12). Было показано, что в раковых клетках miR-152 непосредственно модулирует экспрессия DNMT-1, которая, в свою очередь, может модулировать экспрессию специфических онкогенов и генов-супрессоров опухолей, что приводит к усиленный рост карциномы. Мало что известно о роли miR-152 в регуляции инсулинорезистентности печени и метаболизм глюкозы. Это исследование впервые предоставило насколько нам известно, новое экспериментальное доказательство, показывающее, что высокий уровень глюкозы нарушает активацию пути AKT / GSK и синтез гликогена в гепатоцитах, по крайней мере, частично через подавление miR-152.
Материалы и методы
Клеточная культура
Клетки NCTC 1469 были получены из клеток печени мыши. (Американская коллекция типовых культур, Манассас, Вирджиния, США) и культивированные в среде Игла, модифицированной по Дульбекко, с низким содержанием глюкозы (5 ммоль / л глюкоза; Gibco-BRL, Карлсбад, Калифорния, США) с добавлением 10% лошади сыворотка (HyClone, Logan, UT, USA), 100 Ед / мл пенициллина (Gibco-BRL) и 0,1 мг / мл стрептомицина (Gibco-BRL) при 37 ° C в увлажненном атмосфера 95% O2 и 5% CO2.
Изоляция основной мыши гепатоциты
самцов мышей C57BL / 6J (возраст 12 недель) были предоставлены Научный центр здоровья Пекинского университета (первоначально приобретен у Лаборатория Джексона, Бар-Харбор, Мэн, США).Все процедуры на животных были выполнены в соответствии с Национальными институтами здравоохранения. Рекомендации по уходу за животными и их использованию. Все протоколы для животных были одобрены Комитетом по этике животных Пекинского института Гериатрия (Пекин, Китай). Первичные гепатоциты выделяли методом двухступенчатая перфузия коллагеназы [0,2 мг / мл коллагеназы IV типа (Сигма, Сент-Луис, Миссури, США) в сбалансированном солевом растворе Хэнкса], как описано ранее (13). В гепатоциты собирали центрифугированием при 430 × g в течение 8 мин.Сразу после сбора клетки суспендировали в предварительно нагретая среда William’s E (Sigma) с добавлением 10% плода бычья сыворотка, 20 нг / мл дексаметазона (Sigma), ITS (содержащий 5 инсулин мг / л, трасферрин 5 мг / л и селенат натрия 5 мкг / л; Сигма) и 10 мкг / мл гентамицина (Invitrogen Life Technologies, Carlsbad, Калифорния, США). Гепатоциты помещали в покрытые коллагеном Колбы 25 см2 при плотности 1 × 106 кл. колба.
Трансфекция миметиков miRNA и ингибитор
Приобретен миметик и ингибитор miR-152. от Genepharma (Шанхай, Китай).миметик и ингибитор миРНК контроли использовали в качестве отрицательных контролей соответственно. Идеальный Реагент для трансфекции (Qiagen, Hilden, Германия) использовали для трансфекция миметика и ингибитора miR-152. Выражение miR-152 был обнаружен с помощью количественной полимеразной цепной реакции. (КПЦР) через 48 ч после трансфекции.
Выделение РНК и количественная ПЦР
Обогащенная miRNA была выделена с использованием выделения miRNA. комплект (Takara Bio Inc., Сига, Япония). Стебель-петля реверс Транскрипционная ПЦР была проведена на образцах для обнаружения и количественно определить зрелую миРНК, используя смесь антисмысловых праймеров «стебель-петля» (Таблицы I и II) и транскриптазы AMV (Takara).В кДНК обычно тестировали с помощью кПЦР на основе метода SYBR Green I. согласно инструкции производителя (Takara). Амплификация и обнаружение конкретных продуктов были выполнены в соответствии с инструкциями производителя с использованием ABI PRISM Система 7500 (Applied Biosystems®, Invitrogen Life Технологии). Малая ядрышковая РНК U6 использовалась в качестве референсный ген малой РНК домашнего хозяйства. Относительный ген экспрессию нормализовали к малой ядрышковой РНК U6. Каждый реакция была проведена в трех экземплярах, и был проведен анализ методом 2-ΔΔCT.
Таблица I
Последовательности праймеров, используемых для обратного транскрипция.
Таблица I
Последовательности праймеров, используемых для обратного транскрипция.
Праймер для обратной транскрипции (5′-3 ‘) U6 GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACAAAATATG miR-152 GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCCAAGT Таблица II
Нуклеотид праймеров, используемых для КПЦР.
Таблица II
Нуклеотид праймеров, используемых для КПЦР.
Передний грунт (5′-3 ‘) Универсальный грунт GTGCAGGGTCCGAGGT U6 GCGCGTCGTGAAGCGTTC miR-152 TCAGTGCATGACAGA Вестерн-блоттинг
Клеточные лизаты (15–30 мкг белка) разделяли 10% SDS-PAGE, затем перенесенный на поливинилиденфторид мембрана (Millipore, Биллерика, Массачусетс, США).Затем мембраны были заблокирован 8% обезжиренным сухим молоком и исследован первичным антитела при 4 ° C в течение ночи. Блоты инкубировали с конъюгированные с пероксидазой хрена анти-IgG с последующим обнаружением с усиленной хемилюминесценцией (Millipore). Антитела против AKT, фосфорилированный AKT (Ser473), гликогенсинтаза киназа (GSK) и фосфорилированный GSK (Ser9) были приобретены у Cell Signaling Technology, Inc. (Беверли, Массачусетс, США). Антитела к β-актину были получены из Санта-Крус (Santa Cruz Биотехнология Inc., Санта-Крус, Калифорния, США).
Измерение содержания гликогена
Уровни гликогена измеряли в инкубированных клетках. с 1 нмоль / л инсулина (United States Biological, Салем, Массачусетс, США), в течение 3 часов с использованием набора для анализа гликогена (BioVision, Mountain View, CA, США).
Статистический анализ
Все значения представлены как среднее ± стандартное погрешность среднего указанного числа измерений. В одну сторону дисперсионный анализ использовался для определения статистических значимость.P <0,05 считается статистически значимым значительная разница.
Результаты
Высокий уровень глюкозы вызывает снижение синтез гликогена в гепатоцитах за счет нарушения фосфорилирования АКТ и ГСК
Гепатоциты мыши NCTC 1469 обрабатывали 25 мМ глюкозы в течение 48 часов и уровни гликогена были измерены. Как показано в Рис. 1A, высокий уровень глюкозы лечение значительно снизило уровень экспрессии гликогена в ячейках NCTC 1469. Кроме того, фосфорилирование AKT и GSK был значительно снижен в клетках NCTC 1469, обработанных 25 мМ глюкоза в течение 48 ч (рис.1Б). В для дальнейшей оценки влияния высокого уровня глюкозы на гликоген синтеза, первичные гепатоциты мыши также обрабатывали 25 мМ глюкоза за 48 ч. Результаты показали, что уровни гликогена и фосфорилирование AKT и GSK было снижено у мышей первичной гепатоцитов в ответ на лечение высоким содержанием глюкозы (рис. 1C и D), что указывает на то, что глюкоза вызвала снижение синтеза гликогена в гепатоцитов, за счет нарушения фосфорилирования AKT и GSK.
Высокий уровень глюкозы подавляет экспрессию miR-152 в гепатоцитах
Влияние высокого уровня глюкозы на экспрессию miR-152 были исследованы.Согласно анализу кПЦР, экспрессия miR-152 подавлялась в клетках NCTC 1469, обработанных 25 мМ глюкоза в течение 48 ч (рис. 2А). Высокая глюкоза дополнительно подавляла экспрессию miR-152 у мышей первичные гепатоциты (рис. 2Б). Эти данные предполагают, что miR-152 может участвовать в индуцированном глюкозой резистентность к инсулину.
ИнгибиторmiR-152 способствует снижению синтез гликогена и нарушение фосфорилирования AKT и GSK в гепатоциты
Для дальнейшего исследования эффектов miR-152 на глюкозо-индуцированное снижение синтеза гликогена, miR-152 ингибитор трансфицировали в клетки NCTC 1469.Как показано в Рис. 3A, уровни miR-152 были снизилась до ~ 10% в клетках NCTC 1469, трансфицированных ингибитор miR-152 по сравнению с ингибиторами, трансфицированными скремблированная миРНК. Кроме того, подавление miR-152 ингибировало фосфорилирование AKT и GSK в клетках NCTC 1469, обработанных или без глюкозы (рис. 3B). Кроме того, трансфекция ингибитора miR-152 уменьшала производство гликогена в клетках NCTC 1469, обработанных с или без глюкоза (рис. 3С).
Повышенная регуляция miR-152 меняет вызванное глюкозой снижение синтеза гликогена и AKT и GSK фосфорилирование в гепатоцитах
миметик miR-152 был трансфицирован в NCTC 1469 клеток в течение 48 ч, а затем анализировали с помощью КПЦР.qPCR показал, что уровни miR-152 были увеличены примерно в 200 раз в NCTC 1469 клетки, трансфицированные миметиком miR-152, по сравнению с таковыми трансфицированы скремблированной miRNA (фиг. 4A). Кроме того, трансфекция миметик miR-152 увеличивал уровни фосфорилирования AKT и GSK, и избавил от воздействия высокого уровня глюкозы на активацию путь AKT / GSK (рис. 4B). Наконец, было установлено, что активация miR-152 может обратить вспять вызванное глюкозой снижение синтеза гликогена в гепатоциты (рис.4С).
Обсуждение
Все больше данных указывает на то, что miRNA является участвует в патогенезе диабета 2 типа и инсулина сопротивление (14). В настоящее время исследования, было выявлено, что активация AKT и GSK, и уровни гликогена были ингибированы в клетках NCTC 1469 и мыши первичные гепатоциты после воздействия 25 мМ глюкозы в течение 48 часов. Кроме того, насколько нам известно, это исследование продемонстрировало впервые этот высокий уровень глюкозы подавил экспрессия miR-152 в гепатоцитах.Для дальнейшей оценки влияние miR-152 на вызванное глюкозой снижение гликогена синтез и активация AKT и GSK, миметика miR-152 и ингибитором трансфицировали клетки NCTC 1469 соответственно. Результаты показали, что miR-152 может регулировать активацию AKT и GSK, и впоследствии модулируют синтез гликогена в Клетки NCTC 1469, обработанные 25 мМ глюкозы в течение 48 часов.
Инсулинорезистентность — это сниженная способность к инсулин для стимуляции усвоения глюкозы и синтеза гликогена в периферические ткани, включая скелетные мышцы, жировую ткань и печень.Это критический фактор в патогенезе 2 типа. сахарный диабет. Печень играет центральную роль в выработке глюкозы и липидов. метаболизм и печеночная инсулинорезистентность является отличительной чертой сахарный диабет 2 типа. Ранее сообщалось, что высокий оксидативный стресс, вызванный глюкозой, важен для развития и прогрессирование печеночной инсулинорезистентности. Кроме того, высокий было показано, что глюкоза активирует протеинкиназу C и c-Jun. N-концевые киназные пути, которые действуют на фосфорилирование Ser307 субстрата 1 рецептора инсулина и блокируют последующую активацию пути AKT в печени (11,12,15).В печени путь PI3K / AKT функционирует в инсулине. сигнальный каскад, при котором активированный AKT опосредует фосфорилирование и инактивация GSK, что впоследствии приводит к в активации GS и усилении синтеза гликогена. В возникающая гипергликемия является важным фактором патогенеза инсулинорезистентности. Следовательно, печеночная недостаточность, вызванная высоким содержанием глюкозы. В настоящем исследовании использовалась модель клеток инсулинорезистентности. Под условия высокого уровня глюкозы, инсулин не может активировать свои сигналы путь, приводящий к инсулинорезистентному состоянию.Печеночный инсулин резистентность может быть определена путем измерения инсулино-опосредованного фосфорилирование AKT и GSK и уровни экспрессии гликогена. Настоящее исследование показало, что уровни фосфорилирования AKT и GSK были снижены с последующим нарушением синтеза гликогена, в клетках NCTC 1469 и первичных гепатоцитах мышей, после воздействие 25 мМ глюкозы в течение 48 часов. Эти результаты показывают, что высокий уровень глюкозы вызывал снижение синтеза гликогена в гепатоциты за счет нарушения фосфорилирования AKT и GSK.
Для исследования механизмов, лежащих в основе высокого глюкозо-индуцированное снижение синтеза гликогена и нарушение фосфорилирование AKT и GSK в гепатоцитах, эффекты высоких уровни глюкозы на экспрессию miR-152 были исследованы. В результаты показали, что экспрессия miR-152 была подавляется в клетках NCTC 1469, обработанных 25 мМ глюкозы в течение 48 час Точно так же высокие уровни глюкозы подавляли экспрессию miR-152 в первичных гепатоцитах мышей. Эти данные указывают на то, что miR-152 участвует в индуцированной глюкозой инсулинорезистентности.
Ранее считалось, что miR-152 является участвует в различных карциномах. В желудке и толстой кишке человека рака уровни экспрессии miR-152 были значительно ниже, поскольку по сравнению с подобранными неопухолевыми прилегающими тканями (16). При холангиокарциноме интерлейкин-6 было показано, что он регулирует экспрессию miR-152, таким образом связывая ассоциированные с воспалением цитокины с онкогенезом в холангиокарцинома (17). Цурута и др. (18) сообщили, что Экспрессия miR-152 была снижена при раке эндометрия человека, в то время как восстановление экспрессии miR-152 в клетке рака эндометрия линий было достаточно для подавления роста опухолевых клеток in vitro и in vivo.Кроме того, было установлено, что ДНМТ-1, Гены E2F3, MET и Rictor были кандидатами-мишенями для miR-152, и данные также предполагали, что эпигенетическое молчание может управлять канцерогенез эндометрия (18). DNMT-1 — самая распространенная метилтрансфераза в клетках млекопитающих, и функции в поддержании метилирования ДНК. Гиперметилирование на промоторных CpG-островках и инактивация множественные гены-супрессоры опухоли распространены при карциномах, и способствуют росту опухоли. DNMT-1 играет важную роль в создании и регуляция тканеспецифических паттернов метилированного цитозина остатки (19,20).В раковых клетках снижена экспрессия miR-152 непосредственно модулировал экспрессию DNMT-1 (21). Изменение метилирования ДНК модулирует экспрессию специфических онкогенов и опухолевых супрессоров гены, приводящие к росту карциномы (22,23). Однако участие miR-152 в метаболизме гликогена осталось. неясно. Чтобы прояснить это, ингибитор miR-152 и миметик были трансфицированы в клетки NCTC 1469 соответственно. Трансфекция Ингибитор miR-152 снижал выработку гликогена, что сопровождалось нарушением фосфорилирования AKT и GSK в клетках NCTC 1469 обработанные с глюкозой или без нее.Напротив, усиление регуляции miR-152 посредством трансфекции миметика miR-152 может обратить вспять вызванное глюкозой снижение синтеза гликогена и снижение AKT и Фосфорилирование GSK в гепатоцитах. Эти данные указывают на то, что высокий уровень глюкозы снижает гликогенез в печени, подавляя miRNA-152, которая модулирует путь AKT / GSK и, в свою очередь, приводит к при инсулинорезистентности, таким образом, miR-152 и путь AKT-GSK могут действуют как новые терапевтические мишени в печеночном гликогенезе.
Благодарности
Это исследование было поддержано финансированием Национальная программа фундаментальных исследований Китая (грант №2012CB517502) и Национальный фонд естественных наук Китая (гранты № 81270887 и 81070634).
Ссылки
1
Мешкани Р. и Адели К.: печеночный инсулин. резистентность, метаболический синдром и сердечно-сосудистые заболевания. Clin Biochem. 42: 1331–1346. 2009. Просмотр статьи: Google Scholar: PubMed / NCBI
2
Shearn CT, Fritz KS, Reigan P и Petersen DR: Модификация Akt2 4-гидроксиноненалом ингибирует инсулинозависимая передача сигналов Akt в клетках HepG2.Биохимия. 50: 3984–3996. 2011. Просмотр статьи: Google Scholar: PubMed / NCBI
3
Хенриксен Э.Дж. и Доккен ББ: роль киназа-3 гликогенсинтазы при инсулинорезистентности и типе 2 сахарный диабет. Curr Drug Targets. 7: 1435–1441. 2006. Просмотр статьи: Google Scholar: PubMed / NCBI
4
Шиннер С., Шербаум В.А., Борнштейн С.Р. и Бартель А: Молекулярные механизмы инсулинорезистентности.Diabet Med. 22: 674–682. 2005. Просмотр статьи: Google Scholar: PubMed / NCBI
5
Навано М., Оку А., Уэта К. и др.: Гипергликемия способствует инсулинорезистентности печени и жировой ткани. ткань, но не скелетные мышцы крыс ZDF. Am J Physiol Endocrinol Метаб. 278: E535 – E543. 2000.PubMed / NCBI
6
Рамачандран Д., Рой У., Гарг С. и др.: Экспрессия sirt1 и mir-9 регулируется во время стимуляции глюкозой. секреция инсулина β-островками поджелудочной железы.FEBS J. 278: 1167–1174. 2011.PubMed / NCBI
7
Жоглекар М.В., Парех В.С., Хардикар А.А.: Островковые микроРНК в развитии, регенерации и регенерации поджелудочной железы. сахарный диабет. Индийский J Exp Biol. 49: 401–408. 2011.PubMed / NCBI
8
Пой М.Н., Хауссер Дж., Трайковски М. и др.: miR-375 поддерживает нормальную массу альфа- и бета-клеток поджелудочной железы. Proc Natl Acad Sci USA. 106: 5813–5818.2009. Просмотр статьи: Google Scholar: PubMed / NCBI
9
Корнфельд Дж. У., Байтцель С., Коннер А. С. и др.: Избыточная экспрессия miR-802, вызванная ожирением, снижает уровень глюкозы метаболизм через подавление Hnf1b. Природа. 494: 111–115. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI
10
Chen Y, Song Y, Wang Z и др.: Изменено экспрессия MiR-148a и MiR-152 при раке желудочно-кишечного тракта и его клиническое значение.J Gastrointest Surg. 14: 1170–1179. 2010 г. Просмотр статьи: Google Scholar: PubMed / NCBI
11
Чжан В.Й., Ли Дж.Дж., Ким И и другие: Снижение инсулинорезистентности скополетином у инсулинорезистентные клетки HepG2 с высоким содержанием глюкозы. Horm Metab Res. 42: 930–935. 2010. Просмотр статьи: Google Scholar: PubMed / NCBI
12
Накатани Й., Кането Х., Кавамори Д. и др.: Модуляция пути JNK в печени влияет на инсулинорезистентность статус.J Biol Chem. 279: 45803–45809. 2004. Просмотр статьи: Google Scholar: PubMed / NCBI
13
Рэми Дж., Дешемин Дж. К. и Ваулон С. Перекрестное взаимодействие между митоген-активированной протеинкиназой и костью морфогенетический белок / гемодувелин необходим для индукция гепсидина голотрансферрином у первичных мышей гепатоциты. Haematologica. 94: 765–772. 2009. Просмотр статьи: Google Scholar
14
Мао И, Мохан Р., Чжан С. и Тан Х: МикроРНК как фармакологические мишени при диабете.Pharmacol Res. 75: 37–47. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI
15
Накадзима К., Ямаути К., Шигемацу С. и др. al: Избирательное ослабление метаболической ветви рецептора инсулина. подавление сигналов за счет высокого уровня глюкозы в клеточной линии гепатомы, HepG2 клетки. J Biol Chem. 275: 20880–20886. 2000. Просмотр статьи: Google Scholar: PubMed / NCBI
16
Chen Y, Song Y, Wang Z и др.: Изменено экспрессия MiR-148a и MiR-152 при раке желудочно-кишечного тракта и его клиническое значение.J Gastrointest Surg. 14: 1170–1179. 2010 г. Просмотр статьи: Google Scholar: PubMed / NCBI
17
Бракони Ч., Хуанг Н. и Патель Т: МикроРНК-зависимая регуляция ДНК-метилтрансферазы-1 и опухоли экспрессия гена супрессора интерлейкином-6 при злокачественных опухолях человека. холангиоциты. Гепатология. 51: 881–890. 2010.PubMed / NCBI
18
Цурута Т., Козаки К., Уэсуги А. и др.: MiR-152 — это микроРНК-супрессор опухолей, которая подавляется ДНК. гиперметилирование при раке эндометрия.Cancer Res. 71: 6450–6462. 2011. Просмотр статьи: Google Scholar: PubMed / NCBI
19
Хино Р., Уозаки Х., Мураками Н. и др.: Активация ДНК-метилтрансферазы 1 латентной мембраной ВЭБ белок 2A приводит к гиперметилированию промотора гена PTEN в рак желудка. Cancer Res. 69: 2766–2774. 2009. Просмотр статьи: Google Scholar: PubMed / NCBI
20
Кан М.Ю., Ли ББ, Ким Й.Х. и др.: Ассоциация гистон-метилтрансферазы SUV39h2 с ДНК метилтрансфераза 1 на уровне экспрессии мРНК в первичной колоректальной рак.Int J Cancer. 121: 2192–2197. 2007. Просмотр статьи: Google Scholar: PubMed / NCBI
21
Джи В., Ян Л., Юань Дж и др.: MicroRNA-152. нацелена на ДНК-метилтрансферазу 1 в клетках, трансформированных NiS, через механизм обратной связи. Канцерогенез. 34: 446–453. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI
22
Хуан Дж, Ван И, Го И и Сунь С. Подавленная микроРНК-152 индуцирует аберрантное метилирование ДНК в гепатоцеллюлярная карцинома, связанная с вирусом гепатита B, путем нацеливания на ДНК метилтрансфераза 1.Гепатология. 52: 60–70. 2010. Просмотр статьи: Google Scholar: PubMed / NCBI
23
Бракони Ч., Хуанг Н. и Патель Т: МикроРНК-зависимая регуляция ДНК-метилтрансферазы-1 и опухоли экспрессия гена супрессора интерлейкином-6 при злокачественных опухолях человека. холангиоциты. Гепатология. 51: 881–890. 2010.PubMed / NCBI
Синонимы гликогенеза, антонимы гликогенеза — FreeThesaurus.com
В то же время повышенное производство лактата в первую очередь отражает анаэробный гликогенез, минуя цитратный цикл и дыхательную цепь.Кофеиновая кислота и коричная кислота улучшают метаболизм глюкозы за счет модуляции гликогенеза и глюконеогенеза в инсулинорезистентных гепатоцитах мышей. Источниками из пула 2 являются [F.sub.12], окисление глюкозы, [F.sub.02], гликогенез и другой метаболизм, [F.sub.R2]. Фруктоза является более липогенной, чем глюкоза, и ее потребление обычно приводит к немедленному повышению уровня триглицеридов в плазме, несмотря на то, что она обеспечивает субстрат для глюконеогенеза и гликогенеза. Потребление фруктозы способствует синтезу триглицеридов, особенно когда присутствует глюкоза.sylvatica, осеннему секвестрации мочевины способствует приток азота, полученный в результате катаболизма мышц, процесса, который также способствует гликогенезу в печени и мышцах [10]. Антигипергликемический и гликогенезный эффекты капусты (Brassica oleracea L. увеличение глутатиона у животных, подвергшихся воздействию 25 мкг BPA, предполагает возможную модуляцию этого пути детоксикации, а также гиперпродукцию пирувата, ключевого метаболита, участвующего в цикле Кребса, гликолизе и гликогенезе.Эти изменения могут повлиять на пути энергетического метаболизма. Были обнаружены множественные внутримиоклеточные дефекты действия инсулина, включая нарушение транспорта глюкозы, фосфорилирования глюкозы, гликогенеза и окисления глюкозы.1 В этом выпуске исследователи сосредоточили свое внимание на областях распространенности ожирения, сахарного диабета и т. Д. вероятный гликогенез печени, сопровождающий плохо контролируемый диабет 1 типа, гипогликемию, метастатическую инсулиному, полиморфизм гена перилипина, диабет, связанный с муковисцидозом, тиреотоксический гипокалиемический периодический паралич, первичный гиперпаратиреоз.* в печени стимулирует накопление глюкозы (гликогенез) и подавляет гликогеноз и глюконеогенез. Использование топлива во время гликогенеза в белых мышцах радужной форели (Oncorhynchus mykiss Walbaum), изученных in vitro, J. Инсулинорезистентность вызывает гликогенез и повышенное поглощение глюкозы мышечными клетками. Все хорошо, что хорошо кончается. Однажды внутри гепатоцита ферменты гликогенеза хотели показать свою мощь; Они заключили в тюрьму все молекулы глюкозы, которые попадались на их пути, Они запутали их в цепях; внутри камеры они должны были остаться.В основном это достигается путем преобразования глюкозы в длинноцепочечный гликоген (гликогенез) и хранения его в печени. - Гликогенез = глюкоза + генезис
- Этимология
Определение и примеры гликогенеза — онлайн-словарь по биологии
Определение
существительное
Метаболический процесс производства гликогена из глюкозы для хранения в основном в клетках печени и мышц в ответ на высокий уровень глюкозы в крови. кровоток
Дополнение
У людей и многих других животных гликогенез — это процесс, при котором вырабатывается гликоген, который откладывается в основном в клетках печени и мышц.Короткие полимеры глюкозы превращаются в длинные полимеры. Организм не использует экзогенную глюкозу напрямую, то есть из углеводсодержащей пищи. Вместо этого организм накапливает глюкозу в гликоген внутри клеток в процессе гликогенеза. А когда организму требуется метаболическая энергия, гликоген расщепляется на субъединицы глюкозы в процессе гликогенолиза. Таким образом, гликогенез — это процесс, противоположный гликогенолизу.
Гликогенез начинается в глюкозе, которая фосфорилируется в глюкозо-6-фосфат с помощью ферментов гексокиназы в мышцах и глюкокиназы в печени.Следующие шаги процесса следующие:
Когда цепь удлиняется минимум до 11 остатков, фермент разветвления амило-1,4-1,6-трансглюкозидаза переносит часть цепи в соседнюю цепь, таким образом, устанавливает точка разветвления в молекуле. 1
Сравните:
См. Также:
Ссылка (и):
1 Naik, P. (2015). Биохимия. JP Medical Ltd. стр.182-183.
Последнее обновление: 27 января 2020 г.
Мнемоника гликогенеза для MCAT
Резюме
Гликоген — это форма хранения глюкозы в организме, а гликогенез — это генезис гликогена.Гликоген синтезируется, когда в организме есть избыток глюкозы, что позволяет сохранить глюкозу на потом.
Гликоген хранится в виде гранул в цитоплазме клеток. Это разветвленный полимер, состоящий из прямых цепей и разветвлений. Прямые цепи образованы гликогенсинтазой, которая связывает молекулы глюкозы вместе через альфа-1,4 связи. Точки ветвления образованы ферментами разветвления гликогена, которые связывают молекулы глюкозы через связи альф-1,6.
Есть два основных места, где хранится гликоген: 1) в печени, где хранится гликоген для поддержания уровня глюкозы в крови во время голодания, и (2) в мышцах, где запасенный гликоген используется для удовлетворения энергетических потребностей при упражнениях.
Ключевые моменты

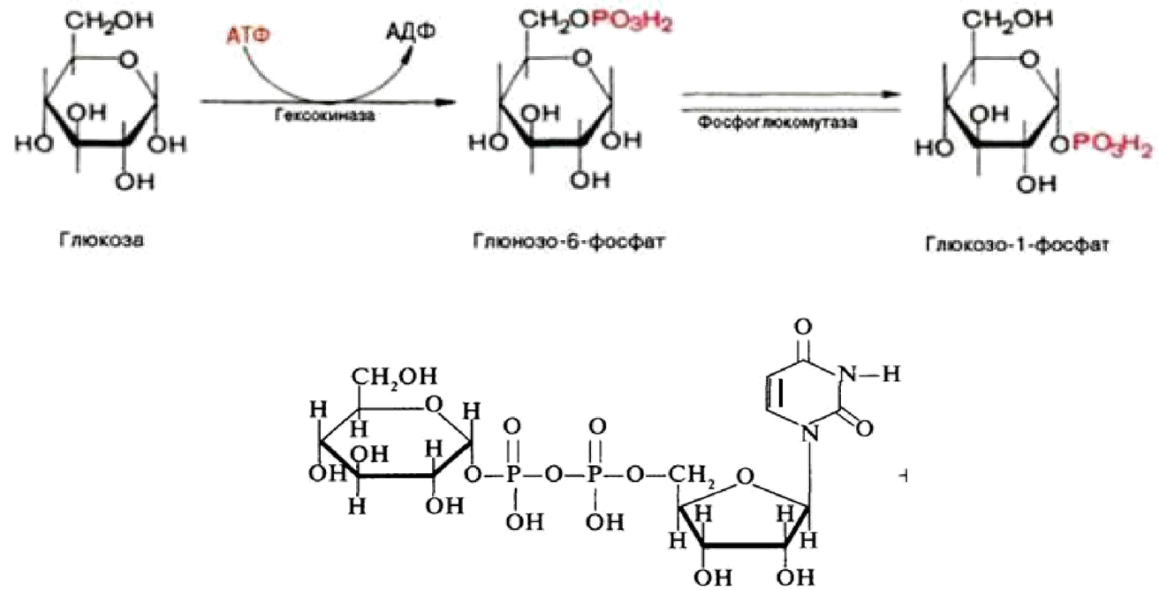 Гликогенин , гомодимер, имеет остаток тирозина на каждой субъединице, который служит якорем для восстанавливающего конца гликогена. Первоначально около семи молекул UDP-глюкозы добавляются гликогенином к каждому остатку тирозина, образуя α (1 → 4) связи.
Гликогенин , гомодимер, имеет остаток тирозина на каждой субъединице, который служит якорем для восстанавливающего конца гликогена. Первоначально около семи молекул UDP-глюкозы добавляются гликогенином к каждому остатку тирозина, образуя α (1 → 4) связи.