Функции белка в организме
☰
Белки в живых организмах выполняют множество важных функций. Поэтому в организмах существует множество различных белков.
Ферментативная функция белков заключается в том, что они служат катализаторами различных химических реакций, протекающих в организме. Ферментативную функцию по-другому называют каталитической. При катализе происходит ускорение химических реакций, причем это ускорение может быть даже в миллионы раз.
Белков-ферментов тысячи, каждый из них обслуживает свою химическую реакции или группу схожих реакций. По типу обслуживаемых реакций ферменты делят на классы. Например, оксидоредуктазы катализируют окислительно-восстановительные реакции, гидролазы обеспечивают гидролиз химических связей и т. д. Реакцию катализирует не вся молекула фермента, а только ее так называемый активный центр. Он включает часть молекулы, которая связывает субстрат (молекулу, которая подвергается превращению), и несколько аминокислот (часто не вместе расположенных), которые обеспечивают саму реакцию.
Белки выполняют структурную функцию. Они входят в состав клеточных мембран и органоидов, межклеточного вещества (белки коллаген и эластин), волос, ногтей и т. п. (кератин).
Двигательная функция белков заключается в сокращении мышц (актин и миозин), обеспечении движения клеток, их ресничек и жгутиков.
Существуют белки, которые обеспечивают перенос различных веществ как внутри клетки, так и по всему организму. Такие белки обеспечивают транспортную функцию. Они легко связываются с субстратом, когда его концентрация высока, и легко высвобождают его при низкой концентрации. К транспортным белкам относится гемоглобин. В легких он связывает кислород и высвобождает углекислый газ, а в тканях наоборот.
Ряд белков, входящих в состав мембран клеток, обеспечивают транспорт малых молекул через мембрану. Такой транспорт может быть как пассивным (белки-каналы), так и активным (белки-переносчики).
Такой транспорт может быть как пассивным (белки-каналы), так и активным (белки-переносчики).
Регуляторная и сигнальная функции белков разнообразны. Многие внутриклеточные процессы (клеточный цикл, транскрипция и трансляция, активация или подавление активности других белков и т. д.) регулируются белками.
Клетки взаимодействуют между собой посредством сигнальных белков, которые передаются через межклеточное вещество. Например, такие сигналы могут стимулировать или подавлять рост клеток. Таким образом обеспечивается согласованность работы клеток той или иной системы органов.
Выделяют рецепторную функцию белков. Белки-рецепторы могут находиться как в цитоплазме, так и в мембранах. Когда на рецептор действует химическое вещество или физический стимул (свет, давление и др), то он изменяется. Это изменение молекулы передается в другие части клетки, посредством катализа определенной реакции, прохождения ионов или связывания молекул-посредников.
Защитная функция белков также весьма разнообразна. Коллаген и кератин обеспечивают не только структурную функцию, но и физическую защиту организма. Также физически организм защищают фибриногены и тромбины, свертывающие кровь в местах ранения (контакта с воздухом).
Белки обеспечивают химическую защиту, связывая и расщепляя чужеродные токсины или вырабатывая свои (для защиты от других организмов).
Если в организме возникает дефицит углеводов и жиров, то белки, распадаясь до конечных продуктов, могут выполнять энергетическую функцию.
Белки могут запасаться как источник энергии и источник аминокислот (например, в яйцеклетках). Это запасающая функция белков.
Функции белков | Кинезиолог
Лекция 4. Функции белков
Определение:
Белок — это отдельный полипептид или агрегат нескольких полипептидов, выполняющий биологическую функцию.
Полипетид — понятие химическое. Белок — понятие биологическое.
Например, иммуноглобулин состоит из четырех полипептидных цепей, которые по отдельности не являются белками, белок — только их функциональный агрегат.
Функции белков
1. Структурная функция.
Белки входят в состав всех клеточных органелл: мембранных — плазмалемма, ядерная оболочка, эндоплазматическая или ретику-лярная сеть (ЭР), комплекс Гольджи, лизосомы, пероксисомы, вакуоль, митохондрии, пластиды — и немембранных — хромосомы, рибосомы, клеточный центр (центриоли), реснички и жгутики, микрофиламенты.2. Каталитическая функция.
Все ферменты — белки. Эта функция в 1982 году перестала считаться уникальной. Выяснилось, что некоторые РНК тоже обладают каталитической активностью. Их называют РНКзимами.
3. Защитная функция (пока уникальна).Антитела — это белки особого класса (иммуноглобулины).
Иммуноглобулины «склеивают» антигены и образуется преципитат
4. Регуляторная функция.
На клеточном уровне: белки — репрессоры и белки – активаторы транскрипции.
На организменном уровне: некоторые гормоны — белки.
Например, инсулин — гормон поджелудочной железы. Регулирует переход глюкозы через плазмалемму. При недостаточной секреции инсулина развивается тяжелое заболевание — сахарный диабет.
Соматотропин — гормон роста. Образуется в передней доле гипофиза.
Там же образуется и адренокортикотропный гормон (АКТГ). Он действует на кору надпочечников, регулируя синтез стероидных гормонов.
5. Трансформация энергии.
Белки сетчатки глаза родопсин и ретинен трансформируют световую энергию в электрическую. Актино-миозиновые комплексы в мышцах преобразуют энергию химических связей в механическую.
6. Транспортная функция.
Гемоглобин осуществляет транспорт О2, СО2.
Трансферрин — транспорт железа.
Системы пермеаз — это мембранные белки, которые переносят полярные соединения через мембрану как по, так и против градиента концентрации.
7. Энергетическая функция.
11 из 20 аминокислот, входящих в состав белков, в организме человека «сгорают» с выделением энергии. Это — заменимые аминокислоты. Они могут быть синтезированы в клетке из продуктов расщепления углеводов и липидов.
8. Питательная функция.
а) Поставка незаменимых аминокислот. У человека 9 из 20 аминокислот не
могут быть синтезированы в организме. Они должны поступать извне.
Понятие «заменимые и незаменимые аминокислоты» видоспецифическое и касается только животных и грибов.
б) Запасные белки для развития зародыша и вскармливания младенца.
Например, казеин — белок молока, овальбумин — яичный белок, глиадин —
белок зерен пшеницы.
9. Буферная функция.
Любой белок — амфотерный полиэлектролит. Белки способствуют поддержанию определенных значений рН в разных отсеках клетки, обеспечивая этим компартментализацию.
Источники: Дымшиц Г.М. Молекулярная биология: http://www.medliter.ru/?page=get&id=012131
Видеолекция: Общие свойства прионов. Лектор: Виталий Кушниров, д.б.н., ведущий научный сотрудник лаборатории молекулярной генетики, Институт биохимии имени А.Н. Баха РАН, Федеральный исследовательский центр «Фундаментальные основы биотехнологии» РАН, 27.08.2015
Видеоурок по биологии «Белки»
Белки — это строительные материалы и живые нано-машины нашего тела.
Каждый из сотен тысяч разных белков обладает неповторимой пространственной структурой. И у каждого белка своя задача и функция. Есть белки костной и мышечной ткани, белки тканей кожи и мозга. Белки ферменты и рецепторы.
Если в организме отсутствует хотя бы один белок (например, белковый гормон инсулин), жизнь человека в опасности, так как инсулин оказывает многогранное влияние на обмен практически во всех тканях. Основное действие инсулина заключается в снижении концентрации глюкозы в крови.
Белки — это самые сложные молекулярные системы, имеющиеся в природе.
Кроме углерода, кислорода, водорода и азота в состав белков могут входить сера, фосфор, железо.
Белки построены из мономеров, которыми являются аминокислоты.
Среди двухсот известных аминокислот только 20 из них участвуют во внутриклеточном синтезе белков. Их называют протеиногенными или стандартными аминокислотами. Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих.
Из 20 аминокислот, входящих в состав белков, может быть образовано вот такое число комбинаций различных белков, которые будут обладать совершенно одинаковым составом, но различным строением.
Все аминокислоты подразделяют на заменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека, к ним относят: аланин, аргинин, аспарагин, аспарагиновую кислоту, глицин, глутамин, глутаминовую кислоту, пролин, серин, тирозин и цистеин.
Незаменимые аминокислоты в организме не синтезируются и должны в обязательном порядке поступать с пищей. Это валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Содержатся они в основном в продуктах животного происхождения.
Для удобства названия аминокислот имеют общепринятые сокращения.
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (─ ) с основными свойствами, другая —карбоксильной группой (─COOH) с кислотными свойствами. Часть молекулы, которая называется радикалом (в формулах она обычно обозначается большой латинской буквой R), у разных аминокислот имеет различное строение.
Аминокислоты соединяются между собой. Так образуется молекула, которая представляет собой пептид. Эта реакция называется (полимеризацией). В процессе полимеризации выделяется молекула воды, а освободившиеся электроны образуют ковалентную связь, которая получила название пептидной. Это связь между атомами углерода и азота.
Поскольку на одном конце дипептида находится свободная аминогруппа, а на другом — свободная карбоксильная группа, дипептид может присоединять к себе другие аминокислоты.
Также белки могут состоять и из большого числа аминокислотных остатков. И, кроме того, каждая аминокислота может встречаться в белке несколько раз.
В состав белка может входить одна, две и более полипептидные цепи. Например, в молекуле инсулина — две цепи, а иммуноглобулины состоят из четырёх цепей.
Среди белков различают протеины, состоящие только из белков, и протеиды, содержащие не белковую часть. Например, гемоглобин.
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве небелкового компонента здесь выступает особая пигментная группа, содержащая железо, — гем.
Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1и β2.
Четвертичная структура гемоглобина придаёт ему способность регулировать присоединение и отщепление кислорода.
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии. В эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина.
В эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина.
Эритроцит при этом приобретает форму серпа. Из-за этого малярийный плазмодий не проникает в эритроцит и не питается белком-гемоглобином. Изменение в форме эритроцита приводит к заболеванию ─ серповидноклеточной анемии.
Если белки состоят только из аминокислот, то их называют простыми.
Если в состав белков входят компоненты неаминокислотной природы, то такие белки относят к сложным.
Если в состав сложных белков входят углеводы, то их называют «гликопротеиды». Если входят липиды — то «липопротеиды», а если нуклеиновые кислоты — «нуклеопротеиды».
Именно строение белковых молекул определяет многообразие функций белков и их особую роль в жизненных процессах. Поэтому исследование структуры белков ─ самая важная стадия познания явлений, происходящих в живой клетке.
Белок можно выявить при помощи его денатурации. Денатурация — это утрата белковой молекулой своей первоначальной структуры.
Денатурация может возникать под воздействием нагревания (температуры), химических веществ (например, кислот, оснований, органических растворителей), обезвоживания, облучения и других факторов, в результате которых свойство белковых молекул резко изменяется.
Зажигаем спиртовку, наливаем в демонстрационную пробирку каллоидный раствор белка в дистиллированной воде. Закрепляем пробирку в держалке и осторожно нагреваем содержимое пробирки. Уже при небольшом нагревании хорошо видны изменения, происходящие в растворе. Он перестаёт быть прозрачным, появляется белый осадок. Это и есть свернувшийся белок. Температура (нагревание) вызывает свёртывание коллоидного раствора белка.
Следующий опыт
В пробирку с коллоидным раствором белка в дистиллированной воде добавляем разбавленный раствор азотной кислоты. Признак реакции — образование осадка. Белок денатурирован.
Третий опыт
Денатурация белка происходит и под действием растворов солей тяжёлых металлов. К раствору белка добавляем раствор сульфата меди. Признаком реакции является образование белого непрозрачного осадка. Это и есть денатурированный белок.
К раствору белка добавляем раствор сульфата меди. Признаком реакции является образование белого непрозрачного осадка. Это и есть денатурированный белок.
Обнаружив белок, мы ничего не можем сказать о его составе, структуре, свойствах. Что бы ответить на все эти вопросы, необходимо, прежде всего, выделить белок — получить его в чистом виде. Существует множество методов получения белков в чистом виде.
Процесс, обратный денатурации, при котором белки возвращают свою природную структуру, называется ренатурацией.
Уровни организации белковой молекулы
Молекулы белков могут принимать различные пространственные формы —конформации, которые представляют собой четыре уровня их организации.
Последовательное чередование различных аминокислотных звеньев в полипептидной цепи называется — первичной структурой белковой молекулы. Она уникальна для любого белка и определяет его форму, свойства и функции.
Молекула белка обладает определённой пространственной формой — это вторичная структура. Такая структура поддерживается водородными связями. Водородные связи возникают межу амино- и карбоксильными группами амикислотных остатков полипептидной цепи.
Водородные связи фиксируют различные пространственные структуры. Хотя они и малопрочные, но из-за того, что их большое количество, — вторичная структура белка достаточно прочна. Части белковой молекулы могут организовываться в спираль или в другие виды вторичной структуры.
Третичная структура белка имеет вид клубка (глобулы). Третичная структура — это трёхмерная организация белковой молекулы. Она поддерживается водородными и дисульфидными (-S-S-) связями между остатками цисцеина (аминокислоты), а также гидрофобными взаимодействиями.
Существует и четвертичная структура белка. Однако она характерна не для всех молекул белка. Четвертичная структура возникает в результате соединения нескольких глобул в сложный комплекс. Например, гемоглобин крови состоит из четырёх таких субъединиц.
Например, гемоглобин крови состоит из четырёх таких субъединиц.
Как вы уже поняли, белки многочисленны и многообразны. И у каждого белка своя задача и функция.
Структурная функция белков
Так как белки являются основой всех биологических мембран, они выполняют строительную функцию.
Белок коллаген — важный составной компонент соединительных тканей.
Эластин — эластичный компонент связок, стенок кровеносных сосудов.
Кератин — фибриллярный белок, обладающий механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и роговой чехол, который покрывает клюв птиц.
Ферментативная функция белков
Ферменты — вещества белковой природы. Их молекулы состоят в основном из аминокислотных звеньев. Ферменты специфичны для каждого вещества. Основная функция их — это ускорение биохимических реакций организма, реакций распада и синтеза.
Они действуют в строго определённой последовательности. Почему так? Дело в том, что избирательность действия ферментов на разные химические вещества связана с их строением. Ферменты имеют специфические активные участки (центры), с которыми связываются субстраты.
Форма и химическое строение активного центра таково, что с ним могут связаться только определённые молекулы в силу их пространственного соответствия, они подходят друг к другу, как ключ к замку.
Связывание субстрата осуществляется именно в активном центре фермента. Одни ферментные системы направляют процессы биосинтеза. Этот процесс требует затрат энергии.
Другие ферментные системы регулируют распад и окисление веществ. При этих реакциях энергия выделяется.
На заключительном этапе химической реакции комплекс распадается с образованием конечных продуктов и свободного фермента.
Освободившийся при этом активный центр фермента может снова принимать новые молекулы вещества — субстрата.
Многие ферменты, как мы уже сказали, представлены белковыми молекулами. Другие состоят не только из белка, но и из небелкового соединения (кофермента). В качестве кофермента могут выступать различные вещества, но, как правило, это витамины и ионы металлов.
Отсутствие витамина в пище сначала приводит к недостаточному образованию кофермента, а без него не может работать (активироваться) соответствующий фермент. Поэтому скорость биохимической реакции, за которую отвечает этот фермент, значительно падает. Итогом этого становится нарушение обмена веществ.
Транспортная функция белков имеет важное значение. Так, гемоглобин переносит кислород из лёгких к клеткам других тканей.
В мышцах эту функцию выполняет белок миоглобин. Сывороточный альбумин крови способствует переносу липидов и жирных кислот, различных биологически активных веществ.
Белки-переносчики осуществляют перенос веществ через клеточные мембраны.
Специфические белки выполняют защитную функцию. Они предохраняют организм от вторжения чужеродных организмов и от повреждения.
Например, на проникновение в организм чужеродных белков реагирует иммунная система организма. Она бросает против них целую армию своих белков, так называемых антител. Антитела являются особым классом гликопротеинов, имеющихся на поверхности B-лимфоцитов в виде мембраносвязанных рецепторов.
При помощи антиген-связывающих участков антитела присоединяются к вирусам и бактериям, чужеродным белкам, препятствуя их размножению.
Ещё один важный белок нашего организма — интерферон — универсальный противовирусный белок.
Фибриноген и тромбин предохраняют организм от кровопотери, образуя тромб.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами.
Регуляторная функция белков присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является упомянутый выше инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии.
Но в качестве источника энергии белки используются в последнюю очередь, после углеводов и жиров. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Таким образом, роль белков огромна. Современная биология показала, что сходство и различие организмов определяются в конечном счёте набором белков. Чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
Белки — ФГБУ «НМИЦ ТПМ» Минздрава России
Белки представляют основу структурных элементов клеток и тканей. Функции их разнообразны, они принимают участие в обмене веществ, сократимости, росте, размножении, мышлении.
Еще одна функция белков — транспортировка необходимых соединений или химических элементов. Гемоглобин, например, переносит кислород, он же транспортирует углекислый газ.
При попадании в организм чужих белков или клеток вырабатываются особые белки — антитела, которые связывают и обеззараживают чужеродные вещества.
И наконец, белки могут служить источником энергии. Но это самое невыгодное «топливо». В сутки в организме человека расщепляется около 400 г белка. Две трети образовавшихся при этом аминокислот идут на восстановление белка, и одна треть расходуется на образование энергии.
В раннем детстве потребность в белке максимальная. С возрастом она уменьшается, так как ткани наращиваются медленнее. К моменту зрелости главной становится не строительная функция, а энергетическая.
К моменту зрелости главной становится не строительная функция, а энергетическая.
Организм не может принять белка больше, чем ему необходимо, и если потребление белка с возрастом не уменьшается, то образуются конечные продукты белкового обмена: мочевая кислота, мочевина, аммиак, креатинин, креатин и др. При избытке этих соединений выведение их затруднено, и они задерживаются в организме, постепенно накапливаясь и нарушая обменные процессы.
Все огромное множество белков — это комбинации 20 аминокислот, из них 10 аминокислот не синтезируются организмом и могут быть получены только из продуктов питания. Эти незаменимые аминокислоты должны поступать в составе потребляемых нами белков.
Белки пищи могут быть животного и растительного происхождения. Ценность пищевого рациона определяется наличием в белке незаменимых аминокислот.
К полезным животным белкам относятся постная говядина, курятина и индюшатина без кожи, яйца, молочные и кисломолочные продукты.
Рыба является не только источником белка, но и обеспечивает нас полезными омега-3-жирными кислотами.
Белки растительного происхождения (фасоль, соя, горох, чечевица) сочетают в себе высококачественный белок и растворимое волокно, которое очищает организм от холестерина.
Орехи и семена богаты не только белками, но и мононенасыщенными жирами.
Грецкие орехи содержат еще и омега-3-жирные кислоты. Это делает их особенно полезными, однако они содержат много калорий, поэтому потреблять их в большом количестве не следует.
Функции белков в организме | Химия онлайн
Функции белков в природе универсальны. Белки входят в состав всех живых организмов. Мышцы, кости, покровные ткани, внутренние органы, хрящи, шерсть, кровь — все это белковые вещества.
Растения синтезируют белки из углекислого газа и воды за счет фотосинтеза. Животные организмы получают, в основном, готовые аминокислоты с пищей и на их базе строят белки своего организма.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д.
Видеофильм «Функции белков»
Разнообразные функции белков определяются a-аминокислотным составом и строением их высокоорганизованных макромолекул.
1. Каталитическая (ферментативная) функцияКаталитическая функция — одна из основных функций белков. Абсолютно все биохимические процессы в организме протекают в присутствии катализаторов – ферментов. Все известные ферменты представляют собой белковые молекулы.
Белки – это очень мощные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой фермент.
В настоящее время известно свыше 2000 различных ферментов, которые являются биологическими катализаторами.
Например, фермент пепсин расщепляет белки в процессе пищеварения.
Даже такая простая реакция как гидратация углекислого газа катализируется ферментом карбоангидразой.
Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации ДНК и матричного синтеза РНК.
2. Транспортная функцияНекоторые белки способны присоединять и переносить (транспортировать) различные вещества по крови от одного органа к другому и в пределах клетки.
Белки транспортируют липиды (липопротеиды), углеводы (гликопротеиды), ионы металлов (глобулины), кислород и углекислый газ (гемоглобин), некоторые витамины, гормоны и др.
Например, альбумины крови транспортируют липиды и высшие жирные кислоты (ВЖК), лекарственные вещества, билирубин.
Белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин. Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения окислительных процессов в тканях.
Белок миоглобин запасает кислород в мышцах.
Специфические белки-переносчики обеспечивают проникновение минеральных веществ и витаминов через мембраны клеток и субклеточных структур.
3. Защитная функцияЗащитную функцию выполняют специфические белки (антитела — иммуноглобулины), которые вырабатываются иммунной системой организма. Они обеспечивают физическую, химическую и иммунную защиту организма путем связывания и обезвреживания веществ, поступающих в организм или появляющихся в результате жизнедеятельности бактерий и вирусов.
Например, белок плазмы крови фибриноген участвует в свертывании крови (образовывает сгусток). Это защищает организм от потери крови при ранениях.
Альбумины обезвреживают ядовитые вещества (ВЖК и билирубин) в крови.
Антитела, вырабатываемые лимфоцитами, блокируют чужеродные белки. Интерфероны — универсальные противовирусные белки.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
4. Сократительная (двигательная) функцияВажным признаком жизни является подвижность, в основе которой лежит данная функция белков, таких как актин и миозин – белки мышц. Кроме мышечных сокращений к этой функции относят изменение форм клеток и субклеточных частиц.
B результате взаимодействия белков происходит передвижение в пространстве, сокращение и расслабление сердца, движение других внутренних органов.
Структурная функция — одна из важнейших функций белков. Белки играют большую роль в формировании всех клеточных структур.
Белки – это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.
Некоторые из них (коллаген соединительной ткани, кератин волос, ногтей, эластин стенок кровеносных сосудов, фиброин шелка и др.) выполняют почти исключительно структурную функцию.
Кератин синтезируется кожей. Волосы и ногти – это производные кожи.
В комплексе с липидами белки участвуют в построении мембран клеток и внутриклеточных образований.
6. Гормональная (регуляторная) функцияРегуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Интересно знать!
В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза, предохраняющие рыб от замерзания, а у ряда насекомых в местах прикрепления крыльев находится белок резилин, обладающий почти идеальной эластичностью. В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
7. Питательная (запасная) функцияПитательная функция осуществляется резервными белками, которые запасаются в качестве источника энергии и вещества.
Например: казеин, яичный альбумин, белки яйца обеспечивают рост и развитие плода, а белки молока служат источником питания для новорожденного.
8. Рецепторная (сигнальная) функцияНекоторые белки (белки-рецепторы), встроенные в клеточную мембрану, способны изменять свою структуру под воздействием внешней среды. Так происходит прием сигналов извне и передача информации в клетку.
Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином.
Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток.
9. Энергетическая функцияБелки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке (после их гидролиза). Обычно белки расходуются на энергетические нужды в крайних случаях, когда исчерпаны запасы углеводов и жиров.
При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Белки
Белки — как биополимеры, их функции и химические свойства — Областной институт повышения квалификации педагогических работников
Автор: Галина Николаевна Сергушева, учитель биологии и химии МБОУ «Средняя общеобразовательная школа № 2 п. Николаевка»
Повсюду, где мы встречаем жизнь,
мы находим, что она связана
с каким-либо белковым телом.
Ф.Энгельс
Задачи:
Сформировать знания о составе и строении белков как высшей ступени развития вещества.
Сформировать знания о химических свойствах белков.
Развитие умений и навыков составления схем химических реакций.
Научиться подтверждать химические свойства белков экспериментально, решать задачи, которые связывают химию с биологией и медициной.
Оборудование:
яичный белок, желатин, смесь гидроксида натрия и калия, лакмусовая бумага, ацетат свинца, раствор сульфата меди (II) и щелочи, концентрированная азотная кислота, этанол, спиртовка, пробирки.
Ход урока
Организационный момент.
Проверка домашнего задания: устный опрос
Аминокислоты, их строение, номенклатура, изомерия
Получение аминокислот
Химические свойства аминокислот
Применение и биологическая функция
Работа по карточкам
Варианты карточек
№1. Ниже приведены проекционные формулы аминокислот, отражающие расположение в пространстве атома Н, NН2-группы и радикала. Какая аминокислота не является составной частью подавляющего числа природных белков, т.е. имеет не L-, а D-конфигурацию?
№2. Какое исходное вещество необходимо взять для получения аминокислоты по приведенной схеме:
NН4CN + Х -аминомасляная кислота?
Вещество Х – это:
№3 Выберите правильное утверждение, описывающее приведенную ниже схему:
1) Аминокислота проявила специфическое свойство, которое следует рассматривать как результат присутствия в молекуле одновременно NН2— и СООН-групп.
2) Аминокислота проявила свойства основания, т. к. изменения произошли по -группе, которая определяет основные свойства вещества.
3) Аминокислота в таком состоянии не может проявлять свойства кислоты, т. к. в карбоксигруппе отсутствует атом водорода.
4) Аминокислота проявила свойство кислоты, т. к. в реакции отщепляются ионы Н+.
5) Течение реакции по приведенной схеме невозможно.
Переход к изучению нового материала:
Понятие пептидов, их строение и свойства
Важнейшее свойство аминокислот является реакция поликонденсации (пригласить ученика к доске записать уравнение реакции взаимодействия глицина с аланином)
Группа атомов с помощью которой связаны две аминокислоты называется пептидной связью, а продукт реакции дипептидом. Он, как и аминокислота, обладает свободными аминогруппой и карбоксильной группой. Следовательно, он способен конденсироваться со следующей молекулой аминокислоты. Пептид — это органическое соединение, содержащее две или более остатка аминокислот, связанных между собой пептидной связью. По числу остатков аминокислот различают дипептиды, трипептиды и т.д. до полипептидов. Изображать молекулу пептида удобно с помощью буквенных обозначений аминокислот (табл. 8, стр. 225). В живых организмах синтез пептидов происходит при участии ферментов из аминокислот, которые поступают в организм вместе с пищей или синтезируются самим организмом. Кроме того, возможен синтез искусственным путём (например: гормон окситоцин, стимулирующий выделение молока молочными железами, аспартам – синтетический заменитель сахара в пищевой промышленности, который в 300 раз слаще сахара, на этикетках с дешевыми газированными напитками он обозначается кодом Е 951. Однако при гидролизе в организме он образует фенилаланин, нежелательный при некоторых заболеваниях или нарушении обмена веществ. Поэтому более дорогие напитки подслащивают сахарозой.
Он, как и аминокислота, обладает свободными аминогруппой и карбоксильной группой. Следовательно, он способен конденсироваться со следующей молекулой аминокислоты. Пептид — это органическое соединение, содержащее две или более остатка аминокислот, связанных между собой пептидной связью. По числу остатков аминокислот различают дипептиды, трипептиды и т.д. до полипептидов. Изображать молекулу пептида удобно с помощью буквенных обозначений аминокислот (табл. 8, стр. 225). В живых организмах синтез пептидов происходит при участии ферментов из аминокислот, которые поступают в организм вместе с пищей или синтезируются самим организмом. Кроме того, возможен синтез искусственным путём (например: гормон окситоцин, стимулирующий выделение молока молочными железами, аспартам – синтетический заменитель сахара в пищевой промышленности, который в 300 раз слаще сахара, на этикетках с дешевыми газированными напитками он обозначается кодом Е 951. Однако при гидролизе в организме он образует фенилаланин, нежелательный при некоторых заболеваниях или нарушении обмена веществ. Поэтому более дорогие напитки подслащивают сахарозой.
Понятия о белках, история их исследования.
Таким образом, мы подошли к рассмотрению понятия белки, т.к. все белки являются полипептидами, но не всякий полипептид является белком. Белки – это высокомолекулярные соединения, состоящие из макромолекул, в которых пептидной связью соединены между собой остатки аминокислот.
Перед тем как продолжить изучение темы прочитайте вопрос, который вы должны дополнить в конце урока. (Вопрос выводится на экран через слайдопроектор, слайд №1)
В организме человека и животных белки под влиянием А подвергаются Б, в результате образуется В, которые используются организмом для синтеза собственных специфических Г.
Человек в течение длительного времени потреблял белки, выделенные главным образом из растений и животных.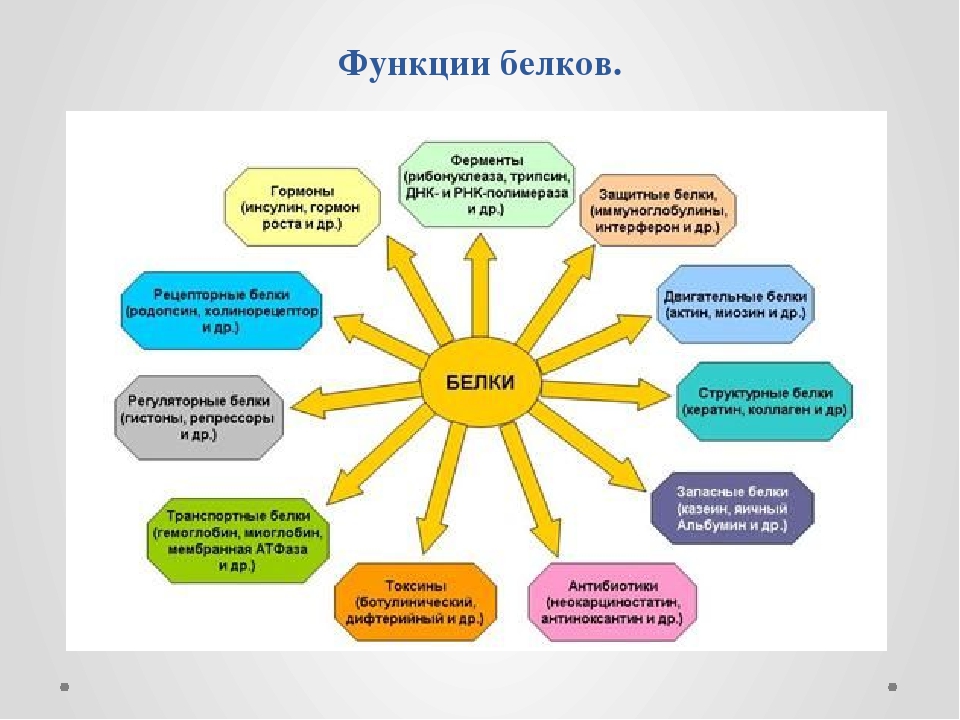 Первый белок, очищенный от примеси соединений другой природы, получен в 1782г. Я. Беккари. Это был белок пшеничного зерна, называемый клейковиной. Вскоре обнаружили, что сходные соединения находятся во всех органах не только растений, но и животных. Этот факт вызвал удивление ученых, привыкших делить вещества на соединения животного и растительного мира. Позже выяснили, что белки составляют неотъемлемую часть всех без исключения живых организмов. Их уважительно стали именовать протеинами (от греч. «протос» — первый).
Первый белок, очищенный от примеси соединений другой природы, получен в 1782г. Я. Беккари. Это был белок пшеничного зерна, называемый клейковиной. Вскоре обнаружили, что сходные соединения находятся во всех органах не только растений, но и животных. Этот факт вызвал удивление ученых, привыкших делить вещества на соединения животного и растительного мира. Позже выяснили, что белки составляют неотъемлемую часть всех без исключения живых организмов. Их уважительно стали именовать протеинами (от греч. «протос» — первый).
После разработки в начале 19 в. метода элементного анализа органических веществ стало известно, что в состав белков, помимо углеводов, водорода и кислорода, входят азот, сера, фосфор и некоторые металлы. Мы сейчас докажем опытом наличие некоторых веществ в качественном составе белка.
Демонстрация опытов:
1. Наличие аминного азота в белках. Описание опыта. В сухую пробирку помещают немного сухого белка, например желатины. Прибавляют пятикратное количество натронной извести (смесь едкого натра и гидроксида кальция), перемешивают встряхиванием и подогревают. Выделяется аммиак, вызывающий посинение розовой лакмусовой бумажки, смоченной водой. Одновременно ощущается запах жженого волоса, что всегда наблюдается при сжигании белковых веществ.
2. Наличие серы в белках.1. При горении белки издают характерный запах «жженого рога» (поджечь шерстяную нитку или пучок волос). Этот запах определяется содержанием в белках атома серы. 2.Описание опыта. В пробирку наливают 10 капель раствора яичного белка и вдвое больший объем 20%-го раствора гидроксида натрия. Содержимое пробирки нагревают до кипения (1–2 мин). К полученному щелочному раствору добавляют 5 капель раствора ацетата свинца(II) и вновь кипятят реакционную смесь. Наблюдается появление серо-черного осадка.
Во время второй мировой войны и сразу после неё исследования белка получили новый стимул, среди них были открыты антибиотики и гормоны.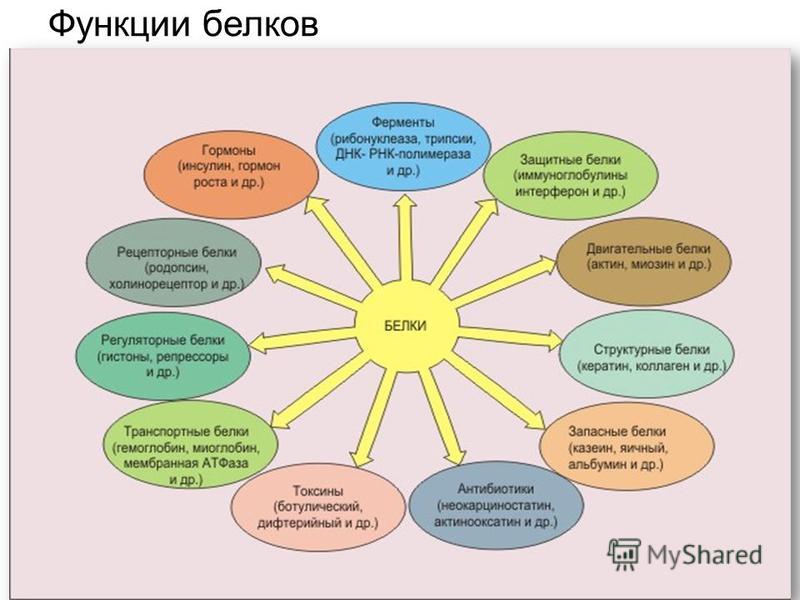 Так, например, в 1945 г. англ. биохимик Фредерик Сенгер приступил к изучению природного белка инсулина (регулирует содержание глюкозы в крови, при нарушении синтеза приводит к сахарному диабету) и на основе его открытий впервые искусственным путём получили инсулин (был вознагражден Нобел. премией).
Так, например, в 1945 г. англ. биохимик Фредерик Сенгер приступил к изучению природного белка инсулина (регулирует содержание глюкозы в крови, при нарушении синтеза приводит к сахарному диабету) и на основе его открытий впервые искусственным путём получили инсулин (был вознагражден Нобел. премией).
Функции белков.
(Проецирование на экран, слайд №2, 3)
Белки выполняют разнообразные функции:
1. Строительный материал – белки участвуют в образовании оболочки клетки, органоидов и мембран клетки. Из белков построены кровеносные сосуды, сухожилия, волосы.
2. Каталитическая роль – все клеточные катализаторы – белки (активные центры фермента). Структура активного центра фермента и структура субстрата точно соответствуют друг другу, как ключ и замок.
3. Двигательная функция – сократительные белки вызывают всякое движение.
4. Транспортная функция – белок крови гемоглобин присоединяет кислород и разносит его по всем тканям.
5. Защитная роль – выработка белковых тел и антител для обезвреживания чужеродных веществ.
6. Энергетическая функция – 1 г белка эквивалентен 17,6 кДж.
Как видите белки, выполняют множество функций. Остановимся на двух очень важных функциях белков – каталитической и защитной. (Заслушиваются сообщения учащихся). С другими функциями мы познакомимся на уроке биологии.
Примерное содержание сообщений:
1.Сообщение. Иногда небольшие изменения окружающей среды могут вызвать серьезные изменения в форме белка, что скажется на его функциях.
Слишком сильные изменения окружающей среды могут привести к потере белком его свойств в связи с изменением формы молекулы.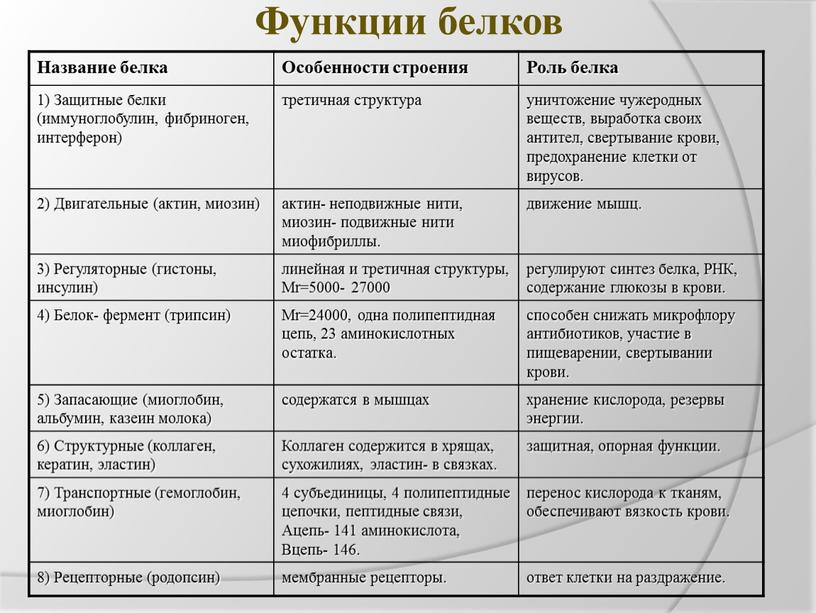 Тепло, спирт, различные растворители, соли тяжелых металлов, изменение кислотности вызывают изменение формы белка из-за разрыва связей между цепями. В некоторых случаях изменения в белках необратимы и называются денатурацией.
Тепло, спирт, различные растворители, соли тяжелых металлов, изменение кислотности вызывают изменение формы белка из-за разрыва связей между цепями. В некоторых случаях изменения в белках необратимы и называются денатурацией.
Лабораторный опыт. На раствор куриного белка действуем спиртом. Отметим, что аналогичные процессы могут протекать при поджаривании или варке яиц. Альбумин – главный белок яйца – денатурирует, что проявляется в изменении внешнего вида и структуры.
Лабораторный опыт «Осаждение белка солями тяжелых металлов».
Описание опыта. В две пробирки наливают по 1–2 мл раствора белка и медленно, при встряхивании, добавляют по каплям в одну пробирку насыщенный раствор сульфата меди, а в другую – 20%-й раствор ацетата свинца. Образуются осадки труднорастворимых солеобразных соединений белка. Опыт иллюстрирует применение белка как противоядия при отравлении солями тяжелых металлов. Данные опыта 1 показывают, что загрязнение природной среды солями тяжелых металлов приводит к отрицательным последствиям для живых организмов. Природные белки теряют присущие им специфические свойства, становятся нерастворимыми, денатурируют. При отравлении людей солями тяжелых металлов используют молоко, белки которого связывают ионы таких металлов. В других случаях изменения обратимы, и, если белок попадает в окружающую среду типа той, что имеется в клетке, он восстанавливает форму и химическую активность.
2. Сообщение. Защитная функция белков связана с выработкой лейкоцитами особых белковых веществ – антител. Синтез антител происходит в ответ на проникновение в организм чужеродных белков или микроорганизмов. Антитела связывают, нейтрализуют и разрушают несвойственные организму соединения. Антитело – молекула, синтезируемая организмом, имеет постоянные и переменные участки (рис. 7). Последние действуют подобно ключу, который подходит к определенному замку. Каждый организм может производить тысячи антител различной специфичности, способные распознавать всевозможные виды чужеродных веществ. Обычно антитела представляют собой белковые или полисахаридные молекулы, находящиеся на поверхности микроорганизма в связанном или в свободном виде.
Обычно антитела представляют собой белковые или полисахаридные молекулы, находящиеся на поверхности микроорганизма в связанном или в свободном виде.
У живых организмов сформировались две системы иммунитета – клеточная и гуморальная. Такое разделение функций иммунной системы связано с существованием двух типов лимфоузлов – Т-клеток и В-клеток.
Клеточный иммунитет – при взаимодействии с антигеном Т-лимфоциты, несущие на мембране рецепторы, способные распознать этот антиген, начинают размножаться и образуют клон таких же Т-клеток. Клетки этого клона вступают в борьбу с несущими антиген микроорганизмами или вызывают отторжение чужеродной ткани.
В-лимфоциты распознают антиген таким же образом, как и Т-клетки, но реагируют иначе. Они синтезируют антитела, которые нейтрализуют антигены.
Химические свойства.
Перед тем как начать разбирать химические свойства белка, мы упомянем о структуре белка. В ознакомительном порядке, т.к. эта тема будет рассматриваться на уроке биологии. ( Структуры белков выводятся на экран, слайд №4)
Три структуры белковых молекул
Структура белковой молекулы | Характеристика структуры | Тип связи, определяющий структуру |
1.Первичная структура | Порядок чередования аминокислот в полипептидной цепи — линейная структура | Пептидная связь –NН-СО- |
2. Вторичная структура | Закручивание полипептидной линейной цепи в спираль – спиралевидная структура | Внутримолекулярная водородная связь |
3. Третичная структура | Способ упаковки вторичной спирали в клубок – клубковидная структура | Дисульфидные и солевые связи. |
Четвертичная структура белка существует у некоторых белков (например, гемоглобин).
1. Денатурация белка. Денатурация белка – свертывание белка, происходит изменение во вторичной и третичной структуре белка, а первичная структура сохраняется. При этом их биологическая функция полностью уничтожается. Именно поэтому всё живое гибнет при действии высоких температур. В некоторых случаях возможен обратный процесс – пептизация. Причины денатурации белка: изменение рН среды, повышенная температура, ультрафиолетовое излучение, рентгеновские лучи, повышенное давление, соли тяжелых металлов. Денатурация может быть обратимой и необратимой.
2. Гидролиз белков. При нагревании белков и пептидов с растворами кислот, щелочей или при действии ферментов протекает гидролиз. Гидролиз белков сводится к расщеплению полипептидных связей, т.е. к разрушению первичной структуры белка.
3. Горение белков – с образованием азота, углекислого газа, воды
4. Качественные реакции на белки: Реакции проводятся в виде лабораторной работы.
а) Биуретова реакция. При действии на белки раствора солей меди (11) в щелочной среде возникает сиреневое или фиолетовое окрашивание за счет образования комплексных соединений. Эта реакция подтверждает наличие в белках пептидных связей.
б) Ксантопротеиновая реакция. При действии на белки концентрированной азотной кислоты образуется желтая окраска, связанная с нитрованием ароматических колец в соответствующих аминокислотах. Если биуретова реакция универсальна на все белки, то ксантопротеиновую реакцию дают только белки, содержащие остатки фенилаланина, триптофана, тирозина ( их много в белках мышечных тканей – миозин, и нет в соединительных – желатин). Реакция подтверждает наличие в аминокислотах белков ароматических ядер.
Название реакции | Что делали | Что наблюдали | Выводы |
а) Биуретовая реакция. | К 2 мл раствора белка добавить раствор сульфата меди (II) и щелочи. | ||
б) Ксантопротеиновая реакция. | К 2 мл раствора белка добавить по каплям концентрирующуюся азотную кислоту. |
4. Закрепление.
1. Возвращаемся к вопросу, заданному в начале урока:
А — фермент
Б — гидролизу
В — a — аминокислота
Г — белки
2. Отметьте пептидные связи и определите, сколько остатков аминокислот входит в состав полипептида:
Итог: Белки — высокомолекулярные органические вещества, которые являются основой живого организма.
Домашнее задание: §27 упр.9, 10
Обмен белков в организме — анализы на белки, симптомы, лечение
directions
Белки являются одними из сложнейших веществ организма и служат основой протоплазмы клеток. В их состав помимо углерода, кислорода, водорода и азота входят и аминокислоты. Последние дают основу для построения молекул белков. Они играют огромную роль в человеческом организме и отвечают за важнейшие функции: дыхание, выделения, пищеварение, движение, защитную, обеспечивают организм необходимой энергией и восполняют компоненты клетки. Нарушение обмена белка развивается в том случае, если в организм поступает его большее либо меньшее количество. На этой почве могут возникать различные опасные заболевания, поэтому при малейшем подозрении необходимо своевременно сделать все тесты.
Врачи-специалисты
Старшая медицинская сестра
Медицинская сестра
Медицинская сестра эндоскопического кабинета
Врач-терапевт
Медицинская сестра процедурной
Анализ на коронавирус методом ПЦР. Результат в течение 3-х дней
Результат в течение 3-х дней
Наши клиники в Санкт-Петербурге
Медицентр Юго-ЗападПр.Маршала Жукова 28к2
Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону +7 (812) 640-55-25
Анализы на белки
Альбумин является основным белком плазмы крови. Его синтез происходит в печени. Главная задача, которую выполняет альбумин, заключается в поддержании давления плазмы относительно объёма крови. Вместе с этим он осуществляет доставку различных веществ и их депонирование. Его сниженный уровень говорит о протекании в организме патологических процессов.
Белковые фракции – комплексный анализ, позволяющий оценить наличие в плазме крови альбумина и глобулинов. Исследование назначается при патологии почек и печени, онкологических и системных заболеваниях, нарушениях питания, а так же хронических и острых воспалительных заболеваниях.
Креатинин представляет собой конечный продукт обмена белков. Принимает участие в энергетическом обмене тканей. Из организма выводится вместе с мочой, поэтому по анализу можно судить о состоянии почек. Высокий уровень указывает на наличие почечной недостаточности, обезвоживании организма, мясной диете.
Мочевая кислота занимается выведение азота из организма. Нарушение её обмена напрямую связано со сбоем в работе почек.
Мочевина вырабатывается в печени. Во время её синтеза обезвреживается аммиак. Анализ мочевины в крови может выявить наличие множество опасных заболеваний, требующих срочного лечения, таких как: злокачественные опухоли, заболевания почек, ожоги, лейкоз, почечная недостаточность, цирроз, гепатит, печёночная недостаточность.
Общий белок – органический полимер, который состоит из аминокислот. Его определение в плазме крови позволяет судить о заболеваниях почек, печени, нарушении питания и онкологических заболеваниях.
Тимоловая проба позволяет дать характеристику работе печени. Повышение результатов исследования возникает в случаях, когда у человека: гепатит А, малярия, токсический гепатит, вирусные инфекции, цирроз печени.
Во время беременности очень часто встречается отличное от нормы значение анализов на белки в организме.
Какие симптомы нарушения обмена белков?
Различают несколько видов нарушения содержания белков в плазме крови: гиперпротеинемия означает увеличение его количества, а гипопротеинемия – уменьшение. Повышенное содержание белка может быть как наследственным, так и приобретённым заболеванием. При нарушении в обмене нуклеиновых кислот возникает подагра.
Симптомы нарушений обмена белка:
- Избыточное потребление белка может проявляться в виде:
- запора либо поноса;
- отвращения к еде;
- повышенного содержания белков в плазме крови;
- дисбактериоза кишечника;
- Низкое потребление белка может проявляться в виде двух различных заболеваний:
- Квашиоркор – это несбалансированный алиментарный недостаток белка в человеческом организме.
 К симптомам заболевания можно отнести: отёки, вялость, апатию, низкую массу тела, асцит, задержку развития, иммунодефицит, пониженное содержание белков в крови. Прогноз при возникновении этого заболевания неблагоприятный и очень часто больные умирают. Чаще всего развивается у детей от 1го до 4-х лет. Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами.
К симптомам заболевания можно отнести: отёки, вялость, апатию, низкую массу тела, асцит, задержку развития, иммунодефицит, пониженное содержание белков в крови. Прогноз при возникновении этого заболевания неблагоприятный и очень часто больные умирают. Чаще всего развивается у детей от 1го до 4-х лет. Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами. - Алиментарная дистрофия – сбалансированная недостаточность. Симптомы возникновения заболевания: отёки, содержание белка в крови на нижней границе, низкая масса тела, иммунодефицит, повышенное содержание кетоновых тел. Для алиментарной дистрофии нехарактерна задержка физического и умственного развития. В отличие от квашиоркора при дистрофии прогноз для заболевших наиболее благоприятный, однако так же встречаются случаи со смертельным исходом. Наблюдается у детей в возрасте до одного года.
- Для несбалансированного питания, при котором происходит дефицит незаменимых аминокислот, характерна: низкая масса тела, нарушение развития и роста, плохой аппетит. В случае недостаточного содержания в организме какой-либо аминокислоты симптомы могут носить специфический характер, влияющий на различные органы и провоцирующий появление заболеваний.
- Избыточное содержание аминокислот так же плохо влияет на организм. Оно проявляется в виде снижения аппетита и массы тела, нарушения вкусовых рецепторов, а так же питания тканей и органов.
Как лечится нарушение обмена белков?
После точной постановки диагноза лечение назначается специалистом для каждого пациента индивидуально. В случае алиментарной дистрофии в первые дни необходимо соблюдать абсолютный покой. Не должно возникать психических и физических нагрузок. Питание при этом должно быть полноценным, богатым витаминами и белками. Вместе с тем расширение рациона происходит постепенно, чтобы организм смог адаптироваться к новому режиму приёма пищи. Вводятся белковые препараты и назначаются анаболические стероидные гормоны. При подагрическом артрите применяются противовоспалительные препараты.
Вводятся белковые препараты и назначаются анаболические стероидные гормоны. При подагрическом артрите применяются противовоспалительные препараты.
815,1285,736,1298,817,1348
Делал ФГДС желудка, очень неприятная продцедура сама по себе. Попал к Мордвинцевой Анне Ахатовне и решил больше ФГДС делать у других специалистов не буду. Очень квалифицированный специалист, все раскладывает по полочкам, ставит правильный диагноз, а самое ГЛАВНОЕ саму продцедуру Анна делает очень профессионально и безболезнено, все неприятные ощущения сходят на нет, очень внимательна к пациентам. Хочу выразить огромную благодарность Анне и советую записываться именно к ней!
Стало плохо во время забора крови. Девушка-лаборант очень быстро и правильно отреагировала, привела в чувство, подбодрила. Приятно, когда к тебе относятся внимательно)
Кириличев Кирилл Александрович 03.12.2020 10:44medi-center.ru
Хочу поблагодарить терапевта Дерешовского Александра Сергеевича, за профессионализм и внимательность к пациенту. Именно этими качествами должен обладать настоящий Врач. Доктор всегда был на связи, проявлял интерес к самочувствию и готов был ответить на любой поставленный мной вопрос. Побольше бы таких специалистов в такое непростое для всех время.
Все понравилось. Врач у которого я была, ответственно отнёсся к моему вопросу.
Главной задачей для медицинских учреждений по прежнему остается завоевать доверие людей (пациентов), оказывая медицинскую помощь (услугу) посредством высокой квалифицированности медицинских работников. Я мама троих детей и внучка шестимесячная у нас. Обслуживание поликлиниками по ОМС с каждым годом становится все хуже и хуже (в частности наших окрестностей Мурино, Девяткино, Кузьмолово,Токсово.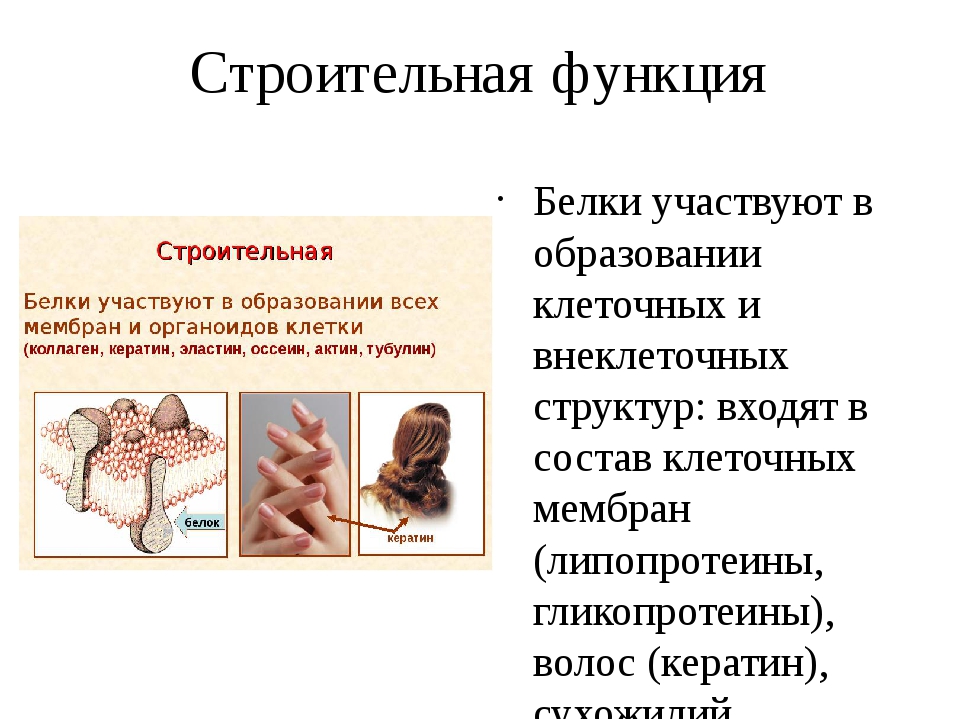 .). В платных медицинских центрах цены конечно разнообразные, но жителям нового Мурино, которые в пожизненной ипотеке платить лишние деньги при имеющимся полисе ОМС как то не серьезно! Обратились впервые за помощью в Медицентр на ул.Охтинская аллея д18 на коммерческой основе, с травмой носа у младшей дочери (4года). Хочу отметить, что лишних денег не взяли, а именно – квалифицированный врач травматолог определил ушиб, а не возможный перелом, тем самым избавил нас от облучения ребенка рентгеном. Позже очень обрадовалась тому, что именно этот центр принимает граждан по ОМС. Написала заявление и принесла необходимый пакет документов на ресепшен. Сотрудники центра с добродушием и пониманием принимали мои документы то на одного ребенка, потом на второго….да еще и не совсем в определенные часы…чего то не хватило….мы все работники государства. Спасибо Ташкиной Марине Сергеевне, Фанченковой Екатерине Викторовне и Петроченко Ольге Александровне – и по сей день встречают с добродушием и всегда стараются подобрать наиболее удобное время для посещения врача, например, для двоих детей сразу. Сдача анализов крови происходит в «волшебно» удобных креслах с массой необходимых вопросов (например: не бывает ли вам плохо от вида крови и т.п.) Благодарна за аккуратность и профессионализм в своем деле Сат Намзыраю Юрьевичу, Леванкову Максиму Владимировичу, Дерешовскому Александру и девушка была (имени не узнала). Проходя дорогу к узким специалистам через терапевта Султанга Валерию Дмитриевну, я не на секунду не усомнилась в ее компетентности , даже не смотря на ее молодой возраст. Индивидуальный подход, умеренная строгость и настаивании на непременном принятии определенных мер в отношении проблемы с моим здоровьем — позволили настроиться на позитив. Возникли сложности с посещением эндокринолога (прием был по другому адресу центра) и гинеколога (плотная запись), а ситуация сложилась экстренная, можно сказать до слез! И вот я в кабинете у заведующего отделением Степановой Натальи Юрьевны! Огромная благодарность и низкий поклон за полезное использование времени с полноценным приемом врача кардиолога в ее лице, необходимых рекомендаций со стороны эндокринологии, да и за простое человеческое общение и понимание!!! Благодаря Наталье Юрьевне я более двух месяцев живу другой жизнью с давлением 110/80, а между прочим более 15 лет страдала от высокого давления 190/140, а разнообразные препараты, которые мне назначали врачи, снижали АД лишь до 140/100 и то на время.
.). В платных медицинских центрах цены конечно разнообразные, но жителям нового Мурино, которые в пожизненной ипотеке платить лишние деньги при имеющимся полисе ОМС как то не серьезно! Обратились впервые за помощью в Медицентр на ул.Охтинская аллея д18 на коммерческой основе, с травмой носа у младшей дочери (4года). Хочу отметить, что лишних денег не взяли, а именно – квалифицированный врач травматолог определил ушиб, а не возможный перелом, тем самым избавил нас от облучения ребенка рентгеном. Позже очень обрадовалась тому, что именно этот центр принимает граждан по ОМС. Написала заявление и принесла необходимый пакет документов на ресепшен. Сотрудники центра с добродушием и пониманием принимали мои документы то на одного ребенка, потом на второго….да еще и не совсем в определенные часы…чего то не хватило….мы все работники государства. Спасибо Ташкиной Марине Сергеевне, Фанченковой Екатерине Викторовне и Петроченко Ольге Александровне – и по сей день встречают с добродушием и всегда стараются подобрать наиболее удобное время для посещения врача, например, для двоих детей сразу. Сдача анализов крови происходит в «волшебно» удобных креслах с массой необходимых вопросов (например: не бывает ли вам плохо от вида крови и т.п.) Благодарна за аккуратность и профессионализм в своем деле Сат Намзыраю Юрьевичу, Леванкову Максиму Владимировичу, Дерешовскому Александру и девушка была (имени не узнала). Проходя дорогу к узким специалистам через терапевта Султанга Валерию Дмитриевну, я не на секунду не усомнилась в ее компетентности , даже не смотря на ее молодой возраст. Индивидуальный подход, умеренная строгость и настаивании на непременном принятии определенных мер в отношении проблемы с моим здоровьем — позволили настроиться на позитив. Возникли сложности с посещением эндокринолога (прием был по другому адресу центра) и гинеколога (плотная запись), а ситуация сложилась экстренная, можно сказать до слез! И вот я в кабинете у заведующего отделением Степановой Натальи Юрьевны! Огромная благодарность и низкий поклон за полезное использование времени с полноценным приемом врача кардиолога в ее лице, необходимых рекомендаций со стороны эндокринологии, да и за простое человеческое общение и понимание!!! Благодаря Наталье Юрьевне я более двух месяцев живу другой жизнью с давлением 110/80, а между прочим более 15 лет страдала от высокого давления 190/140, а разнообразные препараты, которые мне назначали врачи, снижали АД лишь до 140/100 и то на время.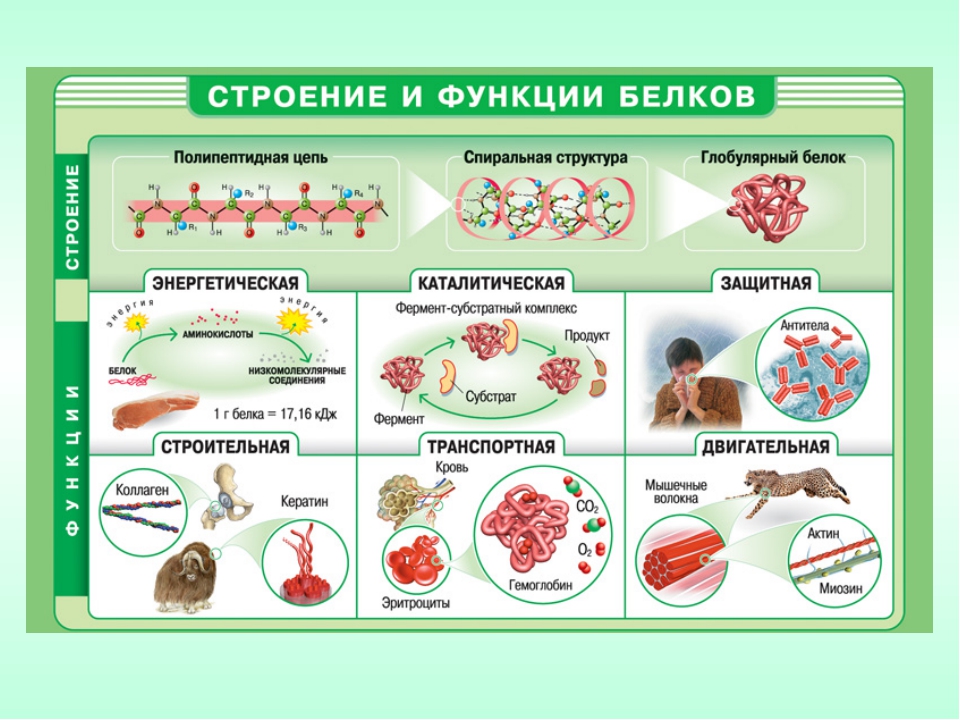 Спасибо за прием гинеколога Эскендеровой Гюлюшак Абдулаевне! Никогда бы не подумала в чем проблема, и что ранее назначенный препарат был просто бесполезен. Отдельно хочется поблагодарить Сидоркина Владимира Александровича (ЛОР) – такого тщательного осмотра я ни на себе ни на детях не наблюдала. Пришла с осипшим голосом, который затруднял мою профессиональную деятельность почти два месяца! Педиатр Абакумова Ольга Николаевна оказалась очень чутким, внимательным, тактичным доктором – нужные советы, не были назначены дорогущие и (наверно) лишние лекарства. Мои девочки перенесли заболевание ветряной оспой, не испытывая сильного недомогания и зуда (одной из них 12 лет) и именно Ольга Николаевна приходила к нам по вызову на дом дважды, один врач – доверие детей! Несомненно написала подробно и много, не подумайте что раньше мне попадались одни шарлатаны или я хорохорюсь. В одном месте и такое добродушное отношение практически всего персонала! Очень часто и резко у нас может заболеть и одно…и другое и сразу, а тут еще и дети!!! Моей семье, и я не сомневаюсь, что многим – очень повезло с таким МЕДИЦЕНТРОМ рядом! Такое добросовестное обслуживание надо поискать! ПРИМИТЕ слова Благодарности, отдельное спасибо, низкий поклон и от всей души от моей многочисленной семьи! Вы все несете определенную миссию, здоровье людям и отлично справляетесь с основной задачей — МЫ ВАМ ДОВЕРЯЕМ !!!
Спасибо за прием гинеколога Эскендеровой Гюлюшак Абдулаевне! Никогда бы не подумала в чем проблема, и что ранее назначенный препарат был просто бесполезен. Отдельно хочется поблагодарить Сидоркина Владимира Александровича (ЛОР) – такого тщательного осмотра я ни на себе ни на детях не наблюдала. Пришла с осипшим голосом, который затруднял мою профессиональную деятельность почти два месяца! Педиатр Абакумова Ольга Николаевна оказалась очень чутким, внимательным, тактичным доктором – нужные советы, не были назначены дорогущие и (наверно) лишние лекарства. Мои девочки перенесли заболевание ветряной оспой, не испытывая сильного недомогания и зуда (одной из них 12 лет) и именно Ольга Николаевна приходила к нам по вызову на дом дважды, один врач – доверие детей! Несомненно написала подробно и много, не подумайте что раньше мне попадались одни шарлатаны или я хорохорюсь. В одном месте и такое добродушное отношение практически всего персонала! Очень часто и резко у нас может заболеть и одно…и другое и сразу, а тут еще и дети!!! Моей семье, и я не сомневаюсь, что многим – очень повезло с таким МЕДИЦЕНТРОМ рядом! Такое добросовестное обслуживание надо поискать! ПРИМИТЕ слова Благодарности, отдельное спасибо, низкий поклон и от всей души от моей многочисленной семьи! Вы все несете определенную миссию, здоровье людям и отлично справляетесь с основной задачей — МЫ ВАМ ДОВЕРЯЕМ !!!
Здравствуйте! Был на днях на приеме у терапевта Красниковой Натальи Михайловны. Врач очень профессионально выполнил свою работу. Наталья Михайловна точно и ясно разъяснила в чем проблема, назначила сдачу нужных анализов и после грамотно растолковала причину заболевания. Очень приятная женщина и прекрасный врач. С таким доктором болеть не страшно! Благодарю за профессионализм и отличный подход!
Функция белков | Биология для майоров I
Результаты обучения
- Определить несколько основных функций белков
Основные типы и функции белков перечислены в таблице 1.
| Таблица 1. Типы и функции белков | ||
|---|---|---|
| Тип | Примеры | Функции |
| Пищеварительные ферменты | Амилаза, липаза, пепсин, трипсин | Помощь в переваривании пищи за счет катаболизма питательных веществ до мономерных единиц |
| Транспорт | Гемоглобин, альбумин | Переносит вещества в крови или лимфе по всему телу |
| Строительный | Актин, тубулин, кератин | Создавать различные структуры, такие как цитоскелет |
| Гормоны | Инсулин, тироксин | Координировать деятельность различных систем организма |
| Оборона | Иммуноглобулины | Защитить организм от инородных патогенов |
| Сокращение | Актин, миозин | Эффект сокращения мышц |
| Хранение | Запасные белки бобовых, яичный белок (альбумин) | Обеспечить питание на ранних этапах развития зародыша и проростка |
Два специальных и распространенных типа белков — это ферменты и гормоны. Ферменты , которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или конъюгированные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях разложения, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят более сложные молекулы из своих субстратов, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами.Следует отметить, что все ферменты увеличивают скорость реакции и, следовательно, считаются органическими катализаторами.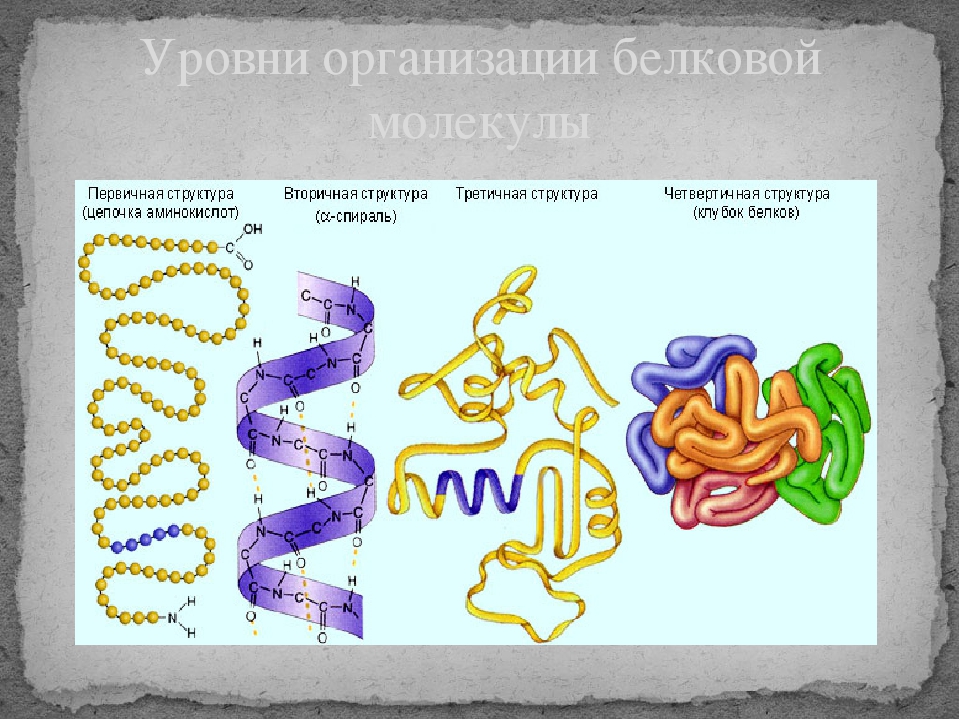 Примером фермента является амилаза слюны, которая гидролизует свою субстратную амилозу, компонент крахмала.
Примером фермента является амилаза слюны, которая гидролизует свою субстратную амилозу, компонент крахмала.
Гормоны представляют собой химические сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые действуют, чтобы контролировать или регулировать определенные физиологические процессы, включая рост, развитие, метаболизм и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.
Белки имеют разную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин — это глобулярный белок, а коллаген, обнаруженный в нашей коже, — это волокнистый белок. Форма белка имеет решающее значение для его функции, и эта форма поддерживается многими различными типами химических связей. Изменения температуры, pH и воздействие химикатов могут привести к необратимым изменениям формы белка, что приведет к потере функции, известной как денатурация.Все белки содержат разные расположения одних и тех же 20 типов аминокислот. Недавно были открыты две редкие новые аминокислоты (селеноцистеин и пирролизин), и к этому списку могут быть добавлены новые открытия.
Вкратце: функция белков
Белки — это класс макромолекул, которые выполняют широкий спектр функций для клетки. Они помогают метаболизму, обеспечивая структурную поддержку и действуя как ферменты, переносчики или гормоны. Строительными блоками белков (мономеров) являются аминокислоты.Каждая аминокислота имеет центральный углерод, связанный с аминогруппой, карбоксильной группой, атомом водорода и R-группой или боковой цепью. Существует 20 обычно встречающихся аминокислот, каждая из которых отличается по группе R. Каждая аминокислота связана со своими соседями пептидной связью. Длинная цепь аминокислот известна как полипептид.
Белки подразделяются на четыре уровня: первичный, вторичный, третичный и (необязательно) четвертичный. Первичная структура — это уникальная последовательность аминокислот.Локальное сворачивание полипептида с образованием таких структур, как спираль α и складчатый лист β , составляет вторичную структуру. Общая трехмерная структура — это третичная структура. Когда два или более полипептида объединяются, чтобы сформировать полную структуру белка, такая конфигурация известна как четвертичная структура белка. Форма и функция белка неразрывно связаны; любое изменение формы, вызванное изменениями температуры или pH, может привести к денатурации белка и потере функции.
Внесите свой вклад!
У вас была идея улучшить этот контент? Нам очень понравится ваш вклад.
Улучшить эту страницуПодробнее
Структура и функции белка — Биохимия
Белки являются наиболее универсальными макромолекул в живых системах и выполняют важные функции практически во всех биологических процессы. Они действуют как катализаторы, они переносят и хранят другие молекулы, такие как кислород, они обеспечивают механическую поддержку и иммунную защиту, они генерируют движение, передают нервы импульсы, и они контролируют рост и дифференциацию.Действительно, большая часть этого текста будет посвящена понимание того, что делают белки и как они выполняют эти функции.
Несколько ключевых свойств позволяют белкам участвовать в таком широком спектре функций.
- 1.
Белки представляют собой линейные полимеры построены из мономерных единиц, называемых аминокислотами . Строительство огромного множества макромолекулы из ограниченного числа строительных блоков мономера — повторяющаяся тема в биохимия. Зависит ли функция белка от линейной последовательности аминокислот? Функция белок напрямую зависит от его трехмерной структуры ().Примечательно, что белки спонтанно складываются в трехмерные объекты. структуры, которые определяются последовательностью аминокислот в белковом полимере. Таким образом, белков являются воплощением перехода от одномерного мира последовательностей к трехмерный мир молекул, способных к разнообразным деятельность .
- 2.
Белки содержат широкий спектр функциональных групп . Эти функциональные группы включают спирты, тиолы, тиоэфиры, карбоновые кислоты, карбоксамиды и различные основные группы.В сочетании с различными последовательности, этот набор функциональных групп отвечает за широкий спектр функций белка. Для Например, химическая реакционная способность, связанная с этими группами, важна для функции ферментов, белков, катализирующих определенные химические реакции в биологических системы (см. главы 8–10).
- 3.
Белки могут взаимодействовать друг с другом и с другими биологическими макромолекулами с образованием сложных ансамблей .Белки в этих сборках могут действовать синергетически, генерируя возможности, не предоставляемые отдельными составляющими белками (). Эти сборки включают макромолекулярные машины, которые выполняют точную репликацию ДНК, передачу сигналов внутри клеток и многие другие важные процессы.
- 4.
Некоторые белки довольно жесткие, тогда как другие обладают ограниченной гибкостью . Жесткие единицы могут функционировать как структурные элементы в цитоскелете (внутреннем каркасе внутри клеток) или в соединительной ткани.Части белков с ограниченной гибкостью могут действовать как шарниры, пружины и рычаги, которые имеют решающее значение для функции белков, для сборки белков друг с другом и с другими молекулами в сложные единицы, а также для передачи информации внутри и между клетками () .
Рисунок
Кристаллы человеческого инсулина. Инсулин — это белковый гормон, имеющий решающее значение для поддержания необходимого уровня сахара в крови. (Ниже) Цепочки аминокислот в определенной последовательности (первичная структура) определяют такой белок, как инсулин.Эти цепочки складываются в четко определенные (подробнее …)
Рисунок 3.1
Структура определяет функцию. Белковый компонент механизма репликации ДНК окружает часть двойной спирали ДНК. Структура белка позволяет копировать большие сегменты ДНК без диссоциации механизма репликации (подробнее …)
Рис. 3.2
Комплексный узел белка. Электронная микрофотография ткани полета насекомого в поперечном сечении показывает гексагональный массив из двух видов белковых нитей.[Любезно предоставлено доктором Майклом Риди.]
Рис. 3.3
Гибкость и функциональность. Связывая железо, белок лактоферрин претерпевает конформационные изменения, которые позволяют другим молекулам различать формы, не содержащие железа, и связанные с железом.
- 3.1. Белки построены из набора из 20 аминокислот
- 3.2. Первичная структура: аминокислоты связаны пептидными связями с образованием полипептидных цепей
- 3.3. Вторичная структура: полипептидные цепи могут складываться в регулярные структуры, такие как альфа-спираль, бета-лист, витки и петли
- 3.4. Третичная структура: водорастворимые белки складываются в компактные структуры с неполярными ядрами
- 3.5. Четвертичная структура: полипептидные цепи могут собираться в многосубъединичные структуры
- 3.6. Аминокислотная последовательность белка определяет его трехмерную структуру
- Резюме
- Приложение: Кислотно-основные понятия
- Проблемы
Что такое белки и какова их функция в организме?
Последнее обновление: 16 декабря 2019 г.Белки состоят из многих строительных блоков, известных как аминокислоты.Нашему организму нужен диетический белок, чтобы поставлять аминокислоты для роста и поддержания наших клеток и тканей. Наши диетические потребности в белке меняются на протяжении всей жизни. Европейское управление по безопасности пищевых продуктов (EFSA) рекомендует взрослым потреблять не менее 0,83 г белка на кг массы тела в день (например, 58 г в день для взрослого человека весом 70 кг). Белки растительного и животного происхождения различаются по качеству и усвояемости, но обычно это не вызывает беспокойства у большинства людей, если их общий белок соответствует их потребностям. Мы должны стремиться потреблять белок из различных источников, который приносит пользу как нашему здоровью, так и планетам.
Из чего состоят белки?
Белки состоят из множества различных аминокислот, связанных вместе. Существует двадцать различных строительных блоков из этих аминокислот, которые обычно встречаются в растениях и животных. Типичный белок состоит из 300 или более аминокислот, и конкретное количество и последовательность аминокислот уникальны для каждого белка. Подобно алфавиту, «буквы» аминокислот могут быть расположены миллионами различных способов для создания «слов» и целого белкового «языка».В зависимости от количества и последовательности аминокислот полученный белок будет принимать определенную форму. Эта форма очень важна, поскольку она будет определять функцию белка (например, мышц или ферментов). У каждого вида, включая человека, есть свои характерные белки.
Аминокислоты подразделяются на незаменимые и несущественные. Как следует из названия, незаменимые аминокислоты не могут вырабатываться организмом и, следовательно, должны поступать из нашего рациона. Принимая во внимание, что незаменимые аминокислоты могут вырабатываться организмом и, следовательно, не должны поступать с пищей.
Таблица 1. Незаменимые и незаменимые аминокислоты.
Незаменимые аминокислоты | Незаменимые аминокислоты |
Гистидин Изолейцин лейцин Лизин метионин Фенилаланин Треонин Триптофан Валин | Аланин аргинин * Аспарагин аспартат Цистеин * Глутамат Глютамин * Глицин * Пролин * Серин таурин * тирозин * |
* это условно незаменимые аминокислоты, что означает, что они необходимы только при определенных условиях (например,грамм. для новорожденных). 1
Что белки делают для организма?
Наши тела состоят из тысяч различных белков, каждый из которых выполняет определенную функцию. Они составляют структурные компоненты наших клеток и тканей, а также многие ферменты, гормоны и активные белки, секретируемые иммунными клетками (рис. 1).
Эти белки организма постоянно восстанавливаются и заменяются на протяжении всей нашей жизни. Этот процесс (известный как «синтез белка») требует постоянного поступления аминокислот.Хотя некоторые аминокислоты могут быть переработаны в результате распада старых белков организма, этот процесс несовершенен. Это означает, что мы должны потреблять диетический белок, чтобы удовлетворить потребность нашего организма в аминокислотах.
Поскольку белок необходим для роста клеток и тканей, адекватное потребление белка особенно важно в периоды быстрого роста или повышенной потребности, например, в детстве, подростковом возрасте, беременности и кормлении грудью. 1
Рисунок 1. Функции белков в организме.
Какие продукты богаты белком?
Белок содержится как в растительной, так и в животной пище. На рисунке 2 показано содержание белка в типичной порции обычных продуктов животного и растительного происхождения. Для получения дополнительной информации о том, как оценить размер здоровых порций, см. Раздел Измерение размеров порций руками.
Рисунок 2. Продукты с высоким содержанием белка. 2
Есть ли разница между белками животного и растительного происхождения?
Как видно на Рисунке 2, продукты животного и растительного происхождения могут быть богатыми источниками белка.Но одинаковы ли они по качеству?
Качество протеина можно определить по-разному; однако все определения относятся к распределению и соотношению незаменимых и заменимых аминокислот, которые они содержат. В целом, белки животного происхождения имеют более высокое качество, поскольку они содержат более высокие пропорции незаменимых аминокислот по сравнению с белками растительного происхождения.
Существует распространенное заблуждение, что в растительных белках полностью отсутствуют некоторые незаменимые аминокислоты. Фактически, большинство растительных белков будут содержать все 20 аминокислот, но, как правило, имеют ограниченное количество определенных незаменимых аминокислот, известных как их ограничивающие аминокислоты.Это означает, что если небольшое количество растительных продуктов потребляется в качестве единственных источников белка, они вряд ли обеспечат достаточное количество незаменимых аминокислот для удовлетворения наших потребностей. Для людей, которые практически не потребляют продукты животного происхождения, таких как веганы или вегетарианцы, важно, чтобы они потребляли белок из источников с дополнительными ограничивающими аминокислотами. Например, потребление риса (с ограниченным содержанием лизина и тиамина, но с высоким содержанием метионина) и бобов (с ограниченным содержанием метионина, но с высоким содержанием лизина и тиамина) обеспечит дополнительные аминокислоты, которые могут помочь удовлетворить потребности в незаменимых аминокислотах.
Белки животного и растительного происхождения также различаются по своей биодоступности и усвояемости. Оценка усвояемых незаменимых аминокислот (DIAAS) является рекомендуемым методом для определения перевариваемости диетического белка и выражается в значениях ниже или иногда даже выше 100. 3 DIAAS более 100 указывает на то, что белок имеет очень высокую усвояемость и качество и является хороший протеин, дополняющий те, которые обладают более низкими качествами. Белки животного происхождения, как правило, имеют более высокие баллы DIAAS по сравнению с белками растительного происхождения (таблица 2).Поскольку большинство людей потребляют белок из различных источников, качество и усвояемость белка обычно не вызывает беспокойства.
Таблица 2. DIAAS и качество различных типов протеина на 100 г пищи. 3, 4
Тип белка | DIAAS | Качество |
Пшеница | 40 | Низкий |
Миндаль | 40 | Низкий |
Рис | 59 | Низкий |
Горох | 64 | Низкий |
Нут | 83 | средний |
Куриная грудка | 108 | Высокая |
Яйцо | 113 | Высокая |
Цельное молоко | 114 | Высокая |
Сколько белка мы должны есть каждый день?
EFSA разработало диетические контрольные значения (DRV) для белка.DRV для белка на разных этапах жизни сведены в таблицу 3. Для среднего взрослого рекомендуется потреблять не менее 0,83 г белка на каждый килограмм массы тела в день. 1 Другими словами, взрослый человек весом 70 кг должен стремиться съедать не менее 58 г белка в день. Это эквивалентно белку, содержащемуся примерно в 200 г куриной грудки или 240 г ореховой смеси.
В периоды роста, такие как детство, беременность и кормление грудью, потребности в белке относительно высоки.Кроме того, в пожилом возрасте соотношение белков и энергии начинает увеличиваться. Это означает, что нам требуется такое же количество белка, но меньше энергии (или калорий) из-за снижения скорости метаболизма и более малоподвижного образа жизни. 1
Таблица 3. Диетические справочные значения для стадий жизни. 1 BW: масса тела.
Справочное значение | г / сутки 70 кг взрослые | |
Детство (12 мес — 17 лет) | 1.14 — 0,83 г / кг BW | – |
Взрослые (18-65 лет) | 0,83 г / кг BW | 58 г |
Пожилые люди (> 65 лет) | 1 г / кг BW | 70 г |
Беременность | 0,83 г / кг BW | 58 г |
+ 1г в сутки | 59 г | |
+ 9 г в сутки | 67 г | |
+ 28 г в сутки | 86 г | |
Грудное вскармливание (0-6 месяцев) | + 19 г в сутки | 77 г |
Грудное вскармливание (> 6 месяцев) | +13 г в сутки | 71 г |
Сколько белка мы едим каждый день?
В целом европейцы потребляют достаточно белка, а дефицит белка в большинстве развитых стран встречается редко (диаграмма 3).Поскольку диета европейцев уже превышает требуемый уровень, EFSA не рекомендует увеличивать текущее потребление белка. 1
Рисунок 3. Потребление белка в европейских странах. 1
Какая польза от протеина для здоровья?
Потребление достаточного количества белка для удовлетворения потребностей нашего организма важно для многих функций организма. Однако есть данные, позволяющие предположить, что в определенных ситуациях увеличение потребления белка выше требуемого уровня может принести дополнительную пользу для здоровья.
Протеин и контроль весаБыло доказано, что употребление в пищу продуктов, богатых белком, усиливает чувство сытости (также известное как сытость) больше, чем продукты с высоким содержанием жиров или углеводов. Краткосрочные исследования показали, что диета с высоким содержанием белка (например, 1,2–1,6 г / кг в день; 84–112 г в день для взрослого человека весом 70 кг) может помочь снизить общее потребление калорий и ускорить потерю веса. 5 Однако доказательства долгосрочного поддержания веса менее очевидны. 5 Как и все диеты, диета с высоким содержанием белка эффективна только в том случае, если ее придерживаются, что может быть трудным для некоторых людей, а низкая приверженность может частично объяснить ограниченную пользу, наблюдаемую при долгосрочном поддержании веса. 5
Белок и саркопенияСаркопения — это заболевание, характеризующееся прогрессирующей потерей мышечной массы и физических функций, которое обычно ассоциируется у пожилых людей. Саркопения связана с повышенной слабостью, риском падений, функциональным снижением и даже ранней смертью. 6 Поскольку белок необходим для восстановления и поддержания мышечной массы, неудивительно, что низкое потребление белка связано с повышенным риском развития саркопении. 6 Точно так же увеличение потребления белка, а также увеличение физической активности может помочь сохранить мышечную массу и силу с возрастом, снижая риск саркопении и заболеваний скелета.
Белок и спортивные результатыПротеин уже давно ассоциируется со спортивной продуктивностью.Белок играет ключевую роль в восстановлении и укреплении мышечной ткани после тренировки. Хотя белок имеет решающее значение для наращивания мышечной массы, для получения максимальной пользы его следует рассматривать в контексте всей диеты, которая включает правильное количество углеводов, жиров, витаминов и минералов. Оптимальное потребление белка будет зависеть от типа (например, тренировка на выносливость или сопротивление), продолжительности и интенсивности упражнений, причем большее количество не всегда означает лучшее. Потребление белка 1,4–2,0 г на кг массы тела в день (например,грамм. 98 — 140 г в день для взрослого человека весом 70 кг) считается достаточным для удовлетворения потребностей большинства людей, занимающихся физическими упражнениями. 7 Спортсмены должны стремиться к потреблению белка за счет сбалансированной диеты, с использованием белковых добавок для людей, которым необходимо поддерживать высокий уровень белка, но ограничивать общее потребление калорий.
Что произойдет, если вы съедите слишком много белка?
Недостаточно доказательств для установления порога потребления белка, и EFSA заявило, что потребление белка в два раза превышает DRV (1.7 г / кг в день или 119 г в день для взрослого человека весом 70 кг) по-прежнему считается безопасным при нормальных условиях. 1 Для людей с заболеванием почек избыток белка может быть проблемой, и этим людям следует проконсультироваться с диетологом или терапевтом, прежде чем повышать уровень белка.
Увеличение весаСуществует распространенное заблуждение, что нельзя набрать вес, употребляя белок. Это неправда, так же, как углеводы и жиры, когда они потребляются во время избытка калорий, избыток белка может превращаться в жировые отложения, что приводит к увеличению веса.Когда дело доходит до поддержания веса, самое главное — сохранять энергетический баланс.
Красное и обработанное мясо и риск ракаБелок необходим для хорошего здоровья, но некоторые продукты с высоким содержанием белка могут быть лучше для нашего здоровья, чем другие. В частности, употребление большого количества красного и обработанного мяса связано с повышенным риском некоторых видов рака. 8 Красное мясо является хорошим источником белка, а также многих других важных питательных веществ, таких как железо, витамин B 12 и цинк, и его не обязательно полностью избегать, чтобы снизить риск.Всемирный фонд исследования рака рекомендует нам стараться потреблять не более трех порций (около 350-500 г вареной массы) красного мяса в неделю и очень мало обработанного мяса. 8
Белковая устойчивостьВыбор продуктов питания, который мы делаем, влияет не только на наше здоровье, но и на окружающую среду. В целом, белки животного происхождения, такие как говядина, молочные продукты и баранина, оказывают более сильное воздействие на окружающую среду (т. Е. Используют больше ресурсов и производят больше парниковых газов) по сравнению с растительными источниками, такими как соя, горох и чечевица (рисунок 4). 9 Хотя нет необходимости или рекомендуется полностью избегать продуктов животного происхождения, изменение рациона питания с включением большего количества источников белка растительного происхождения может принести пользу нашему здоровью и планете. 10 Устойчивое питание — это больше, чем просто выбор экологически чистых продуктов, богатых белком. Дополнительные советы о том, как вести более устойчивый образ жизни, см. В советах по правильному и рациональному питанию и советах по сокращению пищевых отходов.
Рисунок 4 . Содержание белка и выбросы парниковых газов (ПГ) в различных пищевых продуктах. 9
Заключение
Белок необходим для жизни; он поставляет незаменимые аминокислоты, необходимые для роста и поддержания наших клеток и тканей. Наша потребность в белке зависит от нашего жизненного цикла, и большинство европейцев потребляют достаточно, чтобы удовлетворить свои потребности. Поскольку большинство людей придерживаются разнообразной диеты, качество и усвояемость белков, которые они едят, не должны вызывать беспокойства, если общее количество белка удовлетворяет их ежедневные потребности. Поскольку мы едим продукты, а не питательные вещества, мы должны выбирать продукты, богатые белком, которые не только содержат незаменимые аминокислоты, но и поддерживают здоровую и устойчивую диету.
Список литературы
- EFSA (2012). Европейское агентство по безопасности пищевых продуктов, Научное заключение о диетических референсных значениях белка. EFSA Journal 2012; 10 (2): 2557
- База данных Великобритании по составу пищевых продуктов.
- Консультация, F.E., 2011. Оценка качества диетического белка в питании человека. FAO Food Nutr. Пап, 92, стр. 1-66.
- Филлипс, С.М., 2017. Современные концепции и нерешенные вопросы в отношении диетических белков и добавок у взрослых.Границы питания, 4, с.13.
- Лейди, Х.Дж., Клифтон, П.М., Аструп, А., Уичерли, Т.П., Вестертерп-Плантенга, М.С., Ласкомб-Марш, Н.Д., Вудс, С.С. и Маттес, Р.Д., 2015. Роль белка в потере и поддержании веса. Американский журнал клинического питания, 101 (6), стр.132
- Cruz-Jentoft AJ, Sayer AA (2019). Саркопения. Ланцет. 393 (10191): 2636-2646.
- Jager R., Kerksick, C.M., Campbell, B.I., Cribb, P.J., Wells, S.Д., Сквиат, Т.М., Пурпура, М., Зигенфус, Т.Н., Феррандо, А.А., Арент, С.М. и Смит-Райан, A.E., 2017. Позиция Международного общества спортивного питания: белок и упражнения. Журнал
- Всемирный фонд исследований рака / Американский институт исследований рака. Постоянное обновление отчета экспертов проекта за 2018 год. Мясо, рыба и молочные продукты и риск рака.
- Пур Дж., Немечек Т. (2018) Снижение воздействия пищевых продуктов на окружающую среду за счет производителей и потребителей.Science Vol. 360, Issue 6392, pp. 987-992
- ФАО и ВОЗ. 2019. Устойчивое здоровое питание — Руководящие принципы. Рим
- Ферменты — это белки, которые облегчают биохимические реакции, например, пепсин — это пищеварительный фермент в желудке, который помогает расщеплять белки в пище.
- Антитела — это белки, вырабатываемые иммунной системой для удаления посторонних веществ и борьбы с инфекциями.
- ДНК-ассоциированные белки регулируют структуру хромосом во время деления клеток и / или играют роль в регуляции экспрессии генов, например, гистоны и белки когезина
- Сократительные белки участвуют в сокращении и движении мышц, например, актин и миозин
- Структурные белки обеспечивают поддержку в нашем организме, например, белки в наших соединительных тканях, такие как коллаген и эластин.
- Гормональные белки координируют функции организма, например, инсулин контролирует концентрацию сахара в крови, регулируя поглощение глюкозы клетками.
- Транспортные белки перемещают молекулы по нашему телу, например, гемоглобин переносит кислород по крови.
- Различать типы и функции белков
- Белки необходимы для основных физиологических процессов жизни и выполняют функции во всех системах человеческого тела.
- Форма белка определяет его функцию.
- Белки состоят из аминокислотных субъединиц, которые образуют полипептидные цепи.
- Ферменты катализируют биохимические реакции, ускоряя химические реакции, и могут либо разрушать свой субстрат, либо строить более крупные молекулы из субстрата.
- Форма активного центра фермента соответствует форме субстрата.
- Гормоны — это тип белков, используемых для передачи сигналов и коммуникации клеток.
- аминокислота : Любая из 20 встречающихся в природе α-аминокислот (имеющих амино- и карбоксильные группы на одном атоме углерода) и различных боковых цепей, которые объединяются через пептидные связи с образованием белков.
- полипептид : любой полимер (одинаковых или разных) аминокислот, соединенных пептидными связями.
- катализатор : для ускорения процесса.
- катализирующие химические реакции
- синтез и восстановление ДНК
- транспортировка материалов по камере
- прием и отправка химических сигналов
- отвечает на раздражители
- обеспечивает структурную поддержку
- Катаболические ферменты: ферменты, расщепляющие субстрат
- Анаболические ферменты: ферменты, которые строят более сложные молекулы из своих субстратов
- Белки — это биомолекулы, состоящие из аминокислот, которые участвуют почти во всех клеточных действиях.
- Происходит в цитоплазме, трансляция — это процесс, посредством которого синтезируются белки .
- Типичный белок состоит из единственного набора из аминокислот . Каждый белок специально приспособлен для выполнения своих функций.
- Любой белок в организме человека может быть создан из перестановок только 20 аминокислот.
- Существует семь типов белков: антитела , сократительные белки, ферменты, гормональные белки, структурные белки, запасные белки и транспортные белки .
- А атом водорода (H)
- Карбоксильная группа (-COOH)
- Аминогруппа (-Nh3)
- А «переменная» группа
Роль белков в организме — Science Learning Hub
Белки — это молекулы, состоящие из аминокислот. Они кодируются нашими генами и составляют основу живых тканей. Они также играют центральную роль в биологических процессах. Например, белки катализируют реакции в нашем организме, транспортируют молекулы, такие как кислород, поддерживают наше здоровье как часть иммунной системы и передают сообщения от клетки к клетке.
Синтез белка
Ген — это сегмент молекулы ДНК, который содержит инструкции, необходимые для создания уникального белка. Все наши клетки содержат одни и те же молекулы ДНК, но каждая клетка использует различную комбинацию генов для создания определенных белков, необходимых для выполнения своих специализированных функций.
Синтез белка имеет 2 основных этапа. 1-й этап известен как транскрипция, когда образуется молекула-мессенджер (мРНК). Эта молекула транскрибируется с молекулы ДНК и несет копию информации, необходимой для создания белка.На 2-м этапе молекула мРНК покидает ядро в цитоплазму, где рибосомы клетки считывают информацию и начинают сборку белка в процессе, называемом трансляцией.
Во время трансляции рибосомы считывают последовательность мРНК из трех оснований за раз. Каждая из этих трехбуквенных комбинаций (называемых кодонами) кодирует определенную аминокислоту. Например, последовательность оснований ТТТ кодирует аминокислоту лизин.
Имеется 4 основания (аденин, тимин, гуанин и цитозин) и, следовательно, 64 (4 3 ) возможных кодонов, определенных с использованием некоторой комбинации 3 оснований.Однако для построения всех белков в нашем организме требуется всего 20 аминокислот (для некоторых аминокислот требуется более 1 кодона). Именно конкретная последовательность аминокислот определяет форму и функцию белка.
На синтез белка, как и на многие другие биологические процессы, могут влиять факторы окружающей среды. К ним относятся питание матери, температурный стресс, уровень кислорода и воздействие химикатов.
Различные типы белков
В нашем организме существует много разных типов белков.Все они играют важную роль в нашем росте, развитии и повседневном функционировании. Вот несколько примеров:
Альтернативные роли белков
Каждый белок играет определенную роль в нашем организме. Однако ученые обнаружили, что некоторые белки выполняют более одной роли.
Например, д-р Джулия Хорсфилд возглавляет группу по структуре и развитию хромосом в Университете Отаго.Ее лаборатория исследует, как белки когезина, которые регулируют структуру хромосом во время деления клеток, также участвуют в обеспечении того, чтобы гены включались или выключались в нужное время во время развития. Джулия и ее коллеги сосредотачиваются на влиянии снижения содержания белков когезина на экспрессию генов у рыбок данио и используют эти результаты для лучшего понимания конкретных заболеваний человека
Полезная ссылка
Посетите веб-сайт Learn Genetics, чтобы отправиться в анимированные туры, посвященные ДНК, генам, хромосомы, белки, наследственность и признаки.
2.5.5: Типы и функции белков
Белки выполняют многие важные физиологические функции, в том числе катализируют биохимические реакции.
Цели обучения
Ключевые моменты
Ключевые термины
Типы и функции белков
Белки выполняют важные функции во всех системах человеческого тела. Эти длинные цепи аминокислот критически важны для:
Белки (полимеры) представляют собой макромолекулы, состоящие из аминокислотных субъединиц (мономеров).Эти аминокислоты ковалентно связаны друг с другом с образованием длинных линейных цепей, называемых полипептидами, которые затем складываются в определенную трехмерную форму. Иногда эти свернутые полипептидные цепи функционируют сами по себе. В других случаях они объединяются с дополнительными полипептидными цепями, чтобы сформировать окончательную структуру белка. Иногда в конечном белке также требуются неполипептидные группы. Например, гемогобин белка крови состоит из четырех полипептидных цепей, каждая из которых также содержит молекулу гема, имеющую кольцевую структуру с атомом железа в центре.
Белки имеют разную форму и молекулярную массу в зависимости от аминокислотной последовательности. Например, гемоглобин представляет собой глобулярный белок, что означает, что он складывается в компактную глобулярную структуру, но коллаген, обнаруженный в нашей коже, представляет собой волокнистый белок, что означает, что он складывается в длинную вытянутую волоконно-подобную цепь. Вы, вероятно, похожи на членов своей семьи, потому что у вас одинаковые белки, но вы отличны от посторонних, потому что белки в ваших глазах, волосах и остальном теле разные.
Рисунок: Гемоглобин человека : Структура гемоглобина человека. Α- и β-субъединицы белков выделены красным и синим цветом, а железосодержащие гемовые группы — зеленым. Из базы данных по белкам.Поскольку форма определяет функцию, любое небольшое изменение формы белка может привести к нарушению функции белка. Небольшие изменения в аминокислотной последовательности белка могут вызвать разрушительные генетические заболевания, такие как болезнь Хантингтона или серповидно-клеточная анемия.
Ферменты
Ферменты — это белки, которые катализируют биохимические реакции, которые в противном случае не имели бы места.Эти ферменты необходимы для химических процессов, таких как пищеварение и клеточный метаболизм. Без ферментов большинство физиологических процессов протекало бы так медленно (или не протекало бы совсем), что жизнь не могла бы существовать.
Поскольку форма определяет функцию, каждый фермент специфичен для своих субстратов. Субстраты — это реагенты, которые подвергаются химической реакции, катализируемой ферментом. Место, где субстраты связываются с ферментом или взаимодействуют с ним, известно как активный сайт, потому что это место, где происходит химия.Когда субстрат связывается со своим активным центром на ферменте, фермент может способствовать его распаду, перегруппировке или синтезу. Помещая субстрату определенную форму и микроокружение в активном центре, фермент стимулирует протекание химической реакции. Существует два основных класса ферментов:
Рисунок: Ферментная реакция : Катаболическая ферментная реакция, показывающая, что субстрат точно соответствует форме активного центра.Ферменты необходимы для пищеварения: процесс расщепления более крупных молекул пищи на субъединицы, достаточно мелкие, чтобы диффундировать через клеточную мембрану и использоваться клеткой.Эти ферменты включают амилазу, которая катализирует переваривание углеводов во рту и тонком кишечнике; пепсин, катализирующий переваривание белков в желудке; липаза, катализирующая реакции, необходимые для эмульгирования жиров в тонком кишечнике; и трипсин, который катализирует дальнейшее переваривание белков в тонком кишечнике.
Ферменты также необходимы для биосинтеза: процесса создания новых сложных молекул из более мелких субъединиц, которые поставляются или генерируются клеткой.Эти биосинтетические ферменты включают ДНК-полимеразу, которая катализирует синтез новых цепей генетического материала до деления клетки; синтетаза жирных кислот, которая синтезирует новые жирные кислоты для образования жиров или мембранных липидов; и компоненты рибосомы, которая катализирует образование новых полипептидов из мономеров аминокислот.
Гормоны
Некоторые белки действуют как химические сигнальные молекулы, называемые гормонами. Эти белки секретируются эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, метаболизм и размножение.Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови. Другие белки действуют как рецепторы для определения концентрации химических веществ и отправки сигналов для ответа. Некоторые типы гормонов, такие как эстроген и тестостерон, являются липидными стероидами, а не белками.
Другие функции белков
Белки выполняют важные функции во всех системах человеческого тела. В дыхательной системе гемоглобин (состоящий из четырех белковых субъединиц) транспортирует кислород для использования в клеточном метаболизме.Дополнительные белки в плазме крови и лимфе переносят питательные вещества и продукты обмена веществ по всему телу. Белки актин и тубулин образуют клеточные структуры, а кератин образует структурную опору для мертвых клеток, которые становятся ногтями и волосами. Антитела, также называемые иммуноглобинами, помогают распознавать и уничтожать чужеродные патогены в иммунной системе. Актин и миозин позволяют мышцам сокращаться, а альбумин питает раннее развитие эмбриона или проростка.
Рисунок: Тубулин : структурный белок тубулин, окрашенный в красный цвет в клетках мыши.Структура и функции белков
Белки — очень важные молекулы, которые необходимы всем живым организмам. По сухому весу белки — самая крупная единица клеток. Белки участвуют практически во всех клеточных функциях, и каждой роли отводится отдельный тип белка, задачи которого варьируются от общей клеточной поддержки до передачи сигналов и передвижения. Всего существует семь типов белков.
Белки
Синтез белка
Белки синтезируются в организме посредством процесса, называемого трансляцией . Трансляция происходит в цитоплазме и включает преобразование генетических кодов в белки. Генетические коды собираются во время транскрипции ДНК, где ДНК расшифровывается в РНК. Затем клеточные структуры, называемые рибосомами, помогают транскрибировать РНК в полипептидные цепи, которые необходимо модифицировать, чтобы они стали функционирующими белками.
Аминокислоты и полипептидные цепи
Аминокислоты являются строительными блоками всех белков, независимо от их функции.Белки обычно представляют собой цепочку из 20 аминокислот. Человеческое тело может использовать комбинации этих 20 аминокислот для производства любого необходимого ему белка. Большинство аминокислот следуют структурному шаблону, в котором альфа-углерод связан со следующими формами:
Среди различных типов аминокислот «вариабельная» группа наиболее ответственна за вариации, поскольку все они имеют водородные, карбоксильные группы и связи аминогруппы.
Аминокислоты соединяются посредством синтеза дегидратации, пока не образуют пептидные связи. Когда несколько аминокислот связаны между собой этими связями, образуется полипептидная цепь. Одна или несколько полипептидных цепей, скрученных в трехмерную форму, образуют белок.
Структура белка
Структура белка может быть глобулярной или волокнистой в зависимости от его конкретной роли (каждый белок является специализированным). Глобулярные белки обычно компактны, растворимы и имеют сферическую форму.Волокнистые белки обычно имеют удлиненную форму и нерастворимы. Глобулярные и волокнистые белки могут иметь один или несколько типов белковых структур.
Существует четыре структурных уровня белка: первичный, вторичный, третичный и четвертичный. Эти уровни определяют форму и функцию белка и отличаются друг от друга степенью сложности полипептидной цепи. Первичный уровень является самым основным и рудиментарным, в то время как четвертичный уровень описывает сложные связи.
Отдельная белковая молекула может содержать один или несколько из этих уровней структуры белка, и структура и сложность белка определяют его функцию. Коллаген, например, имеет суперскрученную спиральную форму, длинную, тягучую, прочную и похожую на веревку — коллаген отлично подходит для обеспечения поддержки. Гемоглобин, с другой стороны, представляет собой сложенный и компактный глобулярный белок. Его сферическая форма полезна для маневрирования по кровеносным сосудам.
Типы белков
Всего существует семь различных типов белков, к которым относятся все белки.К ним относятся антитела, сократительные белки, ферменты, гормональные белки, структурные белки, запасные белки и транспортные белки.
Антитела
Антитела — это специализированные белки, которые защищают организм от антигенов или чужеродных захватчиков. Их способность перемещаться по кровотоку позволяет им использоваться иммунной системой для идентификации и защиты от бактерий, вирусов и других чужеродных злоумышленников в крови. Один из способов, которым антитела противодействуют антигенам, — это их иммобилизация, чтобы они могли быть уничтожены лейкоцитами.
Сократительные белки
Сократительные белки отвечают за сокращение и движение мышц. Примеры этих белков включают актин и миозин. Эукариоты, как правило, обладают обильным количеством актина, который контролирует сокращение мышц, а также процессы клеточного движения и деления. Миозин приводит в действие задачи, выполняемые актином, снабжая его энергией.
Ферменты
Ферменты — это белки, которые облегчают и ускоряют биохимические реакции, поэтому их часто называют катализаторами.Известные ферменты включают лактазу и пепсин, белки, которые известны своей ролью в заболеваниях пищеварительной системы и в специальных диетах. Непереносимость лактозы вызвана дефицитом лактазы — фермента, расщепляющего сахарную лактозу, содержащуюся в молоке. Пепсин — это пищеварительный фермент, который в желудке расщепляет белки в пище. Нехватка этого фермента приводит к расстройству пищеварения.
Другими примерами пищеварительных ферментов являются ферменты, присутствующие в слюне: амилаза слюны, калликреин слюны и лингвальная липаза — все они выполняют важные биологические функции.Амилаза слюны — это основной фермент слюны, который расщепляет крахмал на сахар.
Гормональные белки
Гормональные белки — это белки-мессенджеры, которые помогают координировать определенные функции организма. Примеры включают инсулин, окситоцин и соматотропин.
Инсулин регулирует метаболизм глюкозы, контролируя концентрацию сахара в крови в организме, окситоцин стимулирует схватки во время родов, а соматотропин — гормон роста, который стимулирует выработку белка в мышечных клетках.
Структурные белки
Структурные белки волокнистые и вязкие, что делает их идеальными для поддержки различных других белков, таких как кератин, коллаген и эластин.
Кератины укрепляют защитные покрытия, такие как кожа, волосы, иглы, перья, рога и клювы. Коллаген и эластин поддерживают соединительные ткани, такие как сухожилия и связки.
Белки хранения
Запасные белки резервируют аминокислоты для организма до тех пор, пока они не будут готовы к употреблению.Примеры запасных белков включают яичный альбумин, который содержится в яичных белках, и казеин, белок на основе молока. Ферритин — еще один белок, который хранит железо в транспортном белке, гемоглобине.
Транспортные белки
Транспортные белки — это белки-носители, которые перемещают молекулы из одного места в другое в организме. Гемоглобин является одним из них и отвечает за транспортировку кислорода через кровь через красные кровяные тельца. Цитохромы, другой тип транспортных белков, действуют в цепи переноса электронов как белки-переносчики электронов.
Что такое белки и для чего они нужны? — Биология муниципального колледжа Маунт-Худ 102
И у прокариот, и у эукариот основная цель ДНК — предоставить информацию, необходимую для создания белков, необходимых для того, чтобы клетка могла выполнять все свои функции. Белки — это большие сложные молекулы, которые играют важную роль в организме. Они выполняют большую часть работы в клетках и необходимы для структуры, функции и регулирования тканей и органов тела.
Белки состоят из сотен или тысяч более мелких единиц, называемых аминокислотами, которые связаны друг с другом длинными цепями.Существует 20 различных типов аминокислот, которые можно комбинировать для получения белка. Последовательность аминокислот определяет уникальную трехмерную структуру каждого белка и его конкретную функцию.
Белки можно описать в соответствии с их широким спектром функций в организме, перечисленных в алфавитном порядке:
| Функция | Описание |
| Антитело
| Антитела связываются с определенными инородными частицами, такими как вирусы и бактерии, чтобы защитить организм. |
| Фермент
| Ферменты осуществляют почти все тысячи химических реакций, протекающих в клетках. Они также помогают формированию новых молекул, считывая генетическую информацию, хранящуюся в ДНК. |
| Посланник
| Белки-мессенджеры, такие как некоторые типы гормонов, передают сигналы для координации биологических процессов между различными клетками, тканями и органами. |
| Конструктивный элемент
| Эти белки обеспечивают структуру и поддержку клеток. В большем масштабе они также позволяют телу двигаться. |
| Транспортировка / хранение
| Эти белки связывают и переносят атомы и небольшие молекулы внутри клеток и по всему телу. |
Вы могли заметить, что «источник энергии» не был указан среди функций белков.Это связано с тем, что белки в нашем рационе обычно расщепляются на отдельные аминокислоты, которые затем наши клетки собирают в наши собственные белки. На самом деле люди не могут вырабатывать некоторые аминокислоты внутри наших собственных клеток — они необходимы нам в нашем рационе (это так называемые «незаменимые» аминокислоты). Наши клетки могут переваривать белки для высвобождения энергии, но обычно это происходит только тогда, когда углеводы или липиды недоступны.
Рис. 4: Примеры продуктов с высоким содержанием белка.(«Белок» Национального института рака находится в открытом доступе)Функции белков очень разнообразны, потому что они состоят из 20 различных химически различных аминокислот, которые образуют длинные цепи, и аминокислоты могут располагаться в любом порядке. Функция белка зависит от формы белка. Форма белка определяется порядком аминокислот. Белки часто состоят из сотен аминокислот и могут иметь очень сложную форму, потому что существует очень много различных возможных порядков для 20 аминокислот!
Рисунок 5: Основные уровни структуры белка.

 К симптомам заболевания можно отнести: отёки, вялость, апатию, низкую массу тела, асцит, задержку развития, иммунодефицит, пониженное содержание белков в крови. Прогноз при возникновении этого заболевания неблагоприятный и очень часто больные умирают. Чаще всего развивается у детей от 1го до 4-х лет. Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами.
К симптомам заболевания можно отнести: отёки, вялость, апатию, низкую массу тела, асцит, задержку развития, иммунодефицит, пониженное содержание белков в крови. Прогноз при возникновении этого заболевания неблагоприятный и очень часто больные умирают. Чаще всего развивается у детей от 1го до 4-х лет. Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами.