Железо — Википедия
| Железо | |
|---|---|
| ← Марганец | Кобальт → | |
| ковкий, вязкий металл серебристо-белого цвета | |
Сверхчистое железо | |
| Название, символ, номер | Железо / Ferrum (Fe), 26 |
| Атомная масса (молярная масса) | 55,845(2)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d6 4s2 |
| Радиус атома | 126 пм |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+3e) 64 (+2e) 74 пм |
| Электроотрицательность | 1,83 (шкала Полинга) |
| Электродный потенциал | Fe←Fe3+ −0,04 В Fe←Fe2+ −0,44 В |
| Степени окисления | 6, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 759,1 (7,87) кДж/моль (эВ) |
| Плотность (при н. у.) | 7,874 г/см³ |
| Температура плавления | 1812 K (1538,85 °C) |
| Температура кипения | 3134 K (2861 °C) |
| Уд. теплота плавления | 247,1 кДж/кг 13,8 кДж/моль |
| Уд. теплота испарения | ~6088 кДж/кг ~340 кДж/моль |
| Молярная теплоёмкость | 25,14[2] Дж/(K·моль) |
| Молярный объём | 7,1 см³/моль |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 2,866 Å |
| Температура Дебая | 460 K |
| Теплопроводность | (300 K) 80,4 Вт/(м·К) |
| Номер CAS | 7439-89-6 |
Желе́зо (Fe от лат. Ferrum) — элемент восьмой группы (по старой классификации — побочной подгруппы восьмой группы) четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Один из самых распространённых в земной коре металлов: второе место после алюминия.
Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Собственно железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего — в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al
Железо как инструментальный материал известно с древнейших времён. Самые древние изделия из железа, найденные при археологических раскопках, датируются 4-м тысячелетием до н. э. и относятся к древнешумерской и древнеегипетской цивилизациям. Это изготовленные из метеоритного железа, то есть сплава железа и никеля (содержание последнего колеблется от 5 до 30 %), украшения из египетских гробниц (около 3800 года до н. э.) и кинжал из шумерского города Ура (около 3100 года до н. э.). От небесного происхождения метеоритного железа происходит, видимо, одно из названий железа в греческом и латинском языках: «сидер» (что значит «звёздный»).
Первыми освоили метод выплавки железа хатты. На это указывает древнейшее (2-е тысячелетие до н. э.) упоминание железа в текстах хеттов, основавших свою империю на территории хаттов (современной Анатолии в Турции). Так, в тексте хеттского царя Анитты (около 1800 года до н. э.) говорится:
Когда на город Пурусханду в поход я пошёл, человек из города Пурусханды ко мне поклониться пришёл (…?) и он мне 1 железный трон и 1 железный скипетр (?) в знак покорности (?) преподнёс…
В древности мастерами железных изделий слыли халибы. В легенде об аргонавтах (их поход в Колхиду состоялся примерно за 50 лет до троянской войны) рассказывается, что царь Колхиды Эет дал Ясону железный плуг, чтобы он вспахал поле Ареса, и описываются его подданные халиберы:
Они не пашут землю, не сажают плодовые деревья, не пасут стада на тучных лугах; они добывают руду и железо из необработанной земли и выменивают на них продукты питания. День не начинается для них без тяжкого труда, в темноте ночи и густом дыму проводят они, работая весь день…
Аристотель описал их способ получения стали: «халибы несколько раз промывали речной песок их страны — тем самым выделяя чёрный шлих (тяжёлая фракция, состоящая в основном из магнетита и гематита), и плавили в печах; полученный таким образом металл имел серебристый цвет и был нержавеющим».
В качестве сырья для выплавки стали использовались магнетитовые пески, которые часто встречаются по всему побережью Чёрного моря: эти магнетитовые пески состоят из смеси мелких зёрен магнетита, титано-магнетита или ильменита, и обломков других пород, так что выплавляемая халибами сталь была легированной, и имела превосходные свойства. Такой своеобразный способ получения железа говорит о том, что халибы лишь распространили железо как технологический материал, но их способ не мог быть методом повсеместного промышленного производства железных изделий. Однако их производство послужило толчком для дальнейшего развития металлургии железа.
Климент Александрийский в своём энциклопедическом труде «Строматы» упоминает, что по греческим преданиям железо (видимо, выплавка его из руды) было открыто на горе Иде — так называлась горная цепь возле Трои (в Илиаде она упоминается как гора Ида, с которой Зевс наблюдал за битвой греков с троянцами). Произошло это через 73 года после Девкалионова потопа, а этот потоп, согласно Паросской хронике, был в 1528 году до н. э., то есть метод выплавки железа из руды был открыт примерно в 1455 году до н. э. Однако из описания Климента не ясно, говорит ли он именно об этой горе в Передней Азии (Ида Фригийская у Вергилия), или же о горе Ида на острове Крит, о которой римский поэт Вергилий в Энеиде пишет как о прародине троянцев:
Остров Юпитера, Крета, лежит средь широкого моря,
Нашего племени там колыбель, где высится Ида…
Более вероятно, что Климент Александрийский говорит именно о фригийской Иде возле Трои, так как там были найдены древние железные копи и очаги железоделательного производства. Первое письменное свидетельство о железе имеется в глиняных табличках архива египетских фараонов Аменхотепа III и Эхнатона, и относится к тому же времени (1450—1400 год до н. э.). Там упоминается о выделке железа на юге Закавказья, которое греки называли Колхидой (и возможно, что слово «kolhidos» может быть модификацией слова «halibos») — а именно, что царь страны Митанни и властитель Армении и Южного Закавказья послал египетскому фараону Аменхотепу II «вместе с 318 наложницами кинжалы и кольца из хорошего железа». Такие же подарки фараонам дарили и хетты.
В самой глубокой древности железо ценилось дороже золота, и по описанию Страбона, у африканских племён за 1 фунт железа давали 10 фунтов золота, а по исследованиям историка Г. Арешяна стоимости меди, серебра, золота и железа у древних хеттов были в соотношении 1 : 160 : 1280 : 6400. В те времена железо использовалось как ювелирный металл, из него делали троны и другие регалии царской власти: например, в библейской книге Второзаконие 3,11 описан «одр железный» рефаимского царя Ога.
В гробнице Тутанхамона (около 1350 года до н. э.) было найдено девятнадцать предметов из железа, включая кинжал из железа в золотой оправе — возможно, подаренный хеттами в дипломатических целях. Но хетты не стремились к широкому распространению железа и его технологий, что видно и из дошедшей до нас переписки египетского фараона Тутанхамона и его тестя Хаттусиля — царя хеттов. Фараон просит прислать побольше железа, а царь хеттов уклончиво отвечает, что запасы железа иссякли, а кузнецы заняты на сельскохозяйственных работах, поэтому он не может выполнить просьбу царственного зятя, и посылает только один кинжал из «хорошего железа» (то есть стали). Как видно, хетты старались использовать свои знания для достижения военных преимуществ, и не давали другим возможности сравняться с ними. Видимо, поэтому железные изделия получили широкое распространение только после Троянской войны и падения державы хеттов, когда благодаря торговой активности греков технология железа стала известной многим, и были открыты новые месторождения железа и рудники. Так на смену «Бронзовому» веку настал век «Железный».
По описаниям Гомера, хотя во время Троянской войны (примерно 1250 год до н. э.) оружие было в основном из меди и бронзы, но железо уже было хорошо известно и пользовалось большим спросом, хотя больше как драгоценный металл. Например, в 23-й песне «Илиады» Гомер рассказывает, что Ахилл наградил диском из железной крицы победителя в соревновании по метанию диска. Это железо ахейцы добывали у троянцев и сопредельных народов (Илиада 7,473), в том числе у халибов, которые воевали на стороне троянцев:
Прочие мужи ахейские меной вино покупали,
Те за звенящую медь, за седое железо меняли,
Те за воловые кожи или волов круторогих,
Те за своих полонёных. И пир уготовлен весёлый…
Возможно, железо было одной из причин, побудивших греков-ахейцев двинуться в Малую Азию, где они узнали секреты его производства. А раскопки в Афинах показали, что уже около 1100 года до н. э. и позднее уже широко были распространены железные мечи, копья, топоры, и даже железные гвозди. В библейской книге Иисуса Навина 17,16 (ср. Судей 14,4) описывается, что филистимляне (библейские «PILISTIM», а это были протогреческие племена, родственные позднейшим эллинам, в основном пеласги) имели множество железных колесниц, то есть в это время железо уже стало широко применяться в больших количествах.
Гомер в «Илиаде» и «Одиссее» называет железо «многотрудный металл», и описывает закалку орудий:
Расторопный ковач, изготовив топор иль секиру,
В воду металл, раскаливши его, чтоб двойную
Он крепость имел, погружает…
Гомер называет железо многотрудным, потому что в древности основным методом его получения был сыродутный процесс: перемежающиеся слои железной руды и древесного угля прокаливались в специальных печах (горнах — от древнего «Horn» — рог, труба, первоначально это была просто труба, вырытая в земле, обычно горизонтально в склоне оврага). В горне окислы железа восстанавливаются до металла раскалённым углём, который отбирает кислород, окисляясь до окиси углерода, и в результате такого прокаливания руды с углём получалось тестообразное кричное (губчатое) железо. Крицу очищали от шлаков ковкой, выдавливая примеси сильными ударами молота. Первые горны имели сравнительно низкую температуру — заметно меньше температуры плавления чугуна, поэтому железо получалось сравнительно малоуглеродистым. Чтобы получить крепкую сталь, приходилось много раз прокаливать и проковывать железную крицу с углём, при этом поверхностный слой металла дополнительно насыщался углеродом и упрочнялся. Так получалось «хорошее железо» — и хотя это требовало больших трудов, изделия, полученные таким способом, были существенно более крепкими и твёрдыми, чем бронзовые.
В дальнейшем научились делать более эффективные печи (в русском языке — домна, домница) для производства стали, и применили меха для подачи воздуха в горн. Уже римляне умели доводить температуру в печи до плавления стали (около 1400 °C, а чистое железо плавится при 1535 °C). При этом образуется чугун с температурой плавления 1100—1200 °C, очень хрупкий в твёрдом состоянии (даже не поддающийся ковке) и не обладающий упругостью стали. Первоначально его считали вредным побочным продуктом (англ. pig iron, по-русски, свинское железо, чушки, откуда, собственно, и происходит слово чугун), но потом обнаружилось, что при повторной переплавке в печи с усиленным продуванием через него воздуха чугун превращается в сталь хорошего качества, так как лишний углерод выгорает. Такой двухстадийный процесс производства стали из чугуна оказался более простым и выгодным, чем кричный, и этот принцип используется без особых изменений многие века, оставаясь и до наших дней основным способом производства железных материалов[4].
Праславянское *želězo (белор. жалеза, укр. залізо, ст.‑слав. желѣзо, болг. желязо, сербохорв. жељезо, польск. żelazo, чеш. železo, словен. železo) имеет ясные параллели в балтийских языках (лит. geležis, латыш. dzelzs). Слово является однокоренным словам «железа» и «желвак»; и имеет смысл «округлый камень, окатыш, блямба»[5].
Имеется несколько версий дальнейшей этимологии этого балтославянского слова.
Одна из них связывает праслав. *želězo с греческим словом χαλκός, что означало железо и медь, согласно другой версии *želězo родственно словам *žely «черепаха» и *glazъ «скала», с общей семой «камень»[6][7]. Третья версия предполагает древнее заимствование из неизвестного языка[8].
Романские языки (итал. ferro, фр. fer, исп. hierro, порт. ferro, рум. fier) продолжают лат. ferrum. Латинское ferrum (< *ferzom), возможно, заимствовано из какого-то восточного языка, скорее всего, из финикийского. Ср. ивр. barzel, шумерск. barzal, ассирийск. parzilla[9]. Отсюда же, вероятно, баскское burdina.
Германские языки заимствовали название железа (готск. eisarn, англ. iron, нем. Eisen, нидерл. ijzer, дат. jern, швед. järn) из кельтских[10].
Пракельтское слово *isarno- (> др.-ирл. iarn, др.-брет. hoiarn), вероятно, восходит к пра-и.е. *h1esh2r-no- «кровавый» с семантическим развитием «кровавый» > «красный» > «железо». Согласно другой гипотезе данное слово восходит к пра-и.е. *(H)ish2ro- «сильный, святой, обладающий сверхъестественной силой»[11].
Древнегреческое слово σίδηρος, возможно, было заимствовано из того же источника, что и славянское, германское и балтийское слова для серебра[12].
Название природного карбоната железа (сидерита) происходит от лат. sidereus — звёздный; действительно, первое железо, попавшее в руки людям, было метеоритного происхождения. Возможно, это совпадение не случайно. В частности, древнегреческое слово сидерос (σίδηρος) для железа и латинское sidus, означающее «звезда», вероятно, имеют общее происхождение.
ru.wikipedia.org
Железо. Описание, свойства, происхождение и применение металла

Чистое железо (99,97%), очищенное методом электролиза
Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
СТРУКТУРА
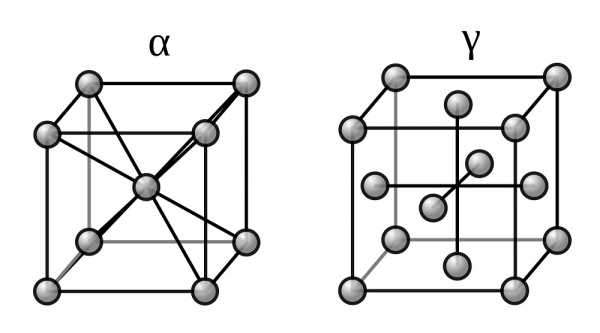
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

Железная руда
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

Железо
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10−5-1·10−8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
ПРОИСХОЖДЕНИЕ

Самородное железо
Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) — Fe
| Молекулярный вес | 55.85 г/моль |
| Происхождение названия | возможно англо-саксонского происхождения |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.57
| Strunz (8-ое издание) | 1/A.07-10 |
| Nickel-Strunz (10-ое издание) | 1.AE.05 |
| Dana (7-ое издание) | 1.1.17.1 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | железно-черный |
| Цвет черты | серый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | несовершенная по {001} |
| Твердость (шкала Мооса) | 4,5 |
| Излом | в зазубринах |
| Прочность | ковкий |
| Плотность (измеренная) | 7.3 — 7.87 г/см3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | ферромагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | изотропный |
| Цвет в отраженном свете | белый |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | m3m (4/m 3 2/m) — изометрический — гексаоктаэдральный |
| Пространственная группа | Im3m (I4/m 3 2/m) |
| Сингония | кубическая |
| Параметры ячейки | a = 2.8664Å |
| Двойникование | (111) также в пластинчатых массах {112} |
| Морфология | в маленьких пузырьках |
Интересные статьи:
mineralpro.ru 13.07.2016mineralpro.ru
Железо — общая характеристика элемента, химические свойства железа и его соединений
 Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия). Металл средней активности, восстановитель.
Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия). Металл средней активности, восстановитель.
Основные степени окисления — +2, +3
Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Химические свойства простого вещества — железа:
Ржавление и горение в кислороде
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O2 + 6H2 O → 4Fe(OH)3
Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II, III):
3Fe + 2O2 → Fe3O4
3Fe+2O2→(Fe IIFe2III)O4 (160 °С)
2) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O –t°→ Fe3O4 + 4H2
3) Железо реагирует с неметаллами при нагревании:
2Fe+3Cl2→2FeCl3 (200 °С)
2Fe + 3Br2 –t°→ 2FeBr3
Fe + S –t°→ FeS (600 °С)
Fe+2S → Fe+2(S2-1) (700°С)
4) В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НСl и Н2SO4, при этом образуются соли железа(II) и выделяется водород:
Fe + 2HCl → FeCl2 + H2 (реакции проводятся без доступа воздуха, иначе Fe+2 постепенно переводится кислородом в Fe+3 )
Fe + H2SO4(разб.) → FeSO4 + H2
В концентрированных кислотах–окислителях железо растворяется только при нагревании, оно сразу переходит в катион Fе3+:
2Fe + 6H2SO4(конц.) –t°→ Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3(конц.) –t°→ Fe(NO3)3 + 3NO2 + 3H2O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
Железный гвоздь, погруженный в голубоватый раствор медного купороса, постепенно покрывается налетом красной металлической меди
5) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 → FeSO4 + Cu
6)
Амфотерность железа проявляется только в концентрированных щелочах при кипячении:
Fе + 2NaОН (50 %) + 2Н2O= Nа2[Fе(ОН)4]↓+ Н2↑
и образуется осадок тетрагидроксоферрата(II) натрия.
Техническое железо — сплавы железа с углеродом: чугун содержит 2,06-6,67 % С, сталь 0,02-2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Мn, Ni, Сr), что придает сплавам железа технически полезные свойства — твердость, термическую и коррозионную стойкость, ковкость и др.
Доменный процесс производства чугуна
Доменный процесс производства чугуна составляют следующие стадии:
а) подготовка (обжиг) сульфидных и карбонатных руд — перевод в оксидную руду:
FeS2→Fe2O3 (O2,800°С, -SO2) FeCO3→Fe2O3 (O2,500-600°С, -CO2)
б) сжигание кокса при горячем дутье:
С(кокс) + O2 (воздух) →СO2 (600—700°С) СO2 + С(кокс) ⇌ 2СО (700—1000 °С)
в) восстановление оксидной руды угарным газом СО последовательно:
Fe2O3→(CO) (FeIIFe2III)O4→(CO) FeO→(CO) Fe
г) науглероживание железа (до 6,67 % С) и расплавление чугуна:
Fе(т)→(C(кокс) 900—1200°С)Fе(ж) (чугун, t пл 1145°С)
В чугуне всегда в виде зерен присутствуют цементит Fe2С и графит.
Производство стали
Передел чугуна в сталь проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева; температура процесса 1700-2000 °С. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (СО2, SО2), либо связываются в легко отделяемый шлак — смесь Са3(РO4)2 и СаSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Получение чистого железа в промышленности — электролиз раствора солей железа, например:
FеСl2→ Fе↓ + Сl2↑ (90°С) (электролиз)
(существуют и другие специальные методы, в том числе восстановление оксидов железа водородом).
Чистое железо применяется в производстве специальных сплавов, при изготовлении сердечников электромагнитов и трансформаторов, чугун — в производстве литья и стали, сталь — как конструкционный и инструментальный материалы, в том числе износо-, жаро- и коррозионно-стойкие.
Оксид железа(II) FеО. Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Fе2+ O2-. При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций:
4FеО ⇌(FeIIFe2 III) + Fе (560—700 °С , 900—1000°С)
FеО + 2НС1 (разб.) = FеС12 + Н2O
FеО + 4НNO3 (конц.) = Fе(NO3)3 +NO2↑ + 2Н2O
FеО + 4NаОН =2Н2O + Nа4FеO3(красн.) триоксоферрат(II) (400—500 °С)
FеО + Н2 =Н2O + Fе (особо чистое) (350°С)
FеО + С(кокс) = Fе + СО (выше 1000 °С)
FеО + СО = Fе + СO2 (900°С)
4FеО + 2Н2O(влага) + O2(воздух) →4FеО(ОН) (t)
6FеО + O2 = 2(FeIIFe2III )O4 (300—500°С)
Получение в лаборатории: термическое разложение соединений железа (II) без доступа воздуха:
Fе(ОН)2 = FеО + Н2O (150-200 °С)
FеСОз = FеО + СO2 (490-550 °С)
Оксид дижелеза (III) – железа(II) (FeIIFe2III )O4 . Двойной оксид. Черный, имеет ионное строение Fe2+(Fе3+)2(O2-)4. Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок (железный сурик), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий (чернение, воронение). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe3O4 не рекомендуется. Уравнения важнейших реакций:
2(FeIIFe2 III )O4 = 6FеО + O2 (выше 1538 °С)
(FeIIFe2III )O4 + 8НС1 (разб.) = FеС12 + 2FеС13 + 4Н2O
(FeIIFe2III )O4 +10НNO3 (конц.) =3Fе(NO3)3 + NO2↑+ 5Н2O
(FeIIFe2III )O4 + O2 (воздух) = 6Fе2O3 (450-600°С)
(FeIIFe2III )O4 + 4Н2 = 4Н2O + 3Fе (особо чистое, 1000 °С)
(FeIIFe2III )O4 + СО =ЗFеО + СO2 (500—800°C)
(FeIIFe2 III )O4 + Fе ⇌4FеО (900—1000 °С , 560—700 °С)
Получение: сгорание железа (см.) на воздухе.
В природе — оксидная руда железа магнетит.
Оксид железа(III) Fе2О3. Амфотерный оксид с преобладанием основных свойств. Красно-коричневый, имеет ионное строение (Fе 3+)2(O2-)3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Fе2O3 nН2О. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
Уравнения важнейших реакций:
6Fе2O3 = 4(FeIIFe2III )O4 +O2 (1200—1300 °С)
Fе2O3 + 6НС1 (разб.) →2FеС13 + ЗН2O (t) (600°С,р)
Fе2O3 + 2NaОН (конц.) →Н2O+ 2NаFеO2 (красн.) диоксоферрат(III)
Fе2О3 + МО=(МIIFе2III)O4 (М=Сu, Мn, Fе, Ni, Zn)
Fе2O3 + ЗН2 =ЗН2O+ 2Fе (особо чистое, 1050—1100 °С)
Fе2O3 + Fе = ЗFеО (900 °С)
3Fе2O3 + СО = 2(FeIIFе2III)O4 + СO2 (400—600 °С)
Получение в лаборатории — термическое разложение солей железа (III) на воздухе:
Fе2(SO4)3 = Fе2O3 + 3SO3 (500-700 °С)
4{Fе(NO3)3 9 Н2O} = 2FеaO3 + 12NO2+ 3O2 + 36Н2O (600-700 °С)
В природе — оксидные руды железа гематит Fе2O3 и лимонит Fе2O3 nН2O
Гидроксид железа (II) Fе(ОН)2. Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Fе — ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Уравнения важнейших реакций:
Fе(OН)2 = FеО + Н2O (150-200 °С, в атм.N2)
Fе(ОН)2 + 2НС1 (разб.) =FеС12 + 2Н2O
Fе(ОН)2 + 2NаОН (> 50%) = Nа2[Fе(ОН)4] ↓(сине-зеленый) (кипячение)
4Fе(ОН)2 (суспензия) + O2 (воздух) →4FеО(ОН)↓ + 2Н2O (t)
2Fе(ОН)2 (суспензия) +Н2O2 (разб.) = 2FеО(ОН)↓ + 2Н2O
Fе(ОН)2 + КNO3(конц.) = FеО(ОН)↓ + NO↑+ КОН (60 °С)
Получение: осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере:
Fе2+ + 2OH (разб.) = Fе(ОН)2↓
Fе2+ + 2(NH3Н2O) = Fе(ОН)2↓+ 2NH4
Метагидроксид железа FеО(ОН). Амфотерный гидроксид с преобладанием основных свойств. Светло-коричневый, связи Fе — О и Fе — ОН преимущественно ковалентные. При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Fе2O3 nН2O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в FеО(ОН). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Fе(ОН)2. Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Соединение состава Fе(ОН)3 не известно (не получено).
Уравнения важнейших реакций:
Fе2O3. nН2O→(200-250 °С, —H2O) FеО(ОН)→( 560-700° С на воздухе , -h3O) →Fе2О3
FеО(ОН) + ЗНС1 (разб.) =FеС13 + 2Н2O
FeO(OH)→Fe2O3.nH2O -коллоид (NаОН (конц.))
FеО(ОН)→Nа3[Fе(ОН)6] белый , Nа5[Fе(OН)8желтоватый (75 °С, NаОН( т))
2FеО(ОН) + Fе(ОН)2=( FeIIFe2III )O4 + 2Н2O (600—1000 °С)
2FеО(ОН) + ЗН2 = 4Н2O+ 2Fе (особо чистое, 500—600 °С)
2FеО(ОН) + ЗВr2 + 10КОН = 2К2FеO4 + 6Н2O + 6КВr
Получение: осаждение из раствора солей железа(Ш) гидрата Fе2О3 nН2O и его частичное обезвоживание (см. выше).
В природе — оксидная руда железа лимонит Fе2O3 nН2О и минерал гётит FеО(ОН).
Феррат калия К2FеО4. Оксосоль. Красно-фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель.
Качественная реакция — образование красного осадка феррата бария. Применяется в синтезе ферритов — промышленно важных двойных оксидов железа (III) и других металлов.
Уравнения важнейших реакций:
4К2FеO4= 4КFеO2 + 3O2 + 2К2O (700 °С)
4К2FеO4 + 6Н2O (гор.) =4FeО(ОН)↓ + 8КОН + 3O2↑
FеО42- + 2OН+(разб.) =4Fе3+ + 3O2↑+10Н2O
FеО42- + 2(NH3. Н2O) →2FеО(ОН)↓ + N2↑+ 2Н2O+ 4OН—
FеО42- + Ва2+ = ВаFеO4 (красн.)↓ (в конц. КОН)
Получение: образуется при окислении соединений железа, например метагидроксида FеО(ОН), бромной водой, а также при действии сильных окислителей (при спекании) на железо
Fе + 2КОН + 2КNO3 = К2FеO4 + 3КNO2+ H2O (420 °С)
и электролизе в растворе:
электролиз
Fе + 2КОН (конц.) + 2Н2O→ЗН2↑ + К2FеO4 ( электролиз)
(феррат калия образуется на аноде).
Качественные реакции на ионы Fе2+ и Fе3+
Обнаружение ионов Fе2+ и Fе3+в водном растворе проводят с помощью реактивов К3[Fе(СN)6] и К4[Fе(СN)6] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, КFеIII[FеII (СN)6]. В лаборатории этот осадок называют берлинская лазурь, или турнбуллева синь:
Fе2+ + К+ + [Fе(СN)6]3- = КFеIII[FеII (СN) 6]↓
Fе3+ + К+ + [Fе(СN)6]4- = КFеIII[FеII (СN) 6]↓
Химические названия исходных реактивов и продукта реакций:
К3FеIII[Fе(СN) 6]- гексацианоферрат (III) калия
К4FеIII[Fе (СN) 6]- гексацианоферрат (II) калия
КFеIII[FеII (СN) 6]- гексацианоферрат (II) железа (Ш) калия
Кроме того, хорошим реактивом на ионы Fе3+ является тиоцианат-ион NСS—, железо (III) соединяется с ним, и появляется ярко-красная («кровавая») окраска:
Fе3+ + 6NСS— = [Fе(NСS)6]3-
Этим реактивом (например, в виде соли КNСS) можно обнаружить даже следы железа (III) в водопроводной воде, если она проходит через железные трубы, покрытые изнутри ржавчиной.


himege.ru
Виды железа — Эра водолея
Каким образом попадает в воду железо и как лучше с ним бороться?
Железо — один из самых распространенных природных элементов. Железо присутствует в большинстве вулканических пород, оно также входит в состав пород, цементирующих песчаники. Железо в значительных количествах содержится в различных глинах, а в осадочных карбонатных породах (например, известняк) встречается только в виде незначительных примесей. Неудивительно, что проблема присутствия в природной воде железа является одной из самых распространенных. C такой водой возникает целый ряд проблем как при бытовом, так и при коммерческо-промышленном использовании.
Уже при концентрациях железа свыше 0,3 мг/л такая вода вызывает образование ржавых потеков, способна изменить цвет тканей при их стирке и т. п. При больших концентрациях у воды возникает характерный металлический привкус, что отрицательно сказывается на качестве напитков (чай, кофе и т. п.). В некоторых случаях может пострадать даже качество еды, приготовленной на воде с высоким содержанием железа. Все это делает задачу по анализу воды и очистке воды от железа очень актуальной как для питьевого и хозяйственно-бытового применения, так и для промышленного использования.
Железо существует в природе в различных формах (в зависимости от валентности): Fe°, Fe+2, Fe+3, а также в виде различных сложных химических соединений.
- Элементарное железо (Fe°). Элементарное, или металлическое железо, безусловно, нерастворимо в воде. В присутствии влаги и кислорода воздуха окисляется до трехвалентного, образуя нерастворимый оксид Fe2O3(процесс, известный в быту как «ржавление»).
- Двухвалентное железо (Fe+2). Почти всегда находится в воде в растворенном состоянии, хотя возможны случаи (при определенных редко встречающихся в природной воде уровнях рН), когда гидроксид железа Fe(OH)2 способен выпадать в осадок.
- Трехвалентное железо (Fe+3). Гидроксид железа Fe(OH)3 нерастворим в воде (кроме случая очень низкого рН). Хлорид FeCl3 и сульфат Fe2(SO4)3 трехвалентного железа растворимы и могут образовываться даже в слабощелочных водах.
- Органическое железо. Органическое железо встречается в воде в разных формах и в составе различных комплексов. Органические соединения железа, как правило, растворимы или имеют коллоидную структуру и очень трудно поддаются удалению.
Различают следующие виды органического железа:
- Бактериальное железо. Некоторые виды бактерий способны использовать энергию растворенного железа в процессе своей жизнедеятельности. При этом происходит преобразование двухвалентного железа в трехвалентное, которое сохраняется в желеобразной оболочке вокруг бактерии.
- Коллоидное железо. Коллоиды — это нерастворимые частицы очень малого размера (менее 1 микрона), в силу чего они трудно поддаются фильтрации на гранулированных фильтрующих материалах. Крупные органические молекулы (такие, как танины и лигнины) также попадают в эту категорию. Коллоидные частицы из-за своего малого размера и высокого поверхностного заряда (отталкивающего частицы друг от друга, препятствуя их укрупнению) создают в воде суспензии и не осаждаются, находясь во взвешенном состоянии.
- Растворимое органическое железо. Так же, как, например, полифосфаты, способны связывать и удерживать в растворе кальций и другие металлы, некоторые органические молекулы способны связывать железо в сложные растворимые комплексы, называемые хелатами. Примером такого связывания может служить удерживающая железо порфириновая группа гемоглобина крови или удерживающий магний хлорофилл растений. Так, прекрасным хелатообразующим агентом является гуминовая кислота, играющая важную роль в почвенном ионообмене. Все вышеперечисленные виды железа «ведут» себя в воде по-разному.
Основные отличительные признаки приведены в таблице.
| Тип железа | Вода из под крана | Вода после отстаивания |
| Двухвалентное | Чистая | Красно-бурый осадок |
| Трехвалентное | Окрашена | Красно-бурый осадок |
| Коллоидное | Желто-бурая | Не образует осадка, не фильтруется |
| Растворенное органическое | Желто-бурая | — |
| Бактериальное | Опалесцирующая пленка, желеобразные образования в водопроводной системе | — |
Двухвалентное
Необходимо только отметить, что «беда никогда не ходит одна» и на практике почти всегда встречается сочетание нескольких или даже всех видов железа. Учитывая, что нет единых утвержденных методик определения органического, коллоидного и бактериального железа, то в деле подбора эффективного метода (скорее, комплекса методов) очистки воды от железа очень много зависит от практического опыта специалиста, занимающегося водоочисткой.
Удаление из воды железа — без преувеличения одна из самых сложных задач в водоочистке. Даже беглый обзор существующих способов борьбы с железом позволяет сделать обоснованный вывод о том, что на данный момент не существует универсального экономически оправданного метода, применимого во всех случаях жизни. Каждый из существующих методов применим только в определенных пределах и имеет как достоинства, так и существенные недостатки.
Итак, к существующим методам удаления железа можно отнести:
- Окисление (кислородом воздуха или аэрацией, хлором, перманганатом калия, перекисью водорода, озоном) с последующим осаждением (с коагуляцией или без нее) и фильтрацией.
Традиционный метод, применяемый уже много десятилетий. Так как реакция окисления железа требует довольно длительного времени, то использование для окисления только воздуха требует больших резервуаров, в которых можно обеспечить нужное время контакта. Это наиболее старый способ и используется только на крупных муниципальных системах. Добавление же специальных окислителей ускоряет процесс. Наиболее широко применяется хлорирование, так как параллельно позволяет решать проблему с дезинфекцией. Наиболее передовым и сильным окислителем на сегодняшний день является озон. Однако установки для его производства довольно сложны, дороги и требуют значительных затрат электроэнергии, что ограничивает его применение. Необходимо отметить также, что в концентрированном виде (например, на точке ввода в воду) озон является ядом (как, собственно говоря, и многие другие окислители) и требует очень внимательного к себе отношения.
Частицы окисленного железа имеют достаточно малый размер (1-3 мкм) и поэтому осаждаются достаточно долго, поэтому применяют специальные химические вещества-коагулянты, способствующие укрупнению частиц и их ускоренному осаждению. Применение коагулянтов необходимо также потому, что фильтрация на муниципальных очистных сооружениях осуществляется в основном на устаревших песчаных или антрацитовых осветлительных фильтрах (не способных задерживать мелкие частицы). Однако даже применение более современных фильтрующих засыпок (например, алюмосиликатов) не позволяет фильтровать частицы размером менее 20 микрон. Проблему могло бы решить применение специальной керамики, но она достаточно дорого стоит (так как не производится в России).
У всех перечисленных способов окисления есть ряд недостатков.
Во-первых, если не применять коагулянты, то процесс осаждения окисленного железа занимает долгое время, в противном же случае фильтрация некоагулированных частиц сильно затрудняется из-за их малого размера.
Во-вторых, эти методы окисления (в меньшей степени это относится к озону) слабо помогают в борьбе с органическим железом.В-третьих, наличие в воде железа часто (практически всегда) сопровождается наличием марганца. Марганец окисляется гораздо труднее, чем железо, и, кроме того, при значительно более высоких уровнях рН.
Все вышеперечисленные недостатки сделали невозможным применение этого метода в сравнительно небольших бытовых и коммерческо-промышленных системах, работающих на больших скоростях.
- Каталитическое окисление с последующей фильтрацией — наиболее распространенный на сегодняшний день метод удаления железа, применяемый в высокопроизводительных компактных системах. Суть метода заключается в том, что реакция окисления железа происходит на поверхности гранул специальной фильтрующей среды, обладающей свойствами катализатора (ускорителя химической реакции окисления).
Наибольшее распространение в современной водоподготовке нашли фильтрующие среды на основе диоксида марганца MnO2: Birm, Greensand, Filox, Pyrolox и др. Эти фильтрующие «засыпки» отличаются между собой как своими физическими характеристиками, так и содержанием диоксида марганца, и поэтому эффективно работают в разных диапазонах значений параметров, характеризующих воду. Однако принцип их работы одинаков. Железо (и в меньшей степени марганец) в присутствии диоксида марганца быстро окисляется и оседает на поверхности гранул фильтрующей среды. Впоследствии большая часть окисленного железа вымывается в дренаж при обратной промывке. Таким образом, слой гранулированного катализатора является одновременно и фильтрующей средой. Для улучшения процесса окисления в воду могут добавляться дополнительные химические окислители. Наиболее распространенным является перманганат калия KMnO4 («марганцовка»), так как его применение не только активизирует реакцию окисления, но и компенсирует «вымывание» марганца с поверхности гранул фильтрующей среды, то есть регенерирует ее. Используют как периодическую, так и непрерывную регенерацию.
Все системы на основе каталитического окисления с помощью диоксида марганца кроме специфических (не все из них работают по марганцу, почти все они имеют большой удельный вес и требуют больших расходов воды при обратной промывке) имеют и ряд общих недостатков.
Во-первых, они неэффективны в отношении органического железа. Более того, при наличии в воде любой из форм органического железа на поверхности гранул фильтрующего материала со временем образуется органическая пленка, изолирующая катализатор — диоксид марганца от воды. Таким образом, вся каталитическая способность фильтрующей засыпки сводится к нулю. Практически «на нет» сводится и способность фильтрующей среды удалять железо, так как в фильтрах этого типа просто не хватает времени для естественного протекания реакции окисления.
Во-вторых, системы этого типа все равно не могут справиться со случаями, когда содержание железа в воде превышает 10-15 мг/л, что совсем не редкость. Присутствие в воде марганца только усугубляет ситуацию.
- Ионный обмен как метод обработки воды известен довольно давно и применялся (да и теперь применяется) в основном для умягчения воды. Раньше для реализации этого метода использовались природные иониты (сульфоугли, цеолиты). Однако с появлением синтетических ионообменных смол эффективность использования ионного обмена для целей водоочистки резко возросла.С точки зрения удаления из воды железа важен тот факт, что катиониты способны удалять из воды не только ионы кальция и магния, но и другие двухвалентные металлы, а значит и растворенное ухвалентное железо. Причем теоретически концентрации железа, с которыми могут справиться ионообменные смолы, очень велики.
Достоинством ионного обмена является также и то, что он «не боится» верного спутника железа — марганца, сильно осложняющего работу систем, основанных на использовании методов окисления. Главное же преимущество ионного обмена то, что из воды могут быть удалены железо и марганец, находящиеся в растворенном состоянии. То есть совсем отпадает необходимость в такой капризной и «грязной» (из-за необходимости вымывать ржавчину) стадии, как окисление.
eravodolei.ru
функции и роль, нормы содержания и признаки недостатка
Железа, которое содержится в теле человека, хватит на крупный гвоздь. Это приблизительно 2,5–4,5 грамм. Казалось бы, совсем немного. Тем не менее влияние железа на многие жизненно важные процессы огромно, и его недостаток (как и избыток) моментально сказывается на нашем самочувствии и может привести к серьезным последствиям.
Роль железа в организме: микроэлемент с важной миссией
У железа очень много функций. Вот основные из них:
- Транспортировка кислорода к тканям. Железо входит в состав гемоглобина — белка, из которого состоят красные кровяные тельца (эритроциты). Именно железо отвечает за захват кислорода, после чего эритроциты переносят его ко всем органам и системам организма. Эти же кровяные тельца (и снова при помощи железа!) подбирают отработанный углекислый газ и транспортируют его в легкие для утилизации. Без железа дыхательные процессы на клеточном уровне были бы просто невозможны.
- Метаболизм. Железо в организме человека является составной частью многих ферментов и белков, которые необходимы для обменных процессов — разрушения и утилизации токсинов, холестеринового обмена, превращения калорий в энергию. Оно также помогает иммунной системе организма справляться с агрессорами.
Нет ничего удивительного в том, что недостаток железа отражается на внешности, здоровье и самочувствии.
При дефиците этого элемента кожа становится бледной и сухой, волосы — тусклыми и слабыми, а ногти — ломкими. В уголках губ возникают незаживающие язвочки, а на кистях рук и ступнях — очень болезненные трещины.
По мере снижения количества железа в организме самочувствие ухудшается — пропадает аппетит, многие замечают дискомфорт при глотании. Иногда вкусы меняются самым странным образом, например, человеку очень хочется погрызть мел или пожевать бумагу.
Люди с нехваткой железа испытывают постоянный упадок сил — они даже просыпаются уставшими. Малейшие физические нагрузки вызывают сильную одышку — так сказывается недостаток кислорода. Другие типичные симптомы дефицита железа — головокружения и даже обмороки, сонливость, раздражительность, ухудшение памяти.
Для людей, страдающих нехваткой железа, типичны постоянные простуды и кишечные инфекции. Как мы уже говорили, железо принимает непосредственное участие в работе защитной системы организма, и при его дефиците иммунитет не может вовремя отражать атаки болезнетворных бактерий.
Наверняка многим эти симптомы покажутся очень знакомыми. Ничего удивительного: по статистике ВОЗ, примерно у 60% населения планеты отмечается недостаток железа в организме, а у 30% дефицит этого элемента так велик, что речь идет уже о железодефицитной анемии — состоянии, при котором значительно понижается уровень гемоглобина.
Интересный факт
Железодефицитная анемия — самый распространенный тип анемии, на нее приходится более 90% всех случаев.
Норма содержания, или Сколько железа мы «носим»?
Как уже было сказано, в нашем организме содержится 2,5–4,5 г железа, и его запас необходимо постоянно пополнять.
Женщинам требуется больше железа, чем мужчинам — это объясняется ежемесячными кровопотерями во время менструаций, а также некоторыми особенностями гормональной системы. В среднем женщина должна ежедневно получать 15 мг железа, а во время беременности и лактации — 20 мг и даже больше.
Мужчинам необходимо 10 мг железа ежедневно.
Детям и подросткам до 18 лет необходимо получать 5–15 мг железа в сутки — потребность в этом элементе повышается с возрастом.
Важно!
Рацион питания современного человека практически не позволяет получать достаточное количество железа с пищей. В среднем мы потребляем около 10–20% от ежедневной нормы железа. Остальное можно восполнить при помощи биодобавок и витаминных комплексов.
Ничто не дает такого точного представления об уровне железа в организме, как обычный биохимический анализ крови, который можно сделать в любой лаборатории.
Нормальный уровень железа для мужчин — от 11,64 до 30,43 мкмоль/л, у женщин — от 8,95 до 30,43 мкмоль/л. У новорожденных детей норма содержания железа в крови гораздо выше — от 17,9 до 44,8 мкмоль/л. Но уже к концу первого года жизни она понижается до 7,16–17,9 мкмоль/л, а к пубертатному периоду достигает взрослых показателей.
Недостаток и переизбыток железа в организме человека: причины и последствия
Избыток железа встречается гораздо реже, чем недостаток. Такая ситуация часто складывается при очень высоком содержании железа в питьевой воде, при болезнях печени и селезенки, а также при метаболических нарушениях. Избыток железа включает такие симптомы, как непрекращающиеся расстройства пищеварения (метеоризм, диареи и запоры, тошнота и рвота, изжога), упадок сил и головокружения, появление пигментации на коже. Если не предпринимать никаких мер, возможно развитие осложнений — артритов, диабета, заболеваний печени. Некоторые специалисты также полагают, что переизбыток железа — один из факторов риска при развитии онкологических заболеваний.
Недостаток железа диагностируется гораздо чаще. И, как правило, он вызван несбалансированной диетой, бедной этим элементом. Другие типичные причины недостатка железа в организме — его активный расход (во время роста, беременности и кормления грудью), кровопотери из-за травм, операций, внутренних кровотечений или обильных менструаций, гастриты, глистные инвазии и дисбактериозы (из-за этих болезней нарушается процесс всасывания железа), нехватка витаминов С и В12, без которых железо не усваивается, нарушения в работе щитовидной железы и отравление свинцом.
Снижение иммунитета, вызванное нехваткой железа, рано или поздно приводит к тому, что инфекционные заболевания приобретают хронический характер, и это одна из главных опасностей дефицита железа. Железодефицитная анемия — значительный фактор риска при развитии сердечной недостаточности и заболеваний печени. Особенно опасна анемия для беременных — у матерей, страдавших ею во время вынашивания ребенка, часто рождаются дети с врожденной анемией.
Как поднять уровень железа?
Даже если анализ крови показал дефицит железа в организме, не стоит немедленно бежать в аптеку за минеральным комплексом и считать, что вопрос закрыт. Необходима консультация врача, так как недостаток железа в организме может говорить о наличии серьезных заболеваний, при которых всасывание железа нарушено.
Если дефицит железа в организме вызван неправильным питанием, это легко поправить.
Диета. Необходимо есть как можно больше продуктов с высоким содержанием железа. Самые ценные его источники — красное мясо, субпродукты (особенно печень), устрицы, яйца, орехи, бобовые, яблоки, гранаты, изюм, инжир. Нужно также пополнить рацион продуктами, которые содержат витамин С (облепиха, шиповник, брюссельская капуста, цитрусовые) и витамин В12 (рыба и морепродукты), они нужны для того, чтобы поступающее железо усваивалось. Употребление чая, кофе и газировки лучше ограничить, а от алкоголя следует отказаться совсем.
Витаминные комплексы. Дополнительный прием витаминов — эффективный способ профилактики дефицита железа в организме. Помимо этого элемента, в комплекс должны входить витамины А, С, Е и D, все витамины группы В, а также медь, марганец и цинк — это оптимальный состав «спасательной команды» при железодефиците.
БАДы. Существует немало биологически активных добавок для людей, страдающих нехваткой железа. Самым известным БАДом для улучшения состояния при анемии является, пожалуй, знакомый всем с детства гематоген. Это сладкая плитка, напоминающая ирис и содержащая большое количество альбумина — природного источника железа.
Если у дефицита железа в организме нет других причин, кроме неправильного питания, уже через месяц-другой при помощи диеты, БАДов и витаминов можно добиться улучшения. А чтобы ускорить процесс, рекомендуем больше двигаться — физическая активность способствует насыщению тканей кислородом и помогает справиться с усталостью и сонливостью — первыми признаками нехватки железа.
www.kp.ru
Химическое и физические свойства железа
Железо — всем известный химический элемент. Он относится к средним по химической активности металлам. Свойства и применение железа мы рассмотрим в этой статье.
Распространенность в природе
Существует довольно большое количество минералов, в состав которых входит феррум. Прежде всего, это магнетит. Он на семьдесят два процента состоит из железа. Его химическая формула — Fe3O4. Данный минерал еще называют магнитный железняк. Он обладает светло-серым цветом, иногда с темно-серым, вплоть до черного, с металлическим блеском. Наибольшее его месторождение среди стран СНГ находится на Урале.

Следующий минерал с высоким содержанием железа — гематит — он на семьдесят процентов состоит из данного элемента. Его химическая формула — Fe2O3. Его еще называют красным железняком. Он обладает окраской от красно-коричневой до красно-серой. Наибольшее месторождение на территории стран СНГ находится в Кривом Роге.
Третий по содержанию феррума минерал — лимонит. Здесь железа шестдесят процентов от общей массы. Это кристаллогидрат, то есть в его кристаллическую решетку вплетены молекулы воды, его химическая формула — Fe2O3•H2O. Как понятно из названия, данный минерал имеет желто-коричневатый цвет, изредка бурый. Он является одной из главных составляющих природных охр и используется в качестве пигмента. Его также называют бурый железняк. Самые крупные места залегания — Крым, Урал.
В сидерите, так называемом шпатовом железняке, сорок восемь процентов феррума. Его химическая формула — FeCO3. Его структура неоднородна и состоит из соединенных вместе кристаллов разного цвета: серых, бледно-зеленых, серо-желтых, коричнево-желтых и др.
Последний часто встречающийся в природе минерал с высоким содержанием феррума — пирит. Он обладает такой химической формулой FeS2. Железа в нем находится сорок шесть процентов от общей массы. Благодаря атомам серы данный минерал имеет золотисто-желтую окраску.
Многие из рассмотренных минералов применяются для получения чистого железа. Кроме того, гематит используют в изготовлении украшений из натуральных камней. Вкрапления пирита могут иметься в украшениях из лазурита. Кроме этого, в природе железо встречается в составе живых организмов — оно является одним из важнейших компонентов клетки. Данный микроэлемент обязательно должен поступать в организм человека в достаточном количестве. Лечебные свойства железа во многом связаны с тем, что данный химический элемент является основой гемоглобина. Поэтому употребление феррума хорошо сказывается на состоянии крови, а следовательно, и всего организма в целом.
Железо: физические и химические свойства
Рассмотрим по порядку два этих больших раздела. Физические свойства железа — это его внешний вид, плотность, температура плавления и т. д. То есть все отличительные черты вещества, которые связаны с физикой. Химические свойства железа — это его способность вступать в реакцию с другими соединениями. Начнем с первых.
Физические свойства железа
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
 Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все.Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
С точки зрения химии
Данный элемент относится к металлам средней активности. Но химические свойста железа являются типичными и для всех остальных металлов (кроме тех, которые находятся правее водорода в электрохимическом ряду). Оно способно реагировать со многими классами веществ.
Начнем с простых
Феррум вступает во взаимодействие с килородом, азотом, галогенами (йодом, бромом, хлором, фтором), фосфором, карбоном. Первое, что нужно рассмотреть, — реакции с оксигеном. При сжигании феррума образуются его оксиды. В зависимости от условий проведения реакции и пропорций между двумя участниками они могут быть разнообразными. Как пример такого рода взаимодействиям можно привести следующие уравнения реакций: 2Fe + O2 = 2FeO; 4Fe + 3O2 = 2Fe2O3; 3Fe + 2O2 = Fe3O4. И свойства оксида железа (как физические, так и химические) могут быть разнообразными, в зависимости от его разновидности. Такого рода реакции происходят при высоких температурах.

Следующее — взаимодействие с азотом. Оно также может произойти только при условии нагревания. Если взять шесть молей железа и один моль азота, получим два моля нитрида железа. Уравнение реакции будет выглядеть следующим образом: 6Fe + N2 = 2Fe3N.
При взаимодействии с фосфором образуется фосфид. Для проведения реакции необходимы такие компоненты: на три моля феррума — один моль фосфора, в результате образуется один моль фосфида. Уравнение можно записать следующим образом: 3Fe + P = Fe3P.
Кроме того, среди реакций с простыми веществами можно также выделить взаимодействие с серой. При этом можно получить сульфид. Принцип, по которому происходит процесс образования данного вещества, подобен описанным выше. А именно происходит реакция присоединения. Для всех химических взаимодействий подобного рода нужны специальные условия, в основном это высокие температуры, реже — катализаторы.
Также распространены в химической промышленности реакции между железом и галогенами. Это хлорирование, бромирование, йодирование, фторирование. Как понятно из названий самих реакций, это процесс присоединения к атомам феррума атомов хлора/брома/йода/фтора с образованием хлорида/бромида/йодида/фторида соответственно. Данные вещества широко используются в разнообразных отраслях промышленности. Кроме того, феррум способен соединяться с кремнием при высоких температурах. Благодаря тому что химические свойства железа разнообразны, его часто используют в химической отрасли промышленности.
Феррум и сложные вещества
От простых веществ перейдем к тем, молекулы которых состоят из двух и более различных химических элементов. Первое, что нужно упомянуть, — реакцию феррума с водой. Здесь проявляются основные свойства железа. При нагревании воды вместе с железом образуется основный оксид (называется он так потому, что при взаимодействии с той же водой образует гидроксид, по-другому говоря — основание). Итак, если взять по одному молю обоих компонентов, образуются такие вещества, как диоксид феррума и водород в виде газа с резким запахом — также в молярных пропорциях один к одному. Уравнение такого рода реакции можно записать следующим образом: Fe + H2O = FeO + H2. В зависимости от пропорций, в которых смешать эти два компонента, можно получить ди- либо триоксид железа. Оба этих вещества очень распространены в химической промышленности, а также используются во многих других отраслях.
С кислотами и солями
Так как феррум находится левее водорода в электрохимическом ряду активности металлов, он спосособен вытеснять данный элемент из соединений. Примером этому является реакция замещения, которую можно наблюдать при добавлении железа к кислоте. Например, если смешать в одинаковых молярных пропорциях железо и сульфатную кислоту (она же серная) средней концентрации, в результате получим сульфат железа (ІІ) и водород в одинаковых молярных пропорциях. Уравнение такой реакции будет выглядеть таким образом: Fe + H2SO4 = FeSO4 + H2.
При взаимодействии с солями проявляются восстановительные свойства железа. То есть с помощью него можно выделить менее активный металл из соли. Например, если взять один моль сульфата меди и столько же феррума, то можно получить сульфат железа (ІІ) и чистую медь в одинаковых молярных пропорциях.
Значение для организма
Один из самых распространенных в земной коре химических элементов — железо. Свойства вещества мы уже рассмотрели, теперь подойдем к нему с биологической точки зрения. Феррум выполняет очень важные функции как на клеточном уровне, так и на уровне всего организма. В первую очередь железо является основой такого белка, как гемоглобин. Он необходим для транспорта кислорода по крови от легких ко всем тканям, органам, к каждой клетке организма, в первую очередь к нейронам головного мозга. Поэтому полезные свойства железа невозможно переоценить.
Кроме того что он влияет на кровеобразование, феррум также важен для полноценного функционирования щитовидной железы (для этого нужен не только йод, как некоторые считают). Также железо принимает участие во внутриклеточном обмене веществ, регулирует иммунитет. Еще феррум в особенно большом количестве содержится в клетках печени, так как помогает нейтрализовать вредные вещества. Также он является одним из главных компонентов многих видов ферментов нашего организма. В суточном рационе человека должно содержаться от десяти до двадцати миллиграмм данного микроэлемента.
Продукты, богатые железом
Таких немало. Они есть как растительного, так и животного происхождения. Первые — это злаки, бобовые, крупы (в особенности гречка), яблоки, грибы (белые), сухофрукты, шиповник, груши, персики, авокадо, тыква, миндаль, финики, помидоры, брокколи, капуста, черника, ежевика, сельдерей и др. Вторые — печень, мясо. Употребление продуктов с высоким содержанием железа особенно важно в период беременности, так как организм формирующегося плода требует большого количества данного микроэлемента для полноценного роста и развития.
Признаки недостатка в организме железа
Симптомами слишком маленького количества феррума, поступающего в организм, являются усталость, постоянное замерзание рук и ног, депрессии, ломкость волос и ногтей, снижение интеллектуальной активности, пищеварительные расстройства, низкая работоспособность, нарушения в работе щитовидной железы. Если вы заметили несколько из этих симптомов, то стоит увеличить количество продуктов с содержанием железа в своем рационе либо купить витамины или пищевые добавки с содержанием феррума. Также обязательно нужно обратиться к врачу, если какие-либо из этих симптомов вы ощущаете слишком остро.

Использование феррума в промышленности
Применение и свойства железа тесно связаны. В связи с его ферромагнитностью, его применяют для изготовления магнитов — как более слабых для бытовых целей (сувенирные магниты на холодильник и т. д.), так и более сильных — для промышленных целей. В связи с тем что рассматриваемый металл обладает высокой прочностью и твердостью, его с древности использовали для изготовления оружия, доспехов и других военных и бытовых инструментов. К слову, еще в Древнем Египте было известно метеоритное железо, свойства которого превосходят таковые у обычного металла. Также такое особенное железо использовалось и в Древнем Риме. Из него изготавливали элитное оружие. Щит или меч, выполненный из метеоритного металла, мог иметь только очень богатый и знатный человек.

Вообще, металл, который мы рассматриваем в данной статье, является самым разносторонне используемым среди всех веществ данной группы. Прежде всего, из него изготавливаются сталь и чугун, которые применяются для производства всевозможных изделий, необходимых как в промышленности, так и в повседневной жизни.
Чугуном называется сплав железа и углерода, в котором второго присутствует от 1,7 до 4,5 процента. Если второго меньше, чем 1,7 процента, то такого рода сплав называется сталью. Если углерода в составе присутствует около 0,02 процента, то это уже обыкновенное техническое железо. Присутствие в сплаве углерода необходимо для придания ему большей прочности, термоустойчивости, стойкости к ржавлению.
Кроме того, в стали может содержаться много других химических элементов в качестве примесей. Это и марганец, и фосфор, и кремний. Также в такого рода сплав для придания ему определенных качеств могут быть добавлены хром, никель, молибден, вольфрам и многие другие химические элементы. Виды стали, в которых присутствует большое количество кремния (около четырех процентов), используются в качестве трансформаторных. Те, в составе которых много марганца (вплоть до двенадцати-четырнадцати процентов), находят свое применение при изготовлении деталей железных дорог, мельниц, дробилок и других инструментов, части которых подвержены быстрому стиранию.
Молибден вводят в состав сплава, чтобы сделать его более термоустойчивым — такие стали используются в качестве инструментальных. Кроме того, для получения всем известных и часто используемых в быту в виде ножей и других бытовых инструментов нержавеющих сталей необходимо добавление в сплав хрома, никеля и титана. А для того чтобы получить ударостойкую, высокопрочную, пластичную сталь, достаточно добавить к ней ванадий. При вводе в состав ниобия можно добиться высокой устойчивости к коррозии и воздействию химически агрессивных веществ.
Минерал магнетит, который был упомянут в начале статьи, нужен для изготовления жестких дисков, карт памяти и других устройств подобного типа. Благодаря магнитным свойствам, железо можно найти в устройстве трансформаторов, двигателей, электронных изделий и др. Кроме того, феррум могут добавлять в сплавы прочих металлов для придания им большей прочности и механической устойчивости. Сульфат данного элемента применяют в садоводстве для борьбы с вредителями (наряду с сульфатом меди).
 Хлориды железа являются незаменимыми при очистке воды. Кроме того, порошок магнетита используется в черно-белых принтерах. Главный способ применения пирита — получение из него серной кислоты. Данный процесс происходит в лабораторных условиях в три этапа. На первой стадии пирит феррума сжигают, получая при этом оксид железа и диоксид серы. На втором этапе происходит превращение диоксида сульфура в его триоксид при участии кислорода. И на завершающей стадии полученное вещество пропускают через водяной пар в присутствии катализаторов, тем самым и получая серную кислоту.
Хлориды железа являются незаменимыми при очистке воды. Кроме того, порошок магнетита используется в черно-белых принтерах. Главный способ применения пирита — получение из него серной кислоты. Данный процесс происходит в лабораторных условиях в три этапа. На первой стадии пирит феррума сжигают, получая при этом оксид железа и диоксид серы. На втором этапе происходит превращение диоксида сульфура в его триоксид при участии кислорода. И на завершающей стадии полученное вещество пропускают через водяной пар в присутствии катализаторов, тем самым и получая серную кислоту.Получение железа
В основном добывают данный металл из двух основных его минералов: магнетита и гематита. Делают это с помощью восстановления железа из его соединений углеродом в виде кокса. Делается это в доменных печах, температура в которых достигает двух тысяч градусов по шкале Цельсия. Кроме того, есть способ восстановления феррума водородом. Для этого необязательно наличие доменной печи. Для осуществления данного метода берут специальную глину, смешивают ее с измельченной рудой и обрабатывают водородом в шахтной печи.
Заключение
Свойства и применение железа разнообразны. Это, пожалуй, самый важный в нашей жизни металл. Став известным человечеству, он занял место бронзы, которая на тот момент была основным материалом для изготовления всех орудий труда, а также оружия. Сталь и чугун во многом превосходят сплав меди с оловом с точки зрения своих физических свойств, устойчивости к механическим воздействиям.
Кроме того, железо на нашей планете более распространено, чем многие другие металлы. Массовая доля его в земной коре составляет почти пять процентов. Это четвертый по распространенности в природе химический элемент. Также данный химический элемент очень важен для нормального функционирования организма животных и растений, прежде всего потому, что на его основе построен гемоглобин. Железо является важнейшим микроэлементом, употребление которого важно для поддержания здоровья и нормальной работы органов. Кроме вышеперечисленного, это единственный металл, который обладает уникальными магнитными свойствами. Без феррума невозможно представить нашу жизнь.
fb.ru
Железо в природе (4,7% в Земной коре)
Железо стоит на втором месте (4,7% в Земной коре) после алюминия по запасам и распространенности на планете. Оно обнаружено еще на заре человеческого общества и до сих пор не теряет своего значения и повсюду используется.
Чаще всего железо находят в богатых металлом рудах, которые можно относительно легко добывать и перерабатывать. В чистом виде железо находили только в метеоритах, а в соединениях оно присутствует в сульфидах, силикатах и оксидах.
Характеристика железа
Физические свойства

Железо – это серебристо-белый металл с сероватым оттенком. В чистом виде пластичен, но непрочен. При добавлении в него различных добавок (например, углерода) твердость и хрупкость сплава повышается. Железо хорошо проводит электричество, тепло и обладает мощными магнитными свойствами, то есть под действием магнитного поля оно намагничивается и потом само становится магнитом.
Железо особенно важно для живых организмов. Оно способствует дыхательным процессам и входит в состав гемоглобина крови (477 мг/л). Это значит, что железо участвует в процессе доставки кислорода от органов дыхания к тканям.
Находясь в воде и на влажном воздухе железо меркнет и ржавеет, а при температуре 1539°С легко плавится и поддается ковке. При высоких температурах железо реагирует с паром воды.
Железо образует 300 разнообразных минералов (карбонаты, сульфиды и т.д.) и энергично мигрирует в земной коре. Его называют металлом земных недр, так как он копится в кристаллизации магмы.
Химические свойства

Железо — металл со средней степенью химической активности. На воздухе, на нем образуется защитная пленка, которая препятствует коррозии и ржавлению. Если воздух влажный, железо окисляется и покрывается ржавчиной.
Растворяется в разведенной соляной или серной кислотах, с выделением водорода. Вытесняет из растворов солей металлы. Во время нагревания взаимодействует с неметаллами.
Соединения и нахождение железа в природе

В естественных водах, среднее содержание железа (в интервале 0,01-26 мг/л). Кроме того, животные особи, бактерии и растения содержат его в своих организмах. Даже в тканях и внутренних органах людей есть железо, поступающее в организм вместе с едой. Потребность в нем для взрослого человека составляет 11-30мг. Избыток железа приводит к гемохроматозу и серьезным нарушениям внутренних органов.
Так как месторождения железных руд возникают в разных геологических условиях, то и состав руд и условия их расположения разнообразны.
Железо содержится во многих рудах:
• гематит (железный блеск, красный железняк),
• пирит (серный колчедан) и гетит,
• магнетит (магнитный железняк),
• сидерит и гидрогенит.
Круговорот железа в природе
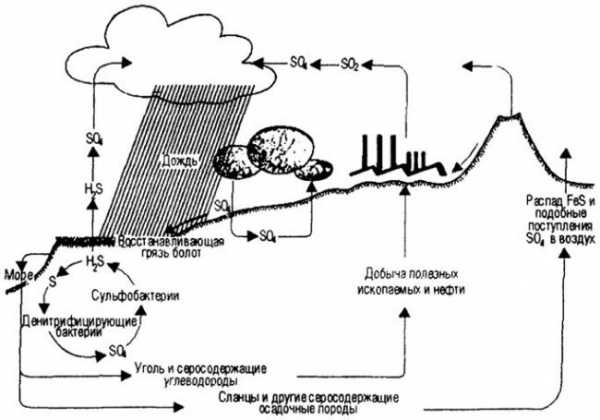
(На примере круговорота серы и других соединений в природе)
За счет жизнедеятельности железобактерий (нитевидные бактерии и одиночные железобактерии) происходит круговорот железа в природе. Они окисляют железо до гидроксида железа, а углерод получают из углекислоты. Таким образом, железобактерии получают энергию для своей жизнедеятельности, а после смерти осаждаются в почве в виде болотной руды.
Области применения железа
В чистом виде железо непрочно, поэтому практически не применяется. Его используют для выработки электромагнитов, как катализатор химических реакций и др.
Основное применение этот металл находит в виде сплавов. На их долю приходится 95% всей металлопродукции. Железо основной компонент стали и чугуна. В стали меньше углерода, чем в чугуне, и поэтому она более пластична и устойчива к резким ударным нагрузкам железа.
Так же железо входит в состав никелевых и других сплавов, использующихся в электротехнике, железо-воздушных аккумуляторах и железо — никелевых аккумуляторах.
На основе железа производятся материалы, которые могут выдерживать действие низкой и повышенной температуры, агрессивной среды, ядерных излучений, вакуума и высоких давлений и т. п.
Железо относится к группе тех металлов, которые очень широко применяются во всех областях народного и бытового хозяйства. Чугун и сталь стали основой современной техники. С их участием произошло развитие тяжелой промышленности, разнообразного наземного транспорта и др.
Большие запасы железа в России, Австралии, Канаде, Казахстане, Индии, Франции, США, Венесуэле и ЮАР.
xn—-8sbiecm6bhdx8i.xn--p1ai
