Формирование гуморального и клеточного иммунитета на коревую вакцину у взрослых | Топтыгина
1. Голева О.В., Самойлова И.Г., Мурина Е.А., Мундруева А.А. Особенности противокоревого иммунитета у населения Санкт-Петербурга // Эпидемиология и вакцинопрофилактика. 2012. № 6. С. 25—29.
2. Готвянская Т.П., Ноздрачева А.В., Русакова Е.В., Евсеева Л.Ф., Николаева О.Г., Полонский В.О., Семененко Т.А. Состояние популяционного иммунитета в отношении инфекций, управляемых средствами специфической профилактики у медицинских работников (по материалам банка сывороток крови) // Эпидемиология и инфекционные болезни. Актуальные вопросы. 2016. № 3. С. 8—16.
3. Костинов М.П., Шмитько А.Д., Соловьева И.Л., Сависько А.А., Полищук В.Б., Рыжова А.А., Черданцев А.
4. Ноздрачева А.В., Рыбин В.В., Грицик А.А., Заволожин В.А., Кузин С.Н., Семененко Т.А. Распространенность антител к вирусам кори, краснухи и эпидемическому паротиту у военнослужащих // Военно-медицинский журнал. 2018. Т. 339, № 1. С. 66-70.
5. Сармометов Е.В., Мокова Н.М., Вольдшмидт Н.Б., Сергевнин В.И., Цвиркун О.В., Метелкина Н.А. Оценка напряженности противокоревого иммунитета у медицинских работников г. Перми // Эпидемиология и вакцинопрофилактика. 2011. № 4. С. 45-48.
6. Смердова М.А., Топтыгина А.П., Андреев Ю.Ю., Сенникова С.В., Зеткин А.Ю., Клыкова Т.Г., Беляков С.И. Гуморальный и клеточный иммунитет к антигенам вирусов кори и краснухи у здоровых людей // Инфекция и иммунитет. 2019. Т. 9, № 3-4. С. 607-611.
2019. Т. 9, № 3-4. С. 607-611.
7. Сылка О.И., Харсеева Г.Г., Леонова И.А. Напряженность иммунитета к вирусу кори у населения г. Ростова-на-Дону // Журнал фундаментальной медицины и биологии. 2013. № 1. С. 41-43.
8. Топтыгина А.П. Общие закономерности формирования и поддержания специфического гуморального иммунного ответа на примере ответа на вирусы кори и краснухи // Инфекция и иммунитет. 2014. Т. 4, № 1. С. 7-14.
9. Топтыгина А.П., Алешкин В.А. Сопоставление первичного и вторичного гуморального иммунного ответа на вакцинацию «Приорикс» // Инфекция и иммунитет. 2013. Т. 3, № 4. С. 359-364.
 2019. Т. 13 (22), № 1. С. 78-85.
2019. Т. 13 (22), № 1. С. 78-85.11. Топтыгина А.П., Пухальский А.Л., Мамаева Т.А., Алешкин В.А., Спектр субклассов противокоревых иммуноглобулинов G у лиц, перенесших корь // Бюллютень экспериментальной биоллогии. 2004. Т. 137, № 3. С. 293-295.
13. Топтыгина А.П., Семикина Е.Л., Копыльцова Е.А., Алешкин В.А. Возрастные особенности формирования гуморального звена иммунного ответа у детей // Медицинская иммунология. 2012. Т. 14, № 4-5. С. 289-294.
14. Топтыгина А.П., Смердова М.А., Наумова М.А., Владимирова Н.
16. Filia A., Bella A., Del Manso M., Baggieri M., Magurano F., Rota M.C. Ongoing outbreak with well over 4,000 measles cases in Italy from January to end August 2017 — what is making elimination so difficult? Euro Surveill. 2017, vol. 22, no. 37: 30614. doi: 10.2807/15607917.ES.2017.22.37.30614
17. Haralambieva I.H., Ovsyannikova I.G., Kennedy R.B., Vierkant R.A., Shane Pankratz V., Jacobson R.M., Poland G.A. Associations between single nucleotide polymorphisms and haplotypes in cytokine and cytokine receptor genes and immunity to measles vaccination. Vaccine, 2011, vol. 29, no. 45, pp. 7883—7895. doi: 10.1016/j.vaccine.2011.08.083
Vaccine, 2011, vol. 29, no. 45, pp. 7883—7895. doi: 10.1016/j.vaccine.2011.08.083
18. Lisowski B., Yuvan S., Bier M. Outbreaks of the measles in the Dutch Bible Belt and in other places — new prospects for a 1000 year old virus. Biosystems, 2019, vol. 177, pp. 16—23. doi: 10.1016/j.biosystems.2019.01.003
19. Orsoo O., Saw Y.M., Sereenen E., Yadamsuren B., Byambaa A., Kariya T., Yamamoto E., Hamajima N. Epidemiological characteristics and trends of a Nationwide measles outbreak in Mongolia, 2015—2016. BMC Public Health., 2019, vol. 19, no. 1, pp. 201. doi: 10.1186/s12889- 019-6511- 0
20. Ovsyannikova I.G., Ryan J.E., Vierkant R.A., Pankratz V.S., Jacobson R.M., Poland G.A. Immunologic significance of HLA class I genes in measles virus-specific IFN-gamma and IL-4 cytokine immune responses.
21. Priya R. Varun N., Vivek S., Sanjay K., Avinash K., Noore S., Rohini, and Veena G K. Measles outbreak in the adolescent population — matter of concern? J. Clin. Diagn. Res., 2017, vol. 11 (8), pp. LC20—LC23. doi: 10.7860/JCDR/2017/28619.10488
22. Tischer A., Gassner M., Richard J.-L., Suter-Riniker F., Mankertz A., Heininger U. Vaccinated students with negative enzyme immunoassay results show positive measles virus- specific antibody levels by immunofluorescence and plaque neutralization test. J. Clin. Virol,, 2007, vol. 38, pp. 204-209. doi: 10.1016/j.jcv.2006.12.017
23. World Health Organization Regional Office for Europe (WHO/Europe). Fifth Meeting of the European Regional Verification Commission for Measles and Rubella Elimination (RVC) 24—26 October 2016, Copenhagen, Denmark. Copenhagen: WHO/ Europe. URL: http://www.euro.who.int/data/assets/pdf_file/0005/330917/5th-RVC-meeting-report.pdf?ua=1
Copenhagen: WHO/ Europe. URL: http://www.euro.who.int/data/assets/pdf_file/0005/330917/5th-RVC-meeting-report.pdf?ua=1
Иммунитет: защита и нападение
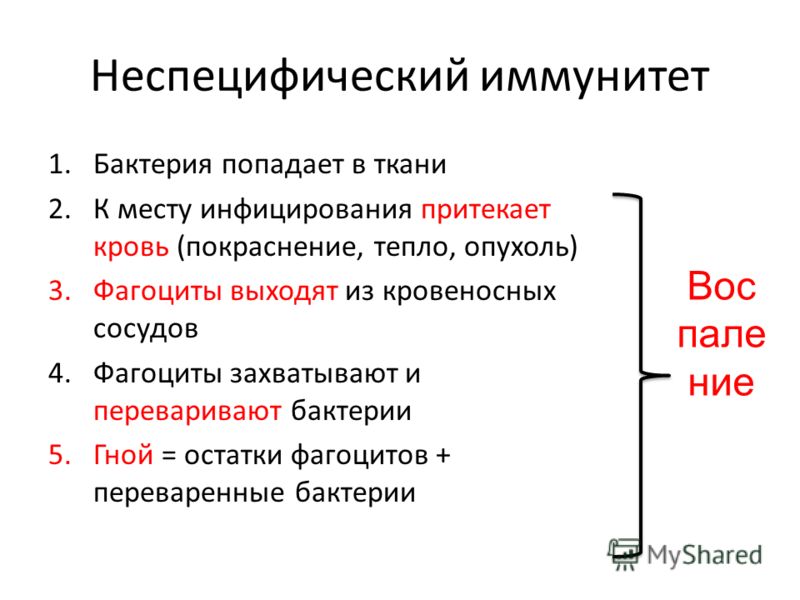
Воспаление представляет собой реакцию ткани на инфекцию или повреждение и имеет следующие симптомы:
- покраснение вследствие усиления кровотока;
- отек вследствие накопления жидкости и клеток в тканях;
- боль вследствие повреждения ткани и раздражения нервных волокон;
- повышение температуры — местное (вследствие усиления кровотока) и/или системное (повышение температуры тела).
В процесс воспаления включаются белки плазмы крови — комплемент и цитокины. Комплементом называется ряд белков плазмы, вступающих в серию каскадных химических реакций в ответ на инфекцию. Это своего рода многоступенчатая сигнальная система, которая маркирует чужеродные микроорганизмы и привлекает в очаг инфекции специальные клетки — «убийцы» патогенов.
В ответ на сигнал тревоги начинается контратака защитной системы организма — запускается клеточный иммунный ответ. В неспецифическом иммунном ответе принимают участие два типа клеток крови — фагоциты и NK-клетки (или натуральные киллеры).
Фагоциты представляют собой крупные лейкоциты, поглощающие и буквально переваривающие внутри себя микроорганизмы и другие чужеродные частицы. Этот процесс называется фагоцитозом. Фагоциты наиболее чувствительны к микроорганизмам, помеченным белком-комплементом или антителами (эти частицы — уже часть адаптивного или специфического иммунного ответа). Кроме клеток, которые атакуют нарушителя по тревоге, в кровотоке также циркулирует регулярный «патруль» или особый вид лейкоцитов — натуральные киллеры. Их мишенью являются злокачественные клетки и клетки, инфицированные вирусами. Врожденный иммунитет быстро активируется на ранних стадиях инфекции. Его механизмы защиты могут ограничивать распространение патогенов в организме, но возможности для устранения чужеродных частиц ограничены и остаются прежними при повторном заражении тем же патогеном.
Адаптивный (приобретенный) иммунитет развивается после первой встречи с чужеродным агентом. Основными его качествами являются специфичность и иммунологическая память.
У специфического иммунитета в ответ на попадание в организм «чужака» в запасе имеется целая стратегия, которой позавидовали бы многие полководцы. «Основные войска» специфического иммунитета — лимфоциты. Это — специализированные лейкоциты, находящиеся в лимфатической системе. Лимфоциты характеризуются очень длительным периодом жизни — от нескольких лет до десятилетий! Известны три типа лимфоцитов: B-клетки, Т-клетки и натуральные киллеры (о них мы уже рассказывали).
Для развития адаптивного иммунитета требуется специфическая мишень — антиген. Антиген представляет собой вещество (обычно крупную молекулу), которая активирует иммунный ответ. Один микроорганизм обычно имеет большое количество антигенов, например, поверхностные структуры, такие как компоненты клеточной стенки, полисахариды капсулы, жгутики и т. д., или внеклеточные белки, такие как токсины или ферменты, вырабатываемые микроорганизмом.
Один микроорганизм обычно имеет большое количество антигенов, например, поверхностные структуры, такие как компоненты клеточной стенки, полисахариды капсулы, жгутики и т. д., или внеклеточные белки, такие как токсины или ферменты, вырабатываемые микроорганизмом.
Сначала происходит выработка В-клетками оружия против нарушителей — белка, который прореагирует с антигеном и сделает его безвредным. Эти белки носят название антител, называемых также иммуноглобулинами (Ig). Антитела очень специфичны и способны связываться только с антигеном той же структуры, что изначально стимулировал их образование. Когда антитело находит соответствующий ему антиген, они соединяются наподобие ключа, вставляемого в замочную скважину.
Затем приобретенный иммунитет начинает действовать сразу на два фронта: гуморальный иммунный ответ направлен на антигены, присутствующие в плазме крови, а клеточный иммунный ответ — на патогены, присутствующие внутри клеток.
В процессе гуморального иммунного ответа В-клетки, активированные специфическими антигенами, начинают усиленно делиться с образованием большого количества идентичных клеток-клонов, каждая из которых способна бороться с данным антигеном. Антитела B-клеток также привлекают фагоциты, уничтожающие и переваривающие антиген-мишень.
Антитела B-клеток также привлекают фагоциты, уничтожающие и переваривающие антиген-мишень.
Клеточный иммунитет использует «специализированные силы» — T-хелперы и цитотоксические T-клетки, непосредственно атакующие и уничтожающие «войска противника» — инфицированные клетки.
После того, как война с инфекцией выиграна, В- и Т-клетки, активированные антигенами, переходят в состояние покоя и становятся лимфоцитами памяти, специфичными по отношению к данному антигену или патогену. При повторном заражении аналогичным или очень похожим (антигенно-аналогичным) микроорганизмом, они обеспечивают быстрый и мощный иммунный ответ. Высокие концентрации нужных антител достигаются уже через 1 — 2 дня после инфицирования.
Итак, приобретенный иммунитет характеризуется тремя основными особенностями:
-
Специфичность: каждое антитело или активированная Т-клетка реагирует только со специфичным антигеном, вызвавшим ее образование.
 При этом они не реагируют с другими антигенами и защищают организм только от заболеваний, характеризующихся присутствием данного антигена.
При этом они не реагируют с другими антигенами и защищают организм только от заболеваний, характеризующихся присутствием данного антигена.
- Память: после того, как в процессе адаптивного иммунного ответа произошло образование специфичного антитела или Т-клетки, производство антител или активация Т-клеток происходит быстрее и в больших количествах. Данная особенность является основой эффекта многих вакцин.
- Толерантность к собственным тканям: механизмы адаптивного иммунного ответа в норме способны отличать собственные структуры организма от чужеродных.
«Иммунитет к COVID-19 выработался шесть лет назад от других «простуд»
Такое предположение сделали американские ученые после исследования образцов крови 2015-2018 годов
Американские исследователи из Института иммунологии в Ла-Хойе опубликовали сенсационные данные. Исследование образцов донорской крови, забор которой проводился в 2015-2018 годах, выявило признаки специфического клеточного иммунитета, аналогичные тем, что появляются при новом коронавирусе.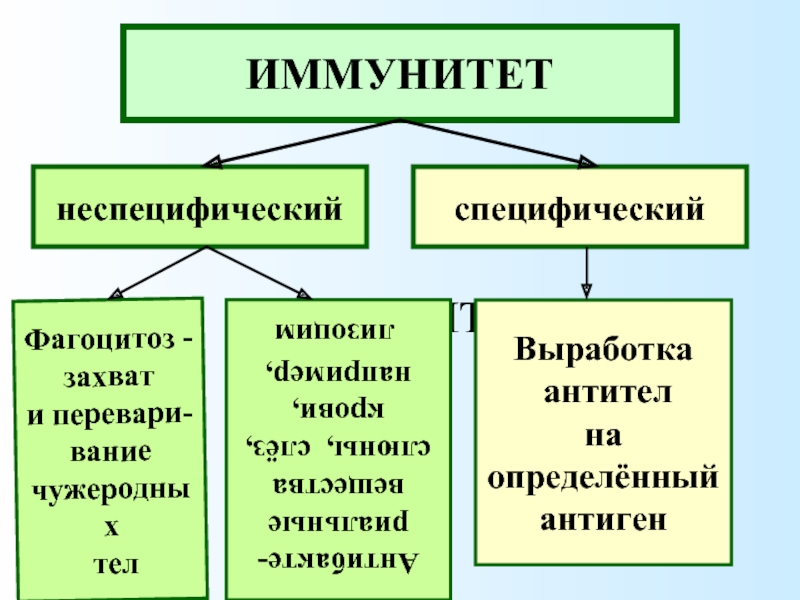 Из этого можно сделать осторожный вывод о том, что организм тех, кто когда-то болел другими разновидностями коронавируса, может оказаться устойчивыми к COVID-19.
Из этого можно сделать осторожный вывод о том, что организм тех, кто когда-то болел другими разновидностями коронавируса, может оказаться устойчивыми к COVID-19.
Сегодня многие озабочены вопросом: дает ли факт наличия антител к новому коронавирусу гарантию иммунитета? Однако ситуация с иммунитетом гораздо сложнее. Его наличие зависит не только от присутствия в крови антител (иммуноглобулинов), но еще и от наличия важных клеток — Т-лимфоцитов, Т-киллеров (CD8-клеток) и Т-хэлперов (CD4-клеток). Т-киллеры способны по разным приметам опознавать в организме клетки, зараженные вирусами, и, в случае их обнаружения, убивать их самостоятельно или призывать другие клетки на помощь. А Т-хэлперы увеличивают количество и «убийственный» потенциал Т-киллеров, специфичных в отношении конкретного вируса.
Новое исследование американцев (пока это препринт) поставило целью выявить специфические антигены коронавируса, вызывающие наиболее сильный клеточный иммунный ответ — эта информация очень важна для создания будущей вакцины.
Однако параллельно случилось другое важное открытие. В каждом втором образце донорской крови людей, взятой в 2015-2018 годах, были найдены именно специфические СD4+ Т-лимфоцитов, которые сегодня обнаруживают у абсолютно всех переболевших новой коронавирусной инфекцией. То есть можно предположить, что 50% населения, которые еще не встретились с новой инфекцией, уже может иметь к ней иммунитет. Кроме того, сегодня в крови у 70% переболевших COVID-19 обнаруживаются еще и специфические CD8+ Т-лимфоциты. Их нашли в 20% образцов донорской крови.
Результаты исследования дают основания предполагать, что значительная часть населения может обладать перекрестным иммунитетом к вирусу SARS-CoV-2 благодаря ранее перенесенным «сезонным простудам», т.е. «обычным» коронавирусам. Те, кто когда-то болел другими «коронами», могли получить антитела, способные справиться с новым вирусом. Возможно, именно поэтому большинство переносят заболевание в легкой форме или вообще без клинической картины заболевания.
«Доноры, чьи образцы крови были подвергнуты анализу, определенно не могли болеть COVID-19 в 2015-2018 годах. Тем не менее, примерно в половине случаев у них обнаружилась специфическая реакция Т-клеток на антигены вируса.
Авторы исследования полагают, что дело в кросс-реактивном иммунитете. Они проверили образцы донорской крови, которые были использованы в эксперименте, на антитела к двум из четырех ранее известных коронавирусов, поражающих человека, HcoV-OC43 и HcoV-NL63, и получили положительный результат анализа. То есть эти люди ранее переболели другими коронавирусными инфекциями, отличными от COVID-19″, — отмечает старший научный сотрудник ЦКБ РАН Сергей Кацалап.
«Это исследование крайне важно для понимания механизмов адаптивного иммунитета, — рассказал «МК» завкафедрой клинической иммунологии и аллергологии Первого МГМУ им. И.М. Сеченова, академик РАН, заслуженный деятель науки РФ Александр Караулов. – Если этиологию заболевания COVID-19 мы изучили, это новый коронавирус SARS-CoV-2, то в отношении формирования иммунитета к нему идут постоянные дискуссии.![]()
Иногда этот иммунитет патогенный (люди умирают от цитокинового шторма или от избыточного иммунного ответа), иногда протективный (что важно для создания вакцин).
В основе противовирусного иммунитета лежит не только и не столько антительный ответ, сколько Т-клеточный иммунитет, реакция Т-клеток: СД-4-хелперов и CD-8 киллеров, а также клеток памяти. Эти клетки вовлекаются в защиту организма в ответ на вирусную инфекцию, в т.ч. и SARS-CoV-2, и, благодаря им, при острой инфекции происходит элиминация вируса, то есть «очистка» от вируса и формирование иммунитета к последующему заражению. И в этом смысле все идет по классике.
Но вопрос еще и в том, от чего зависит тяжесть течения инфекции? Мы видим, что элиминации вируса не возникает у некоторых пожилых или у людей с тяжелыми заболеваниями типа сахарного диабета или онкологии. У них связь между врожденным и адаптивным иммунитетом нарушена; адаптивного у них недостаточно.
Сегодня основная гипотеза ответа на вопрос, почему одни болеют легко, а другие тяжело, заключается в том, что болеющие легко, по всей видимости, имеют перекрестный иммунитет к другим коронавирусам. Перекрестная реактивность встречается при некоторых инфекциях, например, при гриппе.
Перекрестная реактивность встречается при некоторых инфекциях, например, при гриппе.
Установлен факт, что гриппом h2N1 легче болели те, у кого был перекрестный иммунитет к другим штаммам гриппа, то есть, у них есть Т-клетки-киллеры, активно работающие против вируса, что позволяет выздороветь быстрее. Конечно, работа американцев предварительная, нужно провести дополнительные исследования среди тяжелых пациентов в стационарах. И все же эти данные доказывают, что существование перекрестного иммунитета у здоровых людей в ответ на SARS-CoV-2 возможно. И это нужно учитывать при создании вакцин.
— Получается, что обладатели Т-лимфоцитов к старым коронавирусам при встрече с новым, скорее всего, переболеют легче?
— Да, за счет той самой кросс-реактивности между циркулирующими коронавирусами, которые вызывают обычную простуду. Это примерно 40-60% здоровых лиц, не имеющих контактов с COVID, которым Т-клетки памяти потенциально дадут иммунный ответ, то есть запустят активный и достаточный Т-клеточный цитотоксический (киллерный) ответ, помимо антительного ответа.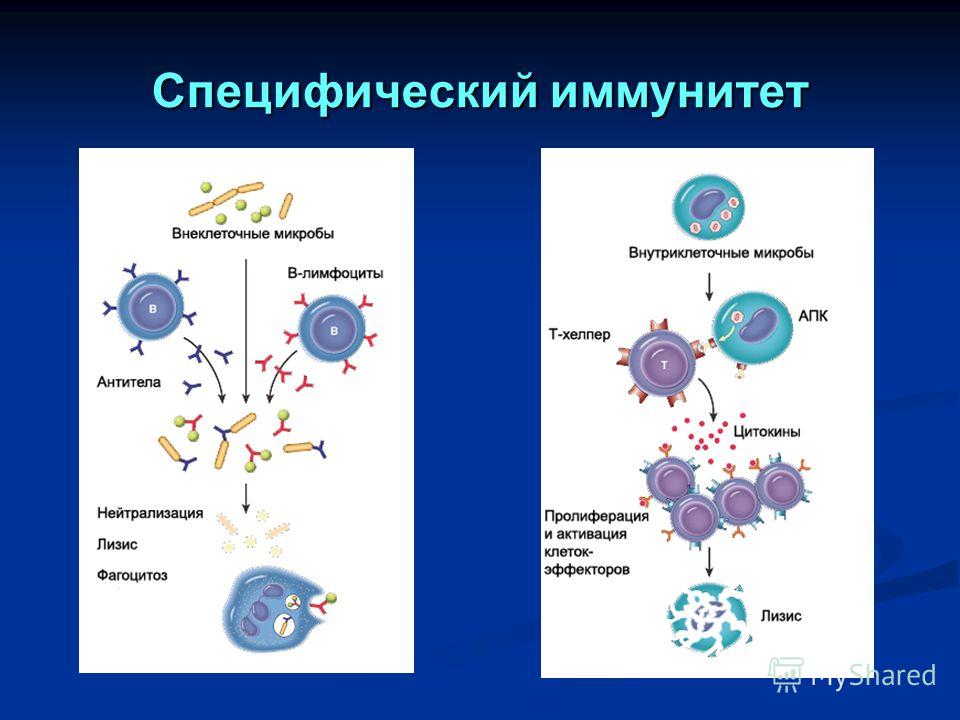 Но этих киллеров очень сложно определять диагностически, нужно специальные исследования в лаборатории…
Но этих киллеров очень сложно определять диагностически, нужно специальные исследования в лаборатории…
Тем временем, в журнале Nature опубликовано еще одно исследование биологов из Вашингтонского университета. У пациента, который перенес тяжелый острый респираторный синдром (ТОРС, вызываемый SARS-CoV) в 2003 году, обнаружили антитела, способные блокировать работу и SARS-CoV-2.
Возбудитель атипичной пневмонии SARS-CoV наиболее близок по своему строению и свойствам к новому SARS-CoV-2. Ученым удалось получить восемь разных антител, используя B-клетки памяти того пациента, которые в разной степени блокировали вирус. И одно из них продемонстрировало способность связываться с S-белком нового коронавируса SARS-CoV-2, который отвечает за проникновение вируса внутрь клетки человека, а значит является протективным, то есть защитным.
И это очень важно, так как именно понимание того, какие фрагменты вируса являются протективными, необходимо для разработки эффективной вакцины от коронавирусной инфекции, а также для новых методов лечения COVID-19, предполагают ученые. «Это также путь использования коктейля антител для профилактики и терапии тяжелого течения болезни», — считает академик Караулов.
«Это также путь использования коктейля антител для профилактики и терапии тяжелого течения болезни», — считает академик Караулов.
Ссылка на публикацию: www.mk.ru
Т-клеточный иммунитет при COVID-19
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Пандемия COVID-19 продолжается и усиливается. Все больше людей в мире встречается с данным вирусом. Уже давно стало понятно, что SARS-CoV-2 не исчезнет из человеческой популяции. Вероятность встречи с ним возрастает для каждого.
Тем не менее, многие люди, неоднократно и длительно контактировавшие с заболевшими COVID-19 – сами не заболевают, никаких клинических симптомов не появляется. Почему так происходит – один из самых насущных вопросов на всех уровнях попыток понимания текущей пандемии, от бытового до научно-медицинского.
Наиболее вероятный ответ на него – особенности иммунного ответа части населения. В предыдущих публикациях описывались варианты протекания инфекционного процесса при COVID-19, механизмы и сроки антителообразования В-лимфоцитами, с учетом того, что известно про эту инфекцию на данном этапе ее изучения. Однако, «не антителами едиными жив наш иммунитет…». В механизмах специфического иммунного ответа на патогены выделяют гуморальный иммунный ответ (опосредуемый присутствующими в плазме крови антителами) и клеточный иммунный ответ (опосредуемый клетками иммунной системы без участия антител). Клеточное звено иммунной системы (прежде всего, Т-клеточное звено) также играет немаловажную роль в появлении резистентности макроорганизма к той или иной инфекции. Как «вырисовывается» понимание – к COVID-19 тоже.
Как «вырисовывается» понимание – к COVID-19 тоже.
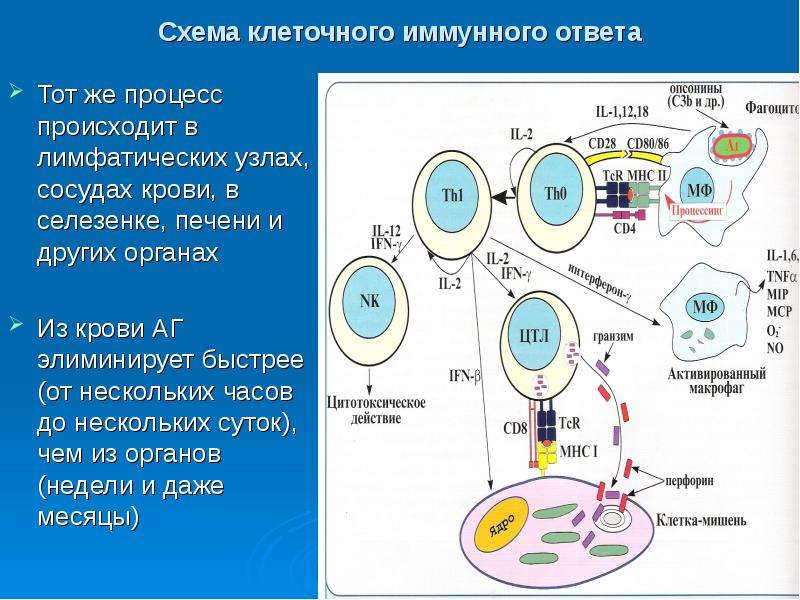
Т-клеточное звено состоит из различных пулов Т-лимфоцитов (обозначаемых общепринятой в иммунологии для указания их характерных маркеров аббревиатурой CD и цифрой/числом – CD-3, CD-4, CD-8, CD-16 и другие). Если ОЧЕНЬ упрощенно, то основные задачи Т-клеточного звена:
Опознать и изучить антиген – передать информацию о нем другим звеньям иммунной системы – уничтожить антиген – запомнить его.
У части людей, в силу особенностей иммунитета (а также, видимо, при инфицировании низкой дозой возбудителя), Т-клеточное звено элиминирует вирус из организма без значимой активации В-клеточного звена, то есть – с низким уровнем антителообразования, нередко не детектируемым (не определяемым) рутинными лабораторными методами. При этом, клинических симптомов часто не развивается. Иными словами, человек может перенести инфекционный процесс без развития болезни, уровень антител у него не определяется, но организм приобретает защиту от повторного заражения. Насколько стойкую и долгую – вопрос остается открытым.
Насколько стойкую и долгую – вопрос остается открытым.
Однако, недавние, достаточно объемные исследования группы ученых из нескольких стран выявили:
- Образование устойчивого Т-клеточного ответа на SARS-CoV-2 у большинства пациентов, встречавшихся с данным вирусом
- При этом у части пациентов, никогда не встречавшихся с SARS-CoV-2 – уже имеются Т-лимфоциты, реагирующие на данный вирус и элиминирующие его из организма.
Подробнее – здесь.
То есть: у части людей есть приобретенная невосприимчивость к SARS-CoV-2, обусловленная, вероятнее всего Т-клетками, которые ранее «активировались» другими коронавирусами и сохранили иммунологическую память.
Данное утверждение сложно проверить массовым лабораторным скринингом. Изучение Т-клеточного ответа к инфекциям – достаточно трудоемкий процесс и чаще удел специализированных научно-исследовательских лабораторий. Однако, уже опубликованные результаты и продолжающиеся работы по изучению Т-клеточного иммунитета при COVID-19 – дают определенную почву для осторожного оптимизма.
Изучение Т-клеточного ответа к инфекциям – достаточно трудоемкий процесс и чаще удел специализированных научно-исследовательских лабораторий. Однако, уже опубликованные результаты и продолжающиеся работы по изучению Т-клеточного иммунитета при COVID-19 – дают определенную почву для осторожного оптимизма.
А.С. Поздняков, к.м.н.,
инфекционист, главный врач ООО «Инвитро-Сибирь»
Статистика INVITRO по пациентам с выявленными антителами к коронавирусу
Анализы для выявления антител в организме
Трансплантационный и специфический противоопухолевый иммунитет в ретроспективе: новые модели, основанные на трансгенезе индивидуальных цепей Т-клеточного рецептора | Казанский
1. Klein J. Natural history of the major histocompatibility complex. A WileyInterscience Publication. New York: John Wiley & Sons, 1986.
2. Jensen C.O. Experimentelle untersuchungen ber krebs bei mausen. Zentralbl Bakteriol Parasitol Infect 1903;34:28–34.
Jensen C.O. Experimentelle untersuchungen ber krebs bei mausen. Zentralbl Bakteriol Parasitol Infect 1903;34:28–34.
3. Loeb L. Tumor growth and tissue growth. Proc Amer Phil Soc 1908;47:1–12.
4. Tyzzer E.E. The study of inheritance in mice with reference to their susceptibility to transplanted tumors. J Med Res 1909;21:519–73.
5. Little C.C., Johnson B.W. The inheritance of susceptibility to implants of splenic tissue in mice. I. Japanese waltzing mice, albinos, and their F1 generation hybrids. Proc Soc Exp Biol Med 1922;19:163–7.
6. Gorer P.A. The genetic and antigenic basis of tumor transplantation. J Pathol Bacteriol 1937;44:691–7.
7. Gorer P.A., Mikulska Z.B. The antibody response to tumor inoculation. Improved methods of antibody detection. Cancer Res 1954;14:651–5.
Gorer P.A., Mikulska Z.B. The antibody response to tumor inoculation. Improved methods of antibody detection. Cancer Res 1954;14:651–5.
8. Snell G.D. Methods for the study of histocompatibility antigens. J Genet 1948;49:87–108.
9. Snell G.D., Dosse J., Nathenson S. Histocompatibility. Academic Press. New York, 1976.
10. Klein J. List of congenic lines of mice. I. Lines with differences at alloantigen loci. Transplantation 1973;15:137–53.
11. Reif A.E., Allen J.M. The AKR thymic antigen and its distribution in leukemias and nervous tissues. J Exp Med 1964;120:413–33.
12. Cantor H., Boyse E.A. Functional subclasses of T-lymphocytes bearing different Ly antigens. J Exp Med 1975;141:1376–89.
J Exp Med 1975;141:1376–89.
13. Murphy K.P. Janeway’s immunobiology. New York: Garland Science, 2012.
14. Brondz B.D. Interaction of immune lymphocytes with normal and neoplastic tissue cells. Folia Biol 1964;10:164–76.
15. Brondz B.D. Complex specificity of immune lymphocytes in allogeneic cell cultures. Folia Biol 1968;14:115–31.
16. Peck A.B., Wigzell H., Janeway C. Jr, Andersson L.C. Environmental and genetic control of T-cell activation in vitro: a study using isolated alloantigen-activated T-cell clones. Immunol Rev 1977;35:146–80.
17. Brondz B.D., Egorova S.G., Kotomina I.F. Enrichment of effector T lymphocytes specific to H-2 antigens by elution from allogeneic target cells and characterization of the eluted lymphocyte population. Eur J Immunol 1975;5(11):773–41.
Eur J Immunol 1975;5(11):773–41.
18. Melief C.J., de Waal L.P., van der Meulen M.Y. et al. Fine specificity of alloimmune cytotoxic T lymphocytes directed against H-2K. A study with Kb mutants. J Exp Med 1980;151(5):993–1013.
19. БрондзБ.Д., ПименовА.А., Бландова З.К., Ворнакова Г.Н. Изучение природы перекрестной реактивности рецепторов цитотоксических Т-лимфоцитов, иммунных к антигенам комплекса H-2 с помощью их фракционирования на монослоях клеток-мишеней. Молекулярная биология 1982;(16):481–92. [BrondzB.D., PimenovА.А., Blandovа Z.K., Vornakovа G.N. Studies of the nature of the cross-reactivity of receptors of cytotoxic Т-lymphocytes, immune to antigens of H-2 сomplex by means of its fractioning at monolayers of target cells. Molekulyarnaya biologiya = Моlecular biology 1982;(16):481–92. (In Russ.)].
20. Брондз Б.Д. Т-лимфоциты и их рецепторы в иммунологическом распознавании. М.: Наука, 1987. С. 353. [Brondz B.D. Т-lymphocytes and itsreceptors in the recognition. Мoscow: Nauka, 1987. P. 353 (In Russ.)].
Брондз Б.Д. Т-лимфоциты и их рецепторы в иммунологическом распознавании. М.: Наука, 1987. С. 353. [Brondz B.D. Т-lymphocytes and itsreceptors in the recognition. Мoscow: Nauka, 1987. P. 353 (In Russ.)].
21. Gross L. Intradermal immunization of C3H mice against a sarcoma that originated in an animal of the same line. Cancer Res 1943;3:326–33.
22. Prehn R.T., Main J.M. Immunity to methylcholantrene-induced sarcomas. J Natl Cancer Inst 1957;18:769–78.
23. Klein G., Sogren H.O., Klein E., Hellstrom K.E. Demonstration of resistance against methylcholantrene-induced sarcomas in the primary autochtonous host. Cancer Res 1960;20:1561–72.
24. Kripke M.L. Antigenicity of murine skin tumors induced by ultraviolet light. J Natl Cancer Inst 1974;53:1333–6.
J Natl Cancer Inst 1974;53:1333–6.
25. Vaage J. Nonvirus-associated antigens in virus-induced mammary tumors. Cancer Res 1968;28:2477–83.
26. Thorn R.M. Specific inhibition of cytotoxic memory cells produced against UV-induced tumors in UV-irradiated mice. J Immunol 1978;121(5):1920–6.
27. Denfeld R.W., Tesmann J.P., Dittmar H. et al. Further characterization of UVB radiation effects on Langerhans cells: altered expression of the costimulatory molecules B7–1 and B7–2. Photochem Photobiol 1998;67(5):554–60.
28. Roberts L.K., Daynes R.A. Modification of immunogenic properties of chemically induced tumors arising in hosts treated concomitantly with ultraviolet light. J Immunol 1980;125(1):438–47.
29. Verel I., Heider K.H., Siegmund M. et al. Tumor targeting properties of monoclonal antibodies with different affinity for target antigen CD44V6 in nude mice bearing headand-neck cancer xenografts. Int J Cancer 2002;99(3):396–402.
30. Legrand N., Freitas A.A. CD8+ T lymphocytes in double alpha beta TCR transgenic mice. I. TCR expression and thymus selection in the absence or in the presence of self-antigen. J Immunol 2001;167(11):6150–7.
31. Ma X., Robin C., Ottersbach K., Dzierzak E. The Ly-6A(Sca-1) GFP Transgene is expressed in all adult mouse hematopoietic stem cells. Stem Cells 2002;20(6):514–21.
32. Johnsen A.K., France J., Nagy N. et al. Systemic deficits in transporter for antigen presentation (TAP) – 1 or proteasome subunit LMP2 have little or no effect on tumor incidence. Int J Cancer 2001;91(3):366–72.
Int J Cancer 2001;91(3):366–72.
33. Matechak E.O., Killeen N., Hedrick S.M., Fowlkes B.J. MHC class-II-specific T-cells can develop in the CD8 lineage when CD4 is absent. Immunity 1996;4(4):337–47.
34. Quinonez R., Sutton R.E. Lentiviral vectors for gene delivery into cells. DNA CellBiol 2002;21(12):937–51.
35. Sumimoto H., Tsuji T., Miyoshi H. et al.Rapid and efficient generation of lentivirally gene-modified dendritic cells from DC progenitors with bone marrow stromal cells. J Immunol Methods 2002;271(1–2):153–65.
36. Dunn G.P., Bruce A.T., Ikeda H. et al. Cancer immunoediting: from immunosurveillance to tumor escape. Nat Immunol 2002;3(11):991–8.
37. Dunn G.P., Old L.J., Schreiber R.D. The three Es of cancer immunoediting. Ann Rev Immunol 2004;22:329–60.
Dunn G.P., Old L.J., Schreiber R.D. The three Es of cancer immunoediting. Ann Rev Immunol 2004;22:329–60.
38. Lin R.L., Zhao L.J. Mechanistic basis and clinical relevance of the role of transforming growth factor-β in cancer. Cancer Biol Med 2015;12(4):385–93.
39. Munn D.H., Mellor A.L. IDO in the tumor microenvironment: inflammation, counter-regulation, and tolerance. Trends Immunol 2016;37(3):193–207.
40. Silaeva Y.Y., Grinenko T.S., Vagida M.S. et al. Immune selection of tumor cells in TCR β-chain transgenic mice. J Immunotoxicol 2014;11(4):393–9.
41. Zvezdova E.S., Grinenko T.S., Pobezinskaya E.L. et al. Coreceptor function of CD4 in response to the MHC class I Molecule. Mol Biol(Mosk) 2008;42(4):662–72.
Mol Biol(Mosk) 2008;42(4):662–72.
42. Kazansky D.B. MHC-restriction and allogeneic immune responses. J Immunotoxicol 2008;5(4):369–84.
43. Janeway C.A. Jr, Bottomly K. Signals and signs for lymphocyte responses. Cell 1994;76(2):275–85.
44. Grakoui A., Bromley S.K., Sumen C. et al. The immunological synapse: a molecular machine controlling T-cell activation. Science 1999;285(5425):221–7.
45. Holdorf A.D., Lee K.H., Burack W.R. et al. Regulation of Lck activity by CD4 and CD28 in the immunological synapse. Nat Immunol 2002;3(3):259–64.
46. Goldstein J.S., Chen T., Gubina E. et al. ICAM-1 enhances MHC-peptide activation of CD8+ T-cells without an organized immunological synapse. Eur J Immunol 2000;30(11):3266–70.
Eur J Immunol 2000;30(11):3266–70.
47. O’Keefe J.P., Blaine K., Alegre M.L., Gajewski T.F. Formation of a central supramolecular activation cluster is not required for activation of naive CD8+ T-cells. Proc Natl Acad Sci USA 2004;101(25): 9351–6.
48. Ding L., Shevach E.M. Activation of CD4+ T-cells by delivery of the B7 costimulatory signal on bystander antigenpresenting cells (trans-costimulation). Eur J Immunol 1994;24(4):859–66.
49. Smythe J.A., Fink P.D., Logan G.J. et al. Human fibroblasts transduced with CD80 or CD86 efficiently trans-costimulate CD4+ and CD8+ T lymphocytes in HLA-restricted reactions: implications for immune augmentation cancer therapy and autoimmunity. J Immunol 1999;163(6):3239–49.
50. Kundig T.M., Bachmann M.F., DiPaolo C. et al. Fibroblasts as efficient antigenpresenting cells in lymphoid organs. Science 1995;268(5215):1343–7.
Kundig T.M., Bachmann M.F., DiPaolo C. et al. Fibroblasts as efficient antigenpresenting cells in lymphoid organs. Science 1995;268(5215):1343–7.
51. Ochsenbein A.F., Sierro S., Odermatt B. et al. Roles of tumour localization, second signals and cross priming in cytotoxic T-cell induction. Nature 2001;411(6841): 1058–64.
52. Побезинский Л.А., Побезинская Е.Л., Звездова Е.С. и др. Накопление нейтрофилов в селезенке мышей, иммунизированных клетками аллогенных опухолей. Доклады академии наук 2005;402(3):421–6. [Pobezinskiy L.А., Pobezinskaya Е.L., Zvezdovа Е.S. et al. Neutrophils’ accumulation in the spleen of mice, immunized with allogenic tumors’ cells. Doklady akademii nauk = Reports of the Academy of Sciences 2005;402(3):421–6. (In Russ.)].
53. Марюхнич Е. В., Звездова Е.С., Анфалова Т.В. и др. Функциональная роль нейтрофилоподобных клеток селезенки в иммунном ответе на клетки аллогенных опухолей. Доклады академии наук 2007;414(1):126–9. [Маryukhnich Е.V., Zvezdovа Е.S., Аnfalovа Т.V. et al. Functional role of neutrophil-like cells of the spleen in the immune response to cells of allogenic tumors. Doklady akademii nauk = Reports of the Academy of Sciences 2007;414(1):126–9. (In Russ.)].
В., Звездова Е.С., Анфалова Т.В. и др. Функциональная роль нейтрофилоподобных клеток селезенки в иммунном ответе на клетки аллогенных опухолей. Доклады академии наук 2007;414(1):126–9. [Маryukhnich Е.V., Zvezdovа Е.S., Аnfalovа Т.V. et al. Functional role of neutrophil-like cells of the spleen in the immune response to cells of allogenic tumors. Doklady akademii nauk = Reports of the Academy of Sciences 2007;414(1):126–9. (In Russ.)].
54. Iking-Konert C., Cseko C., Wagner C. et al. Transdifferentiation of polymorphonuclear neutrophils: acquisition of CD83 and other functional characteristics of dendritic cells. J Mol Med 2001;79(8):464–74.
55. Tanaka E., Sendo F. Abrogation of tumorinhibitory MRC-OX8+(CD8+) effector T-cell generation in rats by selective depletion of neutrophils in vivo using a monoclonal antibody. Int J Cancer 1993;54(1):131–6.
56. Buonocore S., Surquin M., Le Moine A., et al. Amplification of T-cell responses by neutrophils: relevance to allograft immunity. Immunol Lett 2004;94(3):163–6.
57. Wakim L.M., Bevan M.J. Cross-dressed dendritic cells drive memory CD8+ T-cell activation after viral infection. Nature 2011;471(7340):629–32.
58. Li L., Kim S., Herndon J.M. et al. Crossdressed CD8alpha+/CD103+ dendritic cells prime CD8+ T-cells following vaccination. Proc Natl Acad Sci. USA 2012;109(31):12716–21.
59. Zerrahn J., Held W., Raulet D.H. The MHC reactivity of the T-cell repertoire prior to positive and negative selection. Cell 1997;88(5):627–36.
60. Brondz B.D., Kazansky D.B., Chernysheva A.D., Ivanov V.S. Peptides of a major histocompatibility complex class I (Kb) molecule cause prolongation of skin graft survival and induce specific downregulatory T-cells demonstrable in the mixed lymphocyte reaction. Immunology 1995;86(2):219–23.
Brondz B.D., Kazansky D.B., Chernysheva A.D., Ivanov V.S. Peptides of a major histocompatibility complex class I (Kb) molecule cause prolongation of skin graft survival and induce specific downregulatory T-cells demonstrable in the mixed lymphocyte reaction. Immunology 1995;86(2):219–23.
61. Sun R., Shepherd S.E., Geier S.S. et al. Evidence that the antigen receptors of cytotoxic T lymphocytes interact with a common recognition pattern on the H-2Kb molecule. Immunity 1995;3(5):573–82.
62. Anfalova T.V., Galaktionov V.G., Brondz B.D. The functional transformation of cytotoxic lymphocytes into T-suppressors under the influence of two mediators. Immunol Lett 1997;59(2):121–6.
63. Constantine K.L., Mapelli C., Meyers C.A. et al. Micelle-bound conformational preferences of a peptide derived from a murine major histocompatibility complex class I molecule. J Biol Chem 1993;268(30):22830–7.
J Biol Chem 1993;268(30):22830–7.
64. Nathenson S.G., Geliebter J., Pfaffenbach G.M., Zeff R.A. Murine major histocompatibility complex class-I mutants: molecular analysis and structure-function implications. Annu Rev Immunol 1986;4:471–502.
65. Kazanskii D.B., Chernysheva A.D., Sernova N.V. et al. The nature of epitopes, recognized by T-lymphocytes in the allogenic immune response. Mol Biol (Mosk) 1998;32(4):692–702.
66. Davis M.M., Boniface J.J., Reich Z. et al. Ligand recognition by beta T-cell receptors. Annu Rev Immunol 1998;16: 523–44.
67. Van Kaer L., Ashton-Rickardt P.G., Pleogh H.L., Tonegawa S. TAP1 mutant mice are deficient in antigen presentation, surface class I molecules, and CD8+ T-cells. Cell 1993;71(7):1205–14.
Cell 1993;71(7):1205–14.
68. Kuhns S.T., Tallquist M.D., Johnson A.J. et al. T-cell receptor interaction with class I heavy-chain influence T-cell selection. Proc Natl Acad Sci U S A 1999;97(2):756–60.
69. Willcox B.E., Gao G.F., Wyer J.R. et al. TCR binding to peptide-MHC stabilizes a flexible recognition interface. Immunity 1999;10(3):357–65.
70. Казанский Д.Б., Силаева Ю.Ю., Анфалова Т.В. и др. Использование мультиплетных пептидов для стимуляции специфического клеточного иммунитета. Аллергия, астма и клиническая иммунология 2001;(1):48–51. [Kazanskiy D.B., Silaevа Yu.Yu., Аnfalovа Т.V. et al. Use of multiplet peptides for the stimulation of the specific cell immunity. Allergiya, astma i klinicheskaya immunologiya = Аllergy, Asthma and Clinical Immunology 2001;(1):48–51. (In Russ.)].
(In Russ.)].
71. Казанский Д.Б., Побезинский Л.А., Терещенко Т.С. Мотивы в первичной структуре молекул MHC класса I и их использование для создания синтетических лигандов Т-клеточных рецепторов. Вестник РАМН 2004;(12):25–32. [Kazanskiy D.B., Pobezinskiy L.А., Теreshchenkо Т.S. Моtives in the initial structure of MHC class I molecules and its use for the creation of synthetic ligands of Т-cell receptors. Vestnik RAMN = RAMS Herald 2004;(12):25–32. (In Russ.)].
72. Побезинский Л.А., Побезинская Е.Л., Терещенко Т.С. и др. Периферический пул Т-клеток CD8+ содержит лимфоциты с антигенспецифическими рецепторами, распознающими сингенные молекулы MHC класса II. Онтогенез 2004;35(3): 183–9. [Pobezinskiy L.А., Pobezinskaya Е.L., Теreshchenkо Т.S. et al. The peripheral pool of CD8+ T- cells contains lymphocytes with antigen specific receptors, recognizing syngeneic molecules of MHC class II. Ontogenez = Оntogenesis 2004;35(3):183–9. (In Russ.)].
Ontogenez = Оntogenesis 2004;35(3):183–9. (In Russ.)].
73. Казанский Д.Б. Внутритимусная селекция и иммунотерапия рака. Русский журнал СПИД, рак и общественное здоровье 2007;11(1):25–32. [Kazanskiy D.B. Intrathymic selection and immune therapy of cancer. Russkiy zhurnal SPID, rak i obshchestvennoe zdorov’e = Russian Journal for AIDS, Cancer and Public Health 2007;11(1):25–32. (In Russ.)].
74. Kazansky D.B. Intrathymic selection: new insight into tumor immunology. Adv Exp Med Biol 2007;601:133–44.
75. Derbinski J., Schulte A., Kyewski B., Klein L. Promiscuous gene expression in medullary thymic epithelial cells mirrors the peripheral self. Nature Immunol 2001;2(11):1032–9.
76. Anderson M.S., Venanzi E.S., Klein L. et al. Protection of an immunological self shadow within the thymus by the aire protein. Science 2002;289(5597):1395–401.
Anderson M.S., Venanzi E.S., Klein L. et al. Protection of an immunological self shadow within the thymus by the aire protein. Science 2002;289(5597):1395–401.
77. Liston A., Lesage S., Wilson J. et al. Aire regulates negative selection of organ-specific T-cells. Nat Immunol 2003;4(4):350–4.
78. Gao L., Bellantuono I., Elsasser A. et al. Selective elimination of leukemic CD34(+) progenitor cells by cytotoxic T lymphocytes specific for WT1. Blood 2000;95(7):2198–203.
79. Rosenberg S.A., Restifo N.P. Adoptive cell transfer as personalized immunotherapy for human cancer. Science 2015;348(6230):62–8.
80. Klebanoff C.A., Rosenberg S.A., Restifo N.P. Prospects for gene-engineered T-cell immunotherapy for solid cancers. Nat Med 2016;22(1):26–36.
Nat Med 2016;22(1):26–36.
81. Казанский Д.Б., Петрищев В.Н., Штиль А.А. и др. Использование теплового шока антигенпрезентирующих клеток для функционального тестирования аллоспецифических Т-клеток памяти. Биоорганическая химия 1999;(25):117–28. [Kazanskiy D.B., Petrishchev V.N., Shtil’ А.А. et al. Use of the thermal shock of antigen presenting cells for the functional testing of allospecific memory Т-cells. Bioorganicheskaya khimiya = Bioorganic Chemistry 1999;(25):117–28. (In Russ.)].
82. Гриненко Т.С., Побезинская Е.Л., Побезинский Л.А. и др. Подавление клетками памяти CD8+ первичного аллогенного ответа. Бюллютень экспериментальной биологии и медицины 2005;(140):556–61. [Grinenko Т.S., Pobezinskaya Е.L., Pobezinskiy L.А. et al. Suppression of the initial allogeneic response by CD8+ memory cells. Byullyuten’ eksperimental’noy biologii i meditsiny = Bulletin of the Experimental Biology and Medicine 2005;(140):556–61. (In Russ.)].
(In Russ.)].
83. Побезинская Е.Л., Побезинский Л.А., Силаева Ю.Ю. и др. Кросс-реактивность Т-клеточного рецептора клона клеток памяти CD8+, полученного в ответе на иммунизацию клетками аллогенной опухоли. Бюллютень экспериментальной биологии и медицины 2004;(137):563–8. [Pobezinskaya Е.L., Pobezinskiy L.А., Silaevа Yu.Yu. et al. Cross-reactivity of the Т-cell receptor of the clone of CD8+ memory cells, received in the response of for the immunization by allogeneic tumor cells. Byullyuten’ eksperimental’noy biologii i meditsiny = Bulletin of the Experimental Biology and Medicine 2004;(137):563–8. (In Russ.)].
84. Звездова Е.С., Силаева Ю.Ю., Вагида М.С. и др. Создание трансгенных животных, экспрессирующих α- и β-цепи аутореактивного TCR. Молекулярная биология 2010;(44):311–22. [Zvezdovа Е.S., Silaevа Yu.Yu., Vagidа М.S. et al. Сreation of transgenic animals, expressing α- and β-chains of the autoreactive TCR. Molekulyarnaya biologiya = Моlecular Biology 2010;(44):311–22. (In Russ.)].
Molekulyarnaya biologiya = Моlecular Biology 2010;(44):311–22. (In Russ.)].
85. Силаева Ю.Ю., Калинина А.А., Вагида М.С. и др. Сокращение пула Т-лимфоцитов с поверхностным фенотипом эффекторов и клеток памяти под воздействием экспрессии трансгена β-цепи Т-клеточного рецептора. Биохимия 2013;78(5):714–26. [Silaevа Yu.Yu., Kalininа А.А., Vagidа М.S. et al. Reduction of the pool of Т-lymphocytes with the surface phenotype of effectors and memory cells, influenced by the expression of transgene of the β-chain of the Т-cell receptor. Biokhimiya = Biochemistry 2013;78(5):714–26. (In Russ.)].
86. Silaeva Y.Y., Grinenko T.S., Vagida M.S. et al. Immune selection of tumor cells in TCR β-chain transgenic mice. J Immunotoxicol 2014;11(4):393–9.
87. Казанский Д.Б. Трансгенные технологии создания иммунологической защиты организма. Cборник докладов семинара Фонда перспективных исследований «Проблемные вопросы иммунологии» 03 октября 2014 г., М.: Б-принт, 2015. С. 17–25. [Kazanskiy D.B. Тransgene technologies of the creation of the immunologic protection of the organism. Volume of reports of the workshop of the Prospective Research Foundation “Problematic Immunology Issues” October 03 2014, Мoscow: B-print, 2015. Pp. 17–25. (In Russ.)].
Трансгенные технологии создания иммунологической защиты организма. Cборник докладов семинара Фонда перспективных исследований «Проблемные вопросы иммунологии» 03 октября 2014 г., М.: Б-принт, 2015. С. 17–25. [Kazanskiy D.B. Тransgene technologies of the creation of the immunologic protection of the organism. Volume of reports of the workshop of the Prospective Research Foundation “Problematic Immunology Issues” October 03 2014, Мoscow: B-print, 2015. Pp. 17–25. (In Russ.)].
88. Mackay L.K., Rahimpour A., Ma J.Z. et al. The developmental pathway for CD103(+) CD8+ tissue-resident memory T-cells of skin. Nat Immunol 2013;14(12):1294–301.
Члены семей пациентов с COVID-19 имеют Т-клеточный иммунитет
На текущий момент пандемии COVID-19 очень важно исследовать силу и продолжительность иммунного ответа на вирус SARS-CoV-2. Понимание этих параметров критично для эпидемиологических прогнозов и оценки действия вакцины. Появляется все больше данных о том, что Т-клеточный ответ на вирус играет не меньшую роль, чем образование специфических антител. Французские вирусологи и иммунологи из Страсбургского и Руанского университетов изучили формирование иммунного ответа на SARS-CoV-2 в семьях пациентов с COVID-19, их статья опубликована на сайте препринтов medRxiv.
Понимание этих параметров критично для эпидемиологических прогнозов и оценки действия вакцины. Появляется все больше данных о том, что Т-клеточный ответ на вирус играет не меньшую роль, чем образование специфических антител. Французские вирусологи и иммунологи из Страсбургского и Руанского университетов изучили формирование иммунного ответа на SARS-CoV-2 в семьях пациентов с COVID-19, их статья опубликована на сайте препринтов medRxiv.
В исследовании участвовали семь семей; в каждой был по крайней мере один человек (в одной семье трое) с положительным ПЦР-тестом на SARS-CoV-2 и симптомами COVID-19 средней тяжести, которые продолжались от 2 до 15 дней (медианная длительность 7 дней). У них и восьми членов их семей взяли анализ крови в период от 47 до 69 дней от начала симптомов. Контрольную группу составили десять здоровых доноров, которые не контактировали с заболевшими людьми.
Все члены семей в обиходе мыли руки, и все, за исключением одной семьи, исключили объятия и поцелуи. В двух семьях пациенты и другие члены семьи питались отдельно и (или) использовали дома маски, правда, соблюдали эти правила недолго: одна семья — день, другая три дня после появления симптомов. ПЦР-тест на SARS-CoV-2, проведенный в четырех семьях, был позитивным для всех пациентов и негативных для всех контактных членов семей. Из восьми контактных членов семей у шести появились симптомы заболевания, у двух симптомов не было.
В двух семьях пациенты и другие члены семьи питались отдельно и (или) использовали дома маски, правда, соблюдали эти правила недолго: одна семья — день, другая три дня после появления симптомов. ПЦР-тест на SARS-CoV-2, проведенный в четырех семьях, был позитивным для всех пациентов и негативных для всех контактных членов семей. Из восьми контактных членов семей у шести появились симптомы заболевания, у двух симптомов не было.
Тестирование на антитела к белкам вируса S и N в период от 47 до 69 дней от начала симптомов показало у всех пациентов наличие антител IgG; ни у одного из контактных лиц IgG не были обнаружены.
Для обнаружения Т-клеточного ответа клетки из образцов крови стимулировали различными вирусными белками, а затем проводили анализ ELISPOT на интерферон гамма — его продуцируют Т-лимфоциты в ответ на антиген. У всех пациентов был получен Т-клеточный ответ на четыре структурных белка вируса (S1, S2, N и M), кроме того, у шести пациентов — по меньшей мере на один вспомогательный белок. Время взятия крови показывает, что специфический Т-клеточный ответ сохраняется у переболевших COVID-19 средней тяжести до 69 дней от начала симптомов.
Время взятия крови показывает, что специфический Т-клеточный ответ сохраняется у переболевших COVID-19 средней тяжести до 69 дней от начала симптомов.
У шести из восьми контактных лиц тоже был Т-клеточный ответ хотя бы на один антигенный вирусный белок; из них у двух — на пять вирусных белков, у одного — на два белка, у трех – на три. Иначе говоря, по набору антигенов клеточный иммунитет у членов семей был не таким, как у первичных пациентов. Но по количеству специфических Т-клеток, вырабатывающих интерферон гамма, различия не было. Те и другие радикально отличались от здоровых добровольцев контрольной группы. Эти данные позволяют утверждать, что контактные члены семьи выработали специфический Т-клеточный иммунитет к SARS-CoV-2.
Ранее было высказано предположение,
что клеточный иммунитет к SARS-CoV-2 может быть результатом кроссреактивности Т-клеток, специфичных к сезонным коронавирусам. Чтобы учесть этот фактор, авторы данной работы протестировали пациентов, контактных членов семей и здоровых доноров на Т-клеточный ответ на два белка (S1 и S2) сезонных коронавирусов (HCoV-229E и HCoV-OC43). Этот вид иммунитета в одинаковой степени обнаружился во всех группах: и у пациентов, и у контактных членов семей, и у здоровых доноров (кроме одного). В то же время по Т-клеточному ответу на SARS-CoV-2 первые две группы, как уже сказано, радикально отличались от контрольной. Это доказывает, что в данном случае работает именно специфический клеточный иммунитет к новому коронавирусу.
Этот вид иммунитета в одинаковой степени обнаружился во всех группах: и у пациентов, и у контактных членов семей, и у здоровых доноров (кроме одного). В то же время по Т-клеточному ответу на SARS-CoV-2 первые две группы, как уже сказано, радикально отличались от контрольной. Это доказывает, что в данном случае работает именно специфический клеточный иммунитет к новому коронавирусу.
Итак, впервые показано, что внутрисемейный контакт с заболевшим COVID-19 человеком формирует Т-клеточный ответ на вирус, даже если антитела не образуются. Авторы делают вывод, что Т-клеточный ответ может быть более чувствительным индикатором перенесенного заболевания, чем антитела. По их мнению, эпидемиологические данные, основанные только на анализе антител, могут вести к недооценке числа переболевших людей в популяции.
Клеточный иммунитет против антител. Эксперт рассказал, что эффективнее помогает бороться с коронавирусом
Вслух.ру
21 октября 2020, 12:57
О том, что коронавирусом можно переболеть повторно, уже известно. Что антитела помогут спастись от этого — тоже. Но, как выяснилось, через месяц-два, может, полгода они пропадают из крови. Теперь ученые и врачи заговорили о клеточном иммунитете. Подробнее об этом рассказал в программе «Вечерний хэштег» на канале «Тюменское время» московский иммунолог Николай Крючков.
Что антитела помогут спастись от этого — тоже. Но, как выяснилось, через месяц-два, может, полгода они пропадают из крови. Теперь ученые и врачи заговорили о клеточном иммунитете. Подробнее об этом рассказал в программе «Вечерний хэштег» на канале «Тюменское время» московский иммунолог Николай Крючков.
Иммунная система включает в себя неспецифический, врожденный, иммунитет и специфический. Второй условно можно разделить на гуморальный, это известные всем антитела, и клеточный — как следует из названия, это клетки иммунной системы. Последние, в свою очередь, тоже делятся на виды, но в случае с коронавирусом важны лимфоциты.
Когда инфекция впервые попадает в организм, ему нужно время, чтобы познакомиться с ней и понять, как реагировать. Для этого антиген презентуется организму — представляется ему и нужным клеткам, и затем против этого антигена начинают вырабатываться специфические лимфоциты, в том числе клетки памяти. Это нужно, чтобы во вторую встречу с коронавирусом организм был уже подготовлен и имел клетки, которые реагируют на этот антиген.
Клетки памяти живут годами, но все не так хорошо, как может показаться. Иммунолог отметил, что у россиян выработаны клеточная память и антитела к прошлым видам коронавирусной инфекции, но они не помогают в насущной борьбе.
«Само наличие клеток памяти не говорит о том, что организм автоматически имеет очень эффективную защиту от этого возбудителя в будущем. Да, мы предполагаем, что наличие этих клеток положительно сказывается на защите организма, но утверждать этого не можем. Вероятно, наличие клеток памяти снижает тяжесть заболевания. Но уже известно, что как минимум в течение года есть высокие шансы заразиться повторно», — пояснил Николай Крючков.
Сказать, что эффективнее, клеточный иммунитет или антитела, нельзя — они работают сообща. Антительный ответ регулируется клетками иммунной системы, а само наличие антител регулирует клеточный иммунный ответ.
Фото: pixabay
Т-клеток и клеточный иммунитет
Цитотоксические Т-лимфоциты и поверхности слизистой оболочки
В лимфатической системе находятся большие популяции иммунных клеток, которые высвобождаются при обнаружении патогена.
Цели обучения
Опишите особенности лимфатической системы, связанные с иммунным ответом
Основные выводы
Ключевые моменты
- Лимфатическая система содержит лимфу: жидкость, которая омывает ткани и органы и содержит лейкоциты (не эритроциты).
- После созревания В- и Т-клеток большинство из них попадает в лимфатическую систему, где они хранятся в лимфатических узлах до тех пор, пока они не понадобятся.
- Лимфатические узлы также хранят дендритные клетки и макрофаги; поскольку антигены фильтруются через лимфатическую систему, эти клетки собирают их, чтобы представить их В- и Т-клеткам.
- Селезенка, которая является кровью, чем лимфатические узлы для лимфы, фильтрует инородные вещества и патогенные микроорганизмы в комплексе с антителами из крови.
Ключевые термины
- лимфа : бесцветная водянистая жидкость организма, переносимая лимфатической системой, состоящая в основном из лейкоцитов
Лимфатическая система
Лимфа, водянистая жидкость, омывающая ткани и органы, содержит защитные белые кровяные тельца, но не содержит эритроцитов (красных кровяных телец). Лимфа движется по телу через лимфатическую систему, которая состоит из сосудов, лимфатических протоков, лимфатических узлов и органов, таких как миндалины, аденоиды, тимус и селезенка. Хотя иммунная система характеризуется циркулирующими клетками по всему телу, регуляция, созревание и взаимодействие иммунных факторов происходят в определенных участках, известных как лимфатические узлы.
Лимфа движется по телу через лимфатическую систему, которая состоит из сосудов, лимфатических протоков, лимфатических узлов и органов, таких как миндалины, аденоиды, тимус и селезенка. Хотя иммунная система характеризуется циркулирующими клетками по всему телу, регуляция, созревание и взаимодействие иммунных факторов происходят в определенных участках, известных как лимфатические узлы.
Кровь обеспечивает циркуляцию иммунных клеток, белков и других факторов в организме. Примерно 0,1 процента всех клеток крови составляют лейкоциты, в том числе моноциты (предшественники макрофагов) и лимфоциты.Большинство клеток крови — это эритроциты. Клетки иммунной системы могут перемещаться между отдельными лимфатической и кровеносной системами кровообращения, которые разделены интерстициальным пространством, посредством процесса, называемого экстравазацией (прохождение через окружающие ткани).
Напомним, что клетки иммунной системы происходят из стволовых клеток костного мозга. Созревание В-клеток происходит в костном мозге, тогда как клетки-предшественники мигрируют из костного мозга, развиваются и созревают в наивные Т-клетки в органе, называемом тимусом. По мере созревания Т- и В-лимфоциты циркулируют по разным направлениям. В лимфатических узлах, разбросанных по всему телу, находятся большие популяции Т- и В-клеток, дендритных клеток и макрофагов. Лимфа собирает антигены по мере оттока из тканей. Эти антигены фильтруются через лимфатические узлы, прежде чем лимфа возвращается в кровоток. Антигенпрезентирующие клетки (APC) в лимфатических узлах захватывают и обрабатывают антигены, информируя соседние лимфоциты о потенциальных патогенах.
По мере созревания Т- и В-лимфоциты циркулируют по разным направлениям. В лимфатических узлах, разбросанных по всему телу, находятся большие популяции Т- и В-клеток, дендритных клеток и макрофагов. Лимфа собирает антигены по мере оттока из тканей. Эти антигены фильтруются через лимфатические узлы, прежде чем лимфа возвращается в кровоток. Антигенпрезентирующие клетки (APC) в лимфатических узлах захватывают и обрабатывают антигены, информируя соседние лимфоциты о потенциальных патогенах.
Лимфатическая система : (a) Лимфатические сосуды переносят прозрачную жидкость, называемую лимфой, по всему телу.Жидкость проходит через (b) лимфатические узлы, которые фильтруют лимфу, которая входит в узел через афферентные сосуды, а выходит через эфферентные сосуды. Лимфатические узлы заполнены лимфоцитами, которые очищают инфицированные клетки.
В селезенке находятся В- и Т-клетки, макрофаги, дендритные клетки и NK-клетки. Селезенка также является местом, где APC, захватившие инородные частицы в крови, могут связываться с лимфоцитами. Антитела синтезируются и секретируются активированными плазматическими клетками селезенки, которые фильтруют чужеродные вещества и патогенные микроорганизмы в комплексе с антителами из крови.Функционально селезенка относится к крови, как лимфатические узлы к лимфе.
Антитела синтезируются и секретируются активированными плазматическими клетками селезенки, которые фильтруют чужеродные вещества и патогенные микроорганизмы в комплексе с антителами из крови.Функционально селезенка относится к крови, как лимфатические узлы к лимфе.
Селезенка в лимфатической системе : функция селезенки заключается в иммунологической фильтрации крови и обеспечении связи между клетками, соответствующими врожденным и адаптивным иммунным ответам.
Классы Т-клеток
Т-клетки играют центральную роль в клеточно-опосредованном иммунном ответе за счет использования поверхностного Т-клеточного рецептора для распознавания пептидных антигенов.
Цели обучения
Различают наивные, эффекторные (хелперные и цитотоксические), Т-клетки памяти и регуляторные Т-клетки
Основные выводы
Ключевые моменты
- Предшественники Т-клеток происходят из костного мозга, но перемещаются в тимус, где созревают.
 Т-клетки
Т-клетки - можно разделить на три основных подтипа: эффекторные, клетки памяти и регуляторные клетки. Каждый тип выполняет определенную функцию во время иммунного ответа на чужеродные антигены. Подтипы
- Т-клеток дифференцируются по экспрессии уникальных маркеров клеточной поверхности, таких как CD4 для хелперных Т-клеток и CD8 для цитолитических или цитотоксических Т-клеток.
Ключевые термины
- цитотоксический : относится к цитотоксину или является цитотоксином
- цитолитический : Относящийся к цитолизу или относящийся к нему
Клеточный иммунитет опосредуется T лимфоцитами , также называемыми T-клетками.Их название относится к органу, из которого они произведены: вилочковой железе. Этот тип иммунитета способствует уничтожению микробов, находящихся в фагоцитах, или уничтожению инфицированных клеток для устранения резервуаров инфекции. Т-клетки не производят молекулы антител. У них есть антигенные рецепторы, структурно связанные с антителами. Эти структуры помогают распознавать антигены только в виде пептидов, отображаемых на поверхности антигенпрезентирующих клеток.
У них есть антигенные рецепторы, структурно связанные с антителами. Эти структуры помогают распознавать антигены только в виде пептидов, отображаемых на поверхности антигенпрезентирующих клеток.
Т-клетки состоят из функционально различных популяций.К ним относятся наивные Т-клетки, которые распознают антигены и активируются в периферических лимфоидных органах. Эта активация приводит к увеличению пула антиген-специфических лимфоцитов и дифференцировке этих клеток в эффекторные клетки и клетки памяти. Эффекторные клетки включают хелперные Т-клетки и цитолитические или цитотоксические Т-клетки. В ответ на антигенную стимуляцию хелперные Т-клетки (характеризующиеся экспрессией маркера CD4 на своей поверхности) секретируют белки, называемые цитокинами, функция которых заключается в стимуляции пролиферации и дифференцировки самих Т-клеток, а также других клеток, включая В-клетки. , макрофаги и другие лейкоциты.Цитолитические или цитотоксические Т-клетки (характеризующиеся экспрессией маркера CD8 на их поверхности) убивают клетки, продуцирующие чужеродные антигены, такие как клетки, инфицированные вирусами и другими внутриклеточными микробами.
Клеточно-опосредованный иммунитет : Т-клетки способствуют уничтожению клеток, которые проглотили микроорганизмы и представляют чужеродные антигены на своей поверхности.
Т-клетки памяти представляют собой увеличенную популяцию Т-клеток, специфичных к антигенам, которые могут быстро реагировать на последующее столкновение с этим антигеном и дифференцироваться в эффекторную клетку для устранения антигена.Другой класс Т-клеток, называемый регуляторными Т-клетками, действует, чтобы подавлять иммунный ответ и устранять воспаление. Их основная роль заключается в отключении опосредованного Т-клетками иммунитета к концу иммунной реакции.
Клеточный иммунитет
Клеточно-опосредованный иммунитет включает цитотоксические Т-клетки, распознающие инфицированные клетки и вызывающие их разрушение.
Цели обучения
Обобщить клеточно-опосредованный иммунный ответ
Основные выводы
Ключевые моменты
- Как только патоген попадает в клетку, он больше не может быть обнаружен гуморальным иммунным ответом; вместо этого клеточно-опосредованный иммунный ответ должен взять верх, чтобы убить инфицированную клетку, прежде чем он сможет позволить вирусу или бактериям размножаться и распространяться.

- Т-клетки распознают инфицированные клетки, взаимодействуя с антигеном, присутствующим на их молекулах MHC II; прежде чем Т-клетка сможет это сделать, она должна быть активирована посредством взаимодействия с антигенпрезентирующей клеткой или APC.
- Как только цитотоксическая Т-клетка (T C ) активируется, она клонирует себя, производя множество клеток T C с правильными рецепторами; некоторая часть клеток активна и помогает уничтожить инфицированные клетки, в то время как другие являются неактивными клетками памяти, которые будут создавать более активные клетки T C , если инфекция вернется.
- Т-хелперы (клетки T H ) также способствуют клеточному иммунитету, высвобождая сигнальные молекулы, известные как цитокины, которые могут привлекать естественные клетки-киллеры и фагоциты для уничтожения инфицированных клеток и дальнейшей активации клеток T C ; они не уничтожают патогены напрямую.
Ключевые термины
- цитотоксические Т-клетки : подгруппа лимфоцитов (лейкоцитов), которые способны вызывать смерть инфицированных соматических или опухолевых клеток; часть клеточного иммунитета
- цитокин : любой из различных малых регуляторных белков, которые регулируют клетки иммунной системы; они высвобождаются после привязки PRR к PAMPS
Т-клетки
Подобно тому, как гуморальный иммунный ответ имеет В-клетки, которые опосредуют его ответ, клеточный иммунный ответ имеет Т-клетки, которые распознают инфицированные клетки и уничтожают их до того, как патоген внутри сможет реплицироваться и распространиться, чтобы заразить другие клетки. В отличие от В-клеток, Т-лимфоциты (Т-клетки) не могут распознавать патогены без посторонней помощи. Во-первых, антигенпрезентирующая клетка (APC, такая как дендритная клетка или макрофаг) обнаруживает, поглощает (посредством фагоцитоза в случае макрофагов или путем проникновения патогена самостоятельно в случае дендритных клеток) и переваривает патогены на сотни или тысячи фрагментов антигенов. Затем эти фрагменты транспортируются на поверхность APC, где они представлены на белках, известных как главные комплексы гистосовместимости класса II (MHC II, см.).Т-клетки активируются по отношению к определенному антигену, как только они обнаруживают, что он отображается на MHC II. После того, как вирус или бактерия попадают в клетку, гуморальный иммунный ответ больше не может их обнаружить. Вместо этого должен преобладать клеточный иммунный ответ. Для этого Т-клетка активируется путем взаимодействия с антигеном инфицированной клетки или вируса, представленного на MHC II APC.
В отличие от В-клеток, Т-лимфоциты (Т-клетки) не могут распознавать патогены без посторонней помощи. Во-первых, антигенпрезентирующая клетка (APC, такая как дендритная клетка или макрофаг) обнаруживает, поглощает (посредством фагоцитоза в случае макрофагов или путем проникновения патогена самостоятельно в случае дендритных клеток) и переваривает патогены на сотни или тысячи фрагментов антигенов. Затем эти фрагменты транспортируются на поверхность APC, где они представлены на белках, известных как главные комплексы гистосовместимости класса II (MHC II, см.).Т-клетки активируются по отношению к определенному антигену, как только они обнаруживают, что он отображается на MHC II. После того, как вирус или бактерия попадают в клетку, гуморальный иммунный ответ больше не может их обнаружить. Вместо этого должен преобладать клеточный иммунный ответ. Для этого Т-клетка активируется путем взаимодействия с антигеном инфицированной клетки или вируса, представленного на MHC II APC.
APC, MHC и лимфоциты : антигенпрезентирующая клетка (APC), такая как макрофаг, поглощает чужеродный антиген, частично переваривает его в лизосоме, а затем встраивает в молекулу MHC класса II для представления в клетке поверхность. Лимфоциты адаптивного иммунного ответа должны взаимодействовать с встроенными в антиген молекулами MHC класса II, чтобы созреть в функциональные иммунные клетки.
Лимфоциты адаптивного иммунного ответа должны взаимодействовать с встроенными в антиген молекулами MHC класса II, чтобы созреть в функциональные иммунные клетки.
Цитотоксические Т-клетки опосредуют одно из звеньев клеточного иммунного ответа
Существует два основных типа Т-клеток: хелперные Т-лимфоциты (T H ) и цитотоксические Т-лимфоциты (T C ). Лимфоциты T H действуют косвенно, сообщая другим иммунным клеткам о потенциальных патогенах, в то время как цитотоксические Т-клетки (T C ) являются ключевым компонентом клеточно-опосредованной части адаптивной иммунной системы, которая атакует и уничтожает инфицированные клетки.Клетки T C особенно важны для защиты от вирусных инфекций, потому что вирусы реплицируются внутри клеток, где они защищены от внеклеточного контакта с циркулирующими антителами. После активации T C создает большой клон клеток с одним специфическим набором рецепторов клеточной поверхности, подобно пролиферации активированных B-клеток. Как и B-клетки, клон включает активные клетки T C и неактивные клетки памяти T C . Полученные в результате активные клетки T C затем идентифицируют инфицированные клетки-хозяева.
Как и B-клетки, клон включает активные клетки T C и неактивные клетки памяти T C . Полученные в результате активные клетки T C затем идентифицируют инфицированные клетки-хозяева.
T Клетки C пытаются идентифицировать и уничтожать инфицированные клетки, вызывая апоптоз (запрограммированную гибель клеток) до того, как патоген сможет реплицироваться и ускользнуть, тем самым останавливая прогрессирование внутриклеточных инфекций. Чтобы распознать, какие клетки следует преследовать, T C распознает антигены, представленные на комплексах MHC I, которые присутствуют на всех ядросодержащих клетках. Комплексы MHC I отображают текущее считывание внутриклеточных белков внутри клетки и представляют антигены патогена, если патоген присутствует в клетке.Клетки T C также поддерживают лимфоциты NK для уничтожения ранних раковых образований.
Цитокины, высвобождаемые клетками T
H , привлекают NK-клетки и фагоциты Цитокины представляют собой сигнальные молекулы, секретируемые клеткой T H в ответ на инфицированную патогеном клетку; они стимулируют естественные клетки-киллеры и фагоциты, такие как макрофаги. Затем фагоциты поглощают инфицированные клетки и уничтожают их. Цитокины также участвуют в стимуляции клеток T C , повышая их способность идентифицировать и уничтожать инфицированные клетки и опухоли.Краткое изложение того, как активируются гуморальные и клеточно-опосредованные иммунные ответы, представлено в плазматических клетках B и клетках T C , которые вместе называются эффекторными клетками, потому что они участвуют в «воздействии» (вызывая) иммунный ответ уничтожения патогенов и инфицированные клетки-хозяева.
Затем фагоциты поглощают инфицированные клетки и уничтожают их. Цитокины также участвуют в стимуляции клеток T C , повышая их способность идентифицировать и уничтожать инфицированные клетки и опухоли.Краткое изложение того, как активируются гуморальные и клеточно-опосредованные иммунные ответы, представлено в плазматических клетках B и клетках T C , которые вместе называются эффекторными клетками, потому что они участвуют в «воздействии» (вызывая) иммунный ответ уничтожения патогенов и инфицированные клетки-хозяева.
Т-хелперы в иммунном ответе : Т-хелперы активируются путем связывания с антигеном, представленным APC, через рецептор MHCII, заставляя его высвобождать цитокины.В зависимости от высвобождаемых цитокинов это активирует либо гуморальный, либо клеточно-опосредованный иммунный ответ.
Регуляторные Т-клетки
Регуляторные Т-клетки — это подмножество Т-клеток, которые модулируют иммунную систему и контролируют иммунные реакции.
Цели обучения
Опишите функцию и типы регуляторных Т-клеток
Основные выводы
Ключевые моменты
- Регуляторные Т-клетки (Treg) имеют решающее значение для поддержания гомеостаза иммунных клеток, о чем свидетельствуют последствия генетического или физического уничтожения популяции Treg.
- Treg делятся на естественные или индуцированные Treg; Природные Treg — это CD4 + CD25 + Т-клетки, которые развиваются и мигрируют из тимуса, чтобы выполнять свою ключевую роль в иммунном гомеостазе.
- Адаптивные Treg — это нерегулирующие CD4 + Т-клетки, которые приобретают экспрессию CD25 (IL-2R альфа) вне тимуса и обычно индуцируются воспалением и болезненными процессами, такими как аутоиммунитет и рак.
Ключевые термины
- аутоиммунитет : Состояние, при котором иммунная система атакует собственные ткани, т.е.е., аутоиммунное заболевание.
Регуляторные Т-клетки являются компонентом иммунной системы, подавляющим иммунные ответы других клеток. Это важная «самопроверка», встроенная в иммунную систему, чтобы предотвратить чрезмерные реакции и хроническое воспаление. Регуляторные Т-клетки бывают разных форм, из которых наиболее хорошо изучены те, которые экспрессируют CD4, CD25 и Foxp3. Эти клетки также называются CD4 + CD25 + регуляторными Т-клетками или Treg. Эти клетки участвуют в отключении иммунных ответов после того, как они успешно уничтожили вторгшиеся организмы, а также в предотвращении аутоиммунитета.
Это важная «самопроверка», встроенная в иммунную систему, чтобы предотвратить чрезмерные реакции и хроническое воспаление. Регуляторные Т-клетки бывают разных форм, из которых наиболее хорошо изучены те, которые экспрессируют CD4, CD25 и Foxp3. Эти клетки также называются CD4 + CD25 + регуляторными Т-клетками или Treg. Эти клетки участвуют в отключении иммунных ответов после того, как они успешно уничтожили вторгшиеся организмы, а также в предотвращении аутоиммунитета.
CD25 является компонентом рецептора IL2. : рецептор интерлейкина 2 состоит из трех субъединиц (альфа, бета и гамма). CD25 составляет альфа-цепь рецептора IL2.
CD4 + Foxp3 + регуляторные Т-клетки были названы «естественными» регуляторными Т-клетками, чтобы отличить их от популяций «супрессорных» Т-клеток, которые генерируются in vitro . Дополнительные популяции супрессорных Т-клеток включают Tr1, Th4, CD8 + CD28 — и ограниченные Qa-1 Т-клетки. Вклад этих популяций в самотолерантность и иммунный гомеостаз определен менее четко. FOXP3 можно использовать в качестве хорошего маркера для CD4 + CD25 + Т-клеток, а также недавние исследования, показывающие доказательства наличия FOXP3 в CD4 + CD25-Т-клетках.
Вклад этих популяций в самотолерантность и иммунный гомеостаз определен менее четко. FOXP3 можно использовать в качестве хорошего маркера для CD4 + CD25 + Т-клеток, а также недавние исследования, показывающие доказательства наличия FOXP3 в CD4 + CD25-Т-клетках.
Дополнительная подгруппа регуляторных Т-клеток, индуцированные регуляторные Т-клетки, также необходимы для толерантности и подавления. Индуцированные регуляторные T (iTreg) клетки (CD4 + CD25 + Foxp3 + ) являются клетками-супрессорами, участвующими в толерантности.Было показано, что клетки iTreg подавляют пролиферацию Т-клеток и экспериментальные аутоиммунные заболевания. Клетки iTreg развиваются из зрелых CD4 + обычных Т-клеток вне тимуса: определяющее различие между естественными регуляторными T (nTreg) -клетками и клетками iTreg. Хотя клетки iTreg и nTreg обладают схожей функцией, недавно было показано, что клетки iTreg являются важным неизбыточным регуляторным подмножеством, которое дополняет клетки nTreg, частично за счет увеличения разнообразия TCR в рамках регуляторных ответов. Острое истощение пула клеток iTreg на моделях мышей привело к воспалению и потере веса. Вклад клеток nTreg по сравнению с клетками iTreg в поддержании толерантности неизвестен, но оба важны. Эпигенетические различия наблюдались между клетками nTreg и iTreg, причем первые имели более стабильную экспрессию Foxp3 и более широкое деметилирование.
Острое истощение пула клеток iTreg на моделях мышей привело к воспалению и потере веса. Вклад клеток nTreg по сравнению с клетками iTreg в поддержании толерантности неизвестен, но оба важны. Эпигенетические различия наблюдались между клетками nTreg и iTreg, причем первые имели более стабильную экспрессию Foxp3 и более широкое деметилирование.
Рецепторы Т-клеток
Т-клеточный рецептор (TCR), обнаруженный на поверхности Т-клеток, отвечает за распознавание антигенов.
Цели обучения
Обсудить роль рецептора Т-клеток (TCR)
Основные выводы
Ключевые моменты
- Многие TCR распознают один и тот же антиген, и многие антигены распознаются одним и тем же TCR.
- TCR состоит из двух разных белковых цепей (то есть является гетеродимером). В 95% Т-клеток он состоит из альфа (α) и бета (β) цепей, тогда как в 5% Т-клеток он состоит из гамма и дельта (γ / δ) цепей.
- Когда TCR взаимодействует с антигеном и MHC, Т-лимфоцит активируется посредством серии биохимических событий, опосредованных ассоциированными ферментами, корецепторами, специализированными вспомогательными молекулами и активированными или высвобождаемыми факторами транскрипции.

Ключевые термины
- полиморфный : относящийся к полиморфизму (в любом смысле), может иметь несколько форм или форм
- главный комплекс гистосовместимости : MHC представляет собой молекулу клеточной поверхности, которая опосредует взаимодействия иммунных клеток с другими лейкоцитами или клетками организма. MHC определяет совместимость доноров для трансплантации органов, а также предрасположенность к аутоиммунным заболеваниям. У людей MHC также называют антигеном лейкоцитов человека (HLA).
Т-лимфоцитов обладают двойной специфичностью: они распознают полиморфные остатки молекул собственного главного комплекса гистосовместимости (MHC), что объясняет их ограничение MHC; они также распознают остатки пептидных антигенов, отображаемые этими молекулами MHC, что отвечает за их специфичность. Молекулы MHC и пептиды образуют комплексы на поверхности антигенпрезентирующих клеток (APC). Рецептор, который распознает эти комплексы пептид-MHC, называется рецептором Т-клеток (TCR). Клоны Т-клеток с разной специфичностью экспрессируют разные TCR.
Клоны Т-клеток с разной специфичностью экспрессируют разные TCR.
Биохимические сигналы, которые запускаются в Т-клетках после распознавания антигена, трансдуцируются не самим TCR, а инвариантными белками (CD3 и дзета), которые нековалентно связаны с рецептором антигена с образованием комплекса TCR. Т-клетки также экспрессируют другие мембранные рецепторы, которые не распознают антигены, но участвуют в ответах на антигены; все вместе они называются «вспомогательными молекулами».Физиологическая роль некоторых вспомогательных молекул заключается в доставке сигналов Т-клеткам, которые функционируют совместно с сигналами от комплекса TCR для полной активации клетки.
Антигенный рецептор CD4-хелперных Т-лимфоцитов и цитолитических Т-лимфоцитов CD8 представляет собой гетеродимер, состоящий из двух трансмембранных полипептидных цепей, обозначенных альфа и бета, ковалентно связанных друг с другом дисульфидными связями. Каждая альфа- и бета-цепь состоит из одного вариабельного домена (V), одного константного домена (C), гидрофобной трансмембранной области и короткой цитоплазматической области. V-области TCR содержат короткие участки аминокислот, в которых сконцентрирована вариабельность между различными TCR, и они образуют гипервариабельные или определяющие комплементарность области (CDR). Распознавание комплексов пептид-MHC опосредуется CDR, образованными как альфа-, так и бета-цепями TCR.
V-области TCR содержат короткие участки аминокислот, в которых сконцентрирована вариабельность между различными TCR, и они образуют гипервариабельные или определяющие комплементарность области (CDR). Распознавание комплексов пептид-MHC опосредуется CDR, образованными как альфа-, так и бета-цепями TCR.
Ткань, пораженная прионами : Эта микрофотография ткани головного мозга показывает цитоархитектурные гистопатологические изменения, обнаруженные при губчатой энцефалопатии крупного рогатого скота.Присутствие вакуолей, то есть микроскопических «дыр» в сером веществе, придает мозгу коров, пораженных BSE, губчатый вид, когда срезы тканей исследуются в лаборатории.
Т-клеточный рецептор : Т-клеточный рецептор состоит из альфа- и бета-цепей, трансмембранного домена и цитоплазматической области.
Адаптивный иммунитет и суперсемейство иммуноглобулинов
Адаптивный иммунитет стимулируется воздействием инфекционных агентов и привлекает элементы суперсемейства иммуноглобулинов.
Цели обучения
Опишите роль иммуноглобулинов в адаптивном иммунном ответе, в частности, в гуморальном иммунитете.
Основные выводы
Ключевые моменты
- Концепция адаптивного иммунитета предполагает создание de novo у каждого человека чрезвычайно большого репертуара разнообразных рецепторов и избирательное распространение рецепторов, соответствующих антигену / патогену.
- Адаптивные иммунные рецепторы Т- и В-лимфоидных клеток принадлежат к суперсемейству иммуноглобулинов и создаются путем перестройки генных сегментов.
- Иммуноглобулины — это гликопротеины суперсемейства иммуноглобулинов, которые действуют как антитела.
Ключевые термины
- цитокин : любой из различных небольших регуляторных белков, которые регулируют клетки иммунной системы.
Прецизионность иммуноглобулина
Адаптивный иммунитет стимулируется воздействием инфекционных агентов и усиливается с каждым последующим воздействием определенного микроба. Определяющими характеристиками адаптивного иммунитета являются специфичность для различных молекул и способность «запоминать» и более энергично реагировать на повторяющиеся воздействия одного и того же микроба.
Определяющими характеристиками адаптивного иммунитета являются специфичность для различных молекул и способность «запоминать» и более энергично реагировать на повторяющиеся воздействия одного и того же микроба.
Составляющими адаптивного иммунитета являются лимфоциты и их продукты. Существует два типа адаптивных иммунных ответов: гуморальный иммунитет и клеточный иммунитет. Они управляются различными элементами иммунной системы и действуют по уничтожению различных типов микробов.Защитный иммунитет против микроба может быть индуцирован реакцией хозяина на микроб или переносом антител или лимфоцитов, специфичных для микроба. Антитела или иммуноглобулины связывают антигены в фазе узнавания и эффекторной фазе гуморального иммунитета.
Суперсемейство иммуноглобулинов
Иммуноглобулины производятся в мембраносвязанной форме B-лимфоцитами. Эти мембранные молекулы действуют как рецепторы B-клеток для антигенов. Взаимодействие антигенов с мембранными антителами на наивных В-клетках инициирует активацию В-клеток. Эти активированные В-клетки продуцируют растворимую форму иммуноглобулина, которая запускает эффекторные механизмы для устранения антигенов.
Эти активированные В-клетки продуцируют растворимую форму иммуноглобулина, которая запускает эффекторные механизмы для устранения антигенов.
Активация В-клеток : Когда В-клетка встречает свой запускающий антиген, она дает начало множеству крупных клеток, известных как плазматические клетки. Каждая плазматическая ячейка — это, по сути, фабрика по производству антител. Каждая из плазматических клеток производит миллионы идентичных молекул антител и выбрасывает их в кровоток.
Эти антитела являются частью более крупного семейства, называемого суперсемейством ммуноглобулинов .Суперсемейство иммуноглобулинов (IgSF) представляет собой большую группу поверхностных и растворимых белков клетки, которые участвуют в процессах распознавания, связывания или адгезии клеток. Молекулы классифицируются как члены этого суперсемейства на основании структурных особенностей, общих с иммуноглобулинами, которые также известны как антитела. Все они обладают доменом, известным как домен иммуноглобулина или крат . Члены IgSF включают рецепторы антигена клеточной поверхности, корецепторы и костимуляторные молекулы иммунной системы, молекулы, участвующие в презентации антигена лимфоцитам, молекулы клеточной адгезии, определенные рецепторы цитокинов и внутриклеточные мышечные белки.Они обычно связаны с ролями в иммунной системе.
Члены IgSF включают рецепторы антигена клеточной поверхности, корецепторы и костимуляторные молекулы иммунной системы, молекулы, участвующие в презентации антигена лимфоцитам, молекулы клеточной адгезии, определенные рецепторы цитокинов и внутриклеточные мышечные белки.Они обычно связаны с ролями в иммунной системе.
Роли клеток-мишеней и вирус-специфического клеточного иммунитета в первичной инфекции вируса иммунодефицита обезьян
РЕЗЮМЕ
Продолжаются дискуссии о том, контролируется ли острая вирусная инфекция иммунодефицита человека ограничением клеток-мишеней или вирусоспецифическим клеточным иммунитетом. Чтобы решить этот вопрос, мы разработали новую схему математического моделирования, которая позволяет нам включать измерения вирусной нагрузки, клеток-мишеней и вирус-специфического иммунитета, и применили ее к исчерпывающему набору данных, полученному в эксперименте с участием макак-резус, инфицированных вирусом иммунодефицита обезьян. .Половину изученных макак лечили в течение периода первичного инфицирования реагентами, которые блокируют костимуляцию Т-клеток и в результате проявляют серьезное нарушение вирус-специфических иммунных ответов. Наши результаты показывают, что ранняя репликация вируса при нормальной инфекции в значительной степени контролируется вирус-специфическими Т-клетками CD8 + , а не ограничением клеток-мишеней.
Наши результаты показывают, что ранняя репликация вируса при нормальной инфекции в значительной степени контролируется вирус-специфическими Т-клетками CD8 + , а не ограничением клеток-мишеней.
Виремия при инфекции, вызванной первичным вирусом иммунодефицита человека (ВИЧ), характеризуется резким начальным увеличением, достигающим пика через несколько недель, постпиковым снижением и окончательным достижением так называемого заданного значения вирусной нагрузки (2, 4 , 14, 15, 24, 25) (рис.1). Специфические иммунные ответы, особенно вирус-специфические Т-клетки CD8 + , были предложены как важные движущие силы постпикового снижения (2, 17, 19, 21). В 1996 году Филлипс представил альтернативное объяснение постпикового снижения. Используя математическую модель, он продемонстрировал, что наблюдаемый образец ранней репликации вируса может быть результатом взаимодействия только между вирусом и его клетками-мишенями (23). Согласно объяснению Филлипса, сдерживание вирусной репликации на пике и постпиковое снижение вирусной нагрузки происходят из-за истощения клеток-мишеней.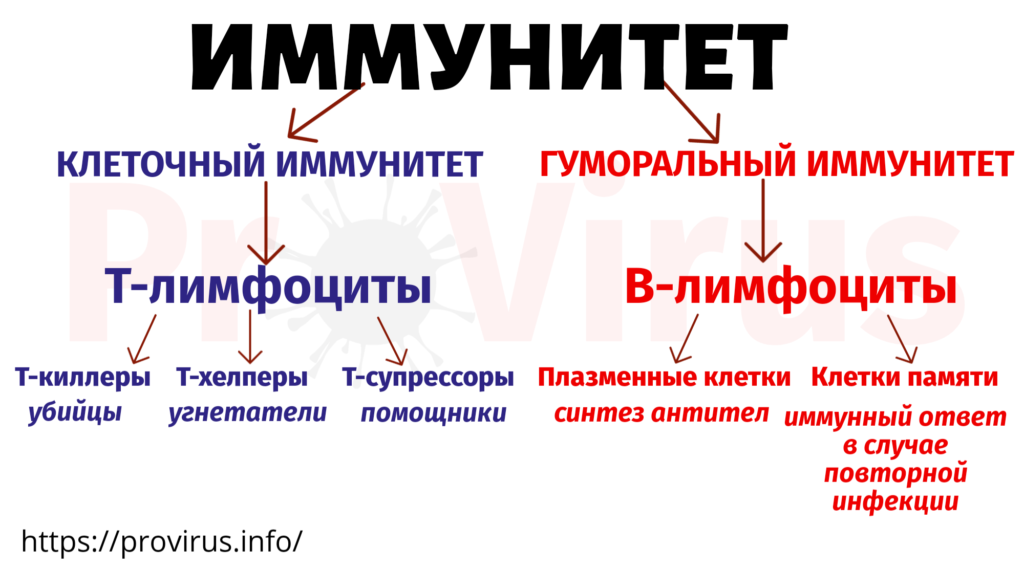
Схема вирусемии (жирная линия), клеток-мишеней (пунктирная линия) и подсчета вирус-специфических CD8 + -Т-клеток (пунктирная линия) при первичной ВИЧ-инфекции.
Предыдущие исследования изучали влияние уровней клеточного иммунитета на раннюю репликацию вируса экспериментально путем истощения клеток CD8 + у макак, инфицированных вирусом иммунодефицита обезьян (SIV) (19, 26). Эти исследования, однако, противоречат потенциальному влиянию CD8-истощающих антител на уровни клеток-мишеней и врожденный иммунитет, поскольку CD8-истощающие антитела могут приводить к усилению гомеостатической и антиген-управляемой пролиферации CD4 + Т-клеток, которые составляют основные клетки-мишени ВИЧ и могут истощать иммунные клетки, отличные от Т-клеток, такие как естественные клетки-киллеры, которые также могут способствовать контролю репликации вируса (8a).В качестве альтернативы экспериментам по истощению CD8 можно использовать математические модели для определения роли ограничения клеток-мишеней и вирус-специфических иммунных ответов на репликацию вируса. Однако исследования с использованием математических моделей до сих пор остаются неоднозначными (5, 27, 29).
Однако исследования с использованием математических моделей до сих пор остаются неоднозначными (5, 27, 29).
Здесь мы стремились выяснить роль ограничения клеток-мишеней и вирус-специфических иммунных ответов в контроле ранней репликации вируса путем анализа первичной инфекции SIVmac239 у макак-резусов ( Macacca mulatta ), одной из наиболее часто используемых моделей животных. для изучения патогенеза СПИДа (6).Преимущества животной модели для наших целей заключаются в способности контролировать время заражения и часто контролировать вирусную нагрузку, уровни клеток-мишеней и вирус-специфические иммунные ответы. В эксперименте, который мы анализируем (8a), мы вмешивались в естественное течение первичной инфекции SIV у половины животных, подавляя костимулирующие сигналы, необходимые Т-клеткам для активации антигенпрезентирующими клетками и инициирования дифференцировки антигенпрезентирующих клеток. и В-клетки.Как следствие, у обработанных животных были нарушены SIV-специфические ответы CD8 + -Т-клеток и замедленные SIV-специфические ответы антител.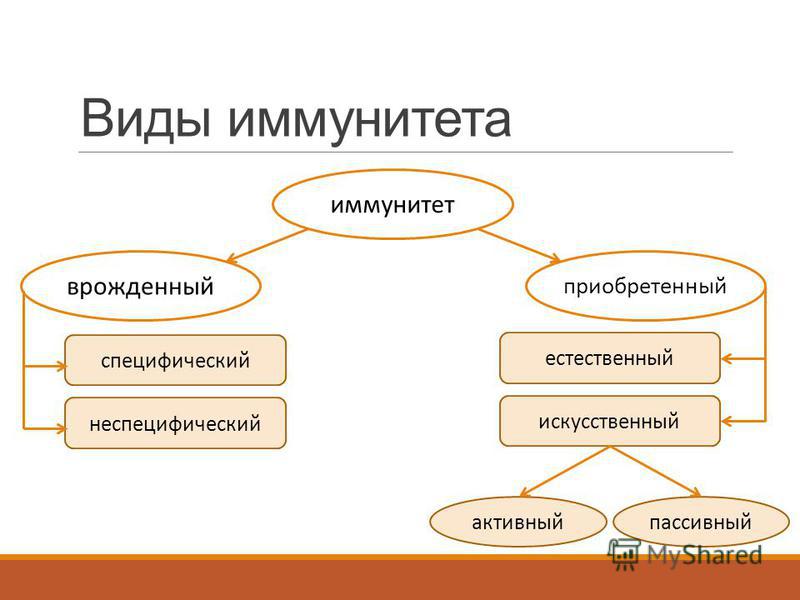 Полученная дисперсия в уровнях иммунитета, специфичного к SIV, позволила нам исследовать детерминанты первичной репликации SIV.
Полученная дисперсия в уровнях иммунитета, специфичного к SIV, позволила нам исследовать детерминанты первичной репликации SIV.
Подход к моделированию, который мы использовали, состоял в том, чтобы подогнать две простые модели к измерениям вирусемии у животных: одна, которая описывает взаимодействие только между вирусом и его клетками-мишенями, и расширенная модель, которая дополнительно учитывает ингибирующий эффект вирус-специфичных иммунные ответы на вирусную репликацию.Измерения уровней клеток-мишеней и вирус-специфичных Т-клеток CD8 + были включены в модель как компоненты скорости роста вируса. Сравнивая степень соответствия двух моделей, мы можем определить, играет ли вирус-специфический ответ CD8 + -Т-клеток значительную роль в первичной инфекции.
МАТЕРИАЛЫ И МЕТОДЫ
Данные. Анализируемый нами набор данных был получен в эксперименте, в котором восемь макак-резус были инфицированы SIVmac239 (8a).От 1 дня до заражения до 27 дней после заражения четырех животных лечили иммуноглобулином CTLA4, который блокирует взаимодействие CD28 / B7 между Т-клетками и дендритными клетками и, таким образом, ингибирует активацию и пролиферацию Т-клеток, и моноклональным антителом против CD40L, которое ингибирует активация дендритных клеток и В-клеток Т-клетками CD4 + и последующее развитие SIV-специфических ответов CD8 + -Т-клеток и выработка антител против SIV. Уровни РНК SIV в плазме определяли количественно с помощью ПЦР с обратной транскриптазой в реальном времени (1, 12).Плотность различных субпопуляций лимфоцитов в периферической крови животных определяли количественно с помощью многопараметрической проточной цитометрии. Фракцию пролиферирующих Т-клеток CD4 + и CD8 + оценивали путем окрашивания на ядерный антиген Ki67, который экспрессируется циклическими клетками. SIV-специфические Т-клетки CD8 + измеряли с использованием тетрамеров Mamu A * 01, специфичных для иммунодоминантных Т-клеточных эпитопов (SIV Gag 181-189 и SIV Tat 28-35 ). Более подробная информация об эксперименте опубликована в другом месте (8a).
Уровни РНК SIV в плазме определяли количественно с помощью ПЦР с обратной транскриптазой в реальном времени (1, 12).Плотность различных субпопуляций лимфоцитов в периферической крови животных определяли количественно с помощью многопараметрической проточной цитометрии. Фракцию пролиферирующих Т-клеток CD4 + и CD8 + оценивали путем окрашивания на ядерный антиген Ki67, который экспрессируется циклическими клетками. SIV-специфические Т-клетки CD8 + измеряли с использованием тетрамеров Mamu A * 01, специфичных для иммунодоминантных Т-клеточных эпитопов (SIV Gag 181-189 и SIV Tat 28-35 ). Более подробная информация об эксперименте опубликована в другом месте (8a).
На рисунке 2 показаны измерения, относящиеся к нашему исследованию: виремия, плотность пролиферирующих Т-клеток CD4 + (которые составляют наиболее важные клетки-мишени для репликации вируса), плотность пролиферирующих Т-клеток CD8 + (a потенциальный суррогатный маркер для SIV-специфического ответа CD8 + -T-клеток во время первичной инфекции), и сумма плотностей SIV Gag 181-189 — и SIV Tat 23-35 -специфических CD8 + Т-лимфоциты периферической крови.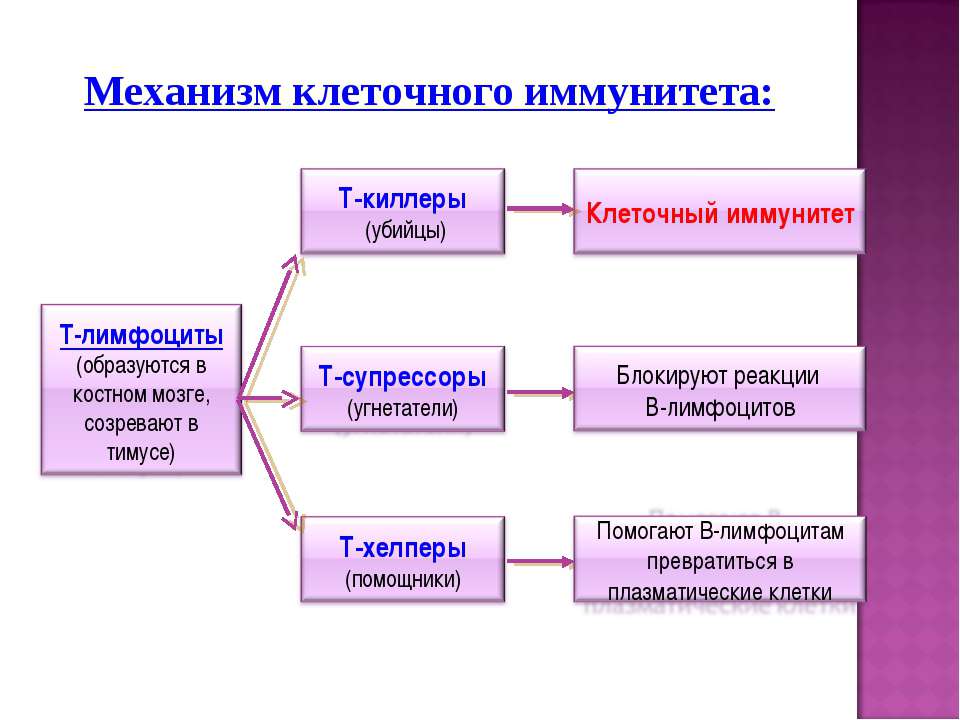 Рисунок 2 дает важную информацию о взаимосвязи между репликацией вируса и уровнями клеток-мишеней и вирус-специфическими ответами CD8 + -Т-клеток. В то время как у обработанных животных Ki67 + CD4 + Т-клетки уменьшаются в течение первых 10 дней заражения и остаются на низком уровне после этого, они только временно достигают низких уровней у необработанных животных. Кроме того, вирус-специфический ответ CD8 + -Т-клеток у обработанных животных слабее, чем у необработанных животных.Вследствие этих различий в уровнях клеток-мишеней и вирус-специфических ответов CD8 + -Т-клеток, леченные и необработанные группы различаются по своей виремии. Пиковая виремия значительно ниже в группе лечения, чем в группе без лечения, в то время как постпиковая виремия значительно выше (8а). Интуитивно более высокий пик виремии у нелеченных животных можно объяснить более высокими уровнями клеток-мишеней, а более низкий постпик виремии в необработанной группе можно объяснить более сильными вирус-специфическими ответами CD8 + -Т-клеток.
Рисунок 2 дает важную информацию о взаимосвязи между репликацией вируса и уровнями клеток-мишеней и вирус-специфическими ответами CD8 + -Т-клеток. В то время как у обработанных животных Ki67 + CD4 + Т-клетки уменьшаются в течение первых 10 дней заражения и остаются на низком уровне после этого, они только временно достигают низких уровней у необработанных животных. Кроме того, вирус-специфический ответ CD8 + -Т-клеток у обработанных животных слабее, чем у необработанных животных.Вследствие этих различий в уровнях клеток-мишеней и вирус-специфических ответов CD8 + -Т-клеток, леченные и необработанные группы различаются по своей виремии. Пиковая виремия значительно ниже в группе лечения, чем в группе без лечения, в то время как постпиковая виремия значительно выше (8а). Интуитивно более высокий пик виремии у нелеченных животных можно объяснить более высокими уровнями клеток-мишеней, а более низкий постпик виремии в необработанной группе можно объяснить более сильными вирус-специфическими ответами CD8 + -Т-клеток. Чтобы количественно оценить конкурирующие эффекты клеток-мишеней и вирусспецифических Т-клеток CD8 + на репликацию вируса, мы проанализировали эти данные с использованием моделей динамики популяции.
Чтобы количественно оценить конкурирующие эффекты клеток-мишеней и вирусспецифических Т-клеток CD8 + на репликацию вируса, мы проанализировали эти данные с использованием моделей динамики популяции.
Измерения виремии (а), Ki67 + CD4 + Т-клеток (б), Ki67 + CD8 + Т-клеток (в) и суммы Gag 181-189 — и Tat 28-35 -специфические CD8 + Т-клетки (d) у обработанных и необработанных животных. Период, в течение которого применялся костимуляторный блокатор, заштрихован.
Модели. Чтобы определить относительный вклад ограничения клеток-мишеней и клеточного иммунитета на репликацию вируса, необходимо отслеживать сложное взаимодействие между вирусом, его клетками-мишенями и вирус-специфическими иммунными клетками. Динамические модели популяции являются подходящими инструментами для достижения этой цели.
Обычным подходом к исследованию роли ограничения клеток-мишеней и вирус-специфичных ответов CD8 + -Т-клеток при первичной инфекции было бы построение динамической модели, описывающей три рассматриваемые популяции — вирус, клетки-мишени, вирус- специфические CD8 + Т-клетки — и их взаимодействие (рис. 3а). Недостатком этого подхода является то, что приходится иметь дело с довольно большим количеством терминов роста, смерти и взаимодействия, каждый из которых связан со своими собственными параметрами. Для простейшей модели, описывающей взаимодействие между вирусом, его клетками-мишенями и вирус-специфическими Т-клетками CD8 + , необходимо иметь дело как минимум с девятью параметрами (рис. 3a предлагает образец модели). Более того, многие механизмы взаимодействия, такие как истощение Т-клеток CD4 + или стимуляция Т-лимфоцитов CD8 + вирусом, не совсем понятны, и поэтому их математическая формулировка будет по своей сути спекулятивной.
3а). Недостатком этого подхода является то, что приходится иметь дело с довольно большим количеством терминов роста, смерти и взаимодействия, каждый из которых связан со своими собственными параметрами. Для простейшей модели, описывающей взаимодействие между вирусом, его клетками-мишенями и вирус-специфическими Т-клетками CD8 + , необходимо иметь дело как минимум с девятью параметрами (рис. 3a предлагает образец модели). Более того, многие механизмы взаимодействия, такие как истощение Т-клеток CD4 + или стимуляция Т-лимфоцитов CD8 + вирусом, не совсем понятны, и поэтому их математическая формулировка будет по своей сути спекулятивной.
Схематическое сравнение общего подхода (a) и нашего альтернативного подхода (b). Общий подход учитывает многие аспекты взаимодействия между вирусом, его клетками-мишенями (в основном CD4 + Т-клетки) и вирус-специфическими ответами CD8 + -Т-клеток и, следовательно, включает множество (неизвестных) механизмов взаимодействия.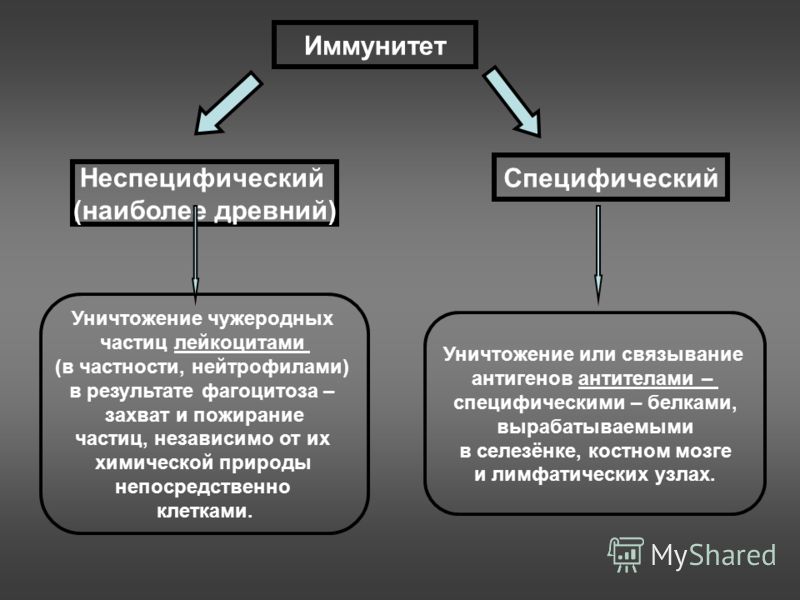 и параметры. Наш альтернативный подход фокусируется на влиянии клеток-мишеней и вирус-специфичных Т-клеток CD8 + на репликацию вируса и игнорирует все другие аспекты взаимодействия, что требует гораздо меньшего количества параметров.Уравнения популяционных динамических моделей, которые могут использоваться для любого подхода, показаны, чтобы проиллюстрировать различия между общим подходом и нашим альтернативным подходом. Модель общего подхода имеет четыре переменных, которые обозначают плотности восприимчивых и продуктивно инфицированных CD4 + Т-клеток ( T и T *, соответственно), свободных от вируса ( V ) и вирус-специфичных CD8 + Т-клетки ( E ). Точка над переменными обозначает производную по времени.Эта модель предполагает, что восприимчивые Т-клетки CD4 + продуцируются с постоянной скоростью λ, умирают со скоростью dT и заражаются свободным вирусом со скоростью β TV . Предполагается, что продуктивно инфицированные Т-клетки CD4 + погибают со скоростью Т и уничтожаются вирус-специфическими Т-клетками CD8 + со скоростью кТ * E .
и параметры. Наш альтернативный подход фокусируется на влиянии клеток-мишеней и вирус-специфичных Т-клеток CD8 + на репликацию вируса и игнорирует все другие аспекты взаимодействия, что требует гораздо меньшего количества параметров.Уравнения популяционных динамических моделей, которые могут использоваться для любого подхода, показаны, чтобы проиллюстрировать различия между общим подходом и нашим альтернативным подходом. Модель общего подхода имеет четыре переменных, которые обозначают плотности восприимчивых и продуктивно инфицированных CD4 + Т-клеток ( T и T *, соответственно), свободных от вируса ( V ) и вирус-специфичных CD8 + Т-клетки ( E ). Точка над переменными обозначает производную по времени.Эта модель предполагает, что восприимчивые Т-клетки CD4 + продуцируются с постоянной скоростью λ, умирают со скоростью dT и заражаются свободным вирусом со скоростью β TV . Предполагается, что продуктивно инфицированные Т-клетки CD4 + погибают со скоростью Т и уничтожаются вирус-специфическими Т-клетками CD8 + со скоростью кТ * E . Свободный вирус продуцируется продуктивно инфицированными CD4 + Т-клетками со скоростью π T * и выводится со скоростью cV .Наконец, предполагается, что вирусспецифичные Т-клетки CD8 + возникают со скоростью E и умирают со скоростью E . Модель, используемая в альтернативном подходе, имеет только одну переменную для бесплатного вируса V . Скорость роста г вируса является функцией плотности восприимчивых CD4 + Т-клеток ( T ) и плотности вирус-специфичных CD8 + Т-клеток ( E ). Конкретные функции, которые мы предполагаем для скорости роста вируса г , см. В Приложении.
Свободный вирус продуцируется продуктивно инфицированными CD4 + Т-клетками со скоростью π T * и выводится со скоростью cV .Наконец, предполагается, что вирусспецифичные Т-клетки CD8 + возникают со скоростью E и умирают со скоростью E . Модель, используемая в альтернативном подходе, имеет только одну переменную для бесплатного вируса V . Скорость роста г вируса является функцией плотности восприимчивых CD4 + Т-клеток ( T ) и плотности вирус-специфичных CD8 + Т-клеток ( E ). Конкретные функции, которые мы предполагаем для скорости роста вируса г , см. В Приложении.
Эти недостатки можно преодолеть путем принятия альтернативного подхода. Мы решили не описывать все аспекты взаимодействия между вирусом и иммунными клетками, вовлеченными в инфекцию, а, скорее, сосредоточиться на эффектах, которые клетки-мишени и вирусспецифические Т-клетки CD8 + оказывают на репликацию вируса. . Мы достигаем этого путем построения моделей, описывающих только динамику вирусной популяции. Количество клеток-мишеней и вирус-специфичных CD8 + -Т-клеток входит в модель как компоненты скорости роста вируса (рис.3б). Этот альтернативный подход сокращает количество параметров до минимума, необходимого для изучения роли клеток-мишеней и специфических CD8 + Т-лимфоцитов в репликации вируса, сохраняя при этом информацию, содержащуюся в измерениях целевых и иммунных клеток.
. Мы достигаем этого путем построения моделей, описывающих только динамику вирусной популяции. Количество клеток-мишеней и вирус-специфичных CD8 + -Т-клеток входит в модель как компоненты скорости роста вируса (рис.3б). Этот альтернативный подход сокращает количество параметров до минимума, необходимого для изучения роли клеток-мишеней и специфических CD8 + Т-лимфоцитов в репликации вируса, сохраняя при этом информацию, содержащуюся в измерениях целевых и иммунных клеток.
Мы построили две модели (см. Приложение), одна, которая описывает взаимодействие только между вирусом и его клетками-мишенями (которую мы называем моделью на основе клеток-мишеней), и расширенная версия модели на основе клеток-мишеней, которая дополнительно принимает во внимание потенциальный эффект ответов CD8 + -Т-клеток (который мы называем моделью иммунного контроля).Мы подгоняем модели к измерениям вирусной нагрузки между 0 и 28 днем после заражения — временным интервалом, который совпадает с периодом лечения и, следовательно, удобен для определения периода первичного заражения. Однако наши результаты не зависят от этого конкретного временного интервала. Сравнение соответствия этих двух моделей с помощью теста F (см. Приложение) позволяет нам определить, играют ли вирус-специфические CD8 + Т-клетки значительную роль в контроле репликации вируса при первичной инфекции.
Однако наши результаты не зависят от этого конкретного временного интервала. Сравнение соответствия этих двух моделей с помощью теста F (см. Приложение) позволяет нам определить, играют ли вирус-специфические CD8 + Т-клетки значительную роль в контроле репликации вируса при первичной инфекции.
В модели иммунного контроля нам необходимо включить показатели вирусоспецифического ответа CD8 + -Т-клеток. Наш набор данных содержит два альтернативных измерения: (i) Gag 181-189 — и Tat 23-35 -специфические CD8 + Т-клетки и (ii) пролиферирующие CD8 + Т-клетки (измеренные по экспрессии ядерного антигена Ki67). Мы предпочитаем пролиферирующие Т-клетки CD8 + , а не Gag 181-189 — и Tat 23-35 -специфические Т-клетки CD8 + по нескольким причинам.Во-первых, мы не знаем, в какой степени Gag 181-189 — и Tat 23-35 -специфические CD8 + Т-клетки отражают общую степень ответа CD8 + -Т-клеток у каждого животного. . Хотя эти аутбредные животные соответствуют Mamu A * 01, они различаются по известным аллелям класса I главного комплекса гистосовместимости, а также по потенциально неопределенным аллелям класса I главного комплекса гистосовместимости (8a). Следовательно, степень, в которой Gag 181-189 — и Tat 23-35 -специфические CD8 + Т-клетки отражают общую степень ответа CD8 + -Т-клеток, может отличаться от животного к животному. .Более того, у нас есть доказательства иммунологического ускользания от вирус-специфических ответов CD8 + -Т-клеток, направленных против эпитопа Tat 23-35 у всех животных к 20-му дню, и, таким образом, Tat 23-35 -специфического CD8 + -Т-клеточный ответ может больше не влиять на преобладающую популяцию вируса после этого момента времени (8a). Поэтому здесь мы представляем результаты, основанные на пролиферирующих Т-клетках CD8 + . Однако мы подчеркиваем, что параллельный анализ, основанный на Gag 181-189 — и Tat 23-35 -специфических CD8 + Т-клетках, дает аналогичные результаты (см.
. Хотя эти аутбредные животные соответствуют Mamu A * 01, они различаются по известным аллелям класса I главного комплекса гистосовместимости, а также по потенциально неопределенным аллелям класса I главного комплекса гистосовместимости (8a). Следовательно, степень, в которой Gag 181-189 — и Tat 23-35 -специфические CD8 + Т-клетки отражают общую степень ответа CD8 + -Т-клеток, может отличаться от животного к животному. .Более того, у нас есть доказательства иммунологического ускользания от вирус-специфических ответов CD8 + -Т-клеток, направленных против эпитопа Tat 23-35 у всех животных к 20-му дню, и, таким образом, Tat 23-35 -специфического CD8 + -Т-клеточный ответ может больше не влиять на преобладающую популяцию вируса после этого момента времени (8a). Поэтому здесь мы представляем результаты, основанные на пролиферирующих Т-клетках CD8 + . Однако мы подчеркиваем, что параллельный анализ, основанный на Gag 181-189 — и Tat 23-35 -специфических CD8 + Т-клетках, дает аналогичные результаты (см. Приложение).
Приложение).
Мы протестировали нашу схему выбора модели, сначала применив ее к исследуемой группе. В связи с тем, что у обработанной группы были серьезно нарушены специфические иммунные ответы на вирус, вклад CD8 + -Т-клеточных ответов в репликацию вируса должен быть незначительным, т.е. не ожидается, что модель иммунного контроля будет подходить значительно лучше. чем модель на основе целевой ячейки.
РЕЗУЛЬТАТЫ
Ограничение клеток-мишеней объясняет вирусный контроль у обработанных животных.Подгонка модели на основе клеток-мишеней к измерениям вирусной нагрузки у обработанных животных дает относительно хорошие результаты, учитывая, что наша модель определяется только двумя параметрами (рис. 4, пунктирные линии). Включение ответов CD8 + -Т-клеток в анализ не приводит к значительному улучшению совпадений у трех из четырех животных (фиг. 4, сплошные линии; см. Таблицу 2). Таким образом, влияние вирус-специфических ответов CD8 + -Т-клеток у этих трех животных незначительно.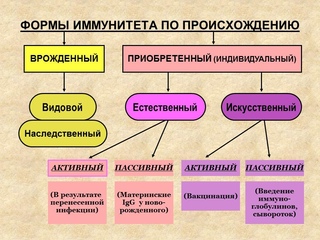 Животное REo6, для которого включение CD8 + -Т-клеточного ответа улучшает приспособленность, также является животным с самыми высокими уровнями пролиферирующих CD8 + Т-клеток, уровнями, сравнимыми с уровнями необработанных животных.Как и ожидалось, мы пришли к выводу, что только взаимодействие между вирусом и его клетками-мишенями может объяснять характер репликации вируса, наблюдаемый при первичной инфекции, и что ответы CD8 + -Т-клеток играют незначительную роль в контроле репликации вируса в постановка костимулирующей блокады.
Животное REo6, для которого включение CD8 + -Т-клеточного ответа улучшает приспособленность, также является животным с самыми высокими уровнями пролиферирующих CD8 + Т-клеток, уровнями, сравнимыми с уровнями необработанных животных.Как и ожидалось, мы пришли к выводу, что только взаимодействие между вирусом и его клетками-мишенями может объяснять характер репликации вируса, наблюдаемый при первичной инфекции, и что ответы CD8 + -Т-клеток играют незначительную роль в контроле репликации вируса в постановка костимулирующей блокады.
Подгонка модели на основе клеток-мишеней (пунктирные линии) и модели иммунного контроля (сплошные линии) к вирусной нагрузке обработанных животных. Только для REo6 животного модель иммунного контроля подходит значительно лучше.
Ограничение клеток-мишеней не объясняет вирусный контроль у нелеченых животных. Результаты для необработанной группы сильно отличаются. Подбор модели на основе клеток-мишеней дает очень плохие совпадения, которые вообще не учитывают структуру первичного заражения (рис. 5, пунктирные линии). Таким образом, ограничение клеток-мишеней само по себе не может объяснить репликацию первичного вируса. Интуитивно понятно, что причина недостатков модели на основе клеток-мишеней заключается в том, что уровни клеток-мишеней не снижаются, а в среднем остаются такими же высокими, как до заражения (рис.2б). Причиной почти неизменных уровней пролиферирующих CD4 + Т-клеток может быть то, что истощение инфицированных вирусом клеток уравновешивается антиген-управляемой пролиферацией CD4 + Т-клеток. Таким образом, модель на основе клеток-мишеней предсказывает постоянно растущую популяцию вируса, несовместимую с наблюдаемой вирусной нагрузкой у нелеченных животных.
5, пунктирные линии). Таким образом, ограничение клеток-мишеней само по себе не может объяснить репликацию первичного вируса. Интуитивно понятно, что причина недостатков модели на основе клеток-мишеней заключается в том, что уровни клеток-мишеней не снижаются, а в среднем остаются такими же высокими, как до заражения (рис.2б). Причиной почти неизменных уровней пролиферирующих CD4 + Т-клеток может быть то, что истощение инфицированных вирусом клеток уравновешивается антиген-управляемой пролиферацией CD4 + Т-клеток. Таким образом, модель на основе клеток-мишеней предсказывает постоянно растущую популяцию вируса, несовместимую с наблюдаемой вирусной нагрузкой у нелеченных животных.
Подгонка модели на основе клеток-мишеней (пунктирные линии) и модели иммунного контроля (сплошные линии) к вирусной нагрузке необработанных животных.Модель иммунного контроля значительно лучше подходит для всех животных.
Включение эффекта пролиферации Т-клеток CD8 + в наш анализ значительно улучшает совпадения у всех четырех животных (рис. 5, сплошные линии; см. Таблицу 2), что дает убедительные доказательства решающей роли специфичных для SIV CD8 + -Т-клеточные ответы при сдерживании ранней репликации вируса. Важность SIV-специфических Т-лимфоцитов CD8 + дополнительно подтверждается открытием, что снижение виремии после пика положительно коррелирует с уровнями пролиферирующих Т-клеток CD8 + (8a).Анализ, основанный на Gag 181-189 — и Tat 23-35 -специфических CD8 + Т-клетках, дает аналогичные результаты (см. Приложение и рис. A1b).
5, сплошные линии; см. Таблицу 2), что дает убедительные доказательства решающей роли специфичных для SIV CD8 + -Т-клеточные ответы при сдерживании ранней репликации вируса. Важность SIV-специфических Т-лимфоцитов CD8 + дополнительно подтверждается открытием, что снижение виремии после пика положительно коррелирует с уровнями пролиферирующих Т-клеток CD8 + (8a).Анализ, основанный на Gag 181-189 — и Tat 23-35 -специфических CD8 + Т-клетках, дает аналогичные результаты (см. Приложение и рис. A1b).
Сравнение соответствия модели иммунного контроля, основанной на различных измерениях SIV-специфических ответов CD8 + -Т-клеток, у обработанных животных (а) и у необработанных животных (b). Подгонки модели иммунного контроля, основанной на сумме Gag 181-189 — и Tat 23-35 -специфических Т-клеток CD8 + , показаны сплошными красными линиями, а подгонки модели иммунного контроля на основе Ki67 + CD8 + Т-клетки показаны сплошными черными линиями.![]() Подгонки модели на основе целевых клеток показаны пунктирными линиями.
Подгонки модели на основе целевых клеток показаны пунктирными линиями.
Клетки, инфицированные вирусом, в основном убиваются вирус-специфическими CD8 + Т-клетками. Таблица 1 содержит оценки параметров для модели на основе клеток-мишеней. Поскольку модель на основе клеток-мишеней неадекватна для учета характера репликации вируса в необработанной группе, мы воздержались от отчетов об оценках параметров для этой группы. Скорость репликации вируса на клетку-мишень r была оценена как 0.030 ± 0 . 005, что согласуется с оценками из других исследований скорости репликации ВИО и ВИЧ (18, 20). Согласно этой оценке, увеличение на 33 количества клеток-мишеней в 1 мкл крови приводит к увеличению скорости роста вируса на 1 log в день. Параметр a (который можно интерпретировать как уровень гибели инфицированных клеток [11, 22, 28]) был оценен как 0 . 77 ± 0 . 16. Эта оценка на соответствует периоду полураспада инфицированных клеток 0 . 9 ± 0 . 24 дня, что согласуется с последними оценками (10).
9 ± 0 . 24 дня, что согласуется с последними оценками (10).
Оценки параметров для совпадений с моделью на основе клетки-мишени a
В таблице 2 показаны оценки параметров модели иммунного контроля и сравнивается качество совпадений с параметрами целевой клетки. на базе модели. Всем четырем нелеченным животным модель иммунного контроля подходит значительно лучше. Оценка скорости репликации вируса на клетку-мишень r существенно не различается между обработанными и необработанными группами, что указывает на то, что чувствительность клеток-мишеней и скорость, с которой клетки-мишени продуцируют вирус, не различаются между обработанными и необработанными. группы.Основное различие между двумя группами касается компонентов смертности инфицированных клеток. Собственная смертность инфицированных клеток, a ‘, которая включает скорость апоптоза и вызванного вирусом убийства, значительно выше в обработанной группе, чем в необработанной группе, для которой a ‘ последовательно оценивается как ноль. Это открытие остается неизменным, если мы основываем наш анализ на Gag 181-189 — и Tat 23-35 -специфических Т-клетках CD8 + вместо пролиферирующих Т-клеток CD8 + .Этот результат предполагает, что во время первичной ВИЧ-инфекции инфицированные клетки преимущественно не убиваются непосредственно вирусом, а в основном цитотоксическими Т-лимфоцитами (CTL), как предполагалось ранее (16).
Это открытие остается неизменным, если мы основываем наш анализ на Gag 181-189 — и Tat 23-35 -специфических Т-клетках CD8 + вместо пролиферирующих Т-клеток CD8 + .Этот результат предполагает, что во время первичной ВИЧ-инфекции инфицированные клетки преимущественно не убиваются непосредственно вирусом, а в основном цитотоксическими Т-лимфоцитами (CTL), как предполагалось ранее (16).
Оценки параметров для соответствия модели иммунного контроля a
Отсутствие влияния покоящихся CD4 + Т-клеток на вирусную репликацию. Проверить актуальность вирусной репликации при покоящихся CD4 + Т-клетки (как определено CD4 + Т-лимфоцитами, которые не экспрессируют Ki67) при первичной инфекции, мы сконструировали расширения модели на основе клеток-мишеней и модели иммунного контроля, которые учитывают потенциал репликации вируса в состоянии покоя CD4 + Т-клетки (см. Приложение).Мы обнаружили, что включение репликации в покоящиеся Т-клетки CD4 + не объясняет раннюю репликацию вируса лучше, чем модель на основе клеток-мишеней или модель иммунного контроля (данные не показаны). Таким образом, даже несмотря на то, что сообщается об инфицировании покоящихся клеток (9), согласно нашему анализу, вклад компартмента покоящихся CD4 + Т-клеток в репликацию вируса незначителен. Кроме того, расширение нашего анализа показывает, что значительное влияние ответов антител на сдерживание распространения вируса при первичной инфекции также может быть исключено (данные не показаны).Этот результат согласуется с низкими уровнями антител у обработанных животных и неопределяемыми уровнями у необработанных животных во время первичной инфекции (8a).
Приложение).Мы обнаружили, что включение репликации в покоящиеся Т-клетки CD4 + не объясняет раннюю репликацию вируса лучше, чем модель на основе клеток-мишеней или модель иммунного контроля (данные не показаны). Таким образом, даже несмотря на то, что сообщается об инфицировании покоящихся клеток (9), согласно нашему анализу, вклад компартмента покоящихся CD4 + Т-клеток в репликацию вируса незначителен. Кроме того, расширение нашего анализа показывает, что значительное влияние ответов антител на сдерживание распространения вируса при первичной инфекции также может быть исключено (данные не показаны).Этот результат согласуется с низкими уровнями антител у обработанных животных и неопределяемыми уровнями у необработанных животных во время первичной инфекции (8a).
ОБСУЖДЕНИЕ
Таким образом, наш анализ показывает, что ограничение клеток-мишеней не может объяснить сдерживание репликации вируса, наблюдаемое во время первичной инфекции SIV. Мы также показываем, что, включив ответы CD8 + -Т-клеток в наш анализ, мы можем значительно лучше учесть характер ранней репликации вируса. Эти результаты устойчивы в отношении изменений временного интервала (с 0 по 28 день), на котором мы основывали наш анализ (данные не показаны). Более того, мы получаем аналогичные результаты, используя измерения Gag 181-189 — и Tat 23-35 -специфических вместо пролиферирующих CD8 + Т-клеток (см. Приложение), что предполагает, что пролиферирующие CD8 + Т-клетки может быть эквивалентной суррогатной мерой для SIV-специфического ответа CD8 + -Т-клеток во время первичной или острой инфекции SIV.
Эти результаты устойчивы в отношении изменений временного интервала (с 0 по 28 день), на котором мы основывали наш анализ (данные не показаны). Более того, мы получаем аналогичные результаты, используя измерения Gag 181-189 — и Tat 23-35 -специфических вместо пролиферирующих CD8 + Т-клеток (см. Приложение), что предполагает, что пролиферирующие CD8 + Т-клетки может быть эквивалентной суррогатной мерой для SIV-специфического ответа CD8 + -Т-клеток во время первичной или острой инфекции SIV.
Наше исследование выходит за рамки экспериментов по истощению CD8 и более ранних количественных исследований в том, что мы тщательно учли влияние клеток-мишеней на репликацию вирусов. Исследование истощения CD8 при первичной инфекции ВИО, проведенное Schmitz et al. (26), например, не измеряли уровни пролиферирующих CD4 + Т-клеток. Это упущение делает сложные выводы о роли ограничения клеток-мишеней и вирус-специфических Т-клеточных ответов CD8 + . Точно так же исследование Stafford et al.(27), в которых математические модели были адаптированы к данным о первичной виремии у ВИЧ-инфицированных пациентов, не принимали во внимание какие-либо измерения клеток-мишеней.
Точно так же исследование Stafford et al.(27), в которых математические модели были адаптированы к данным о первичной виремии у ВИЧ-инфицированных пациентов, не принимали во внимание какие-либо измерения клеток-мишеней.
Наше исследование, в котором использовался подход, сильно отличающийся от моделей истощения CD8, в основном согласуется с выводами Schmitz et al. (26), что вирус-специфичные Т-клетки CD8 + играют решающую роль в первичной инфекции SIV. Однако наши выводы относительно того, как ранняя репликация вируса контролируется на пике, отличаются от выводов Schmitz et al.(26). Schmitz et al. (26) обнаружили, что истощение клеток CD8 + не влияет ни на время пика, ни на пиковый уровень виремии, и, таким образом, исключили роль вирус-специфичных ответов CD8 + -Т-клеток в сдерживание вирусной репликации на пике. С другой стороны, исходя из нашего анализа, мы делаем вывод, что сдерживание вируса на пике не связано с ограничением клеток-мишеней.
Наше открытие о том, что ни сдерживание вируса на пике, ни постпиковый контроль репликации вируса нельзя объяснить ограничением клеток-мишеней у необработанных животных, также не согласуется с выводами Stafford et al.(27), что ограничение клеток-мишеней может объяснить характер репликации вируса в течение первых 100 дней заражения. Это несоответствие связано с тем, что модель, использованная Stafford et al. (27) предсказывает, что уровни клеток-мишеней снижаются во время первичной инфекции, в то время как мы не наблюдали такого снижения у нелеченных животных.
Наш анализ не может идентифицировать факторы, которые контролируют вирусную репликацию на пике в необработанной группе. Мы исключили возможность того, что сдерживание вирусной репликации на пике связано с ограничением клеток-мишеней в этой группе.Более того, вирус-специфические ответы CD8 + -Т-клеток, по-видимому, вряд ли ответственны за контроль репликации SIV на пике, потому что они возникают после пика виремии. Таким образом, возможно, придется задействовать альтернативные факторы. Возможно, например, что врожденные иммунные ответы играют значительную роль в контрольной репликации вируса на пике, что, как было установлено, имеет место при инфицировании вирусом лимфоцитарного хориоменингита у мышей (3).
Таким образом, возможно, придется задействовать альтернативные факторы. Возможно, например, что врожденные иммунные ответы играют значительную роль в контрольной репликации вируса на пике, что, как было установлено, имеет место при инфицировании вирусом лимфоцитарного хориоменингита у мышей (3).
Даже несмотря на то, что мы можем показать, что вирус-специфические CD8 + Т-клетки играют значительную роль в контроле первичной инфекции, предсказание модели иммунного контроля все еще отклоняется от наблюдаемой вирусной нагрузки.Отклонение можно объяснить несколькими факторами. Во-первых, измерения клеток-мишеней и вирус-специфических клеточных иммунных ответов в крови животных могут не отражать уровни этих клеток во всем животном. В частности, перераспределение клеток может затруднить нашу способность предсказывать репликацию вируса. Во-вторых, наше предположение о том, что все пролиферирующие Т-клетки CD4 + одинаково восприимчивы к инфекции, может быть чрезмерно упрощенным. Если подмножество пролиферирующих Т-клеток CD4 + , как, например, SIV-специфические Т-хелперы, будет значительно более восприимчивым и продуктивным, чем в среднем пролиферирующие Т-клетки CD4 + , наша модель на основе целевых клеток должна исправлено.Хотя есть доказательства повышенной чувствительности ВИЧ-специфических Т-лимфоцитов CD4 + во время ВИЧ-инфекции (7), наша модель на основе клеток-мишеней была бы неадекватной только в том случае, если бы было показано, что специфические Т-клетки CD4 + также значительно более продуктивны. чем неспецифические к SIV, пролиферирующие CD4 + Т-клетки. В-третьих, измеренные пролиферирующие Т-клетки CD8 + и Gag 181-189 — и Tat 23-35 -специфические Т-клетки CD8 + могут не отражать общую степень общего клеточного иммунного ответа.Наконец, могут действовать иммунные ответы, отличные от цитотоксических Т-клеток или антител, такие как цитокины и хемокины, выделяемые Т-хелперами.
Если подмножество пролиферирующих Т-клеток CD4 + , как, например, SIV-специфические Т-хелперы, будет значительно более восприимчивым и продуктивным, чем в среднем пролиферирующие Т-клетки CD4 + , наша модель на основе целевых клеток должна исправлено.Хотя есть доказательства повышенной чувствительности ВИЧ-специфических Т-лимфоцитов CD4 + во время ВИЧ-инфекции (7), наша модель на основе клеток-мишеней была бы неадекватной только в том случае, если бы было показано, что специфические Т-клетки CD4 + также значительно более продуктивны. чем неспецифические к SIV, пролиферирующие CD4 + Т-клетки. В-третьих, измеренные пролиферирующие Т-клетки CD8 + и Gag 181-189 — и Tat 23-35 -специфические Т-клетки CD8 + могут не отражать общую степень общего клеточного иммунного ответа.Наконец, могут действовать иммунные ответы, отличные от цитотоксических Т-клеток или антител, такие как цитокины и хемокины, выделяемые Т-хелперами. Поскольку в наших экспериментах мы не измеряли продукцию цитокинов или хемокинов, мы не могли проверить их влияние на репликацию вирусов. В будущем эксперименты по измерению уровней цитокинов, хемокинов и вирус-специфических ответов CD4 + -Т-клеток в сочетании с представленным здесь количественным анализом могли бы рассмотреть подробные механизмы сдерживания вируса различными ветвями иммунной системы.
Поскольку в наших экспериментах мы не измеряли продукцию цитокинов или хемокинов, мы не могли проверить их влияние на репликацию вирусов. В будущем эксперименты по измерению уровней цитокинов, хемокинов и вирус-специфических ответов CD4 + -Т-клеток в сочетании с представленным здесь количественным анализом могли бы рассмотреть подробные механизмы сдерживания вируса различными ветвями иммунной системы.
В настоящем анализе мы сосредоточились на первичной инфекции и не анализировали весь ход инфекции. Подробный анализ всех доступных данных предполагает, что, особенно на более поздних стадиях инфекции, репликация вируса определяется многими факторами, включая антитела и потенциально неизмеряемые ответы, опосредованные CD4 + -Т-клетками (8a). Из-за полностью развитого ответа антител и очевидного ускользания CTL у всех нелеченных животных после первичного заражения наш анализ вряд ли даст такие же простые результаты, если его применить к более поздним стадиям инфекции.
Учитывая все предостережения, связанные с измерениями, на которых мы основали наш анализ, и ограничения в нашем понимании динамики первичной инфекции ВИО в целом, примечательно, насколько хорошо наша чрезвычайно простая модель учитывает наблюдаемую картину первичной ВИО репликация. Понимание первичной инфекции SIV, полученное в результате нашего исследования, демонстрирует силу математических моделей как инструментов для понимания динамики вирусных инфекций.
Модель иммунного контроля.\ prime} {-} kE (t)] \] $$ mathtex $$ (3) E ( t ) — это функция интерполяции измерений плотности пролиферирующих CD8 + -Т-клеток в крови (измеряемая ядерным антигеном Ki67), а параметр k — степень ингибирования вирусного репликация на пролиферирующих CD8 + Т-клеток в день. Параметр a ‘можно интерпретировать как собственную скорость гибели инфицированных клеток, то есть как скорость апоптоза или гибели, вызванной вирусом. \ prime} \] $$ mathtex $$ (4)
и подгоняется к логарифму наблюдаемой вирусной нагрузки с использованием алгоритма наименьших квадратов.
\ prime} \] $$ mathtex $$ (4)
и подгоняется к логарифму наблюдаемой вирусной нагрузки с использованием алгоритма наименьших квадратов.
Сравнение моделей. Мы используем модель на основе клеток-мишеней (уравнение 1) и модель иммунного контроля (уравнение 3), чтобы определить, играет ли иммунный ответ значительную роль в борьбе с первичной инфекцией. Мы применяем стандартную статистическую стратегию: во-первых, мы подбираем две модели, минимизируя остаточную сумму квадратов; затем мы определяем, объясняет ли дополнительный параметр в модели иммунного контроля (уравнение 3) (который измеряет вклад ответов CD8 + -Т-клеток) значительную часть вариации виремии, которая не объясняется мишенью. ячеечная модель (уравнение 1).Формально, мы можем проверить значимость «лучшего» соответствия модели иммунного контроля (уравнение 3), выполнив тест F на остаточной сумме квадратов, нормализованных соответствующими степенями свободы:
$$ mathtex $$ \ [F_ {s} {=} \ frac {(RSS_ {1} {-} RSS_ {2}) / (df_ {1} {-} df_ {2})} {RSS_ {2} / df_ {2}} \] $$ mathtex $$ (5)
Здесь RSS 1 и RSS 2 обозначают остаточные суммы квадратов, полученные в результате подгонки модели на основе клеток-мишеней (уравнение 1) и модели иммунного контроля (уравнение 3), соответственно, и df 1 и df 2 обозначают соответствующие степени свободы. Подгоняя восемь точек данных к модели на основе целевых клеток (уравнение 1), которая имеет два параметра, мы получаем шесть степеней свободы (df 1 = 6), а поскольку модель иммунного контроля (уравнение 3) имеет на один параметр больше, чем модель на основе целевой ячейки (уравнение 1), мы имеем df 2 = 5. Если F s больше критического значения распределения Фишера F (df 1 , df 2 ) = 6,61, где α = 0 . 05, то вирус-специфический ответ CD8 + -Т-клеток значительно способствует репликации вируса при первичной инфекции.\ prime} {-} kE (t)] \] $$ mathtex $$ (6)
Здесь R ( t ) — это функция интерполяции измерений непролиферирующих CD4 + Т-клеток (по измерениям CD4 + Т-клеток, которые не отображают Ki67), а r ′ — это продукция уровень вируса в покоящихся CD4 + Т-клетках (на клетку в день). Скорость продуцирования вируса r ′ в покоящихся клетках была оценена как ноль у всех животных.
Подгоняя восемь точек данных к модели на основе целевых клеток (уравнение 1), которая имеет два параметра, мы получаем шесть степеней свободы (df 1 = 6), а поскольку модель иммунного контроля (уравнение 3) имеет на один параметр больше, чем модель на основе целевой ячейки (уравнение 1), мы имеем df 2 = 5. Если F s больше критического значения распределения Фишера F (df 1 , df 2 ) = 6,61, где α = 0 . 05, то вирус-специфический ответ CD8 + -Т-клеток значительно способствует репликации вируса при первичной инфекции.\ prime} {-} kE (t)] \] $$ mathtex $$ (6)
Здесь R ( t ) — это функция интерполяции измерений непролиферирующих CD4 + Т-клеток (по измерениям CD4 + Т-клеток, которые не отображают Ki67), а r ′ — это продукция уровень вируса в покоящихся CD4 + Т-клетках (на клетку в день). Скорость продуцирования вируса r ′ в покоящихся клетках была оценена как ноль у всех животных. Таким образом, репликация вируса в покоящихся CD4 + Т-клетках незначительна.
Таким образом, репликация вируса в покоящихся CD4 + Т-клетках незначительна.
Анализ на основе Gag 181-189 — и Tat 28-35 -специфических CD8 + Т-клеток. Анализ, представленный в основном тексте, основан на пролиферирующих Т-клетках CD8 + в качестве суррогата SIV-специфического ответа CD8 + -Т-клеток. Здесь мы представляем результаты анализа, основанного на измерениях Gag 181-189 — и Tat 23-35 -специфичных CD8 + Т-клеток. Этот альтернативный выбор суррогата для SIV-специфических ответов Т-клеток CD8 + влияет только на соответствие модели иммунного контроля, но не на соответствие модели на основе клеток-мишеней.
На фиг. A1a показано соответствие модели иммунного контроля, основанной на сумме Gag 181-189 — и Tat 23-35 -специфических CD8 + Т-клеток (сплошные красные линии), для обработанных животных. Подборки, основанные на сумме Gag 181-189 — и Tat 23-35 -специфических CD8 + Т-клеток, очень похожи на подборки на основе Ki67 + CD8 + Т-клеток (сплошной черный линий). Основываясь на любом из двух измерений вирус-специфических ответов CD8 + -Т-клеток, модель иммунного контроля не объясняет характер репликации вируса значительно лучше, чем модель на основе клеток-мишеней (пунктирные линии) в трех из трех случаев. четыре животных (таблицы 2 и A1).
Основываясь на любом из двух измерений вирус-специфических ответов CD8 + -Т-клеток, модель иммунного контроля не объясняет характер репликации вируса значительно лучше, чем модель на основе клеток-мишеней (пунктирные линии) в трех из трех случаев. четыре животных (таблицы 2 и A1).
На рис. A1b показаны соответствия модели иммунного контроля, основанной на сумме Gag 181-189 — и Tat 23-35 -специфических Т-лимфоцитов CD8 + (сплошные красные линии), и нелеченных животных. их с приспособлениями на основе Ki67 + CD8 + Т-клеток (сплошные черные линии). За исключением RBm6 животного, подходы модели иммунного контроля, основанной на сумме Gag 181-189 — и Tat 23-35 -специфических Т-клеток CD8 + , очень похожи на подходы той же модели. на основе Ki67 + CD8 + Т-клеток.
В таблице A1 показаны оценки параметров модели иммунного контроля, основанные на сумме Gag 181-189 — и Tat 23-35 -специфических CD8 + Т-клеток, и сравнивается соответствие модели иммунного контроля и соответствие целевой модели на основе ячеек. У трех из четырех животных модель иммунного контроля объясняет характер репликации вируса значительно лучше, чем модель на основе клеток-мишеней. Как и в анализе, основанном на Ki67 + CD8 + Т-клетках, внутренняя смертность инфицированных клеток, a ‘, оценивается как ноль у всех необработанных животных, что предполагает, что при первичной инфекции инфицированные клетки погибают в основном CTL.
У трех из четырех животных модель иммунного контроля объясняет характер репликации вируса значительно лучше, чем модель на основе клеток-мишеней. Как и в анализе, основанном на Ki67 + CD8 + Т-клетках, внутренняя смертность инфицированных клеток, a ‘, оценивается как ноль у всех необработанных животных, что предполагает, что при первичной инфекции инфицированные клетки погибают в основном CTL.
Оценка параметров для соответствия модели иммунного контроля на основе суммы Gag 181-189 — и Tat 28-35 -специфических CD8 + Т-клеток a
ПРИЛОЖЕНИЕ
Target- ячеечная модель.
Модель на основе клеток-мишеней задается следующим уравнением для плазменной виремии, v :
$$ mathtex $$ \ [\ frac {dv} {dt} {=} v [rT (t) {-} a] \] $$ mathtex $$ (1)
Здесь динамика вируса определяется двумя терминами: rT ( t ), который описывает, как скорость роста вируса зависит от численности клеток-мишеней, T ( t ), в то время. \ prime} {-} a (t {-} t_ {0}) \] $$ mathtex $$ (2)
Обратите внимание, что приведенное выше выражение для вирусной нагрузки линейно по параметрам r и a .
\ prime} {-} a (t {-} t_ {0}) \] $$ mathtex $$ (2)
Обратите внимание, что приведенное выше выражение для вирусной нагрузки линейно по параметрам r и a .
Мы подогнали приведенное выше выражение к логарифму наблюдаемой вирусной нагрузки каждого отдельного животного, отдельно минимизируя сумму квадратов остатков. Эта модель (как и все последующие модели) была подогнана с использованием процедуры «optim ()» языка статистических вычислений R (13), которая позволяет нам ограничивать параметры положительными значениями. Анализ начальной загрузки был использован для расчета 68% доверительных интервалов (ДИ) (8).
БЛАГОДАРНОСТИ
Мы благодарим Алана Ллойда и Марка Танака за полезные обсуждения.
Мы с благодарностью подтверждаем поддержку гранта Deutsche Forschungsgemeinschaft Re 1618 / 2-1 (R.R.R.) и грантов Национального института здравоохранения AI 49334 (R.A. и R.R.R.) и RO1 AI49155 (M.B.F. и S.I.S.). Марк Файнберг — ученый Элизабет Глейзер из Детского фонда борьбы со СПИДом.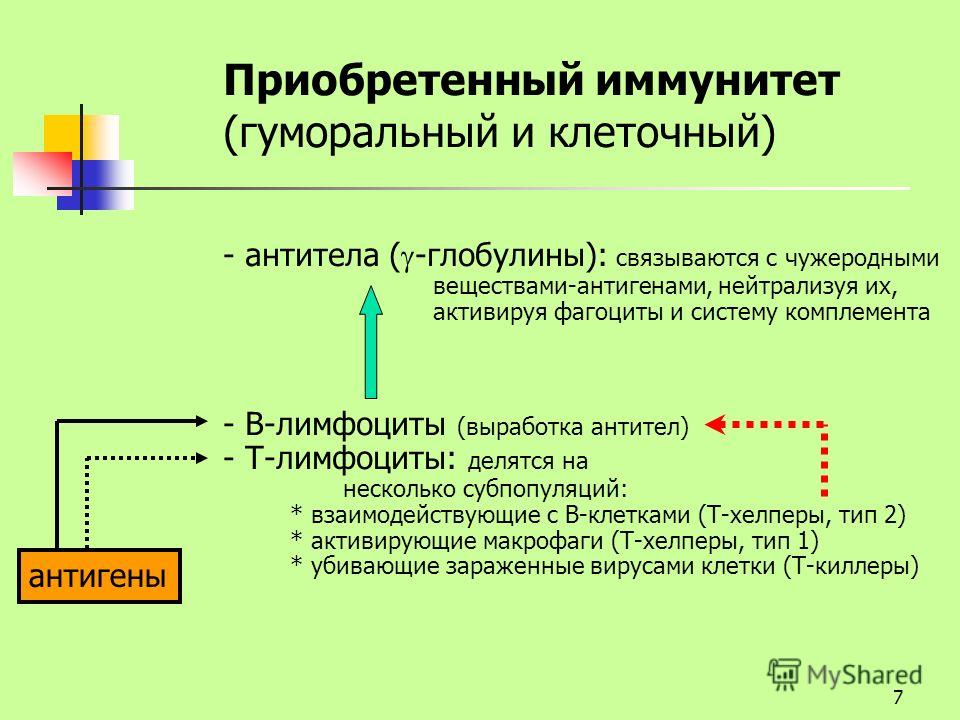
СНОСКИ
- Получено 17 июля 2003 г.
- Принято 9 декабря 2003 г.
- Авторское право © 2004 Американское общество микробиологии
ССЫЛКИ
- 1.↵
Amara, RR, F. Villinger, JD Altman, SL Lydy, SP O’Neil, SI Staprans, DC Montefiori, Y. Xu, JG Herndon, LS Wyatt, MA Candido, NL Kozyr, PL Earl, JM Smith , HL Ma, BD Grimm, ML Hulsey, J. Miller, HM McClure, JM McNicholl, B. Moss и HL Robinson. 2001. Контроль заражения слизистых оболочек и профилактика СПИДа с помощью мультибелковой вакцины ДНК / MVA. Наука 292 : 69-74.
- 2.↵
Кларк, С.Дж., М. С. Сааг, В. Д. Деккер, С. Кэмпбелл-Хилл, Дж. Л. Роберсон, П. Дж. Велдкамп, Дж. К. Каппес, Б. Х. Хан и Г. М. Шоу. 1991. Высокие титры цитопатического вируса в плазме больных с симптоматической первичной инфекцией ВИЧ-1.
 N. Engl. J. Med.
324 : 954-960.
N. Engl. J. Med.
324 : 954-960. - 3.↵
Каузенс, Л. П., Р. Петерсон, С. Хсу, А. Дорнер, Дж. Д. Альтман, Р. Ахмед и К. А. Бирон. 1999. Разошлись два пути: опосредованные интерфероном альфа / бета и интерлейкином 12 пути в стимулировании Т-клеточного гамма-ответа во время вирусной инфекции.J. Exp. Med. 189 : 1315-1328.
- 4.↵
Даар, Э. С., Т. Муджил, Р. Д. Мейер и Д. Д. Хо. 1991. Преходящие высокие уровни виремии у пациентов с первичной инфекцией вируса иммунодефицита человека типа 1. N. Engl. J. Med. 324 : 961-964.
- 5.↵
Де Бур, Р. Дж., И А. С. Перельсон. 1998. Ограниченные клетки-мишени и модели иммунного контроля ВИЧ-инфекции: сравнение. J. Theor. Биол.190 : 201-214.
- 6.↵
Desrosiers, R. C. 1990. Вирусы обезьяньего иммунодефицита.
 Анну. Rev. Immunol.
8 : 557-578.
Анну. Rev. Immunol.
8 : 557-578. - 7.↵
Douek, DC, JM Brenchley, MR Betts, DR Ambrozak, BJ Hill, Y. Okamoto, JP Casazza, J. Kuruppu, K. Kuntsman, S. Wolinsky, Z. Grossman, M Дайбул, А. Оксениус, Д. А. Прайс, М. Коннорс и Р. А. Куп. 2002. ВИЧ преимущественно инфицирует ВИЧ-специфические CD4 (+) Т-клетки.Природа 417 : 95-98.
- 8.↵
Эфрон, Б. и Р. Тибширани. 1986. Методы начальной загрузки для стандартных ошибок, доверительных интервалов и других мер статистической точности. Стат. Sci. 1 : 54-77.
- 8a.↵
Гарбер, Д. А., Дж. Сильвестри, А. П. Барри, А. Феданов, Н. Козырь, Г. МакКлюр, Д. К. Монтефиори, К. П. Ларсен, Дж. Д. Альтман, С. И. Стапранс и М. Б. Файнберг. 2004. Блокада костимуляции Т-клеток выявляет взаимосвязанные действия CD4 + и CD8 + Т-клеток в контроле репликации SIV.J. Clin.
 Расследование. 113:
836-845.
Расследование. 113:
836-845. - 9.↵
Haase, AT, K. Henry, M. Zupancic, G. Sedgewick, RA Faust, H. Melroe, W. Cavert, K. Gebhard, K. Staskus, ZQ Zhang, PJ Dailey , Е. Х. Бальфур, А. Эриче и А. С. Перельсон. 1996. Количественный анализ изображений ВИЧ-1 инфекции в лимфоидной ткани. Наука 274 : 985-989.
- 10.↵
Ho, D. D. 2002. ВИЧ и динамика лимфоцитов. Вакцина 20 : 1933 г.
- 11.↵
Хо, Д. Д., А. У. Нойман, А. С. Перельсон, В. Чен, Дж. М. Леонард и М. Марковиц. 1995. Быстрый оборот вирионов плазмы и лимфоцитов CD4 при ВИЧ-1 инфекции. Природа 373 : 123-126.
- 12.↵
Р. Хофманн-Леманн, Р. К. Свенертон, В. Лиска, К. М. Лойтенеггер, Х. Лутц, Х. М. МакКлюр и Р. М. Рупрехт. 2000. Чувствительная и надежная цепная реакция обратной транскриптазы-полимеразы в одной пробирке в реальном времени для количественной оценки нагрузки РНК SIV: сравнение одно- и двухферментных систем.
 AIDS Res. Гм. Ретровир.
16 : 1247-1257.
AIDS Res. Гм. Ретровир.
16 : 1247-1257. - 13.↵
Ихака Р. и Р. Джентльмен. 1996. R: язык для анализа данных и графики. J. Comput. График. Стат. 5 : 299-314.
- 14.↵
Кан, Дж. О. и Б. Д. Уокер. 1998. Острая инфекция, вызванная вирусом иммунодефицита человека 1 типа. N. Engl. J. Med. 339 : 33-39.
- 15.↵
Кауфманн, Г.Р., П. Каннингем, А. Д. Келлехер, Дж. Заундерс, А. Карр, Дж. Виззард, М. Лоу и Д. А. Купер. 1998. Особенности вирусной динамики при первичном инфицировании вирусом иммунодефицита человека 1 типа. J. Infect. Dis. 178 : 1812-1815 гг.
- 16.↵
Кленерман П., Р. Э. Филлипс, К. Р. Ринальдо, Л. М. Валь, Г. Огг, Р. М. Мэй, А. Дж. Мак-Майкл и М. А. Новак. 1996. Цитотоксические Т-лимфоциты и вирусный оборот при ВИЧ-инфекции 1 типа.
 Proc. Natl. Акад.Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ.
93 : 15323-15328.
Proc. Natl. Акад.Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ.
93 : 15323-15328. - 17.↵
Куп, Р. А., Д. Д. Хо. 1994. Прекращение борьбы с ВИЧ. Природа 370 : 416.
- 18.
Литтл, С. Дж., А. Р. Маклин, К. А. Спина, Д. Д. Ричман и Д. В. Хавлир. 1999. Вирусная динамика острой ВИЧ-1 инфекции. J. Exp. Med. 190 : 841-850.
- 19.↵
Матано, Т., Р. Шибата, К. Симон, М. Коннорс, Х.К. Лейн и М. А. Мартин. 1998. Введение моноклонального антитела против CD8 препятствует клиренсу химерного вируса иммунодефицита обезьян / человека во время первичных инфекций макак-резус. J. Virol. 72 : 164-169.
- 20.↵
Новак, М. А., А. Л. Ллойд, Г. М. Васкес, Т. А. Вильтроут, Л. М. Валь, Н. Бишофбергер, Дж. Уильямс, А. Кинтер, А. С. Фаучи, В. М. Хирш и Дж. Д. Лифсон. 1997.
 Вирусная динамика первичной виремии и антиретровирусной терапии при инфицировании вирусом иммунодефицита обезьян.J. Virol.
71 : 7518-7525.
Вирусная динамика первичной виремии и антиретровирусной терапии при инфицировании вирусом иммунодефицита обезьян.J. Virol.
71 : 7518-7525. - 21.↵
Ogg, GS, X. Jin, S. Bonhoeffer, PR Dunbar, MA Nowak, S. Monard, JP Segal, Y. Cao, SL Rowland-Jones, V. Cerundolo, A. Херли, М. Марковиц, Д. Д. Хо, Д. Ф. Никсон и А. Дж. Мак-Майкл. 1998. Количественный анализ ВИЧ-1-специфических цитотоксических Т-лимфоцитов и плазменной нагрузки вирусной РНК. Наука 279 : 2103-2106.
- 22.↵
Перельсон, А.С., А.У.Нойман, М. Марковиц, Дж. М. Леонард и Д. Д. Хо. 1996. Динамика ВИЧ-1 in vivo : скорость клиренса вирионов, продолжительность жизни инфицированных клеток и время генерации вируса. Наука 271 : 1582-1586.
- 23.↵
Phillips, A. N. 1996. Снижение концентрации ВИЧ во время острой инфекции: независимость от специфического иммунного ответа.
 Наука
271 : 497-499.
Наука
271 : 497-499. - 24.↵
Пятак, М., мл., М. С. Сааг, Л. С. Янг, С. Дж. Кларк, Дж. К. Каппес, К. К. Лук, Б. Х. Хан, Г. М. Шоу и Дж. Д. Лифсон. 1993. Высокие уровни ВИЧ-1 в плазме на всех стадиях инфекции, определяемые методом конкурентной ПЦР. Наука 259 : 1749-1754.
- 25.↵
Шакер Т., А. К. Коллиер, Дж. Хьюз, Т. Ши и Л. Кори. 1996. Клинико-эпидемиологические особенности первичной ВИЧ-инфекции. Анна. Междунар. Med. 125 : 257-264.
- 26.↵
Schmitz, JE, MJ Kuroda, S. Santra, VG Sasseville, MA Simon, MA Lifton, P. Racz, K. Tenner-Racz, M. Dalesandro, BJ Scallon, J. Ghrayeb, MA Forman, DC Montefiori , Е.П. Рибер, Н.Л. Летвин и К.А. Рейман. 1999. Контроль виремии при инфицировании вирусом иммунодефицита обезьян CD8 (+) лимфоцитами. Наука 283 : 857-860.
- 27.
 ↵
↵Стаффорд, М. А., Л. Кори, Ю. З. Цао, Э. С. Даар, Д. Д. Хо и А.С. Перельсон. 2000. Моделирование концентрации вируса в плазме крови при первичной ВИЧ-инфекции. J. Theor. Биол. 203 : 285-301.
- 28.↵
Wei, X., SK Gosh, ME Taylor, VA Johnson, EA Emini, P. Deutsch, JD Lifson, S. Bonhoeffer, MA Nowak, BH Hahn, MS Saag и GM Shaw . 1995. Вирусная динамика при инфекции вирусом иммунодефицита человека 1 типа. Природа 373 : 117-122.
- 29.↵
Вик, Д., С. Г. Селф и Л. Кори. 2002. Контролируют ли первичную ВИЧ-инфекцию дефицитные мишени или убийцы Т? J. Theor. Биол. 214 : 209-214.
Специфический клеточный иммунитет, обнаруженный с помощью теста ингибирования распространения моноцитов in vitro у пациентов с бронхогенной карциномой
Акесон, Р.: Органоспецифические антигены человека в нормальном легком, опухолях легких и клеточной линии опухоли легких. J. Natl. Cancer Inst. 58 , 483 (1977)
Google ученый
Альт, Г., Денк, Х., Фишер, М., Каррер, К., Кокрон, О., Коризек, Э., Микше, М., Огрис, Э., Рейдер, К., Тичер, Р., Врба, Х. : Иммунологический статус до и во время иммунотерапии. Рак-химиотерапия. Rep. (Suppl.) 4 [3], 275 (1973)
Белл, К. Э., Ситхарам, С., МакДэниел, Р. С. Дифференцировочные антигены, происходящие из энтодермы и нервного гребня, экспрессируются опухолью легких человека. J. Immunol. 116 , 1236 (1976)
Google ученый
Бодди, А.W., Holmes, E.C., Roth, J.A .: Ингибирование миграции лейкоцитов человека в агарозе экстрактами KCl рака легких. Surg. Форум 25 , 109 (1974)
Google ученый
Бодди, А. В., Холмс, Е. С., Рот, А., Мортон, Д. Л .: Ингибирование миграции лейкоцитов человека в агарозе экстрактами KCl из карциномы легкого. Int. J. Рак 15 , 823 (1975)
Google ученый
Бубеник Ю., Перлманн, П., Хельмштейн, К., Мобергер, С.: Клеточные и гуморальные иммунные ответы на карциномы мочевого пузыря. Int. J. Рак 5 , 310 (1970)
Google ученый
Burger, DN, Vandenbark, AA, Finke, P., Malley, A., Frikke, M., Black, J., Acott, K., Begley, D., Vetto, RM: Оценка реактивности к экстракты опухолей путем ингибирования адгезии лейкоцитов и кожных тестов. J. Natl. Cancer Inst. 59 , 317 (1977)
Google ученый
Байерс, В.С., Левин, А. С., Хакетт, А. Дж., Фуденберг, Х. Х .: Опухолевый клеточно-опосредованный иммунитет в домашних контактах с больными раком. J. Clin. Вкладывать деньги. 55 , 500 (1975)
Google ученый
Бирн, М., Хеппнер, Г., Столбах, Л., Каммингс, Ф., Макдонаф, Э., Калабрези, П .: Опухолевый иммунитет у пациентов с меланомой, оцененный методами ингибирования колоний и микроцитотоксичности: предварительный отчет. Natl. Cancer Inst. Monogr. 37 , 3 (1973)
Natl. Cancer Inst. Monogr. 37 , 3 (1973)
Google ученый
Кокран, А. Дж., Спилг, В. Г. С., Маки, Р. М., Томас, К. Э .: Послеоперационная депрессия направленного опухолью клеточно-опосредованного иммунитета у пациентов со злокачественными заболеваниями. Br. Med. J. 4 , 67 (1972)
CAS PubMed Google ученый
Декарис, Д., Силобрчич, В., Мажуран, Р., Кадрнка-Ловренчич, М.: Подавление распространения моноцитов. Прямой тест in vitro для оценки гиперчувствительности замедленного типа у человека. Clin. Exp. Иммунол. 16 , 311 (1974)
Google ученый
Эйлбер, Ф. Р., Мортон, Д. Л .: Иммунологические исследования сарком человека: дополнительные доказательства, предполагающие наличие ассоциированного вируса сакромы. Рак 26 , 588 (1970)
Google ученый
Грэм-Поул, Дж., Огг, Л. Дж., Росс, К. Э., Кокран, А. Дж .: Сенсибилизация пациентов с нейробластомой и связанных и не связанных контактов с экстрактами нейробластомы. Ланцет 1 , 1376 (1976)
Google ученый
Hellström, I., Hellström, K. E., Pierce, G.E., Bill, A.H .: Демонстрация гуморального иммунитета, связанного с клетками, против клеток нейробластомы. Proc. Natl. Акад. Sci. США 60 , 1231 (1968)
Google ученый
Hellström, I., Хеллстрём, К. Э., Билл, А. Х., Пирс, Г. Э., Янг, Ю. С. П .: Исследования клеточного иммунитета к клеткам нейробластомы человека. Int. J. Cancer 6 , 172 (1970)
PubMed Google ученый
Hellström, I., Hellström, K. E., Sjögren, H.O., Warner, G.A .: Демонстрация клеточного иммунитета к человеческим новообразованиям различных гистологических типов. Int. J. Cancer 7 , 1 (1971)
PubMed Google ученый
Херберман Р.Б .: Кожные реакции гиперчувствительности замедленного типа на антигены опухолей человека. Рак 34 , 1469 (1974)
Google ученый
Херберман Р. Б .: Иммунологические подходы к диагностике рака. Рак 37 , 549 (1976)
Google ученый
Холлинсхед, А. К., Стюард, Т. Х. М., Герберман, Р. Б.: Реакции гиперчувствительности замедленного действия на растворимые мембранные антигены злокачественных клеток легких человека.J. Natl. Cancer Inst. 52 , 317 (1974)
Google ученый
Холлинсхед, А. К., Сега, Э., Стюард, Т. Х. М., Риччи, К., Минко, Т. К.: Сравнение антигенов рака легких. Тумори 61 , 125 (1975)
Google ученый
Иоахим, Х. Л., Дорсетт, Б. Х. , Палак, Э .: Клеточные и гуморальные иммунные реакции на плоскоклеточный рак легкого.В: Материалы одиннадцатого Международного онкологического конгресса. Bucalossi, P., Veronesi, U., Cascinelli, N. (eds.), New York: American Elsevier 1975
, Палак, Э .: Клеточные и гуморальные иммунные реакции на плоскоклеточный рак легкого.В: Материалы одиннадцатого Международного онкологического конгресса. Bucalossi, P., Veronesi, U., Cascinelli, N. (eds.), New York: American Elsevier 1975
Google ученый
Иоахим, Х. Л., Дорсетт, Б. Х., Палак, Э .: Иммунный ответ в месте опухоли при карциноме легкого. Рак 38 , 2296 (1976)
Google ученый
Ячи, А., Мацуура, Ю., Карпентер, К.М., Хайд, Л .: Иммунохимические исследования антигенов рака легких человека, растворимых в 50% насыщенном сульфате аммония. J. Natl. Cancer Inst. 40 , 663 (1968)
Google ученый
Келли Б., Леви Дж. Г .: Доказательства общего антигена, ассоциированного с опухолью, в экстрактах бронхогенной карциномы человека. Br. J. Рак 35 , 828 (1977)
Google ученый
Маккой, Дж.Л., Джером, Л. Ф., Кэннон, Г. Б., Виз, Дж. Л., Герберман, Р. Б. Реактивность пациентов с раком легких в анализах ингибирования миграции лейкоцитов на 3M экстракт хлорида калия свежих опухолевых тканевых клеток, полученных из рака легких. J. Natl. Cancer Inst. 59 , 1413 (1977)
Google ученый
Макинтайр, К. Р., Сизарет, П. П .: Обнаружение антигенов, связанных с карциномой легкого. В: Материалы одиннадцатого Международного онкологического конгресса.Bucalossi, P., Veronesi, U., Cascinelli, N. (eds.), New York: American Elsevier 1975
(eds.), New York: American Elsevier 1975
Google ученый
Мавлигит, Г. М., Гуттерман, Дж. У., Макбрайд, К. М., Херш, Э. М .: Клеточный иммунитет к солидным опухолям человека. Обнаружение in vitro с помощью бластогенного ответа лимфоцитов на клеточно-ассоциированные и солюбилизированные опухолевые антигены. Natl. Cancer Inst. Monogr. 37 , 167 (1973)
Google ученый
Мажуран, Р., Муягич, Х., Маленица, Б., Силобрчич, В .: Определение клеточного иммунитета к антигенам меланомы у человека с помощью теста ингибирования распространения моноцитов in vitro. Int. J. Рак 17 , 14 (1976)
Google ученый
Мор, Дж. А., Нордквист, Р. Э., Роудс, Э. Р., Коулсон, Р. Е., Коулсон, Дж. Дж .: Антиген и антитела, подобные карциноме альвеолярных клеток, у пациентов с карциномой альвеолярных клеток и другими видами рака. Cancer Res. 34 , 1904 (1974)
Google ученый
Мортон Д.Л., Мальгрен, Р. А. Остеосаркомы человека: иммунологические данные, позволяющие предположить наличие ассоциированного инфекционного агента. Наука 162 , 1279 (1968)
Google ученый
Мюнстер, А. М .: Посттравматическая иммуносупрессия происходит из-за активации супрессорных Т-клеток. Ланцет 1 , 1329 (1976)
Google ученый
Нордквист Р.Э .: Специфические антигены альвеолярно-клеточного рака человека.Cancer Res. 33 , 1790 (1973)
Google ученый
Олдхэм, Р. К., Виз, Дж. Л., Герберман, Р. Б., Перлин, Э., Миллс, М., Блом, Дж., Грин, Д., Рид, Дж., Беллинджер, С., Лоу, И. , Маккой, Дж. Л., Дин, Дж. Х., Кэннон, Дж. Б., Джеу, Дж .: Иммунологический мониторинг и иммунотерапия при карциноме легкого. Int. J. Рак 18 , 739 (1976)
Google ученый
Пауэлл, А.Е., Слосс, А. М., Смит, Р. Н., Макли, Дж. Т., Хубей, К. А .: Специфическая чувствительность лейкоцитов к растворимым экстрактам опухолей человека. Int. J. Рак 16 , 905 (1975)
Google ученый
Приори, Э. С., Уилбер, Дж. Р., Дмоховски, Л .: Иммунофлуоресцентные тесты на сыворотке крови пациентов с остеогенной саркомой. J. Natl. Cancer Inst. 46 , 1299 (1971)
Google ученый
Schlipköter, H.W., Idel, H., Barsoum, A. L., Vollmer, U.J .: Tumorcharakteristische Antigene in Bronchialkarzinomen. Zentralbl. Бактериол. [Я. Abt. Ориг. B] 158 , 109 (1973)
Google ученый
Силобрчич, В., Сабиончелло, А., Мажуран, Р., Декарис, Д., Кадрнка-Ловренчич, М .: Сравнение ингибирования миграции лейкоцитов и распространения моноцитов в качестве тестов in vitro на гиперчувствительность к туберкулину человек. Clin. Exp. Иммунол. 20 , 239 (1975)
Google ученый
Спитлер, Л. Э., Литтуй, Ф. Н., Сагебиль, Р. У .: Клеточный иммунитет у пациентов со злокачественной меланомой и их семейных контактов. Cancer Immunol. Immunother. 2 , 69 (1977)
Google ученый
Tillack, T. W., Rosai, J., Vervynck, D.J .: Иммунологические исследования гликопротеинов, выделенных из клеточных мембран карцином легких человека.J. Natl. Cancer Inst. 52 , 1059 (1974)
Google ученый
Велтри, Р. В., Менголи, Х. Ф., Максим, П. Э., Вестфолл, С., Гапо, Дж. М., Хуанг, К.-В., Спринкл, П. М .: Выделение и идентификация антигенов, ассоциированных с опухолями легких человека. Cancer Res. 37 , 1313 (1977)
Google ученый
Viza, D., Louvier, M., Phillips, J., Bouchiex, C., Guerin, R.A .: Солюбилизация антигена, связанного с некоторыми опухолями бронхов. Евро. J. Рак 11 , 765 (1975)
Google ученый
Восе, Б. М., Мур, М., Джек, Г. Д .: клеточно-опосредованная цитотоксичность для легочных новообразований человека. Int. J. Рак 15 , 308 (1975)
Google ученый
Восе, Б. М., Кимбер, И., Мур, М .: Ингибирование миграции лейкоцитов при неоплазии легких у человека.J. Natl. Cancer Inst. 58 , 483 (1977)
Google ученый
Уотсон, Р. Д., Смит, А. Г., Леви, Дж. Г .: Использование иммуноадсорбентных колонок для выделения антител, специфичных к антигенам, связанным с бронхогенной карциномой человека. Br. J. Рак 29 , 183 (1974)
Д., Смит, А. Г., Леви, Дж. Г .: Использование иммуноадсорбентных колонок для выделения антител, специфичных к антигенам, связанным с бронхогенной карциномой человека. Br. J. Рак 29 , 183 (1974)
Google ученый
Уотсон, Р. Д., Смит, А. Г., Леви, Дж. Г .: Обнаружение с помощью иммунодиффузии антигенных компонентов, ассоциированных с опухолью, в экстрактах бронхогенной карциномы человека.Br. J. Рак 32 , 300 (1975)
Google ученый
Вольф, А .: ассоциированный с опухолью антиген из плеврального выпота пациентов с плоскоклеточным раком легкого. Br. J.Cancer 36 , 1046 (1978)
Google ученый
Границы | Специфический для полиомавируса клеточный иммунитет: от специфического клеточного иммунитета к BK-вирусу к нефропатии, ассоциированной с BK-вирусом?
Введение
BK-вирус (BKV) — это полиомавирус человека, впервые выделенный в 1971 году, который принадлежит к подсемейству papovaviridae и включает два основных штамма, связанных с заболеванием человека: BKV и JC-вирус (JCV).BKV часто вызывает неуместную инфекцию среди населения в целом. До 85% взрослых подвергались воздействию вируса (по данным серологического тестирования), но рецидив вируса может наблюдаться при иммуносупрессии, что свидетельствует о наличии бессимптомной скрытой инфекции. За исключением детей, которым была проведена трансплантация костного мозга, в большинстве случаев у взрослых инфекция BKV соответствует рецидиву вируса, а не инфекции de novo после трансплантации почки.Человеческий BKV был связан с интерстициальным нефритом и стенозом мочеточника при трансплантации почки и геморрагическим циститом у реципиентов трансплантата костного мозга. BKV-нефропатия, связанная с вирусным рецидивом, встречается в 1–10% случаев трансплантации почек и является серьезным осложнением после трансплантации почки, часто приводящим к потере трансплантата (1). Отсутствие нефротоксической противовирусной терапии приводит к снижению иммуносупрессии для контроля репликации вируса, но может привести к отторжению органа.Роль иммунной системы в борьбе с этим вирусом все еще плохо изучена.
Заболеваемость и клинические проявления
Полиомавирусы в общей популяции
Полиомавирусы широко распространены среди населения в целом, но редко вызывают явные клинические заболевания или патологии. Это семейство вирусов эволюционировало вместе со своими хозяевами, о чем свидетельствует их высокая распространенность и низкая заболеваемость (2, 3). В настоящее время семейство полиомавирусов человека состоит из 10 членов.Наиболее распространенными являются полиомавирусы hominis 1 и 2, более известные как BKV и JCV, соответственно, названные в честь инициалов пациентов, от которых они были впервые изолированы в 1970-х годах (3). При распространенности серотипа более 80% для BKV и 50% для JCV эпидемиологические исследования среди населения в целом указывают на раннее и высокое воздействие этих полиомавирусов (4, 5). Первичная инфекция часто протекает субклинически и без специфических симптомов. Естественная передача полностью не выяснена, но, вероятно, происходит респираторным или оральным путем.Известно, что после первичной инфекции BKV и JCV сохраняются в почечно-мочевых путях, но механизмы, участвующие в локализации вируса в этом эпителии, остаются неизвестными (3). Бессимптомное выделение BKV и JCV с мочой наблюдалось у 7 и 19% здоровых доноров крови в возрасте 20–59 лет, соответственно, со средней вирусной нагрузкой 3,51 и 4,64 log копий / мл соответственно. Ни BKV, ни JCV-виремия не обнаружена в плазме у иммунокомпетентных лиц (4).
Полиомавирусы у пациентов с ослабленным иммунитетом
Полиомавирусы — это латентные вирусы, которые могут реплицироваться у пациентов с приобретенным иммунодефицитом.Существенные заболевания органов, связанные с репликацией полиомавирусов, наблюдались у пациентов с хронической приобретенной иммуносупрессией, вызванной процедурами трансплантации органов, инфекцией вируса иммунодефицита человека (ВИЧ) или рассеянным склерозом, получавшим натализумаб. BKV и JCV демонстрируют сходное поведение, с высокой распространенностью среди населения в целом и связанных заболеваний, встречающихся почти только в популяции с ослабленным иммунитетом. Для этих двух вирусов требуются аналогичные механизмы контроля репликации, влекущие за собой ответ хозяина.Однако болезнь BKV не коррелирует напрямую с уровнем иммуносупрессии, но обычно зависит от множества дополнительных факторов риска, включая детерминанты хозяина (такие как иммунные эффекторы), детерминанты органов, которые способствуют репликации BKV, или внешние модуляторы (такие как иммунодепрессанты) (2 ). BKV отвечает за клинические проявления, главным образом, у пациентов с трансплантатом почек и редко у пациентов с трансплантацией сердца или печени, что предполагает роль местных факторов, таких как микровоспаление и репликация BKV в почечном эпителии.Однако BKV-ассоциированный геморрагический цистит также наблюдается в 5–15% аллогенных трансплантатов гемопоэтических стволовых клеток (1).
JCV не вызывает заболевания при трансплантации твердых органов, но отвечает за прогрессирующую мультифокальную лейкоэнцефалопатию (ПМЛ) у пациентов с ВИЧ и пациентов с рассеянным склерозом, получавших натализумаб. Несмотря на специфическую клеточную иммуносупрессию у этих пациентов, нефропатия, вызванная JCV или BKV, встречается редко, а также BKV-ассоциированный PML или энцефалит.Кроме того, BKV редко участвует в внепочечных патологиях, таких как пневмония, энцефалит, гепатит, ретинит, синдром утечки капилляров или рак (1, 3). В последнее время более широкое использование иммуносупрессоров при рассеянном склерозе было связано с появлением инфекций, связанных с ослабленным иммунитетом. Например, Lonergan et al. уже сообщили о более высокой частоте реактивации BKV у пациентов, получавших натализумаб по поводу рассеянного склероза. Однако значение репликации BKV при отсутствии почечной дисфункции неясно (6).
Получатели трансплантата костного мозга
В клинических исследованиях геморрагический цистит, вызванный BKV, наблюдался у реципиентов трансплантата костного мозга, в основном у молодых людей. Его можно эффективно лечить с помощью специальной противовирусной терапии, такой как цидофовир, лефлуномид или фторхинолон. Однако для определения их истинной безопасности и эффективности у этой популяции пациентов необходимы контролируемые клинические испытания цидофовира, лефлуномида и фторхинолонов, используемых для лечения BKV-ассоциированного геморрагического цистита (7).В этой популяции потенциальная нефротоксичность цидофовира вызвала небольшое количество острых нарушений функции почек.
Получатели трансплантата почки
При трансплантации почки реактивация BKV стала серьезным осложнением (в 1–10% случаев) (1). Его физиопатология все еще плохо изучена. Первый случай BKV-ассоциированной нефропатии был описан в 1995 г. и был связан с разработкой иммунодепрессантов, таких как такролимус и микофенолятмофетил (8).В настоящее время BKV остается важной проблемой при трансплантации почек и является основной причиной инфекционного заболевания, которое может привести к потере трансплантата (9, 10). Инфекции BKV обычно соответствуют вирусной реактивации из мочевого эпителия. Эти реактивации происходят у 1–10% реципиентов трансплантата почки (KT) и являются причиной потери трансплантата в 30–80% случаев (1). Потеря вызвана, с одной стороны, токсическим действием вируса, которое вызывает десквамацию умирающих эпителиальных клеток в моче с изменением их ядер (вирусные включения) и вызывает воспалительную интерстициальную реакцию, которая проникает в интерстиций канальцев.Это связано с развитием фиброза и атрофии канальцев. С другой стороны, когда иммуносупрессия снижается для контроля репликации вируса, может возникнуть острое отторжение канальцев. На сегодняшний день механизмы, участвующие в развитии воспаления почек и фиброза, связанного с нефропатией BKV, недостаточно изучены. Фенотип инфильтрирующих клеток во время BKV-нефропатии и во время острого отторжения не отличается в том смысле, что усиливает сложность диагностики BKV-нефропатии на основании острого отторжения.Более того, эти две ситуации могут возникать последовательно, так как диагноз BKV-нефропатии приведет к снижению общей иммуносупрессии, поскольку BKV будет отражать сверхиммуносупрессию, а затем будет способствовать развитию острого отторжения, что потребует повторного усиления иммуносупрессивной терапии. Это подчеркивает необходимость разработки специфических маркеров для конкретных ответов на этот вирус, чтобы избежать эпизодов острого отторжения и контролировать вирусную инфекцию. Интересно, что рецидив BKV в популяции KT, вероятно, требует дополнительных факторов или поврежденной ткани для репликации.Несмотря на высокий уровень распространенности в этой популяции, только у части реципиентов KT разовьется вирусная реактивация и BKV-нефропатия. С другой стороны, у пациентов, получающих подобную иммуносупрессивную терапию после трансплантации сердца, реже развивается инфекция BKV. Кроме того, несмотря на серьезную иммуносупрессию, некоторые случаи BKV были выявлены у реципиентов костного мозга или трансплантатов сердца.
Поскольку данных о патофизиологии этой вирусной реактивации нет, терапевтические подходы не кодифицированы.В настоящее время не существует противовирусного лечения, за исключением цидофовира, который может вызвать почечную токсичность, особенно у пациентов с трансплантатом почки (11, 12). По нашему опыту, несмотря на снижение дозы иммуносупрессии, использование цидофовира, адаптированного для функции почек, связано с высокой частотой острого некроза канальцев.
Диагностика BKV-ассоциированной нефропатии основана на сочетании неспецифических гистологических поражений плюс наличие BKV-виремии (BKV-ДНК плазмы с вирусной нагрузкой> 10 4 копий / мл) или BKV-вирурии (BKV в моче -ДНК с вирусной нагрузкой> 10 7 копий / мл).Вирурия наблюдается у 40% реципиентов КТ и обычно предшествует виремии (24% случаев) (13). В настоящее время из-за плохого исхода BKV-нефропатии врачи модулируют иммуносупрессию до возникновения BKV-нефропатии путем снижения иммуносупрессии. Ранняя диагностика важна для начала лечения до установления необратимого поражения почек (14).
Гистологический диагноз основан на обнаружении признаков репликации вируса в эпителиальных клетках (клетках почечных канальцев и / или капсульных клетках Боумена) и / или мочевыводящих путях («клетки-ловушки»).Эти признаки включают увеличенные ядра с нечеткими изменениями хроматина, внутриядерные вирусные включения, округление и отслоение, которые связаны с воспалительным инфильтратом, некрозом и / или фиброзом. Инфильтрат в основном состоит из мононуклеарных клеток, включая лимфоциты CD4 и CD8 и макрофаги. Вирус может быть идентифицирован иммуногистохимическим методом путем окрашивания на опухолевый антиген Large-SV40. Были описаны следующие модели BKV-ассоциированной нефропатии (1, 2, 11) (Рисунки 1A – C).
• Стадия A — умеренные вирусные цитопатические изменения в нормальной паренхиме почек.
• Стадия B — более серьезные клеточные повреждения с сочетанием вирусных цитопатических изменений и очаговых / мультифокальных областей тубулярной атрофии и / или интерстициального фиброза; воспалительные инфильтраты и / или тубулит (<25% для образца B1; 25–50% для образца B2;> 50% для образца B3). Самый важный дифференциальный диагноз — острое отторжение, которое также может сосуществовать с BKV-ассоциированной нефропатией.
• Стадия C — терминальная стадия BKV-ассоциированной нефропатии с обширным интерстициальным фиброзом и тубулярной атрофией.
Рис. 1. Нефропатия, ассоциированная с ВК-вирусом (A – C): внутриядерное включение вируса в эпителиальные клетки (B, C) . Гистологический анализ среза почки пациента с нефропатией BKV (окрашивание трихромом по Массону). При малом увеличении (x10) обратите внимание на обширный фиброз (окрашивание в зеленый цвет) с серьезным воспалением (ядра лейкоцитов отображаются черным цветом).При большем увеличении (x25) ядро некоторых тубулярных клеток модифицируется наличием большого внутриядерного вирусного включения, которое отображается белым цветом (см. Стрелки). Интерстициальная инфильтрация производится несколькими мононуклеарными клетками.
Согласно гистологическим данным, скорость потери трансплантата колеблется от 10% на стадии A до 80% на стадии C (1). Hirsch et al. (13) проанализировали репликацию BKV у более чем 600 реципиентов de novo KT в течение первого года после трансплантации: частота вируса составила 39.5%, а уровень виремии — 23,9%. Почечная функция через 1 год у пациентов с виремией была значительно нарушена (средняя скорость клубочковой фильтрации 60,4 против 65,7 мл / мин; p = 0,032) с более частыми эпизодами острого отторжения через 6 месяцев (13,0% против 6,1%, ). p = 0,030). Факторы риска развития BKV-виремии и / или BKV-ассоциированной нефропатии были идентифицированы и соответствуют высокому воздействию кортикостероидов, связанных с такролимусом и / или микофенолятмофетилом (по сравнению с более низкой частотой для циклоспорина А плюс микофенолятмофетил), пожилой возраст и мужчина пол (13, 15).
Традиционно предполагается, что интенсивность иммуносупрессии является основным фактором возникновения BKV-ассоциированной нефропатии. Однако вопросы, касающиеся конкретных эффектов иммуносупрессии (т.е. прямого эффекта или индивидуальной восприимчивости), остаются без ответа (13). С одной стороны, у пациентов с традиционной иммуносупрессивной терапией (тройная иммуносупрессия без истощающей индукции антителами) может развиться репликация BKV и нефропатия, а с другой стороны, у пациентов с сильным иммунодефицитом (с истощающими агентами в качестве индукционной терапии для трансплантата или леченными высокие дозы стероидов для лечения острого отторжения) не помогли.Это предполагает, что индивидуальная восприимчивость пациентов может способствовать или контролировать реактивацию BKV.
Elfadawy et al. (16) оценили влияние стойкой или временной BKV-виремии на функцию почечного трансплантата. Среднее начало виремии BKV составило 4,03 ± 2,5 месяца после трансплантации. Возникновение BKV-ассоциированной нефропатии было ограничено пациентами со стойкой высокой BKV-виремией. Через 1 год функция трансплантата была значительно снижена, а частота острого отторжения была значительно выше у реципиентов KT с высокой стойкой или преходящей виремией.Кроме того, пациенты со стойкой низкой виремией в 3,1 раза чаще избавлялись от вируса по сравнению с пациентами со стойкой высокой виремией (отношение рисков = 3,1; p = 0,001), что предполагает потенциальный контроль вируса со стороны иммунная система хозяина связана с низкой вирусной нагрузкой BKV. Это открытие предполагает, что за дисфункцию трансплантата могут быть ответственны механизмы, отличные от прямого проникновения в ткань BKV, а также разрешающие факторы или механизмы, которые способствуют удалению вируса и / или активации иммунной системы, могут участвовать в дисфункции трансплантата.
Пациенты, инфицированные вирусом иммунодефицита человека 1
Инфекция, вызванная вирусом иммунодефицита человека-1, характеризуется тяжелыми приобретенными дефектами клеточной иммунной системы, которые часто бывают более серьезными, чем те, которые наблюдаются у пациентов с трансплантатом в отсутствие специфической антиретровирусной терапии. Однако наблюдались очень редкие случаи BKV-ассоциированной нефропатии. Напротив, хотя реактивация BKV встречается редко, у этих пациентов иногда наблюдается реактивация JCV в головном мозге.Затем JCV отвечает за ПМЛ, редкое демиелинизирующее заболевание центральной нервной системы, которое возникает почти исключительно у пациентов с серьезными дефектами их клеточной иммунной системы. Уровень заболеваемости снизился с развитием высокоактивной антиретровирусной терапии (ВААРТ): в 1995 г. риску подвергались 3,3 [95% ДИ, 1,9–5,7] и 1,3 [95% ДИ, 0,8–1,9] случая на 1000 человеко-лет. –1996 и 2000–2006 гг. Соответственно. Однако выживаемость после ПМЛ остается низкой (среднее время выживания составляло 0.4 года [95% ДИ, 0,0–0,7] до ВААРТ и 1,8 года [95% ДИ, 0,6–3,0] после ВААРТ), с ~ 50% летальностью в течение 1 года после постановки диагноза (17) На сегодняшний день нет специального лечения для PML или контроля для репликации JCV. Однако ВААРТ улучшила прогноз при ПМЛ, вероятно, за счет восстановления иммунного дефекта. Действительно, после начала ВААРТ у ВИЧ-инфицированных пациентов, не получавших лечения, наблюдалось увеличение количества CD4 + Т-клеток центральной памяти, что может быть ранним индикатором восстановления иммунитета (18).
Описание BK-Virus
Члены семейства полиомавирусов имеют общую морфологию и структуру. Вирионы маленькие, без оболочки и выглядят как икосаэдрические частицы диаметром 40–45 мкм. Капсиды содержат кольцевую двухцепочечную ДНК с вирусным геномом 5 т.п.н., обернутую вокруг гистонов, полученных из клетки-хозяина. Геномы полиомавирусов гомологичны более чем на 80%. Их вирусный геном разделен на три области (2, 3):
• Некодирующая контрольная область регулирует транскрипцию гена.В источнике репликации вируса этот регион регулирует экспрессию ранних и поздних вирусных генов.
• Область раннего гена кодирует регуляторные белки, называемые «большим опухолевым антигеном» (LTag) и «малым Т-антигеном» (sTag). LTag и sTag способствуют интеграции и репликации вирусного генома за счет отмены контроля клеточного цикла. LTag способен инактивировать некоторые белки эндоплазматического ретикулума, в частности белок p53, ответственный за контроль клеточного цикла, индуцируя апоптоз.BKV способен предотвращать лизис инфицированных клеток и может инициировать онкогенную трансформацию.
• Область позднего гена кодирует белки капсида: VP-1, VP-2 и VP-3.
Иммунитет к полиомавирусу
У здоровых людей
Вирус-специфическая реакция клеточного иммунитета имеет решающее значение для контроля репликации вируса и предотвращения хронических заболеваний. Вирусные инфекции со склонностью к латентному периоду требуют постоянного иммунного контроля для ограничения скорости и уровня реактивации вируса.Т-клетки отвечают своей цитотоксической активностью и секрецией цитокинов и обладают прямым противовирусным эффектом, который необходим для борьбы с хроническими вирусами (19). Кроме того, антитела (выработанные во время инфекции) могут участвовать в очищении от вируса. BKV-серопозитивные реципиенты имеют титры нейтрализующих антител, но они не защищают от репликации BKV или BKV-ассоциированной нефропатии (20, 21).
Мишени для BKV-специфического клеточного иммунитета обширны, и Т-клетки отвечают против различных антигенов BKV, таких как VP1, VP2, VP3, LTag и sTag.Иммунодоминантный антиген не обнаружен (22, 23). Т-клеточный ответ здоровых серопозитивных людей на BKV был изучен с помощью ELISpot и проточной цитометрии. Из общего числа протестированных 75% имели более 10 пятнообразующих единиц на 10 6 PBMC по крайней мере для одного из пептидных пулов, полученных из BKV, добавленных в анализе. Положительные ответы были обнаружены на пептиды, полученные из всех пяти основных белков BKV (VP1, VP2, VP3, LTag и sTag). Кроме того, 91% людей имели ответ, опосредованный CD4 + , тогда как только 33% генерировали ответ Т-клеток CD8 + (24).
BK-вирус-специфический клеточный и гуморальный иммунитет у 122 иммунокомпетентных лиц, как было показано, широко распространен у молодых людей. BKV-специфический клеточный и гуморальный иммунитет достигает максимума у людей в возрасте от 20 до 30 лет, а затем снижается с увеличением временного расстояния от первичной инфекции BKV. В клеточном иммунном ответе доминируют полифункциональные Т-клетки CD4 + , которые обладают пролиферативной активностью и преимущественно экспрессируют полифункциональные цитокины (25).
Полиомавирус BK у пациентов с иммуносупрессией
Эпизоды реактивации BKV имеют сложную и плохо изученную патофизиологию. Было предложено множество факторов, таких как детерминанты хозяина (например, возраст, BKV-серонегативность перед трансплантацией, специфические клеточные иммунные ответы, …) и инфицированная ткань (например, способность к репликации BKV), детерминанты вируса (например, репликативная характеристики) и внешние модуляторы (например, иммуносупрессивное лечение, сопутствующие инфекции, медиаторы воспаления и т. д.) (2).
При трансплантации почки изменение BKV-специфического Т-клеточного ответа играет решающую роль в инициации и прогрессировании нефропатии, хотя нам неизвестны точные патофизиологические механизмы (26, 27). Оценка BKV-специфического клеточного иммунитета может использоваться в иммунологическом мониторинге для управления репликацией BKV. Неспособность развить или расширить специфический клеточный иммунный ответ является центральным событием для инициации и поддержания репликации BKV и прогрессирования BKV-ассоциированной нефропатии.BKV-специфический интерферон (IFN) γ-секретирующие Т-лимфоциты были обнаружены в периферической крови здоровых серопозитивных людей. Напротив, BKV-серопозитивные реципиенты KT, получавшие иммуносупрессоры, имели значительно более низкие средние частоты специфических IFN-γ-секретирующих Т-лимфоцитов по сравнению с контролем, тогда как BKV-специфические IFN-γ-секретирующие T-клетки не были обнаружены у KT-пациентов с BKV-ассоциированными. нефропатия.
Снижение иммуносупрессии у пациентов с BKV-ассоциированной нефропатией было связано с появлением IFN-γ-секретирующих Т-клеток до того же уровня, что и у здоровых контролей, а также со снижением BKV-нагрузки в плазме и моче (21).
У 42 реципиентов KT с виремией BKV секреция IFN-γ Т-лимфоцитами была продемонстрирована после стимуляции LTag и VP-1. Этот клеточный иммунный ответ был значительно выше у пациентов с клиренсом вируса по сравнению с пациентами с постоянной или повышенной виремией. VP-1 преимущественно стимулировал CD4 + Т-клетки, тогда как LTag предпочтительно стимулировал CD8 + (23). CD4 + Т-клетки, которые одновременно секретируют IFN-γ / TNF-α / IL-2, чаще обнаруживались у пациентов с быстрым клиренсом BKV, что свидетельствует о защитной роли BKV-специфических полифункциональных CD4 + T-клеток (22, 28).Удивительно, но у пациентов с BKV-ассоциированной нефропатией наблюдалось увеличение эффекторных Т-клеток CD4 + памяти. Это предполагает, что не только контроль пролиферации Т-клеток, но и другие механизмы дифференцировки также могут быть вовлечены в контроль / распространение BKV. Кроме того, несмотря на относительно обычное использование иммуносупрессии, высокая частота серопространственности в популяции трансплантатов и небольшое количество пациентов, у которых развивается нефропатия BKV, позволяют предположить, что в этой популяции может быть индивидуальная восприимчивость к репликации BKV.
Качество ответа на BKV обсуждалось в других исследованиях. Частоты BKV-специфических CD4 + T-клеток были значительно выше у реципиентов трансплантата с репликацией BKV по сравнению с частотами T-клеток у здоровых людей соответствующего возраста. Интересно, что репликация BKV у пациентов с трансплантатом почки была связана со значительным изменением функциональности Т-клеток, с более низкой пролиферативной активностью и более низкими уровнями полифункциональных Т-клеток по сравнению со здоровыми контрольными.Снижение количества продуктивных клеток с тройными цитокинами наблюдалось с одновременным увеличением количества продуктивных клеток с одним цитокином (25). Эти результаты предполагают, что полифункциональность Т-клеток в ответ на вирус может иметь важное значение для борьбы с вирусом. Сообщалось, что частота BKV-нефропатии снижается при использовании терапии на основе ингибиторов mTOR по сравнению с терапией на основе CNI. Поскольку ингибиторы mTOR нарушают клеточный цикл и, как сообщается, снижают пролиферацию вируса in vitro , мы можем предположить, что ингибиторы mTor могут снижать репликацию вируса.Однако мы не можем исключить, что использование ингибиторов mTor могло иметь более низкую иммуносупрессивную функцию. Например, было высказано предположение, что ингибиторы mTOR связаны с более высокой скоростью острого клеточного отторжения и более высоким развитием антидонор-специфических антител и хроническим гуморальным отторжением при почечном трансплантате.
Интересно, что JCV отвечает за ПМЛ у пациентов с ослабленным иммунитетом, у которых есть дефицит CD4, тогда как JCV редко вызывает заболевание у пациентов с трансплантированными органами.Подобно BKV, ответ Т-клеток, по-видимому, играет ключевую роль в контроле репликации JCV. В частности, низкое количество Т-клеток CD4 + (≥50 клеток / мкл) и наивная подгруппа с большим количеством копий ДНК JCV при диагностировании ПМЛ, по-видимому, являются факторами риска смертности (17, 29, 30 ). Сообщалось о критической роли специфических для JCV ответов CD4 + Т-клеток в борьбе с инфекцией JCV. Восстановление Т-клеточного ответа против JCV связано с клиренсом JCV и улучшением выживаемости.Кроме того, JCV-специфические цитотоксические Т-лимфоциты CD8 + (CTL) не обнаруживаются в активной форме PML. Раннее обнаружение JCV-специфических CTL имело 87% прогностическую ценность для последующего JCV-контроля, тогда как отсутствие CTL имело 82% прогностическую ценность для последующего активного PML ( p = 0,0009) (31).
Было показано, что у пациентов с ПМЛ специфичные для JCV цитотоксические Т-лимфоциты CD8 + сверхэкспрессируют Programed Cell Death-1 (PD-1), рецептор-ингибитор, связанный с клеточным истощением.Связывание PD-1 с его лигандами, PD-L1 и PD-L2, делает Т-лимфоциты анергическими, предотвращая пролиферацию и производство интерлейкина-2 (IL-2). Блокирование рецептора PD-1 in vitro увеличивало JCV-специфический Т-клеточный иммунный ответ у ВИЧ-положительных пациентов с ранней ПМЛ (32). Эти результаты подчеркивают различные механизмы, которые могут участвовать в поддержании вируса, и что модуляция костимуляции посредством второго семейства сигналов может играть роль в противовирусном ответе.
Экспериментальные модели полиомавируса
Для определения роли иммунной системы в контроле репликации полиомавируса было разработано несколько моделей вирусной инфекции. Недавно на гуманизированных мышах была разработана мышиная модель для изучения JCV-специфического иммунного ответа. Эти мыши способны развивать Т- и В-клеточные реакции человека после контакта с JCV. Через шесть недель после инокуляции JCV и CD4 + , и CD8 + Т-клетки сверхэкспрессировали PD-1, который был обнаружен на CD4 + и CD8 + JVC-специфических Т-клетках у пациентов с ПМЛ, что позволяет предположить, что инфекция JCV может влияют на иммунное истощение (33).
Никаких животных моделей BKV еще не проводилось. Однако грызуны являются естественными хозяевами мышиного полиомавируса (MPyV). MPyV имеет обширную гомологию последовательностей с полиомавирусом человека. Если первичная инфекция протекает бессимптомно, во время эпизодов иммуносупрессии происходит реактивация вируса. Мыши, инфицированные MPyV, являются хорошей моделью для изучения патофизиологии полиомавирусных инфекций человека (34, 35). После трансплантации почки у этих мышей развилась MPyV-ассоциированная нефропатия, аналогичная BKV-ассоциированной нефропатии человека.Репликация MPyV была наибольшей, почти исключительно при трансплантации почки, и была связана с потерей почечного трансплантата, усилением аллореактивности CD8 + Т-клеток и усилением антидонорского Т-клеточного ответа, которое привело к отторжению (36). Эта репликация MPyV происходила почти исключительно в трансплантате почки, но не в нативных почках этой модели мышей с трансплантатом почек. Это породило гипотезу о том, что почечные клетки, претерпевающие регенерацию и дифференцировку, из-за повреждения, вызванного трансплантацией, или из-за местного воспаления, становятся доступными для вируса (36, 37).
Варианты иммунного противовирусного лечения
Специфический иммунологический мониторинг
Иммуно-вирусологический мониторинг (путем изучения функциональной способности специфических Т-лимфоцитов) может быть использован для выявления пациентов с риском инфекционных осложнений при приобретенном иммунодефиците (19). Выявление низкого противовирусного ответа против BKV при трансплантации почки может быть маркером более высокого риска развития рецидива BKV и / или нефропатии BKV. В таких случаях модуляция иммуносупрессии во время трансплантации может способствовать размножению BKV-специфических Т-клеток и, таким образом, контролировать репликацию вируса.Обнаружение BKV-специфических Т-клеток можно использовать в качестве инструмента для управления иммуносупрессией с целью контроля репликации вируса при одновременном поддержании адекватной иммуносупрессии для предотвращения отторжения (27).
Инновационное терапевтическое лечение на основе иммунной системы
Иммунная терапия может дополнительно способствовать контролю BKV и может быть альтернативой существующим вариантам лечения для восстановления эффективного вирусоспецифического иммунного ответа. Описан метод генерации BKV-специфических цитотоксических Т-лимфоцитов от серопозитивных BKV здоровых доноров и пациентов с KT, основанный на стимуляции PBMC дендритными клетками, пульсирующими инактивированным BKV (38).
Исследования Ex vivo показали, что образование и распространение BKV-специфических Т-клеток возможно у реципиентов KT и пациентов с трансплантацией аллогенных гемопоэтических стволовых клеток. Эти специфические лимфоциты были получены из гемопоэтических стволовых клеток от здоровых доноров или после экспансии ex vivo BKV-специфических Т-клеток. Эти клетки обладали способностью пролиферировать после повторной стимуляции антигеном, продуцировать провоспалительные цитокины и индуцировать цитотоксичность in vitro (39).
Другая иммунная терапия может быть разработана на основе вакцин. В этом контексте для разработки пептидной вакцинации было бы интересно найти иммунодоминантные пептиды.
Кроме того, идентификация роли рецептора PD1 / PDL1-L2, члена второго семейства сигнальной активации, во время инфекции JCV открывает новые перспективы. Во время инфекции JCV PD1, экспрессируемый инфицированными клетками, нарушает активацию Т-клеток и контроль вируса. Регулирование этого пути или ингибирование его сигнала может быть потенциально полезным и контролировать репликацию вируса.Однако его модуляция у пациентов с трансплантатом может быть связана с более широкой активацией функции Т-клеток, что приводит к острому отторжению.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
4. Эгли А., Инфанти Л., Думулин А., Бузер А., Самаридис Дж., Стеблер С. и др.Распространенность и репликация полиомавирусов BK и JC у 400 здоровых доноров крови. J Infect Dis (2009) 199 : 837–46. DOI: 10.1086 / 597126
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Антонссон А., Грин А.С., Маллитт К.А., О’Рурк П.К., Павлита М., Уотербоер Т. и др. Распространенность и стабильность антител к полиомавирусам BK и JC: долгосрочное исследование австралийцев. J Gen Virol (2010) 91 (Pt 7): 1849–53. DOI: 10.1099 / vir.0.020115-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Лонерган Р.М., Карр М.Дж., Де Гаскун К.Ф., Костелло Л.Ф., Уотерс А., Кофлан С. и др. Реактивация полиомавируса BK у пациентов с рассеянным склерозом, получающих терапию натализумабом. J Нейровирол (2009) 15 (5–6): 351–9. DOI: 10.3109 / 13550280
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8.Purighalla R, Shapiro R, McCauley J, Randhawa P. BK вирусная инфекция в аллотрансплантате почки, диагностированная с помощью игольной биопсии. Am J Kidney Dis (1995) 26 (4): 671–3. DOI: 10.1016 / 0272-6386 (95) -8
CrossRef Полный текст | Google Scholar
12. Хирш Х. Х., Бреннан Д. К., Драхенберг С. Б., Джиневри Ф., Гордон Дж., Лимай А. П. и др. Полиомавирусная нефропатия при трансплантации почки: междисциплинарные анализы и рекомендации. Трансплантация (2005) 79 (10): 1277–86. DOI: 10.1097 / 01.TP.0000156165.83160.09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Хирш Х. Х., Винченти Ф., Фриман С., Тунцер М., Читтерио Ф., Викек А. и др. Репликация полиомавируса BK у пациентов с трансплантатом почки de novo, получающих такролимус или циклоспорин: проспективное рандомизированное многоцентровое исследование. Am J Transplant (2013) 13 : 136–45.DOI: 10.1111 / j.1600-6143.2012.04320.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Якоби Дж., Пригниц А., Бюттнер М., Корн К., Вайдеманн А., Хильгерс К. Ф. и др. BK-виремия и полиомавирусная нефропатия при 352 трансплантации почек; факторы риска и потенциальная роль ингибирования mTOR. BMC Nephrol (2013) 14 : 207. DOI: 10.1186 / 1471-2369-14-207
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15.Рамос Э., Драхенберг С.Б., Пападимитриу Дж. К., Хамзе О., Финк Дж. К., Классен Д. К. и др. Клиническое течение полиомавирусной нефропатии у 67 пациентов с трансплантацией почки. J Am Soc Nephrol (2002) 13 : 2145–51. DOI: 10.1097 / 01.ASN.0000023435.07320.81
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Эльфадави Н., Флехнер С.М., Шольд Дж. Д., Сринивас Т. Р., Поджио Е., Фатика Р. и др. Переходная и стойкая BK-виремия и отдаленные исходы после трансплантации почки и почки-поджелудочной железы. Clin J Am Soc Nephrol (2014) 9 : 553–61. DOI: 10.2215 / CJN.08420813
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Энгсиг Ф. Н., Хансен А. Б., Омланд Л. Х., Кронборг Г., Герстофт Дж., Лаурсен А. Л. и др. Заболеваемость, клиническая картина и исход прогрессирующей мультифокальной лейкоэнцефалопатии у ВИЧ-инфицированных пациентов в эпоху высокоактивной антиретровирусной терапии: общенациональное когортное исследование. J Infect Dis (2009) 199 (1): 77–83.DOI: 10.1086 / 595299
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Хуа В., Цзяо Ю., Чжан Х., Чжан Т., Чен Д., Чжан Ю. и др. CD4-клетки центральной памяти являются ранним индикатором восстановления иммунитета у пациентов с ВИЧ / СПИДом, получающих антиретровирусное лечение. Immunol Invest (2012) 41 (1): 1–14. DOI: 10.3109 / 08820139.2011.576739
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19.Harari A, Dutoit V, Cellerai C, Bart P-A, Du Pasquier RA, Pantaleo G. Функциональные признаки защитного противовирусного Т-клеточного иммунитета при вирусных инфекциях человека. Immunol Rev (2006) 211 : 236–54. DOI: 10.1111 / j.0105-2896.2006.00395.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Хирш Х. Х., Ноулз В., Дикенманн М., Пассвег Дж., Климкаит Т., Михатч М. Дж. И др. Проспективное исследование репликации полиомавируса типа BK и нефропатии у реципиентов почечного трансплантата. N Engl J Med (2002) 347 : 488–96. DOI: 10.1056 / NEJMoa020439
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Комоли П., Аззи А., Маккарио Р., Бассо С., Ботти Дж., Базиль Дж. И др. BK-специфический иммунитет полиомавируса после трансплантации почки. Трансплантация (2004) 78 : 1229–32. DOI: 10.1097 / 01.TP.0000137932.44791.D3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22.Мюллер К., Шахтнер Т., Саттлер А., Мейер С., Фридрих П., Тридзенская Н. и др. BK-VP3 как новая мишень клеточного иммунитета при инфицировании вирусом ВК. Трансплантация (2011) 91 : 100–7. DOI: 10.1097 / TP.0b013e3181fe1335
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Бинггели С., Эгли А., Шауб С., Бине И., Майр М., Штайгер Дж. И др. BK-специфический клеточный иммунный ответ полиомавируса на VP1 и большой Т-антиген у реципиентов почечного трансплантата. Am J Transplant (2007) 7 : 1131–9. DOI: 10.1111 / j.1600-6143.2007.01754.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Тонг Д., Миллер Дж., Кокко К., Маклафлин С., Лукачер А. Здоровые люди генерируют преимущественно клеточный ответ CD4 против полиомавируса BK. Am J Transplant (2005) 5 (S11): 452.
Google Scholar
25.Schmidt T, Adam C, Hirsch HH, Janssen MWW, Wolf M, Dirks J, et al. Специфические клеточные иммунные реакции на полиомавирус BK зависят от возраста и сильно коррелируют с фазами репликации вируса. Am J Transplant (2014) 14 (6): 1334–45. DOI: 10.1111 / ajt.12689
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Комоли П., Чиони М., Бассо С., Гальярдоне С., Потенца Л., Веррина Е. и др. Иммунитет к полиомавирусной инфекции BK: иммунный мониторинг для регулирования баланса между риском нефропатии BKV и индукцией аллоиммунитета. Clin Dev Immunol (2013) 2013 : 256923. DOI: 10.1155 / 2013/256923
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Тридзенская Х., Саттлер А., Мюллер К., Шахтнер Т., Данг-Гейне С., Фридрих П. и др. Новый подход для улучшенной оценки фенотипических и функциональных характеристик BKV-специфического Т-клеточного иммунитета. Трансплантация (2011) 92 : 1269–77. DOI: 10.1097 / TP.0b013e318234e0e5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Gasnault J, Costagliola D, Hendel-Chavez H, Dulioust A, Pakianather S, Mazet A-A, et al. Повышение выживаемости ВИЧ-1-инфицированных пациентов с прогрессирующей мультифокальной лейкоэнцефалопатией, получающих раннюю комбинированную антиретровирусную терапию из 5 препаратов. PLoS One (2011) 6 (6): e20967. DOI: 10.1371 / journal.pone.0020967
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30.Gasnault J, Kahraman M, de Goër de Herve MG, Durali D, Delfraissy J-F, Taoufik Y. Критическая роль специфичных для вируса JC ответов Т-лимфоцитов CD4 в предотвращении прогрессирующей мультифокальной лейкоэнцефалопатии. AIDS (2003) 17 : 1443–9. DOI: 10.1097 / 00002030-200307040-00004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Du Pasquier RA, Kuroda MJ, Zheng Y, Jean-Jacques J, Letvin NL, Koralnik IJ. Проспективное исследование демонстрирует связь между специфичными для вируса JC цитотоксическими Т-лимфоцитами и ранним контролем прогрессирующей мультифокальной лейкоэнцефалопатии. Мозг (2004) 127 (Pt 9): 1970–8. DOI: 10.1093 / мозг / awh315
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Tan CS, Bord E, Broge TA Jr, Glotzbecker B, Mills H, Gheuens S, et al. Повышенная экспрессия программы клеточной смерти-1 на Т-лимфоцитах пациентов с прогрессирующей мультифокальной лейкоэнцефалопатией. J Acquir Immune Defic Syndr (2012) 60 : 244–8. DOI: 10.1097 / QAI.0b013e31825a313c
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33.Тан С.С., Броге Т.А. младший, Сеунг Э., Врбанак В., Вискиди Р., Гордон Дж. И др. Обнаружение иммунных ответов, специфичных для вируса JC, на новой гуманизированной модели мыши. PLoS One (2013) 8 : e64313. DOI: 10.1371 / journal.pone.0064313
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Лилли Б.Н., Гилберт Дж. М., Плоег Х. Л., Бенджамин Т.Л. Полиомавирусу мышей необходим белок эндоплазматического ретикулума Derlin-2 для инициации инфекции. J Virol (2006) 80 : 8739–44. DOI: 10.1128 / JVI.00791-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Swanson PA II, Lukacher AE, Szomolanyi-Tsuda E. Иммунитет к полиомавирусной инфекции: модель полиомавируса на мышах. Semin Cancer Biol (2009) 19 (4): 244–51. DOI: 10.1016 / j.semcancer.2009.02.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36.Хан Ли ЭД, Кембалл С.К., Ван Дж., Донг Й., Степлер Д.С. младший, Хэмби К.М. и др. Мышиная модель полиомавирусной нефропатии трансплантатов почек. Am J Transplant (2006) 6 : 913–22. DOI: 10.1111 / j.1600-6143.2006.01265.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Атенсио И.А., Шадан Ф.Ф., Чжоу XJ, Вазири Н.Д., Вильярреал Л.П. Почки взрослых мышей становятся восприимчивыми к острой полиомавирусной инфекции и реактивируют хронические инфекции в ответ на клеточное повреждение и регенерацию. J Virol (1993) 67 : 1424–32.
PubMed Аннотация | Google Scholar
38. Комоли П., Бассо С., Аззи А., Моретта А., Де Сантис Р., Дель Гальдо Ф. и др. Дендритные клетки, обработанные антигеном BK полиомавируса, индуцируют ex vivo вирусы полиомы BK цитотоксические Т-клеточные линии у серопозитивных здоровых людей и реципиентов почечного трансплантата. J Am Soc Nephrol (2003) 14 (12): 3197–204. DOI: 10.1097 / 01.ASN.0000096374.08473.E3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Блит Э., Клэнси Л., Симмс Р., Гаундар С., О’Коннелл П., Миклетуэйт К. и др. BK-вирус-специфические Т-клетки для использования в клеточной терапии проявляют специфичность по отношению к множеству антигенов и полифункциональные цитокиновые ответы. Трансплантация (2011) 92 : 1077–84. DOI: 10.1097 / TP.0b013e31823328c0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стойкие симптомы COVID-19 минимально влияют на развитие специфического клеточного иммунитета SARS-CoV-2
РЕЗЮМЕ
SARS-CoV-2 представляет собой беспрецедентную проблему для общественного здравоохранения, поскольку остается много неизвестных факторов, влияющих на вирусную патогенность и развитие инфекции. иммунитет после заражения.В то время как большинство инфицированных SARS-CoV-2 людей с COVID-19 от легкой до умеренной степени вылечивают свою инфекцию с небольшими осложнениями, у значительного числа людей наблюдались длительные симптомы, продолжавшиеся в течение нескольких недель после первоначального диагноза. Стойкие вирусные инфекции обычно сопровождаются иммунологической дисрегуляцией, особенно в клеточном иммунном компартменте. Однако неясно, влияет ли стойкий COVID-19 в легкой или средней степени тяжести на развитие вирусоспецифического клеточного иммунитета.С этой целью мы проанализировали развитие специфического клеточного иммунитета SARS-CoV-2 у выздоравливающих пациентов с COVID-19, у которых наблюдались симптомы COVID-19 в течение восьми или менее дней или симптомы, сохраняющиеся в течение 18 дней или более. Мы заметили, что продолжительность симптомов COVID-19 минимально влияет на величину, антигенную специфичность и транскрипционный профиль специфического клеточного иммунитета SARS-CoV-2 в компартментах как CD4 +, так и CD8 + Т-клеток. Кроме того, мы наблюдали, что реактивность против структурного белка N из SARS-CoV-2 у выздоравливающих пациентов с COVID-19 коррелирует с степенью реактивности против сезонных человеческих коронавирусов 229E и NL63.Эти результаты дают дополнительное представление о сложных процессах, которые регулируют развитие клеточного иммунитета против SARS-CoV-2 и связанных с ним коронавирусов человека.
Заявление о конкурирующих интересах
SJT сообщает о других от Pfizer во время проведения исследования; личные сборы от Merck, личные сборы от Sanofi, личные сборы от Takeda, личные сборы от Themisbio, личные сборы от Janssen, помимо представленных работ. Все другие авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Заявление о финансировании
Эта работа финансировалась из внутренних источников Государственного университета Нью-Йорка.
Заявления авторов
Я подтверждаю, что были соблюдены все соответствующие этические принципы и получены все необходимые разрешения IRB и / или комитета по этике.
Да
Подробная информация об IRB / надзорном органе, предоставившем одобрение или исключение для описанного исследования, приводится ниже:
Это исследование было рассмотрено IRB медицинского университета SUNY Upstate, одобрено Western Institutional Review Board (IRB # 1587400) и выполняется с информированного согласия.
Получено все необходимое согласие пациента / участника, и соответствующие институциональные формы заархивированы.
Да
Я понимаю, что все клинические испытания и любые другие проспективные интервенционные исследования должны быть зарегистрированы в утвержденном ICMJE реестре, таком как ClinicalTrials.gov. Я подтверждаю, что любое такое исследование, указанное в рукописи, было зарегистрировано и предоставлен регистрационный идентификатор испытания (примечание: при публикации проспективного исследования, зарегистрированного ретроспективно, просьба предоставить заявление в поле идентификатора испытания, объясняющее, почему исследование не было зарегистрировано заранее) .
Да
Я соблюдал все соответствующие инструкции по составлению отчетов об исследованиях и загрузил соответствующие контрольные списки отчетов по исследованиям сети EQUATOR и другие соответствующие материалы в качестве дополнительных файлов, если применимо.
Да
Доступность данных
Авторы заявляют, что все данные, подтверждающие выводы этого исследования, доступны в этой статье или у соответствующего автора по обоснованному запросу. Данные по экспрессии гена RNAseq были депонированы в базе данных Gene Expression Omnibus (GSE165373).
КЛЕТОЧНЫЙ ИММУНИТЕТ ДОНОРА ПРИ ОТКАЗЕ И ДОЛГОСРОЧНОМ -…: Трансплантация
Влияние иммунизации до и после трансплантации на выживаемость трансплантата, интенсивность инфильтрата и in situ / системный клеточный иммунный ответ хозяина были исследованы для класса I MHC — разных реципиентов почечного аллотрансплантата крысы. Наивные, несенсибилизированные PVG (RT1 c ) реципиенты MHC класса I, отличные от PVG.R1 (RT1.A a на фоне PVG), ортотопические трансплантаты почки показали долгосрочную (> 50 дней) выживаемость (LTS) в большинстве ( 41/52) дел.Предтрансплантационная иммунизация реципиентов кожным трансплантатом PVG.R1 чаще всего приводила к отторжению (средняя выживаемость> 21,3 дня) с 8/15 крысами, живущими ≤2 недель, и только 3/15 крыс с LTS. Предтрансплантационная иммунизация кожным трансплантатом от полностью отличного от MHC донора PVG.1A (RT1 «на фоне PVG») привела к острому отторжению (среднее значение = 6,1 дня), при этом 0/8 крыс выжили> 2 недель. Отдельные (PVG.lA) и сторонние (LEW) кожные трансплантаты, специфичные для доноров I и II классов, применяемые на LTS (> 50 дней) PVG.У реципиентов почечного трансплантата R1 наблюдалось типичное отторжение кожного трансплантата 1-го и ускоренного 2-го набора, но не влияло на выживаемость трансплантата почки. Напротив, 6/7 реципиентов почечного трансплантата LTS PVG.R1 принимали кожные трансплантаты PVG.R1 на неопределенный срок после их временного частичного отторжения. Гистологический анализ аллотрансплантатов почек выявил самую высокую степень инфильтратов мононуклеарных клеток у животных, специфически сенсибилизированных PVG.1A, кожных трансплантатов до трансплантации. Класс доноров. Частоты специфических цитотоксических предшественников Т-лимфоцитов (pCTL), как определено с помощью анализов с ограничивающим разведением, были увеличены и эквивалентны через 1 неделю после трансплантации в элюатах клеток аллотрансплантата почки от не отторгающихся наивных реципиентов (1/127–1 / 2209) и отторгающих пресенсибилизированных животных ( 1 / 470–1 / 7848).У LTS-животных уменьшилось количество pCTL внутри трансплантата через> 50 дней (1 / 2969–1 / 61875), так же как и у LTS через> 50 дней после трансплантации кожных трансплантатов PVG.R1, PVG.lA или LEW. Во всех группах частоты pCTL спленоцитов были значительно ниже, чем соответствующие значения в пределах аллотрансплантата. Для сравнения, между любыми группами не наблюдалось значительных различий в частотах предшественников пролиферативных Т-лимфоцитов (pPTL) внутри трансплантата или селезенки. Эти результаты показывают, что несенсибилизированные реципиенты трансплантатов почечных клеток Idisparate класса I способны поддерживать выживание трансплантата в ранний посттрансплантационный период, несмотря на наличие значительного in situ антидонорского MHC-специфического клеточного иммунного ответа класса I.Эти результаты также показывают, что у долгоживущих реципиентов PVG почечных аллотрансплантатов, отличных от класса I, развивается специфическая функциональная толерантность к донорским аллоантигенам I класса, что может быть связано с уменьшением частоты цитотоксических (но не пролиферативных) предшественников Т-клеток антикласса I.
Выявление гуморального и клеточного иммунитета, специфичного для SARS-COV-2, у выздоравливающих людей с COVID-19 — Иммунология
Авторы: Ling Ni et al.
Ссылка на статью: https: // doi.org / 10.1016 / j.immuni.2020.04.023
Журнал / предпечатная подготовка: иммунитет
Теги: Иммунология / Иммунитет, Клиническая
Основные результаты исследований
1. Наличие нейтрализующих антител у 13 из 14 пациентов, выписанных из стационара с COVID-19.
2. Антитела вырабатываются против NP и S-RBD, а не против M протеазы.
3. Предполагается положительная корреляция между сильной нейтрализацией антител и клеточным иммунным ответом.
Резюме
Ling Ni et al.проанализировать гуморальный и клеточный иммунитет у 14 пациентов с COVID-19 с легкими симптомами, которые стали свободными от вируса и недавно были выписаны из больницы или через две недели после выписки, и по сравнению с 7 здоровыми донорами. Из 14 когорт пациентов они наблюдали присутствие нуклеокапсида SARS-CoV-2 (N) и специфичных для рецепторно-связывающего домена (RBD) IgM и IgG у всех пациентов с преобладанием подклассов IgG1 и IgG3. Путем анализа нейтрализации с использованием псевдовируса SARS-CoV-2 они выявили присутствие нейтрализующих антител, распознающих белок RBD-S, у 13 пациентов.Кроме того, они измерили присутствие Т-клеток, специфичных для SARS-COV2, и их способность секретировать IFN-гамма с помощью ELISPOT. Они сообщили о положительной корреляции между наличием высокого титра нейтрализующих антител и наличием клеточного иммунитета.
Влияние на исследования SARS-CoV2 / COVID19
Лучшее понимание иммунного ответа на SARS-CoV2 / COVID19, что может помочь в разработке эффективных стратегий для дизайна вакцины и диагностических инструментов.
Тип исследования
· Исследование in vitro
· Клиническое когортное исследование (14 пациентов с COVID-19)
Сильные и слабые стороны статьи
Новизна: Суть и новизна этого исследования заключается в отслеживании нейтрализующей активности антител, вырабатываемых пациентами с COVID-19 с легкими симптомами, которые стали свободными от вируса и были выписаны из больницы. Авторы пытаются соотнести гуморальный иммунитет с наличием клеточного иммунитета.
Стоя в поле:
Это исследование подкрепляет наблюдения, сделанные в других отчетах о наличии гуморального и клеточного иммунитета, возникающего после заражения SARS-COV2. Они указывают на наличие нейтрализующих антител у 13 из 14 пациентов через две недели после выписки из больницы.
Соответствующая статистика: авторы используют t-критерий Стьюдента для всех статистических анализов, несмотря на то, что не проверяют нормальное распределение данных, а некоторые данные явно не имеют нормального распределения и поэтому должны быть проанализированы с использованием непараметрических тестов.
Использованная вирусная модель: SARS-COV2 (проанализирована кровь пациентов с COVID-19) и псевдовирус SARS-COV2 для анализов нейтрализации.
Возможность перевода: это не переводится напрямую, но лучшее понимание иммунного ответа, развиваемого у выздоравливающих пациентов, может помочь в разработке вакцины.
Основные ограничения:
— Небольшой размер когорты
— Исследование отслеживает иммунитет выздоравливающих пациентов через две недели после выписки из больницы, что слишком рано после заражения, чтобы делать выводы о долгосрочном иммунитете, который следует оценивать гораздо позже.
— Рисунок 2B, один образец не имеет данных о разведении.
— На рисунке о клеточном иммунитете (рис. 3) пример точечных графиков для здорового донора (рис. 3A) подчеркивает более низкую частоту Т-клеток по сравнению с двумя пациентами с COVID-19, что не коррелирует с графиком. на рис. 3В. У здорового донора, по-видимому, выше частота CD3- / NK-клеток, которые не комментируются. Их вывод о положительной корреляции между клеточным и гуморальным иммунитетом преувеличен.
— В таблице своего пациента они подчеркивают, что данные были измерены до лечения; Было бы интересно узнать, какое лечение получали пациенты.

 При этом они не реагируют с другими антигенами и защищают организм только от заболеваний, характеризующихся присутствием данного антигена.
При этом они не реагируют с другими антигенами и защищают организм только от заболеваний, характеризующихся присутствием данного антигена.


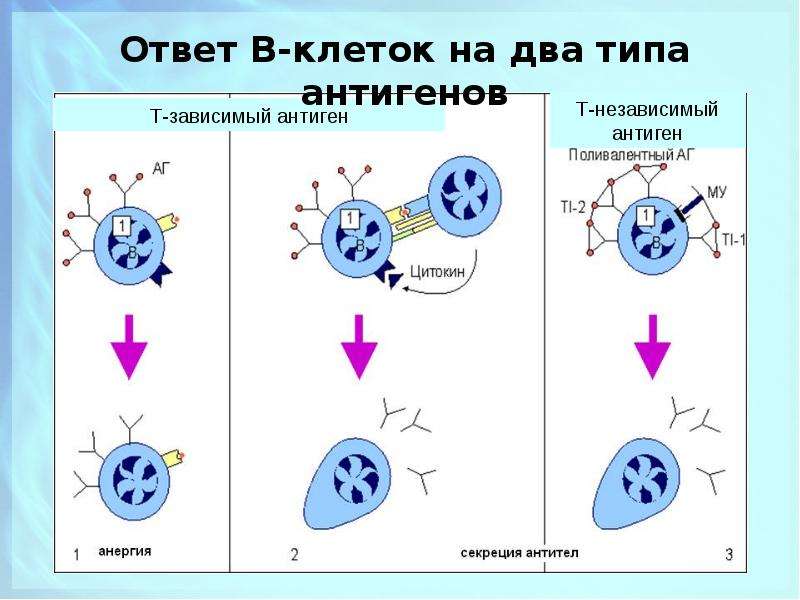
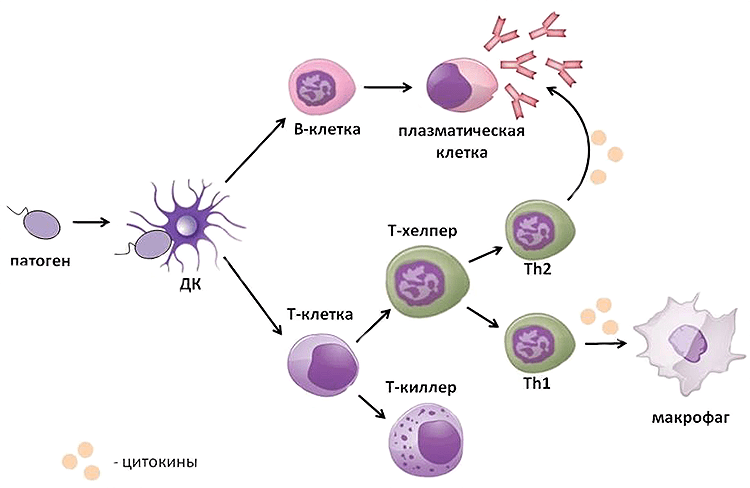 N. Engl. J. Med.
324 : 954-960.
N. Engl. J. Med.
324 : 954-960. 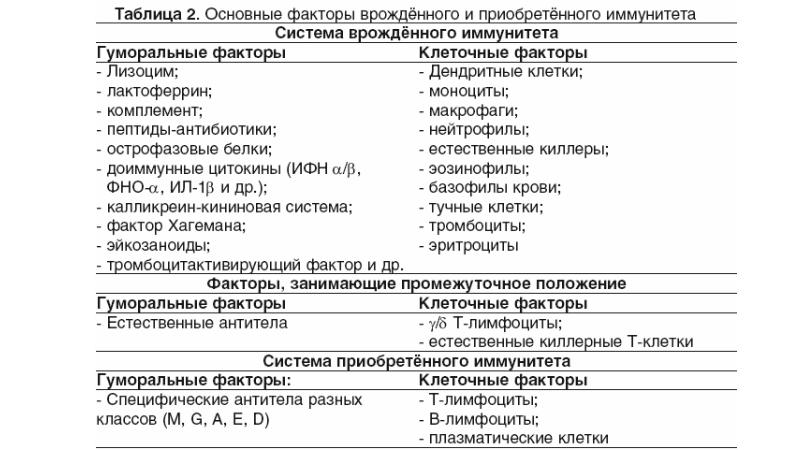 Анну. Rev. Immunol.
8 : 557-578.
Анну. Rev. Immunol.
8 : 557-578.  Расследование. 113:
836-845.
Расследование. 113:
836-845.  AIDS Res. Гм. Ретровир.
16 : 1247-1257.
AIDS Res. Гм. Ретровир.
16 : 1247-1257.  Proc. Natl. Акад.Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ.
93 : 15323-15328.
Proc. Natl. Акад.Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ.
93 : 15323-15328.  Вирусная динамика первичной виремии и антиретровирусной терапии при инфицировании вирусом иммунодефицита обезьян.J. Virol.
71 : 7518-7525.
Вирусная динамика первичной виремии и антиретровирусной терапии при инфицировании вирусом иммунодефицита обезьян.J. Virol.
71 : 7518-7525.  Наука
271 : 497-499.
Наука
271 : 497-499.  ↵
↵