Гормоны гонадотропный — Справочник химика 21
Гонадотропный гормон гипофиза быка 117,8 86,3 204,1 70,7 105,5 28,8 — 4,1 253,4 50,6 20,8 [c.484]
Из других гликопротеинов, выполняющих ряд важнейших биологических функций, следует отметить все белки плазмы крови (за исключением альбуминов), трансферрин, церулоплазмин, гонадотропный и фолликулостимулирующие гормоны, некоторые ферменты, а также гликопротеины в составе слюны (муцин), хрящевой и костной тканей и яичного белка (овомукоид). Углеводные компоненты, помимо информативной функщп , [c.93]
Биосинтез андрогенов осуществляется главным образом в семенниках и частично в яичниках и надпочечниках. Основными источниками и предшественниками андрогенов, в частности тестостерона, являются уксусная кислота и холестерин. Существуют экспериментальные доказательства, что путь биосинтеза тестостерона от стадии холестерина включает несколько последовательных ферментативных реакций через прегненолон и 17-а-окси-прегненолон (см.
Биологическая роль андрогенов в мужском организме в основном связана с дифференцировкой и функционированием репродуктивной системы, причем в отличие от эстрогенов андрогенные гормоны уже в эмбриональном периоде оказывают существенное влияние на дифференцировку мужских половых желез, а также других тканей, определяя характер секреции гонадотропных гормонов у взрослых. Во взрослом организме андрогены регулируют развитие мужских вторичных половых признаков, сперматогенез в семенниках и т.д. Следует отметить, что андрогены оказывают значительное анаболическое действие, выражающееся в стимуляции синтеза белка во всех тканях, но в большей степени в мышцах.
Мукоиды делятся на растворимые, нерастворимые и кислые, К первой категории относятся мукоид, специфичный для группы крови А, мукоиды слюны, яйца (овомукоид), бациллы сибирской язвы и гонадотропный гормон мочи. Из числа растворимых мукоидов приведем овомукоид 3,-остаточный протеид стекловидной жидкости II капсуля хрусталика. Кислым мукоидом (полисахаридная часть которого содержит Ы-ацетилглюкозамип и глюконовую кислоту) является мукоид, вырабатываемый подчелюстной железой. [c.453]
Продуцированием половых гормонов в гонадах управляют гонадотропные гормоны (с белковым строением, см. гл. Белки ), вырабатываемые в свою очередь передней долей гипофиза.
ГОНАДОТРОПНЫЕ ГОРМОНЫ — ГОРЕНИЕ [c. 494]
494]
Регуляция биосинтеза андрогенов определяется гормонами центральных желез — гонадолиберином и гонадотропинами. Под их контролем находится синтез ферментов, участвующих в образовании тестостерона и других половых гормонов. Гонадотропные гормоны контролируют также секрецию андрогенов в кровяное русло, где они связываются с белком глобулиновой фракции — тестостерон-связывающим глобулином.
Антигормоны — вещества сыворотки крови, обладающие антигормональной активностью. Они легко образуются при длительном введении белковых гормонов (гонадотропных, тиреотропиого, соматотропного и др.), полученных от других видов животных. Каждый антигормон обладает выраженной видовой специфичностью. Он нейтрализует только действие гормона того вида животного, на который он выработался, не нейтрализуя действия соответствующих гормонов других видов животных. [c.268]
Гликопротеиды — сложные белки, в состав которых входят углеводы, например белки соединительпых тканей, групповые вещества крови и некоторые гормоны (гонадотропный гормон).
После введения тестов в научную практику было установлено, что эстрогенные гормоны находятся не только в яич1ках, но также в плаценте и в Крови. Затем было замечено, что сама деятельность половых гормонов чрезвычайно зависит от деятельности гипофиза. Если удалить гипофиз у животных, то половой цикл совершенно нарушается, но при введении экстракта гипофизарной ткани он восстанавливается. Отсюда следует вывод, что толчок для начала полового цикла дают гормоны, вырабатываемые гипофизом, так называемые гипофизарные или гонадотропные, которые вызывают выработку половых гормонов непосредственно из яичников или мужских половых органов. Это было установлено не химическими методами, а чисто биологическим путем, когда еще ничего не знали о строении самого активного вещества. Был установлен также факт обратного порядка. Оказывается, что и сами половые органы известным образом действуют на выработку гормонов в гипофизе. Так, у кастрированной мыши (женская особь) выделение гипофизарных гормонов после операции чрезвычайно увеличивается.
Ведущую роль в регуляции синтеза эстрогенов и прогестерона играют гонадотропные гормоны гипофиза (фоллитропин и лютропин), которые опосредованно, через рецепторы клеток яичника и систему аденилатциклаза—цАМФ и, вероятнее всего, путем синтеза специфического белка, контролируют синтез гормонов. Основная биологическая роль эстрогенов и прогестерона, синтез которых начинается после наступления половой зрелости, заключается в обеспечении репродуктивной функции организма женщины. В этот период они вызывают развитие вторичных половых признаков и создают оптимальные условия, обеспечивающие возможность оплодотворения яйцеклетки после овуляции. Прогестерон выполняет в организме ряд специфических функций подготавливает слизистую оболочку матки к успешной имплантации яйцеклетки в случае ее оплодотворения, а при наступлении беременности основная роль—сохранение беременности оказывает тормозящее влияние на овуляцию и стимулирует развитие ткани молочной железы.

Передняя доля гипофиза вырабатывает следующие гормоны тиреотропный гормон, стимулирующий секреторную функцию щитовидной железы адренокортикотропный гормон (АКТГ), стимулирующий функцию коры надпочечных желез лутеотропный гормон, или лактоген (пролактин), вызывающий секрецию молока в молочной железе два гонадотропных гормона (гормон, стимулирующий развитие фолликулов в яичнике, и гормон лутеинизации, регулирующий образование каротиноидов в яичнике и выработку мужских половых гормонов), а также соматотроп-ный гормон или гормон роста, контролирующий размеры тела животных.
Гормональный контроль созревания яйцеклетки и овуляции особенно хорошо изучен у морских звезд и амфибий. У этих животных гонадотропные гормоны стимулируют определенные клетки яичника, побуждая их выделять вторичный медиатор, который в свою очередь воздействует на ооциты и индуцирует процесс их созревания.
Чем индущ1руется первоначальный рост отдельных примордиальных фолликулов, неизвестно, ио полагают, что гормональная стимуляция не имеет к этому отношения. С другой стороны, продолжение развития таких фолликулов, вероятно, зависит от гонадотропных гормонов гипофиза [в основном от фолликулостимулирующего гормона (ФСГ)] и от эстрогенов, секретируемых
С другой стороны, продолжение развития таких фолликулов, вероятно, зависит от гонадотропных гормонов гипофиза [в основном от фолликулостимулирующего гормона (ФСГ)] и от эстрогенов, секретируемых
Человек. Д. может быть причиной бесплодия мужчин. У лиц, имевших контакт с Д. в концентрации свыше 965 мг/м в течение 1—3 лет, уменьшалось количество сперматозоидов в эйя-куляте, при контакте свыше 3 лет уменьшались размеры семенников, развивалась атрофия эпителия семенных канальцев, азооспермия, в крови возрастало содержание гонадотропных гормонов гипофиза. Восстановление функции после прекращения контакта с Д. наступало только в том случае, если суммарная длительность контакта не превышала 200 ч и не было изменений уровня фолликулостимулирующего гормона в крови. У жен рабочих, контактировавших с Д., втрое увеличена частота самопроизвольных абортов, повышен процент врожденных аномалий новорожденных и их смертность. Среди новорожденных доминируют девочки (в эксперименте показано нарушение деления Y-хромосомы). Повышена смертность от злокачественных новообразований (преимущественно рак легких) у людей, контактировавших с Д. ( Бюлл. МРПТХВ Неагп et al. Potashnik). [c.656]
Повышена смертность от злокачественных новообразований (преимущественно рак легких) у людей, контактировавших с Д. ( Бюлл. МРПТХВ Неагп et al. Potashnik). [c.656]
А. г. регулируют развитие мужских половых органов, их функцию, в.пи яют на развитие вторичных половых признаков. Основное действие А. г. соответствует деятельности семенников (testis), в свяаи с чем эти гормоны наз. тестоидными. Андрогенная активность А. г. проявляется почти на всех кивотных и ма.ло зависит от вида. Образование А. г. в половых железах (гонадах) нроисходит под стимулирующим действием гормонов — белков передней доли гипофиза, т. п. гонадотропных гормонов. А. г. влияют пе только па половую сферу, они являются также регуляторами роста и необходимы для жизнодеяте.льности организмов в женском организме А. г. содержатся в меньших количествах. Различают первичные и вторичные А. г. К первичным относят гормоны, образующиеся в железах внутренней секреции у особи мужского по.ла— в семенниках и в корковом слое надпочечников, у особи женского пола — в яичниках и в корковом слое надпочечников к первичным А. г. относится тестостерон. Вторичными называют А. г., к-рые являются продуктами превращения в организме [c.112]
г. относится тестостерон. Вторичными называют А. г., к-рые являются продуктами превращения в организме [c.112]
Все стадии эстрального цикла контролируются гонадотропными гормонами, представляющими собой полипептиды, выделяемые передней дг/ лей гипофиза. Однако существует механизм обратной связи, посредством которого стероиды яичников воздействуют на нервные клетки гипоталамической области мозга, вызывая выделение нейрогуморальных веществ в особую воротную систему, соединяющую переднюю долю гипофиза с мозгом. Считают, что эти вещества контролируют поступление гонадотропинов в общий кровоток. Большие дозы эстрогенов, вводимые во время всего менструального цикла, препятствуют овуляции и уменьшают таким образом плодовитость. Это явление наметило подходы к созданию новых контрацептинов, принимаемых per os, но, поскольку весьма нежелательны побочные эффекты, в настоящее время применяется смесь прогестинов и эстрогенов. [c.380]
S гомогенизатор 5622 гомогенизация 5620, 5623. 5624 гомогенизированный 5621 гомогенная реакция 5618 гомогенная система 5619 гомогенная смесь 5617 гомогенность 5614 гомогенный 5615 гомогенный катализ 5616 гомолог 5627 гомологический 5625 гомологический ряд 5626 гомополимеризация 5630 гонадотропный гормон 5219 гончарная глина 1046, 8639 горелка 1642 [c.676]
5624 гомогенизированный 5621 гомогенная реакция 5618 гомогенная система 5619 гомогенная смесь 5617 гомогенность 5614 гомогенный 5615 гомогенный катализ 5616 гомолог 5627 гомологический 5625 гомологический ряд 5626 гомополимеризация 5630 гонадотропный гормон 5219 гончарная глина 1046, 8639 горелка 1642 [c.676]
Гольмий — см. Лантаниды Гомберга — Бахманна — Гея реакция 1—981 Гомо-(приставка) 1—982 Гомогенизация 5—82 Гомсгенное равновесие — см. Равновесие химическое Гомогенные системы 1—982, 868 Гомогентизиновая кислота 1—982 Гомолитические реакции 1—983 Гомологические ряды 1—984 Гомосахариды 5—301 Гомоцистеин 3—202 Гомоцистеиндесульфгидраза 1 —1070 Гонадотропные гормоны 1—987 Гопкалит 1—988 Гордеин 4—347 Горение 1—988 [c.559]
ЦИНК. 2п. Химический элемент П группы периодической системы элементов. Атомный вес 65,37. Двухвалентный металл. В природе встречается преимущественно в виде сернистого Ц. 7пЗ и углекислого Ц. 7пС0з. Входит в состав растений, животных и микроорганизмов. В растениях содержится ог 15 до 70 мг Ц. на 1 кг сухих веществ, в организме животных — от 30 до 90 мг на 1 кг живого веса, в крови — до 9 мг/л. Ц. входит в состав гормона инсулина. Он усиливает активность карбогидразы — фермента, расщепляющего угольную кислоту на углекислый газ и воду. Ц. концентрируется в половых клетках. Соли Ц. усиливают активность гонадотропных гормонов. Содержание Ц. в почвах колеблется в пределах 25—65 мг/кг, в том числе в усвояемо.м для возделываемых культур состоянии — от 0,03 до 20 мг/кг (больше всего в подзолистых почвах и очень мало в нейтральных черноземах и в слабощелочных каштановых, бурых почвах и сероземах). См. Цинко- [c.354]
В растениях содержится ог 15 до 70 мг Ц. на 1 кг сухих веществ, в организме животных — от 30 до 90 мг на 1 кг живого веса, в крови — до 9 мг/л. Ц. входит в состав гормона инсулина. Он усиливает активность карбогидразы — фермента, расщепляющего угольную кислоту на углекислый газ и воду. Ц. концентрируется в половых клетках. Соли Ц. усиливают активность гонадотропных гормонов. Содержание Ц. в почвах колеблется в пределах 25—65 мг/кг, в том числе в усвояемо.м для возделываемых культур состоянии — от 0,03 до 20 мг/кг (больше всего в подзолистых почвах и очень мало в нейтральных черноземах и в слабощелочных каштановых, бурых почвах и сероземах). См. Цинко- [c.354]
К глюкопротеидам принадлежит и гонадотропный гормон, найденный в моче беременных женщин. Он содержит 18% углевода (см. гл. XIII). [c.236]
Несмотря на то, что гипофиз по своим размерам является лишь весьма небольшим органом (гипофиз человека весит примерно 0,7 г), он содержит очень много важных гормонов, большинство которых находится в его передней доле. Гормоны передней доли гипофиза отличаются по способу своего действия от гормонов задней доли гипофиза. Так, например, описанные выше гормоны задней доли гипофиза — окситоцин и питрессин — действуют очень быстро, вызывая заметный эффект через несколько минут после инъекции. В отличие от них, гормоны передней доли действуют крайне медленно как правило, их эффект выявляется только через много часов или дней. Изменения, наблюдаемые при введении многих из этих гормонов, обычно не являются результатом непосредственного их действия, а зависят от их влияния на различные другие эндокринные железы. Так, например, действие гонадотропного гормона гипофиза часто выявляется благодаря вызываемому им увеличению активности половых желез, а влияние тиреотропного гормона гипофиза обнаруживается как результат повышения секреции тироидного гормона. Вполне понятно, что результаты подобного непрямого действия выявляются не сразу, а только через длительный промежуток времени. [c.319]
Гормоны передней доли гипофиза отличаются по способу своего действия от гормонов задней доли гипофиза. Так, например, описанные выше гормоны задней доли гипофиза — окситоцин и питрессин — действуют очень быстро, вызывая заметный эффект через несколько минут после инъекции. В отличие от них, гормоны передней доли действуют крайне медленно как правило, их эффект выявляется только через много часов или дней. Изменения, наблюдаемые при введении многих из этих гормонов, обычно не являются результатом непосредственного их действия, а зависят от их влияния на различные другие эндокринные железы. Так, например, действие гонадотропного гормона гипофиза часто выявляется благодаря вызываемому им увеличению активности половых желез, а влияние тиреотропного гормона гипофиза обнаруживается как результат повышения секреции тироидного гормона. Вполне понятно, что результаты подобного непрямого действия выявляются не сразу, а только через длительный промежуток времени. [c.319]
Щелочные экстракты из передней доли гипофиза содержат также тиреотропный гормон. Он лучше растворим, чем гормон роста, и не осаждается 30-процентным ацетоном [74]. Тиреотропный гормон растворяется в 50-процентном ацетоне и 50-процеит-ном пиридине [80] и, в отличие от истинных белков, не осаждается трихлоруксусной кислотой [81, 82]. Все попытки получить этот гормон в чистом виде окончились неудачей, несмотря на то, что его подвергали многократной (100 раз) переочистке. Молекулярный вес этого гормона 10 000 [83]. Лучшие его препараты свободны от примесей гормона роста и гонадотропного гормона [82]. Действие тиреотропного гормона на щитовидную железу обнаруживается по увеличению веса щитовидной железы [80]. При введении животному тиреотропного гормона содержание. иода в его щитовидной железе уменьшается, а в крови увеличивается [81]. Тиреотропный гормон стимулирует дыхание клеток [c.320]
Он лучше растворим, чем гормон роста, и не осаждается 30-процентным ацетоном [74]. Тиреотропный гормон растворяется в 50-процентном ацетоне и 50-процеит-ном пиридине [80] и, в отличие от истинных белков, не осаждается трихлоруксусной кислотой [81, 82]. Все попытки получить этот гормон в чистом виде окончились неудачей, несмотря на то, что его подвергали многократной (100 раз) переочистке. Молекулярный вес этого гормона 10 000 [83]. Лучшие его препараты свободны от примесей гормона роста и гонадотропного гормона [82]. Действие тиреотропного гормона на щитовидную железу обнаруживается по увеличению веса щитовидной железы [80]. При введении животному тиреотропного гормона содержание. иода в его щитовидной железе уменьшается, а в крови увеличивается [81]. Тиреотропный гормон стимулирует дыхание клеток [c.320]
Слово ГОНАДОТРОПНЫЙ — Что такое ГОНАДОТРОПНЫЙ?
Слово состоит из 13 букв: первая г, вторая о, третья н, четвёртая а, пятая д, шестая о, седьмая т, восьмая р, девятая о, десятая п, одиннадцатая н, двенадцатая ы, последняя й,
Слово гонадотропный английскими буквами(транслитом) — gonadotropnyi
Значения слова гонадотропный.
 Что такое гонадотропный?
Что такое гонадотропный?Гонадотропные гормоны
ГОНАДОТРОПНЫЕ ГОРМОНЫ (син. гонадотропины) — гормоны, стимулирующие развитие и функционирование половых желез. Синтез и секреция гонадотропных гормонов происходят под действием соответствующих гипоталамических нейрогормонов в передней доле гипофиза…
Краткая медицинская энциклопедия. — М., 1989
Гонадотропные гормоны, или гонадотропины — подкласс тропных гормонов передней доли гипофиза и плаценты, физиологической функцией которых является регуляция работы половых желёз.
ru.wikipedia.org
Гонадотропные гормоны, гонадотропины (от гонады и греч. trópos — направление, trépo — поворачиваю, направляю, изменяю), вырабатываются передней долей гипофиза и регулируют эндокринную функцию половых желёз.
БСЭ.— 1969—1978
ГОНАДОТРОПИН, ГОРМОН ГОНАДОТРОПНЫЙ
ГОНАДОТРОПИН, ГОРМОН ГОНАДОТРОПНЫЙ (gonadotrophic hormone) — один из гормонов, синтезируемых и секретируемых гипофизом; влияет на яички или яичники (гонады)…
vocabulary.ru
Гонадотропин, Гормон Гонадотропный (Gonadotrophin, Gonadotrophic Hormone) Гонадотропин (Gonadotrophin), Гормон Гонадотропный (Gonadotrophic Hormone) — один из гормонов, синтезируемых и секретируемых гипофизом; влияет на яички или яичники (гонады)…
Медицинские термины от А до Я
Гонадотропин (Gonadotrophin), Гормон Гонадотропный (Gonadotrophic Hormone) один из гормонов, синтезируемых и секретируемых гипофизом; влияет на яички или яичники (гонады)…
Медицинские термины.— 2000
Гормон гонадотропный
Гормон гонадотропный (h. gonadotropicum; гонада + греч. tropos поворот, направление; син. гонадотропин) общее название тропных Г. передней доли гипофиза…
Большой медицинский словарь. — 2000
Гормон гонадотропный — любой гормон передней доли гипофиза, который активирует гонады. Например, фолликулостимулирующий гормон, лютеинизирующий гормон.
vocabulary.ru
Русский язык
Гонадотро́пный.
Орфографический словарь. — 2004
- гомункул
- гонада
- гонадотропин
- гонадотропный
- гонад
- гонвед
- гонг
Агонисты гонадотропных релизинг–гормонов в лечении миомы матки | Тихомиров А.
 Л.
Л.Согласно современным представлениям миома матки – это моноклональный [5–7] гормончувствительный пролиферат, состоящий из фенотипически измененных гладкомышечных клеток миометрия.
Моноклональная характеристика миомы матки позволила опровергнуть теорию о том, что миома матки развивается вследствие системных гормональных изменений, обозначив это образование, как локальную патологию миометрия.Существуют две теории происхождения клетки–предшественника миомы матки: одна подразумевает появление дефекта клетки во время онтогенетического развития матки, вследствие длительного нестабильного периода формирования эмбриональных гладкомышечных клеток [8], вторая – предполагает возможность повреждения клетки в зрелой матке [10]. Тот факт что, согласно патологоанатомическим исследованиям распространенность миомы матки достигает 85% [9], позволяет считать вторую теорию происхождения клетки–предшественника более очевидной.
Формирование «зачатка роста» миоматозного узла вероятнее всего происходит следующим образом.
 Во время каждого овуляторного менструального цикла во время первой фазы под действием эстрогенов на поверхности клеток миометрия накапливаются рецепторы к половым гормонам и различным факторам роста (EGF, TGF бета, bFGF и др.) [23–25]. После овуляции под воздействием прогестерона, вырабатываемого желтым телом, происходит процесс гиперплазии миометрия. Прогестерон оказывает как прямое воздействие на клетки миометрия, связываясь со своими специфическими рецепторами, так и опосредованное, за счет экспрессии различных факторов роста [11–14]. Гиперплазия миометрия происходит равномерно, это, в частности, реализуется за счет сбалансированной экспрессии двух типов рецепторов прогестерона (А и В). А–тип рецепторов является блокирующим, а В–тип эффекторным. Равномерное распределение этих рецепторов обеспечивает равномерное увеличение ткани миометрия [15].
Во время каждого овуляторного менструального цикла во время первой фазы под действием эстрогенов на поверхности клеток миометрия накапливаются рецепторы к половым гормонам и различным факторам роста (EGF, TGF бета, bFGF и др.) [23–25]. После овуляции под воздействием прогестерона, вырабатываемого желтым телом, происходит процесс гиперплазии миометрия. Прогестерон оказывает как прямое воздействие на клетки миометрия, связываясь со своими специфическими рецепторами, так и опосредованное, за счет экспрессии различных факторов роста [11–14]. Гиперплазия миометрия происходит равномерно, это, в частности, реализуется за счет сбалансированной экспрессии двух типов рецепторов прогестерона (А и В). А–тип рецепторов является блокирующим, а В–тип эффекторным. Равномерное распределение этих рецепторов обеспечивает равномерное увеличение ткани миометрия [15]. В случае ненаступления беременности концентрация прогестерона в крови падает и в ткани миометрия активизируется процесс апоптоза, за счет которого происходит элиминация избыточных гладкомышечных клеток.
 Именно благодаря этому механизму матка не увеличивается в размере от цикла к циклу.
Именно благодаря этому механизму матка не увеличивается в размере от цикла к циклу. Можно предполагать, что в ходе многократно повторяющихся циклов гиперплазии миометрия, сменяющихся апоптозом, происходит накопление гладкомышечных клеток, в которых нарушается процесс апоптоза, и эти пролиферирующие клетки подвергаются воздействию различных повреждающих факторов. Повреждающим фактором могут выступать ишемия, обусловленная спазмом спиральных артерий во время менструации, воспалительный процесс, травматическое воздействие вследствие медицинских манипуляций или очаг эндометриоза.
С каждым менструальным циклом количество поврежденных клеток накапливается, но судьба их может быть различной. Часть клеток рано или поздно элиминируется из миометрия, из других начинают формироваться «зачатки» миоматозных узлов с различным потенциалом к росту. «Активный зачаток роста» на первых стадиях развивается за счет физиологического колебания гормонов во время менструального цикла. В дальнейшем образовавшаяся кооперация клеток активизирует аутокринно–паракринные механизмы, обусловленные факторами роста, формирует локальные автономные механизмы поддержания роста (локальная продукция эстрогенов из андрогенов [16,17] и образование соединительной ткани [10]), и в результате значение физиологических концентраций половых гормонов для формирования миоматозного узла перестает быть основным.

Исходя из данных генетического анализа миоматозных узлов пролиферативная активность миомы матки обусловлена дисрегуляцией генов высокоподвижных групп протеинов (HMGIC и HMGIY) [18–20], расположенных в хромосомах 12 и 6 соответственно, то есть в локусах наиболее распространенных хромосомных дисрегуляций, характерных для этого образования. Продуктом экспрессии генов HMGIY и HMGIC являются белки, отнесенные к различным семействам группы высокоподвижных белков (high mobility group proteins), которые являются хроматин–ассоциированными негистонными белками [21]. Эти белки играют важную роль в регуляции структуры и функции хроматина. Помимо этого, они ответственны за правильность трехмерной конфигурации комплекса ДНК с белком, то есть участвуют в таких клеточных процессах, как транскрипция ДНК. Аберрантная экспрессия HMGIC и HMGIY белков чаще всего характеризует злокачественный процесс [20]. Дисрегуляция этих белков вследствие хромосомных перестроек наиболее часто выявляется в различных доброкачественных мезенхимальных образованиях, таких как липома, легочная гамартома, полип эндометрия, а также и в лейомиоме [20,21].
 Эти белки экспрессируются практически во всех органах и тканях во время онтогенеза (надпочечники, аорта, кости, мозг, сердце, кишечник, почка, легкое, печень, мышцы, яичники, плацента, кожа, селезенка, желудок, яички и матка), в то время как во взрослом организме экспрессия этих белков выявлена только в легких и почках [22]. Помимо этого, HMG белки экспрессируются при выращивании
Эти белки экспрессируются практически во всех органах и тканях во время онтогенеза (надпочечники, аорта, кости, мозг, сердце, кишечник, почка, легкое, печень, мышцы, яичники, плацента, кожа, селезенка, желудок, яички и матка), в то время как во взрослом организме экспрессия этих белков выявлена только в легких и почках [22]. Помимо этого, HMG белки экспрессируются при выращивании in vitro клеточных культур вышеуказанных тканей [22]. Подобный характер экспрессии HMGIC и HMGIY белков указывает на их участие в быстром росте эмбриональных тканей и тканей в культуре.
Моноклональный пролиферат гладкомышечных клеток миометрия, в которых за счет дисрегуляции HMG генов активизирована программа клональной пролиферации ткани, на фоне нормального гормонального фона увеличивается в размерах, в то время как клетки неизмененного миометрия находятся в состоянии относительного покоя.
Значение гормонального фона для роста миоматозного узла до определенного этапа критично. С увеличением его размера формирование аутокринно–паракринной регуляции роста и становление локальных автономных механизмов делает рост миомы относительно независимым.

Изучение системы взаимодействия гипоталамуса, гипофиза и яичников способствовало расширению представлений об этиологии и патогенезе ряда гинекологических заболеваний. Стало очевидным, что для их коррекции необходима возможность экзогенного введения различных гормонов, определяющих функционирование гипоталамо–гипофизарно–яичниковой системы (ГГЯС). Основными ее регуляторами являются гонадотропные релизинг–гормоны (ГнРГ). В начале 80–х годов прошедшего столетия удалось синтезировать их химические аналоги, этот факт был расценен, как одно из революционных свершений в медицине. Действительно, появление лекарственной возможности «корректировать» работу ГГЯС и устранять воздействие половых гормонов на основные мишени позволяет рассматривать применение аналогов ГнРГ в качестве истинно патогенетической терапии, в частности, таких распространенных гинекологических нозологий, как миома матки и эндометриоз.
Как известно, механизм действия агонистов ГнРГ (ГнРГа) заключается в следующем: после связывания ГнРГ с рецепторами на поверхности гонадотропных клеток происходит интенсивное высвобождение ЛГ и ФСГ.
 Вместе с тем продолжительное воздействие ГнРГа на гипофиз в течение нескольких часов приводит к утрате чувствительности гонадотропных клеток и быстрому уменьшению интенсивности секреции и биосинтеза гонадотропинов, особенно ЛГ. В таком десентизированном состоянии гонадотропные клетки могут оставаться до тех пор, пока продолжается непрерывное воздействие высоких доз агонистов на гипофиз.
Вместе с тем продолжительное воздействие ГнРГа на гипофиз в течение нескольких часов приводит к утрате чувствительности гонадотропных клеток и быстрому уменьшению интенсивности секреции и биосинтеза гонадотропинов, особенно ЛГ. В таком десентизированном состоянии гонадотропные клетки могут оставаться до тех пор, пока продолжается непрерывное воздействие высоких доз агонистов на гипофиз. Это приводит к прогрессивному падению концентрации эстрогенов до уровня, наблюдаемого в менопаузе. Уровни тестостерона, андростендиона и пролактина снижаются параллельно уменьшению концентрации ЛГ. После отмены препарата в крови постепенно начинается подъем концентрации ФСГ и эстрадиола, однако уровень ЛГ остается подавленным еще в течение 4 недель.
Аналоги гонадотропин–релизинг гормона, способные вызвать обратимое гипогонадотропное/гипогонадное состояние, давно используются с целью лечения миомы матки. Множество исследований показали, что ГнРГа терапия может уменьшить размер и привести к инволюции миомы матки.
 Было высказано предположение, что уменьшение размеров миомы связано с гипогонадным состоянием, вызванным ГнРГ агонистами. Однако различные миоматозные узлы в одной матке в связи с их доказанной моноклональностью имеют различную чувствительность к терапии ГнРГа. Уменьшение размеров миомы вызвано не только гипоэстрогенным состоянием, но и другими дополнительными факторами.
Было высказано предположение, что уменьшение размеров миомы связано с гипогонадным состоянием, вызванным ГнРГ агонистами. Однако различные миоматозные узлы в одной матке в связи с их доказанной моноклональностью имеют различную чувствительность к терапии ГнРГа. Уменьшение размеров миомы вызвано не только гипоэстрогенным состоянием, но и другими дополнительными факторами. Одним из альтернативных механизмов действия ГнРГа может быть прямой эффект ГнРГа на клетки лейомиомы.
МРНК рецептора ГнРГ, как и самого ГнРГ, транскрибируются как в нормальном миометрии, так и в ткани лейомиомы [1]. Выращивание в культуре эксплантов нормального миометрия и лейомиомы выявило, что экспланты нормального миометрия растут в виде hills and valleys, в то время как экспланты лейомиомы образуют агрегаты ball–like. Анализ in vitro показал, что ГнРГа могут вызывать значительные морфологические изменения в структуре шаровидных агрегатов лейомиомы, но в то же время не оказывают никакого воздействия на экспланты нормального миометрия.
 При оценке характера воздействия ГнРГа на экспрессию продуктов генов, ассоциированных с G1 фазой клеточного цикла, таких как циклин D1, циклин Е, p33cdk2 и p34cdk4, было выявлено, что ГнРГа оказывают дозозависимый двухфазный эффект на экспрессию циклина E и p33cdk2 в культуре ткани из лейомиомы (2).
При оценке характера воздействия ГнРГа на экспрессию продуктов генов, ассоциированных с G1 фазой клеточного цикла, таких как циклин D1, циклин Е, p33cdk2 и p34cdk4, было выявлено, что ГнРГа оказывают дозозависимый двухфазный эффект на экспрессию циклина E и p33cdk2 в культуре ткани из лейомиомы (2). С помощью ФИТЦ меченных ГнРГ было показано, что ГнРГ непосредственно связывается с цитоплазматической мембраной гладкомышечных клеток миометрия и миомы, взаимодействуя со своим специфичным рецептором.
ГнРГ гипоталамического происхождения довольно быстро разрушается в гипофизе и присутствует в довольно низкой концентрации в периферическом кровотоке. Поэтому маловероятно, что гипоталамус является основным источником ГнРГ, воздействующим на рост лейомиомы в матке. Таким образом, наличие в миометрии и в миоме как мРНК рецептора ГнРГ, так и мРНК ГнРГ позволяет предполагать, что ГнРГ или ГнРГ–подобные пептиды вовлечены в аутокринную и/или паракринную регуляцию пролиферации миометрия и лейомиомы in vivo.

Так, гладкомышечные клетки, культивированные из миометрия и лейомиомы, экспрессируют мРНК ГнРГ рецептора и ГнРГ. Их обработка ГнРГа приводит к морфологическим изменениям в шаровидных агрегатах, полученных при выращивании in vitro экспланта лейомиомы, а также к изменениям в экспрессии генов, ассоциированных с фазой G1 клеточного цикла. В миометрии эти изменения отсутствуют. Эти результаты предполагают, что ГнРГа может воздействовать на клетки лейомиомы через свои мембранные рецепторы, что приводит к уменьшению экспрессии генов циклина Е и p33cdk2.
ГнРГ–агонисты также оказывают существенный эффект на экстрацеллюлярный матрикс миомы, который играет важную роль в ее росте и регрессии. Ремоделирование ткани, включающее перестройку экстрацеллюлярного матрикса (ЭЦМ), регулируется совместным действием матриксных металлопротеиназ (ММП) и их тканевыми ингибиторами (ТИММП). Было показано, что лейомиома экспрессирует мРНК как ММП, так и ТИММП и их экспрессия обратно пропорционально изменяется во время роста миомы и во время регрессии, индуцированной ГнРГ агонистами [2].
 Обусловленная ГнРГа регрессия миомы сопровождается увеличением экспрессии ММП с сопутствующим уменьшением экспрессии ТИММП–1, что может обеспечивать благоприятную среду для деградации ЭЦМ.
Обусловленная ГнРГа регрессия миомы сопровождается увеличением экспрессии ММП с сопутствующим уменьшением экспрессии ТИММП–1, что может обеспечивать благоприятную среду для деградации ЭЦМ. В результате исследования эффекта терапии ГнРГа на миому матки не обнаруживается значительных различий в гистологической картине миоматозных узлов пролеченных и нелеченных больных, в то время как иммуногистохимические исследования выявляют значительное снижение клеточного пролиферативного индекса (на 85%) под воздействием агонистов, а индекс метки ингибитора апоптоза bcl–2 не имеет значительных различий среди сравниваемых групп больных. Таким образом, терапия ГнРГ–агонистами приводит к значительному снижению количества клеток в клеточном цикле. Также отмечается значительное уменьшение экспрессии рецепторов эстрогенов и прогестерона [3].
Результат консервативной терапии миомы может оказаться недостаточным при наличии у больной больших миоматозных узлов. В таких случаях избежать хирургического вмешательства невозможно, тем не менее применение ГнРГ–агонистов у оперированных больных также значительно улучшает конечные результаты лечения.
 Это обусловлено способностью ГнРГ–агонистов уменьшать выраженность спаечного процесса за счет снижения активности образования тромбина, фибрина, ингибитора активатора плазминогена на 25%, уровня продуктов деградации фибрина на 35%, а также снижения иммунной активности NK–клеток и тем самым уменьшения воспалительного ответа организма [4]. Однако длительность операции значительно возрастает у тех пациенток, у которых миоматозный узел после терапии ГнРГ–агонистами приобретал при предоперационном ультразвуковом исследовании выраженную гипоэхогенность вследствие значительного размягчения ткани миомы, что усложняло выделение такого узла из матки. С другой стороны, назначение ГнРГ–агонистов после консервативной миомэктомии позволяет подавить микроскопические регенерационные зачатки миомы в миометрии и тем самым снизить существующий уровень рецидивирования заболевания, а также использовать прямое антипролиферативное и проапоптическое свойство ГнРГ–агонистов на возможные скрытые очаги эндометриоза (внутреннего и наружного).
Это обусловлено способностью ГнРГ–агонистов уменьшать выраженность спаечного процесса за счет снижения активности образования тромбина, фибрина, ингибитора активатора плазминогена на 25%, уровня продуктов деградации фибрина на 35%, а также снижения иммунной активности NK–клеток и тем самым уменьшения воспалительного ответа организма [4]. Однако длительность операции значительно возрастает у тех пациенток, у которых миоматозный узел после терапии ГнРГ–агонистами приобретал при предоперационном ультразвуковом исследовании выраженную гипоэхогенность вследствие значительного размягчения ткани миомы, что усложняло выделение такого узла из матки. С другой стороны, назначение ГнРГ–агонистов после консервативной миомэктомии позволяет подавить микроскопические регенерационные зачатки миомы в миометрии и тем самым снизить существующий уровень рецидивирования заболевания, а также использовать прямое антипролиферативное и проапоптическое свойство ГнРГ–агонистов на возможные скрытые очаги эндометриоза (внутреннего и наружного).
В настоящий момент специалистам в области гинекологии доступен широкий спектр различных форм а–ГнРГ, одним из которых является Диферелин®. Проведенные нами в течение последних лет клинические наблюдения применения Диферелина у 46 пациенток в возрасте от 32 до 52 лет показали высокую эффективность этого препарата в отношении регрессии миоматозных узлов при адекватном назначении препарата.
Первоначальный размер матки больных, включенных в исследование, не превышал 10 недель беременности, а диаметр доминантных узлов не превышал 3 см. В среднем за 3 месяца консервативной терапии Диферелином размеры матки уменьшились до 5–6 недель, а миоматозные узлы уменьшились на 30–80%. Подобный разброс в результатах лечения объясняется гетерогенностью миоматозных узлов, что, вероятно, обусловливает их различную чувствительность к препарату.
Таким образом, Диферелин® является эффективным препаратом для комплексного консервативного лечения миомы матки малых размеров. Особенно важно его применение при сочетанных гинекологических патологиях: миома матки, эндометриоз и гиперплазии эндометрия.
 Это обусловлено тем, что во многом лечение миомы матки, эндометриоза и гиперпластических процессов эндометрия осуществляется фактически с использованием одних и тех же лечебных подходов. Диферелин® применяется также в послеоперационном противорецидивном лечении этих заболеваний [10]. При этом при применении Диферелин®а отсутствуют прогестагенные и андрогенные побочные эффекты, негативный эффект в отношении липидного профиля. Он может применяться при сопутствующих заболеваниях: фиброзно-кистозной мастопатии, гиперкоагуляции, поликистозном овариальном синдроме, дислипидемиях. Диферелин® значительно лучше переносится, чем антигонадотропины, что способствует большей приверженности пациентов лечению [26], и на современном этапе является препаратом патогенетической терапии доброкачественных гиперплазий матки и эндометриоза всех локализаций.
Это обусловлено тем, что во многом лечение миомы матки, эндометриоза и гиперпластических процессов эндометрия осуществляется фактически с использованием одних и тех же лечебных подходов. Диферелин® применяется также в послеоперационном противорецидивном лечении этих заболеваний [10]. При этом при применении Диферелин®а отсутствуют прогестагенные и андрогенные побочные эффекты, негативный эффект в отношении липидного профиля. Он может применяться при сопутствующих заболеваниях: фиброзно-кистозной мастопатии, гиперкоагуляции, поликистозном овариальном синдроме, дислипидемиях. Диферелин® значительно лучше переносится, чем антигонадотропины, что способствует большей приверженности пациентов лечению [26], и на современном этапе является препаратом патогенетической терапии доброкачественных гиперплазий матки и эндометриоза всех локализаций.Литература
1. Kobayashi Y, Zhai YL, Iinuma M, Horiuchi A, Nikaido T, Fujii S. Effects of a GnRh analogue on human smooth muscle cells cultured from normal myometrial and from uterine leiomyomal tissues. Mol Hum Reprod 1997 Feb 3:2 91 – 9
Mol Hum Reprod 1997 Feb 3:2 91 – 9
2. Q Dou, RW Tarnuzzer, RS Williams, GS Schultz, N Chegini Differential expression of matrix metalloproteinases and their tissue inhibitors in leiomyomata: a mechanism for gonadotrophin releasing hormone agonist–induced tumour regression Mol Hum Reprod 3:11 1997 Nov
3. Vu K, Greenspan DL, Wu TC, Zacur HA, Kurman RJ Cellular proliferation, estrogen receptor, progesterone receptor, and bcl–2 expression in GnRH agonist–treated uterine leiomyomas Hum Pathol 1998 Apr 29:4 359–63
4. Shindler AE Gonadotropin–releasing agonist for prevention of postoperative adhesions: an оverview Gynecol Endocrinol 2004 19 51–55.
5. Rein MS. Advances in uterine leiomyoma research: the progesterone hypothesis. Environ Health Perspect 2000;108 Suppl 5:791–3.
6. Tiltman AJ. Smooth muscle neoplasms of the uterus. Curr Opin Obstet Gynecol 1997;9(1):48–51.
7. Wang S, Su Q, Zhu S, et al. Clonality of multiple uterine leiomyomas. Zhonghua Bing Li Xue Za Zhi 2002;31(2):107–11.
Zhonghua Bing Li Xue Za Zhi 2002;31(2):107–11.
8. Fujii S. [Uterine leiomyoma: pathogenesis and treatment]. Nippon Sanka Fujinka Gakkai Zasshi 1992;44(8):994–9.
9. Tiltman AJ. Smooth muscle neoplasms of the uterus. Curr Opin Obstet Gynecol 1997;9(1):48–51.
10. Тихомиров А.Л. Патогенетическое обоснование ранней диагностики, лечения и профилактики миомы матки. Дисс. д.м.н., Москва, 1998.
11. Maruo T, Matsuo H, Samoto T, et al. Effects of progesterone on uterine leiomyoma growth and apoptosis. Steroids 2000;65(10–11):585–92.
12. Maruo T, Matsuo H, Shimomura Y, et al. Effects of progesterone on growth factor expression in human uterine leiomyoma. Steroids 2003;68(10–13):817–24.
13. Maruo T, Ohara N, Wang J, Matsuo H. Sex steroidal regulation of uterine leiomyoma growth and apoptosis. Hum Reprod Update 2004;10(3):207–20.
14. Massart F, Becherini L, Marini F, et al. Analysis of estrogen receptor (ERalpha and ERbeta) and progesterone receptor (PR) polymorphisms in uterine leiomyomas. Med Sci Monit 2003;9(1):BR25–30.
Med Sci Monit 2003;9(1):BR25–30.
15. Wu X, Wang H, Englund K, et al. Expression of progesterone receptors A and B and insulin–like growth factor–I in human myometrium and fibroids after treatment with a gonadotropin–releasing hormone analogue. Fertil Steril 2002;78(5):985–93.
16. Bulun SE, Simpson ER, Word RA. Expression of the CYP19 gene and its product aromatase cytochrome P450 in human uterine leiomyoma tissues and cells in culture. J Clin Endocrinol Metab 1994;78(3):736–43.
17. Kikkawa F, Nawa A, Oguchi H, et al. Positive correlation between cytochrome P450 2E1 mRNA level and serum estradiol level in human uterine endometrium. Oncology 1994;51(1):52–8.
18. Hennig Y, Rogalla P, Wanschura S, et al. HMGIC expressed in a uterine leiomyoma with a deletion of the long arm of chromosome 7 along with a 12q14–15 rearrangement but not in tumors showing del(7) as the sole cytogenetic abnormality. Cancer Genet Cytogenet 1997;96(2):129–33.
19. Higashijima T, Kataoka A, Nishida T, Yakushiji M. Gonadotropin–releasing hormone agonist therapy induces apoptosis in uterine leiomyoma. Eur J Obstet Gynecol Reprod Biol 1996;68(1–2):169–73.
Gonadotropin–releasing hormone agonist therapy induces apoptosis in uterine leiomyoma. Eur J Obstet Gynecol Reprod Biol 1996;68(1–2):169–73.
20. Hisaoka M, Sheng WQ, Tanaka A, Hashimoto H. HMGIC alterations in smooth muscle tumors of soft tissues and other sites. Cancer Genet Cytogenet 2002;138(1):50–5.
21. Tallini G, Dal Cin P. HMGI(Y) and HMGI–C dysregulation: a common occurrence in human tumors. Adv Anat Pathol 1999;6(5):237–46.
22. Gattas GJ, Quade BJ, Nowak RA, Morton CC. HMGIC expression in human adult and fetal tissues and in uterine leiomyomata. Genes Chromosomes Cancer 1999;25(4):316–22.
23. Andersen J. Growth factors and cytokines in uterine leiomyomas. Semin Reprod Endocrinol 1996;14(3):269–82.
24 Dixon D, He H, Haseman JK. Immunohistochemical localization of growth factors and their receptors in uterine leiomyomas and matched myometrium. Environ Health Perspect 2000;108 Suppl 5:795–802.
25. Koutsilieris M, Elmeliani D, Frenette G, Maheux R. Leiomyoma–derived growth factors for smooth muscle cells. In Vivo 1992;6(6):579–85.
Leiomyoma–derived growth factors for smooth muscle cells. In Vivo 1992;6(6):579–85.
26. Current reproductive endocrinology.Obstetrics and Gynecology Clinics of North America. Vol. 27, Sep 2000, №3, p.641 – 651.
.
Препараты гонадотропинов
ФСГ — фолликулостимулирующий гормон отвечает за рост и развитие фолликула в яичнике, а ЛГ — лютеи-низирующий гормон, обеспечивает окончательное созревание яйцеклетки и овуляцию в середине цикла (разрыв лидирующего фолликула и выход зрелой яйцеклетки в брюшную полость).
Выделяют два вида лекарственных препаратов гонадотропных гормонов: препараты ЧМГ содержат оба гормона ФСГ и ЛГ; препараты ФСГ содержат только гормон ФСГ.
В нашей клинике наиболее часто применяются из препаратов ЧМГ — «Менопур» (фирма «Ферринг», Германия), а из препаратов ФСГ — «Пурегон» (фирма «Органон», Голландия) и «Гонал-Ф» (фирма «Сероно», Италия).
Указанные лекарственные препараты отличаются не только по составу, но и по технологии их производства.
«Менопур» получают из мочи женщин, пребывающих в менопаузе, с помощью специальной технологии. Препарат проходит высокую степень очистки от посторонних примесей.
Препараты «Пурегон» и «Гонал-Ф» созданы путем генной инженерии, в состав препаратов входит только определенный участок молекулы ФСГ, который непосредственно обеспечивает рост фолликула.
Применение обоих препаратов безопасно с точки зрения развития иммунной реакции против «чужих» гормонов.
Побочные эффекты этих препаратов возникают нечасто и включают дискомфорт в животе, метеоризм (вздутие живота), смену настроения, повышенную утомляемость или беспокойство, которые в большинстве случаев ослабевают или полностью исчезают после пункции фолликулов.
Одним из возможных осложнений терапии препаратами гонадотропных гормонов является множественный рост фолликулов и развитие гиперстимуляции яичников. Препараты выпускаются в виде сухого вещества (порошка) и прилагаемого растворителя (в ампулах) и вводятся один раз в день внутримышечно.
Препараты выпускаются в виде сухого вещества (порошка) и прилагаемого растворителя (в ампулах) и вводятся один раз в день внутримышечно.
При этом 2-4 ампулы сухого вещества разводятся содержимым одной ампулы растворителя. Обычно пациентки делают себе инъекции сами, иногда — привлекают своих родственников или знакомых, умеющих делать внутримышечные инъекции.
В любом случае, всегда можно рассчитывать на нашу помощь — инъекции может делать медицинская сестра процедурного кабинета. Мы настоятельно рекомендуем, чтобы первую инъекцию сделала именно она для того, чтобы научить пациентку или того, кто будет ей делать инъекции, правилам введения препарата.
Препараты нужно вводить в той дозе, которая назначена врачом, в одно и то же время суток, лучше — во 2-й половине дня.
Инструкция пациентам ЭКО по введению препаратов «Менопур» и «Пурегон» («Гонал-Ф»)
1. Тщательно вымойте и высушите руки.
Тщательно вымойте и высушите руки.
2. Заранее приготовьте: один стерильный шприц с иглой для внутримышечных инъекций, 2 ватных шарика, смоченных 70% спиртом, одну ампулу растворителя и 3 или 4 ампулы лекарственного вещества (в соответствии с листом назначений).
3. Спиртовым шариком обработайте указательный и большой палец правой руки и быстро (одним движением) откупорьте ампулы.
4. Снимите колпачок с иглы и наберите 1 или 2 мл воды (предлагаемого стерильного растворителя) в шприц и растворите данное количество растворителя поочередно в каждой из 2-х — 4-х ампул с сухим веществом, последовательно перенося содержимое предыдущей ампулы (уже растворенное) в следующую ампулу (с еще не растворенным сухим веществом). Вещество растворяется практически мгновенно; иглу следует вводить в ампулу как можно глубже.
5. Наберите в шприц растворенное содержимое всех ампул; держа шприц вертикально, легким нажатием на поршень постарайтесь удалить из шприца все пузырьки воздуха.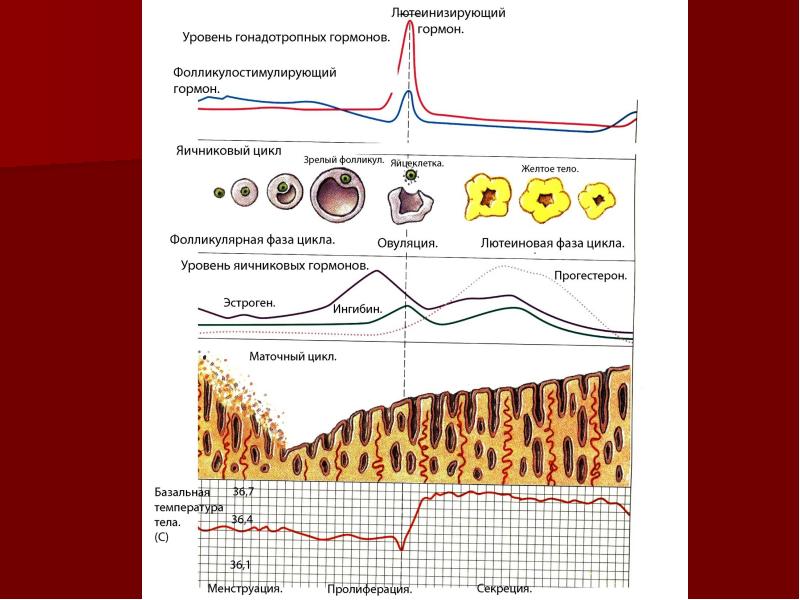
6. Возьмите шприц и новый спиртовой шарик в правую руку.
7. Выберите место для инъекции, желательно, чтобы оно не совпало с местом предыдущей (вчерашней) инъекции. Аккуратно захватите кожу в этой области левой рукой. Примите удобное положение и, опираясь на ногу, противоположную той, где предстоит сделать инъекцию, постарайтесь максимально расслабить мышцы последней.
8. Обработайте спиртовым шариком место укола и зажмите шарик под большим пальцем левой руки.
9. Держа набранный шприц как «метательное копье», проткните иглой кожу (глубина проникновения должна быть не менее 1/2 длины иглы) и быстро введите иглу в мышцу.
10. Плавным нажатием на поршень выдавите содержимое шприца, после чего быстро извлеките иглу.
11. Обработайте место инъекции спиртовым шариком.
12. Весь использованный материал (ватные шарики, использованные шприцы и т.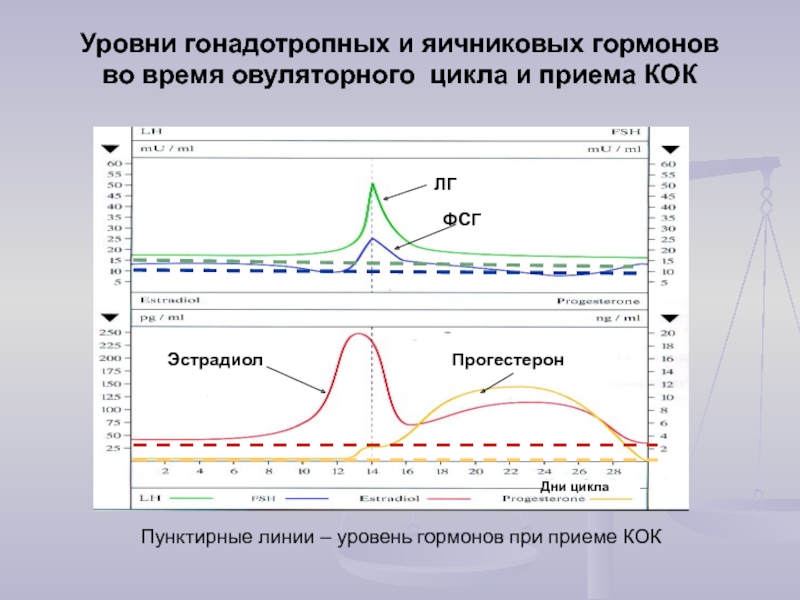 д.) выбрасывается (в обычных контейнерах для мусора — какого-либо специального оборудования не требуется).
д.) выбрасывается (в обычных контейнерах для мусора — какого-либо специального оборудования не требуется).
Гипофизарные инъекции в рыбоводстве (обзор подготовлен Мироновым С. Г.)
Физиологический метод или метод гипофизарных инъекций — применяется для большинства весеннее-летне нерестующих рыб (осетр, карп, лещ, судак, белый амур и др.). К применению метода гипофизарных инъекций в рыбоводстве независимо друг от друга пришли два исследователя: Иеринг (Ihering) в Бразилии — 1935 г. и Гербильский в СССР — 1936 г. /Гербильский, 1975/.
Для стимуляции созревания производителей рыб используется тот же гонадотропный гормон, который содержится в гипофизе, и при нересте в естественных условиях поступает из гипофиза в кровь, вызывая созревание половых клеток. Гонадотропный гормон может накапливается в гипофизе рыб в определенные сезоны года (перед нерестом). Это позволяет использовать гипофиз рыб-доноров как источник гонадотропного гормона, при помощи которого можно получать зрелые половые продукты от производителей на рыбоводных предприятиях /Иванов, 1988/.
При внутримышечных инъекциях суспензии гипофиза рыб производителям, гонадотропный гормон поступает в кровь и стимулирует у них переход половых желез от IV к V стадии зрелости, получение зрелой, способной к оплодотворению икры у самок и доброкачественной спермы у самцов. При такой искусственной стимуляции созревания производителей путем введения им гипофизов, взятых от других рыб, происходит увеличение количества гонадотропного гормона гипофиза в крови. В природной среде то же самое происходит под влиянием нерестовых условий, усиливающих выделение собственного гонадотропного гормона /Иванов, 1988/. Для того, чтобы обеспечить длительность хранения гипофизов, извлеченных у рыб-доноров, их подвергают обработке химически чистым ацетоном, который обезвоживает и обезжиривает ткань гипофиза.
В ряде случаев гонадотропный гормон обладает видовой специфичностью, т. е. гипофиз, взятый у рыб одного вида, может оказаться неэффективным для других видов рыб. Например, гипофизы судака не подходят для стимуляции созревания у карповых рыб, поэтому на рыбоводных предприятиях для стимуляции созревания производителей используют, как правило, гипофизы того же вида рыбы. Гипофизы заготавливают только у рыб находящихся на IV стадии зрелости. Наилучшее время заготовки гипофизов — преднерестовая миграция. Для того чтобы подготовить гипофизы для хранения, их после извлечения подвергают ацетонированию.
Гипофизы заготавливают только у рыб находящихся на IV стадии зрелости. Наилучшее время заготовки гипофизов — преднерестовая миграция. Для того чтобы подготовить гипофизы для хранения, их после извлечения подвергают ацетонированию.
Количество вводимого гипофиза зависит от его гонадотропной активности. Гонадотропная активность гипофиза определяется с помощью тест-объектов, в качестве которых используют самок вьюна или самцов лягушек. Вьюновая единица (В.Е.) — это такая минимальная доза гипофиза, которая у зимней самки вьюна, находящейся на IV стадии зрелости, средней массой 35 — 45 г вызывает созревание и овуляцию икры через 30 — 50 часов после инъекции при температуре 16 — 18 0С в лабораторных условиях. Лягушачья единица (Л. Е.) — это такая минимальная доза гипофиза, которая через 30 — 40 мин после инъекции вызывает реакцию спермиации у одного самца лягушки. Наилучшее время тестирования активности гипофизов — март. Активность 1 мг препарата ацетонированного гипофиза сазана обычно соответствует 1 Л. Е., 1 мг ацетонированного гипофиза осетра соответствует обычно 3,3 Л. Е. /Иванов, 1988/.
Е., 1 мг ацетонированного гипофиза осетра соответствует обычно 3,3 Л. Е. /Иванов, 1988/.
При проведении гипофизарных инъекций доза вводимого препарата, количество инъекций и продолжительность созревания производителей во многом зависят от температуры воды и степени зрелости производителей.
Следует учитывать, что при гипофизарных инъекциях положительного результата можно добиться только в том случае, если гонады инъецируемой рыбы находятся в IV завершенной стадии зрелости. Если гонады у производителей имеют более низкую стадию зрелости, то гипофизарная инъекция не вызывает у них созревания половых продуктов, либо половые продукты оказываются непригодными к оплодотворению. Завершенность IV стадии зрелости гонад у самок может быть оценена по степени поляризации ядра в ооците, что выявляется с помощью биопсии. У недостаточно зрелой икры ядро располагается в центре и по мере созревания перемещается к анимальному полюсу. Оценка степени зрелости гонад у самок по поляризации ядра чаще всего проводится для карпа и осетровых рыб. При этом самок осетровых рыб можно инъецировать только при достижении определенной степени поляризации ядра в ооците.
При этом самок осетровых рыб можно инъецировать только при достижении определенной степени поляризации ядра в ооците.
Дозы гонадотропных гормонов для стимуляции созревания различных видов рыб приведены в таблице.
Дозы гонадотропного гормона гипофиза, применяемого для стимуляции созревания производителей разных видов рыб
Примечание:
ме — мышиные единицы — для хориогонина.
При гормональной стимуляции созревания производителей гипофизарные инъекции самкам производятся, как правило, дробно: общее количество гипофиза, необходимое для созревания икры, делится на несколько порций — одну или две предварительных и разрешающую инъекции. Такая схема в особенности подходит для стимуляции созревания самок карпа, если ядро у них находится в центре ооцита. Предварительная инъекция составляет обычно 1/10 часть общей дозы. При низких температурах воды (в пределах нерестового диапазона температур) количество инъекций также может быть увеличено до трех и более (применяется для карпа). Промежуток времени между инъекциями может составлять от 6 до 12 часов в зависимости от температуры. Например, для стимуляции развития ооцитов у карпа, если ядра находятся в центре, применяется трехкратные гипофизарные инъекции, при которых первая доза составляет 0,2 мг/кг, вторая — через 6 часов — 0,4 мг/кг, третья — через 12 часов после второй — 2 мг/кг. При отсутствии овуляции икры после третьей инъекции стимуляцию продолжают, при этом доза каждой последующей инъекции увеличивается на 0,25 — 0,5 мг/кг, четвертая и последующие инъекции делаются через 24 часа.
Промежуток времени между инъекциями может составлять от 6 до 12 часов в зависимости от температуры. Например, для стимуляции развития ооцитов у карпа, если ядра находятся в центре, применяется трехкратные гипофизарные инъекции, при которых первая доза составляет 0,2 мг/кг, вторая — через 6 часов — 0,4 мг/кг, третья — через 12 часов после второй — 2 мг/кг. При отсутствии овуляции икры после третьей инъекции стимуляцию продолжают, при этом доза каждой последующей инъекции увеличивается на 0,25 — 0,5 мг/кг, четвертая и последующие инъекции делаются через 24 часа.
Самцы хорошо созревают после однократной гипофизарной инъекции, поэтому, например, самцам карпа вводится доза гипофизов в два раза меньшая, чем самкам. Самцов инъецируют, как правило, за час до разрешающей инъекции самкам.
Общее количество гипофиза, требуемого для стимуляции, рассчитывается исходя из общей массы производителей, с учетом температуры воды (у верхней границы нерестового диапазона доза снижается). При приготовлении суспензии гипофизов для инъецирования их взвешивают, измельчают, помещают в фарфоровую ступку и тщательно растирают пестиком до порошкообразного состояния. Затем, помешивая, постепенно добавляют необходимое количество физиологического раствора, исходя из нормы 0,5 или 1 мл на одного производителя. Суспензия гипофизов медленно вводится в мышцы спины выше боковой линии в первую треть тела рыбы (карпу — под чешуйку). Место прокола при этом придерживается пальцем, и после удаления иглы несколько секунд массируется, чтобы введенная суспензия не вылилась обратно.
Затем, помешивая, постепенно добавляют необходимое количество физиологического раствора, исходя из нормы 0,5 или 1 мл на одного производителя. Суспензия гипофизов медленно вводится в мышцы спины выше боковой линии в первую треть тела рыбы (карпу — под чешуйку). Место прокола при этом придерживается пальцем, и после удаления иглы несколько секунд массируется, чтобы введенная суспензия не вылилась обратно.
Для обеспечения нормального созревания икры после гипофизарной инъекции температуру воды в емкостях с производителями постепенно увеличивают на 2 — 3 оC. После проведения инъекций недопустимо понижение температуры.
Гипофизы, используемые для инъекций наряду с гонадотропным гормоном, содержат и тиреотропный гормон, повышающий уровень обменных процессов у рыбы, поэтому у инъецированных рыб возрастает потребность в кислороде. Содержание кислорода в воде должно быть оптимальным.
Ссылки на источники:
Гербильский Н.Л. Метод гипофизарных инъекций и его роль в рыбоводстве // Гормональная стимуляция полового цикла рыб в связи с задачами воспроизводства рыбных запасов: Труды ВНИРО. – Т. 111. – Л.: Наука, 1975. С. 7 – 22.
– Т. 111. – Л.: Наука, 1975. С. 7 – 22.
Иванов А.П. Рыбоводство в естественных водоемах. – М.: Агропромиздат, 1988. – 367 с.
Гормональная стимуляция производителей осетровых рыб
Гормональная стимуляция производителей осетровых рыб
Для стимуляции созревания производителей осетровых рыб всегда использовался гонадотропный гормон, который содержится в гипофизе половозрелых рыб. При нересте в естественных условиях гормон поступает из гипофиза осетров в кровь, вызывая созревание половых клеток. Гонадотропный гормон накапливается в гипофизе рыб перед нерестом. Это позволяет использовать эти гипофизы как источник гонадотропного гормона, при помощи которого можно получать зрелые половые продукты от производителей на рыбоводных предприятиях.
При внутримышечных инъекциях суспензии гипофиза гонадотропный гормон поступает в кровь рыб и стимулирует у них переход половых желез от 4-й до 5-й стадии зрелости. Таким образом, икра становится способной к оплодотворению, а у самцом при таких инъекциях созревает качественная сперма.
Таким образом, икра становится способной к оплодотворению, а у самцом при таких инъекциях созревает качественная сперма.
При искусственной стимуляции производителей гипофизом других рыб, происходит увеличение количества гонадотропного гормона в крови. В природной среде то же самое происходит под влиянием нерестовых условий, усиливающих выделение собственного гонадотропного гормона.
Для того, чтобы обеспечить длительность хранения гипофизов, извлеченных у рыб, их подвергают обработке ацетоном, который обезвоживает и обезжиривает гипофиз.
Обычно гонадотропный гормон обладает видовой специфичностью. Гипофиз, взятый у рыб одного вида, может оказаться неэффективным для других видов рыб, поэтому на рыбоводных заводах для стимуляции созревания производителей используют гипофизы того же вида рыбы. Гипофизы заготавливают только у рыб на 4-й стадии зрелости.
Наилучшее время заготовки гипофизов – преднерестовая миграция. Для того чтобы подготовить гипофизы для хранения, их после извлечения подвергают ацетонированию.
Количество вводимого гипофиза зависит от его гонадотропной активности. Гонадотропная активность гипофиза определяется с помощью тест – объектов, в качестве которых используют самцов лягушек.
Лягушачья единица (Л. Е.) – это минимальная доза гипофиза, которая через 30 мин после инъекции вызывает у самца лягушки реакцию спермиации.
Активность 1 мг препарата ацетонированного гипофиза сазана соответствует 1 Л. Е., а 1 мг ацетонированного гипофиза осетра соответствует 3,3 Л. Е.
При проведении гипофизарных инъекций доза вводимого препарата, количество инъекций и продолжительность созревания производителей зависит от температуры воды и степени зрелости производителей.
Следует учитывать, что при гипофизарных инъекциях положительного результата можно добиться только в том случае, если гонады инъецируемой рыбы находятся в 4-1 завершенной стадии зрелости.
Завершенность 4-й стадии зрелости гонад у самок может быть оценена по степени поляризации ядра в ооците, что выявляется с помощью биопсии. У недостаточно зрелой икры ядро располагается в центре и по мере созревания перемещается к анимальному полюсу.
У недостаточно зрелой икры ядро располагается в центре и по мере созревания перемещается к анимальному полюсу.
Оценка степени зрелости гонад у самок по поляризации ядра проводится для осетровых рыб. При этом самок осетровых рыб можно инъецировать только при достижении определенной степени поляризации ядра в ооците.
Дозы гонадотропных гормонов для стимуляции созревания различных видов рыб рассчитываются по специальным таблицам.
При гормональной стимуляции созревания производителей гипофизарные инъекции самкам осетров производятся дробно. Сначала одну – две предварительных инъекции, а затем разрешающая.
Для обеспечения нормального созревания икры после гипофизарной инъекции температуру воды в емкостях с производителями, вышедшими на нерестовые температуры постепенно увеличивают ещё на 2-3 °С. После проведения инъекций понижение температуры недопустимо!.
Гипофизы, используемые для инъекций наряду с гонадотропным гормоном, содержат и тиреотропный гормон, повышающий уровень обменных процессов у рыбы, поэтому инъецированные рыбы потребляют больше кислорода. Содержание кислорода в нерестовой воде (14-16 °С) должно быть не менее 100 % насыщения. Лучше ≥ 120 % (≈ 7-8 мг/л).
Содержание кислорода в нерестовой воде (14-16 °С) должно быть не менее 100 % насыщения. Лучше ≥ 120 % (≈ 7-8 мг/л).
До недавнего времени на осетровых заводах Каспия и Азовского побережья для инкубации осетровых видов рыб использовали гипофиз самих осетровых рыб. Однако, в связи с практическим исчезновением осетров в природных водоёмах исчез и добываемый из них гипофиз.
Заводы и коммерческие осетровые предприятия оставались без природного гонадотропного препарата для созревания производителей.
Для компенсации появившегося дефицита этих препаратов сначала рыбоводы стали подмешивать к осетровому гипофизу карповые. Пробовали делать и дробные поочерёдные инъекции тем и другим препаратом, а также применять глицериновую вытяжку гипофизов осетровых рыб.Результаты в принципе на 90 % были удовлетворительными.
Однако, и эти ничтожные возможности по приобретению осетрового гипофиза исчезли. Стал остро вопрос о дешёвом общедоступном заменителе.
Такими стали синтетические препараты сурфагон и нерестин-5 которые интенсивно используются в последнее время. Но они до конца ещё не исследованы, особенно на предмет их негативного воздействия на осетровых рыб. Перед учёными стояла задача по определению оптимальной схемы гонадотропной стимуляции осетровых производителей с целью поиска наиболее эффективного прижизненного получения икры для воспроизводства и самое главное – определение безопасности икры, применяемой для пищевых целей.
После продолжительных исследований с 2000 до 2015 гг. была разработана оптимальная схема гонадотропной стимуляции осетровых рыб с использованием гипофизов сазана, сурфагона и невестина-5 с целью получения овулированной икры.
Некоторые выдержки из исследований эффективности гонадотропной
№ п/п |
Виды рыб | Сроки овуляции после инъекций (часы) | Средняя масса рыб (кг) | Средняя масса икры (кг) | Созревание рыб (%) | Вес икры от массы тела рыб (%) |
1 | Бестер (ББС) | 17-18 | 30,2 | 5,0 | 100 | 16,5 |
2 | Русский осётр | 15-17 | 18,1 | 2,8 | 100 | 15,5 |
3 | Ленский осётр | 16-17 | 16,4 | 2,5 | 100 | 15,2 |
4 | Севрюга | 25-30 | 12,1 | 1,4 | 80 | 11,6 |
5 | Стерлядь | 14-16 | 1,8 | 0,2 | 100 | 11,1 |
6 | Бестер (БС) | 16-17 | 27,3 | 4,1 | 100 | 15,0 |
7 | Остер (ОС) | 16-18 | 15,8 | 2,4 | 100 | 15,2 |
стимуляции этими препаратами:
Примечание:
- Разброс некоторых параметров произошёл потому, что опыты проводились в разных хозяйствах при разных нерестовых температурах, разных навесках производителей.

- Созревание только 80 % севрюг произошло по вине самих заводов, которые начали стимулировать самок осетров, не достигших 4-й стадии зрелости.
- Самый высокий выход икры (16,5 %) получился у (ББС) бестеров, которым предварительно вводили инъекции гипофиза сазана, а разрешающие инъекции – нерестином-5.
Во всех опытах предварительная и разрешающая инъекция препаратов оказывала лучшее воздействие на срок овуляции и выход икры по сравнению с однократной. Так что и сурфагон и нерестин-5 можно с успехом применять для стимуляции созревания самок бестера без снижения качества получаемой продукции.
Что касается влияния стимулирующих препаратов на качество пищевой овулированной икры, то здесь до сих пор дебаты в учёной среде не утихают. Ясно лишь одно – если можно избегать этого, то это надо делать и не обращать внимания на результаты исследований, так как они могут быть не точными.
Ещё 40 лет тому назад овуляция у осетровых рыб была изучена не до конца. Не удавалось стимулировать производителей таким образом, чтобы добиваться высокого процента окулирующих ооцитов. Результаты опытов при этом сильно разнились.
Не удавалось стимулировать производителей таким образом, чтобы добиваться высокого процента окулирующих ооцитов. Результаты опытов при этом сильно разнились.
Изучение влияния состава среды культивирования овариальных фолликулов на овуляцию ооцитов осетровых рыб показывало, что одним из факторов, влияющих на результат гормональной стимуляции зависит от среды. Процент ооцитов осетровых рыб, которые овулируют под влиянием экстракта гипофизов осетровых рыб или прогестерона, увеличивался послеизменения среды культивирования.
В качестве исходных сред в этой работе были использованы модифицированный для осетровых рыб раствор Рингера (раствор нескольких неорганических солей в дистиллированной воде с точно выдержанными концентрациями, таких как хлорид натрия, хлорид калия, хлорид кальция, а также бикарбонат натрия для стабилизации кислотности раствора pH).
Разбавление нерестовой воды бикарбонатом натрия (NaHCO3) позволяло получать довольно высокий процент овуляции ооцитов. Проверка способности к развитию показала, что наилучшей является разведенная до 70 % среда L-15, содержащая 1.84 г/л бикарбоната натрия. Тем не менее, и в этой среде овуляцию ооцитов in vitro (это технология выполнения экспериментов, когда опыты проводятся «в пробирке» – вне живого организма) удалось получить далеко не у всех самок, поэтому поиск оптимальной среды продолжаются.
Проверка способности к развитию показала, что наилучшей является разведенная до 70 % среда L-15, содержащая 1.84 г/л бикарбоната натрия. Тем не менее, и в этой среде овуляцию ооцитов in vitro (это технология выполнения экспериментов, когда опыты проводятся «в пробирке» – вне живого организма) удалось получить далеко не у всех самок, поэтому поиск оптимальной среды продолжаются.
Для получения высокого процента созревших и способных к оплодотворению и развитию яйцеклеток важны не только условия инкубации, но и использование оптимальной гормональной обработки. Известно, что овуляцию ооцитов осетровых рыб индуцируют гонадотропный гормон гипофиза и прогестерон. Уже практически найдена среда культивирования фолликулов осетровых рыб, позволяющая получать под влиянием гонадотропных гормонов гипофиза и прогестерона большое число овулировавших яиц. Доказано, что созревание ооцитов осетровых рыб, вызываемое in vitro бикарбонатными ионами, обязано их прямому действию на ооцит. У осетровых рыб инсулин способен вызывать in vitro созревание ооцитов.
У осетровых рыб инсулин способен вызывать in vitro созревание ооцитов.
Выводы.
Даже беглый обзор зарубежных исследований развития биотехнологий разведения осетровых рыб показывает, что мы остались далеко – далеко в «дремучем лесу».
Для восстановления запасов «диких» осетровых видов рыб в природных водоёмах Украины и для развития товарного коммерческого осетроводства после принятия Закона Украины «Про збереження осетрових видів риб» нам необходимо влиться в общий научный процесс по совершенствованию биотехнологий их разведения.
Ещё можно наверстать упущенное! Нужно только желание!!!
Лечение эндокринного бесплодия в СПб
Бесплодие – одна из самых актуальных медико-социальным проблем. Проблемы с естественным зачатием могут быть вызваны различными факторами. И примерно в 40% случаях отсутствие желанной беременности обусловлено имеющимся у женщины стойким гормональным дисбалансом. В этом случае речь идет об эндокринном бесплодии.
В этом случае речь идет об эндокринном бесплодии.
Почему гормональные нарушения приводят к бесплодию
Функционирование зрелой женской репродуктивной системы регулируется несколькими гормонами. И большинство эндокринных расстройств приводит к нарушению процесса созревания и овуляции яйцеклетки, что и становится основной причиной бесплодия. А сопутствующие изменения эпителия маточных труб и эндометрия снижают вероятность успешной имплантации плодного яйца, если оплодотворение все же происходит.
Основные гормоны, которые оказывают влияние на развитие и работу женской половой системы:
- Фолликулостимулирующий гормон (ФСГ или фоллитропин). Относится к классу гонадотропных гормонов гипофизарного происхождения, которые влияют лишь на активность гонад (половых желез, то есть женских яичников). Под его действием происходит рост фолликулов с созревающими в них яйцеклетками, усиливается синтез эстрогена и активируется преобразование в него тестостерона.

- Лютеинизирующий гормон (ЛГ) – тоже гонадотропный гипофизарный гормон. Обеспечивает за своевременную овуляцию созревшей яйцелетки, поддержание активности образующегося после этого желтого тела, стимулирует выработку прогестерона.
- Пролактин. Вырабатывается в гипофизе и влияет в основном на железистую ткань молочных желез. Но он способен также продлевать 2 фазу цикла, что является нормальным для периода грудного вскармливания. В значительной части случаев эндокринного бесплодия выявляется выраженная пролактинемия.
- Эстрогены. Фактически это 3 вещества сходной структуры, хотя и разной степени биологической активности. Но их обычно объединяют под общим названием. К эстрогенам относят эстрадиол, эстрон и эстриол. Основная часть этого гормона синтезируется в корковом слое яичников (в стенках фолликула и затем в желтом теле), причем в первой половине овариально-менструального цикла его концентрация существенно выше. Эстрогены считаются основным женским половым гормоном.
 Ведь именно он отвечает за пролиферацию эндометрия для подготовки к имплантации плодного яйца, поддерживает функциональную активность всех половых органов. А при его резком снижении речь идет не просто об эндокринном бесплодии, а уже о формировании менопаузы.
Ведь именно он отвечает за пролиферацию эндометрия для подготовки к имплантации плодного яйца, поддерживает функциональную активность всех половых органов. А при его резком снижении речь идет не просто об эндокринном бесплодии, а уже о формировании менопаузы. - Прогестерон. Секретируется желтым телом в послеовуляторный период, содействует имплантации и поддерживает состояние наступившей беременности. Если зачатия не произошло, резкое падение уровня прогестерона обеспечивает наступление менструации с началом нового цикла.
На работу репродуктивной системы у женщин влияет также хорионический гонадотропин. Это гормон, основной точкой приложения которого являются яичники. Но он вырабатывается лишь момента наступления беременности, так что для женщин с эндокринным бесплодием определение его уровня не является информативным.
Выработка и активность всех гормонов – отнюдь не изолированные процессы. В эндокринной регуляции репродуктивной функции большое значение имеет обратная связь. И изменение уровня хотя бы одного гормона сопровождается комплексными сдвигами в синтезе остальных биологически активных веществ. А это отражается на процессе созревания и овуляции яйцеклеток, нарушает функционирование эндометрия, маточных труб и эпителия шейки матки. Поэтому в большинстве случаев эндокринному бесплодию у женщин сопутствуют ановуляторные циклы со склонностью к нарушению сроков, продолжительности и обильности менструаций.
И изменение уровня хотя бы одного гормона сопровождается комплексными сдвигами в синтезе остальных биологически активных веществ. А это отражается на процессе созревания и овуляции яйцеклеток, нарушает функционирование эндометрия, маточных труб и эпителия шейки матки. Поэтому в большинстве случаев эндокринному бесплодию у женщин сопутствуют ановуляторные циклы со склонностью к нарушению сроков, продолжительности и обильности менструаций.
Чем может быть вызвано эндокринное бесплодие
Однозначную причину развития у женщины эндокринного бесплодия удается выявить далеко не всегда. Ведь прямую временную связь между действием какого-то фактора и появившимися гормональными проблемами отследить достаточно сложно, да и срок их формирования определить подчас затруднительно. Конечно, встречаются случаи, когда причина нарушений точно известна, при этом она скорее всего имеет ятрогенную (связанную с врачебным воздействием) природу. Чаще всего у женщины в анамнезе имеется несколько потенциально вредоносных факторов, и речь идет об их совокупном влиянии.
Причиной дизгормональных нарушений и обусловленного этим эндокринного бесплодия могут быть любые состояния и заболевания, сопровождающиеся отрицательным влиянием на работу гиполатамо-гипофизарной системы и яичников. Причем такое воздействие может быть не только прямым, но и опосредованным.
К основным факторам риска по формированию эндокринного бесплодия относят:
- Наличие отягощенного гинекологического анамнеза с признаками возможных дизгормональных нарушений. Это может быть позднее менархе, долгое установление менструального цикла, периоды нарушений менструации.
- Длительная и нерациональная гормональная контрацепция.
- Наличие в анамнезе медицинских абортов, особенно если была прервана первая беременность.
- Диагностированные опухоли репродуктивных органов – кисты яичников, миома матки.
- Перенесенные или хронические аднекситы.
- Возраст женщины свыше 35 лет, что объясняется началом естественного угасания активности яичников и постепенным истощением их овариального резерва.

- Ожирение, сахарный диабет, патология щитовидной железы, гормонально активная аденома гипофиза.
- Наличие хронических интоксикаций, что способно негативно сказаться на состоянии яичников. Причем они могут быть связаны не только с профессиональными вредностями, но и с курением, алкоголизацией, проживанием в экологически неблагоприятных зонах.
- Хронические стрессы, психоэмоциональное истощение, неврозоподобные состояния. Все это сопровождается нарушением выработки пролактина и гонадотропных гормонов, что и приводит к эндокринному бесплодию. Кроме того, для коррекции таких расстройств нередко назначают препараты психотропного действия, которые тоже влияют на гипоталамо-гипофизарную систему.
Потенциально вредоносных факторов достаточно много, поэтому к группе риска по развитию эндокринного бесплодия относятся многие женщины. Причем с проблемой гормональных расстройств могут столкнуться и пациентки, уже благополучно родившие собственных детей.
Каким бывает эндокринное бесплодие
К основным формам женского эндокринного бесплодия относят:
-
Гипоталамо-гипофизарная дисфункция, когда гормональные нарушения возникают в центральном звене регуляции работы репродуктивной системы. И самым частым вариантом такой патологии является гиперпролактинемия.
-
СПКЯ – синдром поликистозных яичников. В патогенезе этого состояния отмечается повышение выработки андрогенов, что сопровождается ановуляцией и формированием множеством мелких овариальных кист.
-
Синдром гиперандрогении. При этом может отмечаться повышение секреции андрогенов (мужских половых гормонов), увеличение их функциональной активности (особенно в условиях эстрогенового дефицита), повышенная чувствительность рецепторов к этим гормонам.
-
Синдром резистентных яичников, когда имеется снижение чувствительности яичниковой ткани к стимулирующему действию гонадотропных и других гормонов.
-
Ранняя менопауза в результате истощения яичников.
-
Недостаточность лютеиновой фазы овариально-менстрального цикла, что обусловлено дефицитом выработки прогестерона. Это может приводить как к эндокринному бесплодию, так и к прерыванию наступающих беременностей на самых ранних сроках после имплантации. При этом пациентки могут не подозревать о свершившемся зачатии, а самопроизвольный аборт принимают за наступление задержавшейся менструации.
-
Лютеинизация неовулировавшего фолликула. При этом яйцеклетка созревает, но не овулирует. А на месте неразорвавшегося фолликула с погибшим ооцитом формируется ложное желтое тело.
-
Расстройства на фоне заболеваний щитовидной железы.
Как подтвердить эндокринное бесплодие
Диагностика эндокринного бесплодия включает тщательный сбор анамнеза, оценку соматического и гинекологического статуса пациентки. Но к ключевым моментам обследования относят определение гормонального профиля и оценка овуляции.
В диагностический комплекс при подозрении на эндокринное бесплодие входят:
- Определение базальной гормональной секреции на 2-3 день после начала менструации, в раннюю фолликулиновую фазу. Оценивают уровень пролактина, эстрогена (эстрадиола), гонадотропинов, тестостерона, гормонов щитовидной железы и тиреотропного гормона, антител к тиреоглобулину и тиреоидной пероксидазе.
- УЗ-мониторинг фолликулогенеза и подтверждение овуляции.
- Определение функциональной активности желтого тела, для чего оценивают уровень эстрадиола и прогестерона на 6–8 день после произошедшей подтвержденной овуляции.
- Тесты функциональной диагностики: мочевой тест для определения предполагаемого времени овуляции по уровню ЛГ, построение графика базальной температуры.
- УЗИ органов малого таза для оценки состояния яичников, толщины эндометрия в различные фазы цикла, выявления других факторов бесплодия.
Возможно дополнительное назначение и других исследований. Используются биопсия эндометрия, рентгеноскопия черепа с прицельной оценкой гипофизарной области, УЗИ щитовидной железы и молочных желез. Объем обследования врач определяет индивидуально.
Как лечить эндокринное бесплодие
Лечение эндокринного бесплодия – непростая задача, решить которую возможно лишь при грамотном комплексном подходе. Необходимо нормализовать работу всех органов внутренней секреции, даже если их гормоны не оказывают непосредственного влияния на яичники. Поэтому нередко приходится назначать препараты для коррекции функции щитовидной железы, надпочечников, поджелудочной железы. Женщине может также потребоваться нормализация веса, стабилизация психоэмоционального состояния, помощь в отказе от вредных привычек.
На следующем этапе лечения назначаются препараты для стимуляции созревания фолликулов и провоцирования овуляции. К ним относят:
- Кломифен цитрат (основной препарат с этим действующим веществом – Клостилбегит). Механизм его действия основан на стимуляции выработки ФСГ.
- Гонадотропины. К ним относят человеческий менопауальный гонадотропин (ЧМГ), препараты на основе хорионического гонадотропина человека (ХГЧ), рекомбинантный ФСГ (р-ФСГ).
Схема стимуляции овуляции для лечения эндокринного бесплодия подбирается индивидуально, с учетом многих факторов. Дополнительно могут быть назначены препараты для коррекции гиперандрогении, гиперпролактинемии и других нарушений. Если же проводимая терапия не дает ожидаемого эффекта и не приводит к наступлению беременности в течение 6 месяцев, решается вопрос о целесообразности использования ЭКО.
Эндокринное бесплодие требует тщательного подбора препаратов, их дозировки и схемы применения. Ведь чрезмерная стимуляция яичников чревата не только многоплодной беременностью, но и развитием серьезных побочных явлений. Не стоит забывать и о целесообразности динамической оценки результатов проводимого лечения, своевременного использования дополнительных методик и вспомогательных репродуктивных технологий.
Клиника репродуктивной медицины ICLINIC – специализированный центр, ориентированный на максимально результативное решение проблемы супружеского бесплодия. Наличие собственной лаборатории и современного диагностического оборудования позволяет проводить полноценное обследование пациентов. Для лечения бесплодия высококвалифицированные опытные врачи ICLINIC используют только проверенные и действительно результативные терапевтические схемы. При необходимости медикаментозная терапия дополняется ЭКО и другими ВРТ. Поэтому даже при тяжелых комбинированных формах бесплодия пациенты ICLINIC имеют шанс стать родителями.
Определение гонадотропного средства по Merriam-Webster
go · nad · o · trop · ic | \ gō-ˌna-də-ˈträ-pik \ варианты: или реже гонадотропный \ gō- ˌna- də- ˈtrō- fik , — ˈträ- \ : действует на гонады или стимулирует их.Gonadotropic Cell — обзор
Gonadotropins
Эти гормоны вырабатываются гонадотропными клетками передней доли гипофиза.Они влияют на созревание и функцию яичников и семенников. Гонадотропины включают ФСГ и ЛГ, оба из которых являются гликопротеинами. ФСГ (~ 34 кДа) содержит 10% углеводов, а ЛГ (~ 25 кДа) — 15% углеводов. Углеводородные цепи обоих гонадотропинов содержат маннозу, галактозу, фукозу, глюкозамин, галактозамин и сиаловую кислоту. Гонадотропины состоят из двух разных полипептидов, α и β. Субъединица α идентична как для ЛГ, так и для ФСГ; β-цепь специфична для каждого гормона. Хотя активность зависит от β-цепи, присутствие двух субъединиц необходимо для биологических функций гормона.
Действия FSH . ФСГ вызывает созревание и развитие фолликула Граафа в яичнике. Вместе с ЛГ он стимулирует синтез эстрогена и прогестерона в яичниках. Самый высокий уровень ФСГ в плазме достигается до овуляции.
В семенниках ФСГ способствует развитию семенных канальцев и является одним из факторов, участвующих в инициации сперматогенеза. Он нацелен на клетки Сертоли, чтобы стимулировать выработку эстрогенов из андрогенов, и вместе с тестостероном он индуцирует синтез андрогенсвязывающих белков в этих клетках, что помогает локально поддерживать высокий уровень тестостерона, необходимый для сперматогенеза.В плазме мужчин уровень ФСГ очень постоянен.
LH действия . У женщин ЛГ контролирует развитие желтого тела и стимулирует секрецию эстрогена и прогестерона. Он индуцирует белок StAR и синтез ферментов, участвующих в прегненолоне и других предшественниках стероидных гормонов. Хотя развитие фолликула Граафа в основном контролируется ФСГ, выработка эстрогена зависит от обоих кортикотропинов.
У мужчин ЛГ также называют гормоном, стимулирующим интерстициальные клетки (клетки Лейдига) (ICSH).Он способствует выработке и секреции тестостерона, который, в свою очередь, помогает поддерживать сперматогенез и развитие вторичных половых органов.
ФСГ и ЛГ активируют аденилатциклазу в клетках-мишенях. Уровни ЛГ и ФСГ меняются с возрастом; они низкие до полового созревания и повышаются у женщин в постменопаузе. Повышение уровня ЛГ у мужчин и циклическая секреция ФСГ у девочек предшествуют наступлению половой зрелости. ЛГ и ФСГ меняются в течение менструального цикла. В начальной фазе цикла ЛГ увеличивается медленно и заметно увеличивается в середине цикла, что вызывает овуляцию.ФСГ сначала немного увеличивается, затем падает, а в середине цикла увеличивается параллельно с увеличением ЛГ. После овуляции концентрация обоих гормонов падает.
Секреция контролируется гонадолиберином; циркулирующие половые стероиды влияют на секрецию гонадолиберина посредством обратной связи.
Другими паракринными факторами яичникового происхождения являются активин и ингибин, белки, которые оказывают противоположное действие на гонадотропные клетки, и статин фолликулов, пептид, регулирующий активин и ингибин.
Самый быстрый словарь в мире: словарь.com
гонадотропный гормон гормон, секретируемый передней долей гипофиза и плацентой; стимулирует гонады и контролирует репродуктивную деятельность
гонадотропный гормон: гормон, секретируемый передней долей гипофиза и плацентой; стимулирует гонады и контролирует репродуктивную деятельность
соматотропный гормон гормон, вырабатываемый передней долей гипофиза
соматотропный гормон гормон, вырабатываемый передней долей гипофиза
антидиуретический гормон: гормон, секретируемый задней долей гипофиза (торговое название питрессин), а также нервными окончаниями в гипоталамусе; влияет на артериальное давление, стимулируя капиллярные мышцы, и снижает поток мочи, влияя на реабсорбцию воды почечными канальцами
тиреотропный гормон гормон передней доли гипофиза, стимулирующий функцию щитовидной железы
гонадотропный гормон, секретируемый передней долей гипофиза и плацентой; стимулирует гонады и контролирует репродуктивную деятельность
гонадотропный, связанный с гонадотропином, или связанный с ним, или связанный с ним
тиреотрофный гормон гормон передней доли гипофиза, стимулирующий функцию щитовидной железы
гонадотропный гормон, секретируемый передней долей гипофиза и плацентой; стимулирует гонады и контролирует репродуктивную деятельность
андрогенный гормон мужской половой гормон, который вырабатывается в семенниках и отвечает за типичные мужские половые признаки
адренокортикотропный гормон гормон, вырабатываемый передней долей гипофиза, который стимулирует кору надпочечников
гонадотропный, связанный с гонадотропином или связанный с ним
змеи рода Tropidoclonion морщинистые
гормон паращитовидной железы гормон, синтезируемый и выделяемый в кровоток паращитовидными железами; регулирует фосфор и кальций в организме и участвует в нервно-мышечном возбуждении и свертывании крови
лактогенный гормон гонадотропный гормон, секретируемый передней долей гипофиза
nitrobacterium любая из почвенных бактерий, участвующих в круговороте азота; они окисляют соединения аммония до нитритов или окисляют нитриты до нитратов
адренокортикотропный гормон гормон, вырабатываемый передней долей гипофиза, который стимулирует кору надпочечников
гормоны желудочно-кишечного тракта, гормоны, влияющие на функционирование желудочно-кишечного тракта
Онтогенез гонадотропных и тиреотропных клеток в передней доле гипофиза эмбриона мыши
Aubert ML, Conne BS, Winiger BP, Lang U, Sizonenko PC (1983) Гормональная регуляция сайтов связывания GnRH.В: Tixier-Vidal A, Richard P (eds) Мультигормональные регуляции в нейроэндокринных клетках. Editions INSERM, vol 110, pp 319
Aubert ML, Bégeot M, Winiger BP, Morel G, Sizonenko PC, Dubois PM (1985) Онтогенез гипоталамических рецепторов GnRH и гипофизарных GnRH у плодов и новорожденных крыс. Эндокринология 116: 1565–1576
Google Scholar
Baker B, Gross DS (1978) Цитология и распределение типов секреторных клеток в гипофизе мыши, как продемонстрировано с помощью иммуноцитохимии.Am J Anat 153: 193–216
Google Scholar
Бейкер Б.Л., Яффе Р.Б. (1975) Генезис типов клеток в аденогипофизе плода человека, наблюдаемый с помощью иммуноцитохимии. Am J Anat 143: 137–162
Google Scholar
Bégeot M, Dupouy JP, Dubois MP, Dubois PM (1981) Иммуноцитологическое определение гонадотропных и тиреотропных клеток в нормальном развитии передней доли гипофиза у плодов крысы и в экспериментальных условиях.Нейроэндокринология 32: 285–294
Google Scholar
Bégeot M, Dubois MP, Dubois PM (1983) Сравнительное исследование in vivo и vitro дифференцировки иммунореактивных гонадотропных клеток в передней доле гипофиза у плодов крысы. Нейроэндокринология 37: 52–58
Google Scholar
Clements JA, Reyes FI, Winter JSD, Faiman C (1976) Исследования полового развития человека.III. Гипофиз плода, а также концентрация ЛГ, ХГ и ФСГ в сыворотке и околоплодных водах. J Clin Endocrinol Metabol 42: 9–19
Google Scholar
Degnelie P (1978) Théorie et méthodes statistiques. Diffusion Vanderayez. Les Presses agonomiques de Gembloux, vol II, pp 16–451
Dearden NY, King AS (1976) Цитодифференцировка и развитие портальных сосудов в гипофизе мышей. J Anat 121: 551–569
Google Scholar
Дев П.К., Шривастава П.Н. (1975) Тинкториальное поведение типов клеток в аденогипофизе швейцарских мышей-альбиносов.Acta Anat 92: 178–193
Google Scholar
Dubois MP (1971) Гликопротидные гормоны гликопротидных гормонов гипофиза. Разделение иммунофлуоресценции тиреотропных клеток и гонадотропных клеток в гипофизе крупного рогатого скота, яйцеклеток и прокинов. Ann Rech Vet 2: 197–222
Google Scholar
Dubois PM, Dubois MP (1974) Mise en évidence par иммунофлуоресценции l’activité gonadotrope LH dans l’antéhypophyse foetale humaine.В: Forest MG, Bertrand J (eds) Endocrinologie de la période périnatale. INSERM, Париж, стр. 37–61
Google Scholar
Dubois PM, Bégeot M, Dubois MP, Herbert DC (1978) Иммуноцитологическая локализация ЛГ, ФСГ, ТТГ и их субъединиц в гипофизе нормальных и анэнцефальных плодов. Cell Tissue Res 191: 249–265
Google Scholar
Гросс Д.С., Бейкер Б.Л. (1977) Иммуногистохимическая локализация гонадотропин-рилизинг-гормона в мозге эмбриона и ранней постнатальной мыши.Am J Anat 148: 195–216
Google Scholar
Gross DS, Baker BL (1979) Корреляция развития между гипоталамическим гонадотропным рилизинг-гормоном и гипофизарным лютеинизирующим гормоном. Am J Anat 154: 1–10
Google Scholar
Grotjan HE, Leveque NW, Berkowitz AS, Keek BA (1984) Количественное определение субъединиц LH, высвобождаемых клетками передней доли гипофиза крысы в первичной культуре.Эндокринол клеток Mol 35: 121–129
Google Scholar
Грумбах М.М., Каплан С.Л. (1973) Онтогенез секреции гормона роста, инсулина, пролактина и гонадотропина у плода человека. В кн .: Физиология плода и новорожденного. Труды сэра Дж. Баркрофта, Centanary Symposium. Кембридж, Англия, 1972 г., Cambridge University Press, стр. 462–484
Google Scholar
Hagen C, McNeilly AS (1975) Идентификация лютеинизирующего гормона человека, фолликулостимулирующего гормона, β-субъединицы лютеинизирующего гормона и α-субъединицы гонадотропина в гипофизе плода и взрослого.J Endocrinol 67: 49–57
Google Scholar
Harris GW, Jacobsohn D (1952) Функциональные трансплантаты передней доли гипофиза. Proc R Soc B 139: 263–276
Google Scholar
Jost A (1966) Функция передней доли гипофиза в жизни плода. В: Харрис GW, Донован Б.Т. (ред.) Гипофиз, том 2. Лондон Баттервартс, стр. 299–323
Google Scholar
Каплан С.Л., Грумбах М.М. (1976a) Онтогенез гормона плода человека.II. Лютеинизирующий гормон (ЛГ) и фолликулостимулирующий гормон (ФСГ). Acta Endocrinol 81: 808–829
Google Scholar
Каплан С.Л., Грумбах М.М., Оберт М.Л. (1976b) Онтогенез гормонов гипофиза и гипоталамических факторов у плода человека. Созревание регуляции функции передней доли гипофиза центральной нервной системой. Недавнее исследование Prog Horm Res 32: 161–243
Google Scholar
Pasteels JL, Gausset P, Danguy A, Ectors F (1974) Секреция гонадотропинов гипофизом плода и младенца человека.В: Forest MG, Bertrand J (eds) Endocrinologie de la période périnatale, стр. 13–36
Sano M, Sasaki F (1969) Эмбриональное развитие передней доли гипофиза мыши изучается с помощью световой электронной микроскопии. Z Anat Entwickl Gesch 129: 195–222
Google Scholar
Setalo G, Nakane PK (1978) Функциональная дифференциация клеток передней доли гипофиза плода у крысы. Endocrinol Exp 10: 155–166
Google Scholar
Setalo G, Vigh S, Horwath J (1976) Функциональная дифференциация синтезирующих ФСГ клеток в дистальной части гипофиза плода крысы.Acta Biol Acad Sci Hung 27: 147–154
Google Scholar
Штернбергер Л.А. (1979) Иммуноцитохимия. Wiley J and Sons (ред.) Издание Wiley Medical, Нью-Йорк (США)
Google Scholar
Tougart C, Picart R, Tixier-Vidal A (1980) Иммуноцитохимическая локализация гликопротеиновых гормонов в передней доле гипофиза крысы. J Histochem Cytochem 28: 101–114
Google Scholar
Watanabe YG, Daikoku S (1979) Иммуногистохимическое исследование цитогенеза аденогипофизарных клеток у плодов крыс.Дев Биол 68: 557–567
Google Scholar
Winters AJ, Eskay RL, Porter JC (1974) Концентрация и распределение TRH и LRH в мозге плода человека. J Clin Endocrinol Metabol 39: 960–963
Google Scholar
Wurzel JM, Curatola LM, Gurr JA, Goldschmidt AM, Kourides IA (1983) Лютеотропная активность плаценты крысы не связана с хорионическим гонадотропином.Эндокринология 113: 1854–1857
Google Scholar
Гонадотропиновые гормоны
Ашхейм и Зондек (1928) исследовали мочу беременных женщин и обнаружили, что в ней присутствуют по крайней мере два различных вещества. Одно вещество стимулировало рост фолликулов в яичниках, а другое вызывало секреторные изменения в разорванном фолликуле после овуляции.
Гонадотропины — это любые гормоны, которые стимулируют гонады или половые железы для выполнения их репродуктивных или эндокринных функций.У мужчин этими железами являются яички, а у женщин — яичники. Гонадотропины включают лютеинизирующий гормон (ЛГ) и фолликулостимулирующий гормон (ФСГ), вырабатываемые передней долей гипофиза, а также плацентарный гормон хорионический гонадотропин человека (ХГЧ). Поэтому клетки передней доли гипофиза, вырабатывающие гонадотропины, называются гонадотрофами и составляют десять процентов железы. Обычно они специфичны для одного гормона (ЛГ или ФСГ), хотя некоторые секретируют их оба.
Механизм действия ХГЧ ЛГ и ФСГ Play
Химическая природа
ЛГ и ФСГ — большие молекулы, состоящие из гликозилированных белков. У них идентичная альфа-субъединица, но бета-субъединица у каждой разные. Это различие отвечает за специфическое связывание каждого гормона со своим рецептором.
Эффекты
ФСГ и ЛГ низкие в детстве. Их уровни повышаются после полового созревания, причем ЛГ показывает более значительное увеличение.Они также резко повышаются в середине менструального цикла и снова в период постменопаузы. ХГЧ вырабатывается из плаценты и является основой используемых сегодня тестов на беременность.
Физиологическое действие гонадотропных гормонов на яичники и семенники имеет важное значение для правильной функции гонад. В их отсутствие наиболее важные аспекты репродуктивной функции терпят неудачу, и человек становится бесплодным.
Лютеинизирующий гормон (ЛГ)
ЛГ связывается с определенными клетками семенников, называемыми клетками Лейдига, посредством специфических рецепторов.Это приводит к их роли в синтезе и секреции тестостерона, основного мужского полового гормона. В яичнике ЛГ связывается с клетками теки, клетками капсулы яичника, которые также производят тестостерон. Однако ему суждено превратиться в женский половой гормон эстроген в соседних гранулезных клетках яичника, окружающих развивающийся фолликул яичника.
Характерный выброс ЛГ наблюдается у женщин, но не у мужчин, который называется преовуляторным выбросом.Это время совпадает с пиком зрелости яйцеклетки в фолликуле яичника и вызывает овуляцию в течение 24-72 часов. Большой фолликул в какой-то момент разрывается, высвобождая зрелую яйцеклетку и некоторые клетки, сгруппированные вокруг нее, а также жидкость внутри фолликула, которые быстро поглощаются соседней фаллопиевой трубой, откуда она попадает в полость матки. ФСГ в это время также быстро повышается, но не с той же амплитудой.
После овуляции клетки, которые окружали развивающуюся яйцеклетку внутри фолликула, называемые клетками гранулезы, теперь размножаются, образуя небольшую новую твердую структуру вместо заполненного жидкостью фолликула, а именно желтого тела (желтого тела). .Фактически, это характерное изменение фолликула в маленькое желтоватое пятно (лютеинизация) и является причиной названия этого гормона.
Клетки желтого тела вырабатывают большое количество женских стероидных гормонов, прогестерона и эстрогена (в основном эстрадиола). Прогестерон необходим для подготовки эндометрия к имплантации новой зиготы, если яйцеклетка подвергнется оплодотворению в фаллопиевой трубе. ЛГ также сохраняет желтое тело здоровым и функциональным в случае наступления беременности, пока развитие плаценты не достигнет стадии, во время которой ХГЧ может взять на себя роль поддержания беременности.
Фолликулостимулирующий гормон (ФСГ)
ФСГ отвечает за стимуляцию роста и созревания фолликулов яичников, чтобы могла произойти овуляция. Поэтому при экзогенном введении он гиперстимулирует яичники, производя несколько зрелых фолликулов и несколько зрелых ооцитов — это вместо типичной одиночной зрелой яйцеклетки, производимой в каждом яичниковом цикле.
FSH также поддерживает функцию специальных клеток в семенниках, клеток Сертоли, которые необходимы для правильного созревания сперматозоидов.
Регулирование секреции гонадотропинов с обратной связью
Контроль секреции ФСГ и ЛГ гонадотрофами гипофиза осуществляется главным образом гонадотропин-рилизинг-гормоном (ГнРГ), также называемым ЛГ-рилизинг-гормоном (ЛГРГ). Это пептидный гормон, синтезируемый гипоталамусом, главной эндокринной железой человеческого тела. Когда он секретируется гипоталамическими нейронами, он действует на гонадотрофов передней доли гипофиза через связывание рецепторов, чтобы стимулировать секрецию гонадотропинов.
По мере того, как уровень ЛГ повышается в ответ на секрецию гонадолиберина, увеличивается выработка тестостерона, эстрогена и прогестерона. Эти половые стероиды теперь подавляют секрецию гонадолиберина в гипоталамусе, создавая классический паттерн отрицательной обратной связи. Они также напрямую подавляют гонадотрофы гипофиза.
По этой причине уровни LH повышаются импульсами, а не постоянно. ФСГ также следует той же схеме, хотя и в меньшей степени. Количество импульсов сильно варьируется, особенно в зависимости от стадии овариального цикла у женщин.
Другие гормоны, а именно ингибин и активин, также играют роль в регуляции секреции ФСГ. Они также производятся в половых железах.
Нарушения секреции гонадотропинов
Когда секреция гонадотропинов снижается, функция гонад нарушается, что приводит к состоянию, называемому гипогонадизмом. Это проявляется как олигоспермия и аменорея у мужчин и женщин соответственно.
Изолированный дефицит ЛГ с нормальным уровнем ФСГ приводит к развитию мужских гипогонадных признаков и симптомов, сопровождающихся фертильностью из-за созревания сперматозоидов, стимулированного ФСГ.Такого человека часто называют «плодородным евнухом».
Высокий уровень гонадотропина, с другой стороны, указывает на сбой в цепи отрицательной обратной связи. Это может быть вызвано кастрацией или удалением яичников, но наиболее частой причиной у людей является либо недостаточность гонад, либо наличие секреторной опухоли гипофиза. Клинические эффекты такого состояния минимальны.
Применение в медицине
Секреция гонадотропинов необходима для образования зрелых ооцитов и сперматозоидов.По этой причине, в частности, предотвращение нормальной секреции ЛГ приводит к бесплодию. Таков механизм действия широко используемых противозачаточных таблеток с низкой дозой эстроген-прогестина. Они оказывают угнетающее действие на гонадотрофов, а также предотвращают выброс ЛГ и, таким образом, подавляют овуляцию.
АнтагонистыGnRH также можно использовать для подавления секреции гонадотропинов. Эти агенты блокируют рецептор GnRH на клетках гонадотрофов. Хотя это дает мощный противозачаточный эффект, другие их эффекты не позволяют использовать их для этой цели.
Список литературы
http://www.vivo.colostate.edu/hbooks/pathphys/endocrine/hypopit/lhfsh.html
https://www.britannica.com/science/gonadotropin
Дополнительная литература
Гонадотропные и физиологические функции ювенильного гормона у рабочих шмелей (Bombus terrestris)
Abstract
Развитие развитой социальности пчел связано с очевидными модификациями передачи сигналов ювенильного гормона (JH). В отличие от большинства насекомых, у которых JH представляет собой гонадотропин, регулирующий фертильность самок, у высоко эусоциальной медоносной пчелы ( Apis mellifera ) JH утратил гонадотрофную функцию у взрослых самок и вместо этого регулирует возрастное разделение труда между рабочими пчелами.Чтобы пролить свет на эволюцию передачи сигналов JH у пчел, мы выполнили аллатэктомию и заместительную терапию, чтобы управлять уровнями JH у рабочих «примитивно эусоциального» шмеля Bombus terrestris . Рабочие пчелы, подвергнутые аллатэктомии, показали заметное снижение развития яичников, откладывания яиц, уровней транскриптов жирового тела Vitellogenin и Krüppel, гомолога 1 , гемолимфы изобилия белка Vitellogenin, секреции воска и образования яйцеклеток. Эти эффекты были обращены, по крайней мере частично, обработкой аллатэктомированных пчел JH-III, естественным JH пчел.Аллатэктомия также повлияла на количество сложноэфирного компонента в секрете железы Дюфура, который, как считается, передает социальный сигнал, связанный с фертильностью рабочих. Эти находки подтверждают гипотезу о том, что в отличие от медоносных пчел, JH является гонадотропином у шмелей, и подтверждают гипотезу о том, что эволюция развитой эусоциальности у медоносных пчел была связана с серьезными модификациями передачи сигналов JH.
Образец цитирования: Шпиглер Х., Амсалем Э., Хуанг З.Й., Коэн М., Сигель А.Дж., Хефец А. и др.(2014) Гонадотропные и физиологические функции ювенильного гормона у рабочих шмелей ( Bombus terrestris ). PLoS ONE 9 (6): e100650. https://doi.org/10.1371/journal.pone.0100650
Редактор: Уильям Хьюз, Университет Сассекса, Великобритания
Поступила: 28 января 2014 г .; Принята к печати: 29 мая 2014 г .; Опубликован: 24 июня 2014 г.
Авторские права: © 2014 Shpigler et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана Соединенными Штатами — Израильским двухсторонним фондом сельскохозяйственных исследований и разработок, # IS-4418-11, http://www.bard-isus.com в Великобритании; Американо-израильский двухсторонний научный фонд — BSF # 2007465, http://www.bsf.org.il/BSFPublic/Default.aspx в ГБ и ВДС; докторская стипендия Hoffman Leadership and Responsibility в HS; и награда за постдокторскую стипендию Vaadia-BARD № FI-462-2012 от BARD до HS. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Эндокринные системы обычно интегрируют несколько сигналов окружающей среды и координируют процессы в нескольких тканях.Гормональная регуляция генетически сложна, потому что многие гены могут быть вовлечены в производство, клеточные реакции (включая регулировку пороговых значений) и регуляцию эндокринных сигналов окружающей средой. С эволюционной точки зрения, даже ограниченные модификации эндокринных сигнальных путей могут влиять на множество тканей и вызывать глубокие согласованные изменения морфологии, физиологии или функции. Эти характеристики делают эндокринные системы хорошими кандидатами для объяснения обширных эволюционных новшеств, таких как те, которые связаны с эволюцией обществ животных [1].В соответствии с этой предпосылкой, существуют доказательства причастности гормонов к регуляции таких процессов, как кастовая дифференциация и разделение труда, которые имеют решающее значение для организации сообществ насекомых (см. Обзор в [2]).
Пчелы представляют собой отличную модельную систему для изучения гормональных аспектов эволюции социальности, поскольку филогенетически родственные виды демонстрируют различные формы социальной жизни, а эндокринная система пчел изучена лучше, чем у других социальных насекомых.Хотя большинство видов пчел являются одиночными, существует также множество социальных видов, которые демонстрируют различные уровни социальной сложности, от небольших групп, состоящих только из нескольких особей, до многолетних сообществ медоносных пчел и пчел без жала с их сложными системами коммуникации, морфологической кастой. система и сложное разделение труда между рабочими [3], [4].
Наиболее изученным эндокринным сигналом в контексте социальной организации является ювенильный гормон (ЮГ) (см. Обзоры в [2], [5], [6]).JH регулирует важные функции в различных онтогенетических и физиологических процессах у насекомых [7]. У взрослых насекомых (имаго) он обычно действует как гонадотропин, который у самок лучше всего проявляется в регуляции развития ооцитов (оогенезе). Одна из основных ролей JH — регулирование выработки желточного белка Vitellogenin ( Vg ) в жировом теле и его накопления в развивающемся ооците [8], [9]. Эта модель оогенеза JH — Vg — подтверждена исследованиями многих, но не всех видов насекомых, изученных на сегодняшний день [10], [11].Одним из хорошо изученных исключений для этой модели является медоносная пчела Apis mellifera , у которой как у высокопродуктивных маток, так и у рабочих-яйцекладок низкий уровень JH и высокий уровень Vg [12] — [14]. Королевы, у которых железы телесного тела (CA), единственный известный источник JH у насекомых [7], были удалены хирургическим путем («аллатэктомия»), все еще откладывают яйца со скоростью, сравнимой с контрольной маткой [15]. В отличие от положительной корреляции у большинства насекомых, у медоносной пчелы уровни JH и Vg имеют отрицательную корреляцию, и есть доказательства модели двойного репрессора, в которой JH подавляет экспрессию Vg , а Vg подавляет уровни JH [16]. , [17].У рабочих медоносных пчел JH и Vg есть важные не репродуктивные функции, включая ключевую роль в регулировании возрастного разделения труда. Молодые рабочие пчелы, которые выполняют свои обязанности в гнезде, такие как уход за расплодом, имеют низкий уровень JH и высокий уровень Vg (который они используют для производства маточного молочка [18], [19]), тогда как пожилые рабочие обычно выполнять кормодобывающую деятельность с высоким уровнем JH и низким уровнем Vg [20]. Манипуляции с уровнями JH с помощью аллатэктомии (хирургическое удаление CA желез) или лечения JH или его аналогами замедляли или ускоряли время перехода от деятельности в гнезде к деятельности по добыче пищи, соответственно [21], [22].Взятые вместе исследования медоносных пчел согласуются с предпосылкой, что у этого вида JH утратил гонадотрофическую функцию на взрослой стадии и вместо этого участвует в регуляции возрастного разделения труда [2], [5], [23] ], [24].
Эти поразительные различия в функции JH между одиночными насекомыми и очень социальным медом, а также влияние JH на разделение труда приводят к гипотезе, что модификации в передаче сигналов JH были важны для эволюции развитой социальности у медоносных пчел [5] [24] — [26].Согласно этой гипотезе, JH сохранял свои гонадотропные функции у одиночных и, возможно, также у примитивно социальных пчел, но не у взрослых очень эусоциальных медоносных пчел. Исследования с одиночными пчелами ( Osmia rufa ), факультативно социальными пчелами ( Megalopta genalis ) и примитивно эусоциальными пчелами ( Lasioglossum zephyrum и Bombus terrestris ), показывающие положительную корреляцию между уровнями JH и развитием ооцитов, подтверждают это. посылка [27] — [31].Есть также некоторые свидетельства того, что лечение JH или его аналогами усиливает оогенез как у потовой пчелы Lasioglossum zephyrum [31], так и у шмеля B. terrestris [32], [33]. В B. terrestris обработка JH ускоряла оогенез даже в присутствии королевы, что обычно препятствует размножению рабочих. Обработка JH-I, который не является естественным JH шмелей [28], [29], усиливала биосинтез Vg в жировом теле гинекологов шмелей после овариэктомии [34].С другой стороны, лечение либо JH-I, либо аналогом JH метопреном не влияло на специализацию задачи (разделение труда) у шмелей B. terrestris и B. impatiens [35], [36]. Эти исследования предполагают, что у шмелей JH влияет на оогенез, но не имеет или оказывает незначительное влияние на разделение труда. Однако этих исследований недостаточно, чтобы установить JH как гонадотропин, необходимый для оогенеза и размножения.
В этом исследовании мы объединили аллатэктомию и заместительную терапию с JH-III, естественным JH шмелей, чтобы строго проверить гипотезу о том, что JH обладает гонадотропными функциями у шмелей B.Территория . Наши результаты показывают, что JH необходим для развития и созревания ооцитов и участвует в регуляции вителлогенеза и некоторых дополнительных физиологических процессов, связанных с воспроизводством. Далее мы сравнили наши результаты для B. terrestris с результатами аналогичных манипуляций с JH у медоносных пчел и обсудили эволюцию передачи сигналов JH и социальность у пчел.
Материалы и методы
Пчелы
Bombus terrestris колоний были приобретены у Polyam Pollination Services, Яд-Мордехай, Израиль.Каждая колония содержала матку, 5–10 рабочих и выводок на всех стадиях развития. Каждую колонию помещали в деревянный скворечник (21 × 21 × 12 см) с передней стенкой и крышкой из прозрачного акрилового пластика. Ящики с пчелами были размещены в климатической камере (28 ± 1 ° C; 50 ± 5% относительной влажности) в постоянной темноте в Центре исследований пчел в кампусе Эдмонда Дж. Сафры Еврейского университета в Иерусалиме, Гиват Рам, Иерусалим. Пчел кормили ad libitum коммерческим сахарным сиропом и свежей пыльцой (собранной медоносными пчелами), смешанной с сахарным сиропом (закупленной у Polyam Pollination Services).В конце экспериментов мы измерили длину маргинальной клетки как показатель размера тела. Длина маргинальной ячейки сильно коррелирует с длиной крыла и другими показателями размера тела, но она более надежна, чем длина крыла, потому что на нее не влияет износ крыла и предыдущий опыт полета [37], [38]. Средний размер тела не отличался между пчелами, подвергшимися разной обработке в трех экспериментах, описанных ниже (Таблица S1).
Хирургическое удаление желез аллятного тела (аллатэктомия)
Мы собрали недавно появившихся рабочих пчел (до 24 часов после выхода из куколки) из нескольких исходных семей.В этом возрасте кутикула взрослых шмелей относительно мягкая, и ими легко манипулировать. Пчелы имели свободный доступ к сахарному сиропу и пыльце ad libitum как до, так и после операции аллатэктомии. Сначала мы обезболивали пчел на льду в течение 5–30 минут (разница в продолжительности охлаждения, по-видимому, была связана с индивидуальными различиями в размере тела, возрасте и состоянии питания, а также потому, что мы охлаждали пчел группами по четыре человека), а затем закрепили их с помощью формованных пластилин на ледяном металлическом предметном столике под стереоскопическим микроскопом (Nikon SMZ645, × 50).Пчел фиксировали дорсальной стороной вверх и головой вниз, чтобы обнажить тонкую кутикулу шеи, соединяющую грудную клетку и голову. Мы использовали тонкий скальпель, чтобы открыть поперечный разрез в задней части головной капсулы, и переместили внутреннюю мембрану и трахею, чтобы обнажить СА-железы. Используя тонкие щипцы, мы осторожно захватили каждое тело и отсоединили его. Вся процедура заняла от 2 до 5 минут, кутикула вернула свою первоначальную форму, а через несколько часов после операции разрез казался самоуплотненным.С ложнооперированными пчелами ( ‘Sham’ ) обрабатывали и вскрывали аналогичным образом, но только осторожно касались CA и не отделяли их. Контрольных пчел ( «Control ») подвергали анестезии и обращались с ними аналогичным образом, но не оперировали. После обработки пчел мы поместили их в небольшую клетку с другими работниками, с которыми работали аналогично, и дали им восстановиться в течение ночи в инкубаторе (32 ° C, относительная влажность 70%). На второй день выживших пчел из каждой экспериментальной группы распределили на группы по три человека, каждую пересаживали в свежую деревянную клетку (12 × 5 × 8 см).Группы держали в инкубаторе в течение шести дней, а затем собирали. Большая часть смертности произошла в первый день, до распределения пчел по группам. Средняя выживаемость в первый день в трех экспериментах, подробно описанных ниже, составляла 50% для аллатэктомированных пчел ( ‘CA-‘ ), 80% для имитации и 100% для контрольных пчел. Во всех трех экспериментах выживаемость CA-пчел в течение первого дня была ниже по сравнению с контрольной и ложной группами (анализ выживаемости Каплана-Мейера с последующим логранговым тестом Exp.1: χ 2 (2) = 18,6 p <0,001; Exp. 2: χ 2 (3) = 13 p = 0,004; Exp. 3: χ 2 (3) = 24,6 p <0,001; Рис. S1). Выживаемость в клетках в течение второго-седьмого дня была лучше у пчел CA- (70%) и была аналогична выживаемости пчел Sham и Control в экспериментах 2 и 3 (80%, 95%, соответственно; тест Логранка). ; Эксп. 1: χ 2 (2) = 6,3 p = 0,04; Эксп. 2: χ 2 (3) = 0,78 p = 0,85; Эксп. 3: χ 2 (3) = 6,1 p = 0,1).
Заместительная терапия
Для заместительной терапии ( ‘CA- + JH’ ) мы охлаждали двухдневных аллатэктомированных пчел (через 24 часа после операции) на льду в течение 3-5 минут, а при анестезии лечили местно 70 нг JH-III (Sigma, номер по каталогу: J-2000) растворяется в 3.5 мкл диметилформамида (DMF, J.T Backer, номер по каталогу: 7032), что дает конечную концентрацию 20 нг / мкл. Раствор JH наносили на дорсальную часть грудной клетки [33]. Этот протокол лечения основан на предыдущих исследованиях с медоносными пчелами и наших исследованиях с шмелями [33], [39]. Поддельные и CA-пчелы обрабатывались и охлаждались аналогичным образом, но обрабатывались только носителем (3,5 мкл ДМФ). Контрольная группа была охлаждена, но в остальном не подвергалась лечению. После обработки пчел снова поместили в клетки. Выживаемость была одинаковой для пчел CA- и CA- + JH (рис.S1).
Измерение титров гемолимфы JH
образцов гемолимфы были собраны у пчел, подвергшихся обработке CA-, Sham и Control в семидневном возрасте. Пчел охлаждали на льду в течение 3–5 мин и фиксировали пластилином для моделирования на хирургической пластине на восковой основе спинной частью вверх. Мы открыли небольшой разрез в мембране, соединяющей голову и грудную клетку, и взяли образец гемолимфы, используя 10 мкл стеклянной капиллярной трубки (Drummond, Cat #: 5-000-1001). Мы собрали 1–7 мкл гемолимфы у каждой пчелы, немедленно перенесли образец в 5-миллилитровый стеклянный флакон, содержащий 500 мкл ацетонитрила для ВЭЖХ (Bio-Lab, № по каталогу 01203501), и закрыли флакон крышкой с тефлоновым покрытием.Образцы хранили замороженными (-20 ° C) до отправки на сухом льду в Университет штата Мичиган для анализа. Мы измерили титры JH с помощью радиоиммуноанализа, как описано в [29]. Образцы были закодированы таким образом, что человек, выполняющий RIA, не знал о лечении. Мы использовали однофакторный дисперсионный анализ с последующим апостериорным LSD-тестом для сравнения титров JH у пчел, подвергнутых различным обработкам. Мы использовали программное обеспечение SPSS 17.0 (IBM) для всех статистических анализов.
Химический анализ желез Дюфура
Были собраны семидневные пчелы из групп CA-, Sham и Control и удалены их яичники (см. Ниже).Остальную часть тушки хранили замороженной (-20 ° C) до отправки на сухом льду в Тель-Авивский университет для анализа. Железу Дюфура отделили от укуса и экстрагировали 50 мкл пентана, содержащего 1 мкг эйкозана в качестве внутреннего стандарта. Химические анализы выполняли с помощью газовой хроматографии с использованием капиллярной колонки из плавленого кремнезема DB-1 (30 м × 0,25 мм внутренний диаметр) при температурной программе от 170 ° C до 300 ° C со скоростью 4 ° C / мин. Идентичность соединений была установлена с помощью газовой хроматографии / масс-спектрометрии (ГХ / МС) путем сравнения времен удерживания и массовой фрагментации синтетических стандартов [40].Количественное определение соединения было достигнуто интегрированием пика ГХ по сравнению с внутренним стандартом в тех же хроматографических условиях. Мы использовали односторонний дисперсионный анализ с последующим апостериорным LSD-тестом для сравнения общей секреции желез и содержания эфиров.
Оценка состояния яичников
Пчел охлаждали на льду и фиксировали на пластине для препарирования воска под стереомикроскопом (Nikon SMZ645). Мы вскрыли два боковых разреза в брюшной полости, погрузили внутренние органы в пчелиный физиологический раствор [41] и вырезали яичники.Яичники помещали в каплю физиологического раствора на предметном стекле микроскопа и измеряли длину 4-8 терминальных (базальных) ооцитов с помощью окулярной линейки под препаровальным микроскопом (X10). Среднюю длину терминальных ооцитов использовали в качестве показателя состояния яичников для каждой пчелы [29]. Мы сравнили среднее развитие яичников между группами, используя тест Краскела – Уоллиса с последующими апостериорными тестами Коновера.
Измерение уровней мРНК
Kr-h2 и Vg жирового телаМы использовали кПЦР для изучения влияния JH на уровни мРНК Vg и Kr-h2 в жировом теле.Мы собрали 7-дневных пчел из четырех экспериментальных групп, описанных в эксперименте 3 (см. Ниже; CA-, Sham, Control и CA- + JH 2 ), и охладили их на льду. Брюшную полость открыли, и мы удалили яичники (и измерили конечный размер ооцита), кишечник и другие внутренние органы, оставив жировое тело и дорсальную кутикулу. Мы мгновенно заморозили жировое тело в жидком азоте и сохранили его в морозильной камере со сверхнизкой температурой (-80 ° C). Суммарную РНК из рассеченной ткани экстрагировали с помощью набора Invisorb Spin Tissue RNA Mini Kit (Invitek GmbH, Берлин) и количественно оценивали с помощью спектрофотометра ND-1000 (NanoDrop Technologies).кДНК синтезировали из 250 нг РНК. Для оценки уровня экспрессии генов мы использовали детектор последовательности ABI7000 и протокол обнаружения зеленого SYBR (Applied Biosystems [33]). Фактор элонгации a ( Ef1a ) был использован в качестве контрольного гена домашнего хозяйства на основе предыдущих исследований с медоносными пчелами и шмелями, показывающих, что его уровни транскриптов не меняются в зависимости от возраста или задачи [33], [39], [42] . Количественная оценка была основана на количестве циклов ПЦР, необходимых для преодоления порога интенсивности флуоресценции (Ct).Для статистического анализа мы использовали значения ΔCt с нормальным распределением. Для сравнения уровней транскриптов между группами лечения использовали однофакторный дисперсионный анализ с последующим апостериорным LSD-тестом. Для графического представления мы нормализовали значения ΔCt относительно нижней выборки. Кратные различия в относительных уровнях экспрессии изображали как среднее ± стандартная ошибка (с использованием метода 2 -ΔΔCt в соответствии с бюллетенем 2 ABI User Bulletin). Последовательности праймеров, используемых для ПЦР-амплификации кДНК B. terrestris Vg , Kr-h2 и Ef1a , представлены в таблице S2.
Иммуноблоты на белок гемолимфы VG
Мы использовали иммуноблоттинг («вестерн-блоттинг») для оценки влияния JH на уровни белка гемолимфы VG. Мы собрали образец гемолимфы 2,5–7 мкл от каждой пчелы из 4 экспериментальных групп, изученных в эксперименте 3 (CA-, Sham, Control и CA- + JH 2 ), как описано выше. Мы немедленно растворяем гемолимфу в буфере для образцов Лэммли (LSB) плюс 1% коктейля 17 ингибиторов протеазы (PIC, Sigma, № по каталогу: P8340) и 0,2% EDTA (№ по каталогу JT Baker: V49658) в соотношении 1/5 и инкубируют при 95 ° C в течение 5 минут.Мы проанализировали образцы с помощью SDS 7% PAGE. Мы использовали кроличьи антитела против Apis mellifera VG [19] в концентрации 1–3000 и козьи антикроличьи вторичные антитела (Thermo Scientific, № по каталогу: 31460) в количестве 1–50000. Обнаружение белка выполняли с помощью набора EZ-ECL — хемилюминесцентного обнаружения пероксидазы хрена (каталожный номер Biological Industries: 20–500). Для фотографирования и анализа гелей использовали люминесцентный анализатор изображений LAS-1000 (FujiFilm). Чтобы предсказать размер белка BtVG, мы сначала использовали ExPASy (http: // web.expasy.org/translate) для перевода последовательности нуклеотидной мРНК в последовательность белка и множественного выравнивания последовательностей (ClastalO) с клонированной мРНК Vg родственных шмелей, которые доступны в базе данных NCBI ( Bombus ignitus и Bombus hypocrita ). Для оценки прогнозируемого размера белка в Дальтонах мы использовали калькуляторы размера белка ProtParam (http://web.expasy.org/protparam) и PeptideMass (http://web.expasy.org/peptide_mass). Мы оцениваем молекулярный размер окрашенных белков, сравнивая расстояние их миграции в геле с размером белков известной лестницы размера (Fementas, каталожный номер: SM 1851).
Эксперимент 1: Влияние аллатэктомии на титры JH гемолимфы, развитие яичников и секрецию желез Дюфура
Из 6 колоний было собранорабочих клоунов и случайным образом разделено на три экспериментальные группы: «CA-» , «фиктивный» и «контрольный» . Каждая группа состояла из трех рабочих, которые получали одинаковое лечение и были помещены в небольшие деревянные клетки (12 × 5 × 8 см) в инкубатор (32 ° C, относительная влажность 70%). Пчелы получали сахарный сироп и жмых ad libitum .Осматривали клетки не реже одного раза в день. В нашем анализе использовались только группы, в которых к концу эксперимента дожили как минимум две пчелы. На седьмой день мы собрали пчел и измерили титры JH каждой гемолимфы, развитие яичников и состав секрета железы Дюфура. Мы выбрали выборку пчел в семидневном возрасте, потому что в этом возрасте бескамные рабочие демонстрируют весь диапазон развития ооцитов с небольшими признаками поглощения яиц или без них [28], [43]. Эксперимент проводился в течение мая — июля 2010 г.
Эксперимент 2: Влияние JH на развитие яичников, яйцекладку и секрецию воска
рабочих пчел были собраны из 8 семей (около 20–30 пчел на семью, собранных в течение нескольких дней) и разделены на экспериментальные группы, как в эксперименте 1. Половина пчел CA- была обработана однократно JH-III, как описано выше (CA — + JH 1 ). На седьмой день мы собрали пчел, удалили их яичники и оценили их состояние. В конце эксперимента мы открывали все чашки для яиц и подсчитывали количество яиц в каждой клетке.Мы использовали два индекса для оценки количества парафина, выделяемого во время эксперимента. Сначала мы подсчитали количество восковых горшков и чашек в каждой клетке. Во-вторых, мы соскребали воск со дна и по бокам каждой клетки, используя тонкий скальпель и щипцы, и взвешивали его с помощью тонкой шкалы с точностью до 1 мг (Mettler Toledo; AB54–5). Мы использовали тесты Краскела – Уоллиса с последующими апостериорными тестами Коновера для сравнения количества яиц, восковых клеток и веса воска. Этот эксперимент проводился в апреле — мае 2011 г.
Эксперимент 3: Влияние JH на развитие яичников, яйцекладку,
Vg и Kr-h2 экспрессию мРНК жирового тела, уровни белка VG гемолимфы, секрецию парафина и количество восковых клетокПлан эксперимента был аналогичен описанному для эксперимента 2. Чтобы повысить эффективность заместительной терапии, мы использовали два последовательных курса лечения JH, проводимых, когда пчелы находились на 2 и 4 день после вылупления (CA- + JH 2 ) . Мы определили влияние JH на состояние яичников, яйценоскость и секрецию воска, как описано выше.Кроме того, мы измерили уровни мРНК Vg и Kr-h2 в жировом теле с помощью количественной ПЦР, подробно описанной выше, и иммуноблота для оценки уровней белка гемолимфы VG для пчел из 4 экспериментальных групп. Все измерения в этом эксперименте были взяты у одних и тех же фокусных пчел. Эксперимент проводился в апреле-мае 2012 года, а молекулярные анализы — в последующие месяцы.
Результаты
Влияние аллатэктомии на титры JH гемолимфы (Опыт 1)
Аллатекомизированные пчелы (CA-) имели на порядок более низкие уровни титров JH гемолимфы (39 ± 8 нг / мл, n = 20) по сравнению с контролем (453 ± 79 нг / мл, n = 19) и ложнооперированными (327 ± 65 нг / мл, n = 19) пчел (односторонний дисперсионный анализ, F = 8.83, р <0,001; Рисунок 1). Титры JH были одинаковыми для пчел, подвергнутых ложной обработке, и для контрольных пчел (LSD post-hoc p> 0,05). Эти результаты согласуются с гипотезой о том, что CA-железы являются единственным источником JH у шмеля B. terrestris .
Рис. 1. Влияние аллатэктомии на титры JH гемолимфы.
Рабочие шмелей, получавшие такое же лечение, были размещены группами по три человека в небольших клетках без матки. Титры JH определяли в возрасте 7 дней с помощью специфического радиоиммуноанализа JH-III.Показаны среднее значение ± стандартная ошибка (SE) и размер выборки внутри столбцов или над ними. Значение p суммирует результаты одностороннего дисперсионного анализа; группы с разными буквами значительно различаются в апостериорном ЛСД-тесте (p <0,05). CA- = аллатэктомированные пчелы; Имитация = имитация пчел, Контроль = контроль пчел.
https://doi.org/10.1371/journal.pone.0100650.g001
Влияние JH на оогенез и яйценоскость (Примеры 2 и 3)
В Exp. 2, яичники аллатэктомированных пчел содержали мелкие ооциты на базальных стадиях развития (средняя длина терминального ооцита 0.32 ± 0,15 мм, n = 9) по сравнению с пчелами из трех других экспериментальных групп, которые также имели большие ооциты (критерий Краскела-Уоллиса, χ 2 (3) = 12,5, p = 0,005; рис. 2A). Заместительная терапия одной обработкой JH (CA- + JH 1 ) привела к значительному увеличению средней длины концевых ооцитов (1,33 ± 0,29 мм, n = 10) по сравнению с группой CA-, но длина ооцита, тем не менее, была короче, чем у искусственно обработанных (2,15 ± 0,24 мм, n = 18) или контрольных (2,17 ± 0,24 мм, n = 18) пчел (апостериорный тест Коновер p <0.05). Состояние яичников было одинаковым у пчел, подвергнутых ложной обработке, и у контрольных пчел. Яйца были отложены контрольными (6,4 ± 1,2 яйца на клетку, n = 6 клеток) и ложно обработанными пчелами (6,9 ± 2,5, n = 6), но не пчелами CA- (n = 4) или CA- + JH 1 (n = 4) пчел (критерий Краскела-Уоллиса, χ 2 (3) = 12,4, p = 0,006; рис. 2B).
Рисунок 2. Влияние JH на фертильность рабочих.
A. Влияние JH на развитие ооцитов. Значения представляют собой медианные и 95% доверительные интервалы длины терминального ооцита.Заместительная терапия включала однократное местное лечение JH-III (CA- + JH 1 ). С . То же, что и A., но заместительная терапия включала два последовательных курса лечения JH-III (CA- + JH 2 ). Б . Влияние JH на яйценоскость. Значения представляют собой среднее значение ± стандартная ошибка количества яиц, отложенных в клетке, в которой размещается группа без маток. Д . То же, что и B., но заместительная терапия включала два последовательных курса лечения JH-III. Размер выборки показан внутри столбцов или над ними и отображает количество пчел в A и B и количество клеток (групп) в C и D.Значение p суммирует результаты теста Краскела-Уоллиса; группы с разными буквами значительно различаются в апостериорном тесте Коновера (p <0,05). E . Фотография репрезентативных яичников из эксперимента 3 (суммирована на панели C). Дополнительные сведения см. В легенде к рис. 1.
https://doi.org/10.1371/journal.pone.0100650.g002
В Exp. 3, у аллатэктомированных рабочих, подвергшихся заместительной терапии двумя препаратами JH (CA- + JH 2 ), яичники были в таком же состоянии (2.24 ± 0,17 мм, n = 17; 2C и E), как у контрольных (2,71 ± 0,12 мм, n = 27) и ложнооперированных (2,55 ± 0,2 мм, n = 20) пчел (p> 0,05), и со значительно более крупными ооцитами по сравнению с CA-пчелами. (0,45 ± 0,19 мм, n = 16; тест Краскела-Уоллиса χ 2 (3) = 37,3, p <0,001 с последующим апостериорным тестом Коновера p <0,05; рис. 2C). Как и в предыдущих экспериментах (Опыт 2, см. Рис. 2; Опыт 1, см. Рис. S2), у аллатэктомированных пчел были неразвитые яичники, содержащие только ооциты на базальных стадиях. Яйца откладывали в клетки контроля (10 ± 1.6 яиц в клетке, n = 10), ложная (7,1 ± 2,1, n = 9) и группы CA- + JH 2 (3,1 ± 2,2, n = 6; яйца были отложены только в половине клеток) , но не в клетках с CA- (n = 6) пчелами (критерий Краскала-Уоллиса, χ 2 (3) = 14,5, p = 0,002; Рис. 2D). Среднее количество отложенных яиц в группе CA- + JH 2 было ниже, чем в контроле (апостериорный тест Коновера, p <0,05), но не в группе ложной операции (апостериорный тест Коновера, p> 0,05). ). Разница в количестве отложенных яиц между CA- + JH 2 и CA-пчелами, а также между фиктивной и контрольной группами не была статистически значимой (апостериорный тест Коновер, p <0.05).
Влияние JH на экспрессию
Vg в жировом теле и гемолимфе (Опыт 3)Fat body Vg Уровни мРНК были в три-четыре раза ниже у аллатэктомированных пчел (CA-, n = 8) по сравнению с контролем (n = 8) и пчелами с ложной операцией (n = 7; однофакторный дисперсионный анализ ANOVA F). = 9,7, p <0,001, апостериорный тест LSD p <0,01). Заместительная терапия двумя препаратами JH (CA- + JH 2 ) восстановила мРНК Vg жирового тела до уровней, аналогичных таковым у пчел из контрольной и ложнооперированной групп (апостериорный тест LSD p> 0.05, рис. 3А). Качественные оценки влияния JH на уровни белка VG гемолимфы согласуются с результатами обилия транскриптов. У контрольных и ложно оперированных пчел были сильные полосы, соответствующие белку примерно 202 кДа, предсказанному размеру белка Bt VG. Эта полоса была сильно окрашена в иммуноблоттинге и также была четко идентифицирована в гелях, окрашенных неспецифическим белковым красителем Ponceau S. Напротив, окрашивание CA-пчел было очень слабым.Окрашивание пчел, получавших заместительную терапию (CA- + JH 2 ), было более сильным, чем у пчел CA-, и почти таким же сильным, как у пчел из контрольной и ложнооперированной групп (рис. 3B). Эти результаты согласуются с гипотезой о том, что JH регулирует экспрессию Vg.
Рисунок 3. Влияние JH на уровни вителлогенина.
A. Обилие транскриптов вителлогенина ( Vg ) в жировом теле (среднее ± стандартная ошибка; размер выборки в столбцах). Значение p суммирует результаты одностороннего дисперсионного анализа; группы с разными буквами значительно различаются в апостериорном ЛСД-тесте (p <0.05). Б . Уровни белка VG в гемолимфе. Верхний блот показывает иммуноокрашивание антителом, направленным против белка Apis mellifera VG. На нижней панели показано неспецифическое окрашивание белка того же блоттинга с помощью Ponceau S. Каждый столбец содержит данные от одной пчелы. Дополнительные сведения см. В пояснениях к рис. 1 и 2.
https://doi.org/10.1371/journal.pone.0100650.g003
Влияние JH на экспрессию мРНК
Kr-h2 в жировом теле (Exp.3)Жировое тело Kr-h2 уровни мРНК были примерно в шесть раз ниже у аллатэктомированных пчел (CA-, n = 8) по сравнению с контрольными (n = 8) и ложнооперированными пчелами (n = 7; рис. ANOVA, F = 20,3, p <0,001; апостериорный тест LSD, p <0,01). Заместительная терапия двумя обработками JH (CA- + JH 2 , n = 7) привела к полному восстановлению уровней мРНК, аналогичных таковым у контрольных пчел и пчел с ложной операцией (апостериорный тест LSD, p> 0,05, рис. . 4). Этот вывод подтверждает гипотезу о том, что в г.экспрессия Kr-h2 у terrestris регулируется JH.
Влияние JH на секрецию парафина и конструкцию восковой чаши (Примеры 2 и 3)
В Exp. 2 аллатэктомированные пчелы выделяли значительно меньше парафина (CA-, 14 ± 3 мг, n = 4 клетки) по сравнению с контрольными (80 ± 10 мг, n = 8) и ложно обработанными (72 ± 15 мг, n = 7) пчелами. Однократная заместительная терапия (CA- + JH 1 ) не восстановила секрецию парафина до уровней, измеренных для необработанных пчел (19 ± 7 мг, n = 4; тест Краскела-Уоллиса, χ 2 (3) = 14.2, р = 0,003; Рис. 5А). Пчелы из контрольной и имитационной оперированных групп, но не из групп лечения СА или однократной заместительной терапии, построили восковые клетки (критерий Краскела-Уоллиса χ 2 (3) = 12,5, p = 0,005; рис. 5B). Заместительная терапия двумя препаратами JH (CA- + JH 2 ) привела к частичному выздоровлению, измеренному как значительное увеличение секреции парафина (36 ± 8 мг, n = 6 клеток, рис. 5C) и строения клеток (1,2 ± 0,7). , n = 6, рис. 5D) по сравнению с CA-пчелами (воск: 7,4 ± 1 мг; клетки: 0,2 ± 0,1, n = 6).Однако секреция парафина и построение клеток в группах CA- + JH 2 были все еще ниже, чем в клетках контроля (воск: 86 ± 11 мг; клетки: 4,6 ± 0,7, n = 10) и ложно оперированных (воск: 59 ± 10 мг; клетки: 2,8 ± 0,7, n = 9) пчелы (критерий Краскела-Уоллиса, χ 2 (3) = 14,07, p <0,001, рис. 5C и 5D). Мы обнаружили аналогичный эффект аллатэктомии на секрецию воска также в эксперименте 1 (рис. S3). Эти данные позволяют предположить, что JH влияет на секрецию воска у шмелей B. terrestris .
Рисунок 5.Влияние JH на секрецию воска.
A и C. Количество секретируемого парафина; B и D . количество восковых горшков и ячеек, построенных в клетке во время эксперимента. Заместительная терапия включала одно лечение JH-III в A и B и два последовательных курса лечения в C и D. Значения p суммируют результаты теста Краскела-Уоллиса; группы с разными буквами значительно различаются в апостериорном тесте Коновера (p <0,05)). Остальные детали как на рис.2.
https://doi.org/10.1371/journal.pone.0100650.g005
Влияние аллатэктомии на секрецию железы Дюфура (Опыт 1)
Общая секреция была сходной у аллатэктомированных, контрольных и ложно оперированных пчел (однофакторный дисперсионный анализ F = 0,51, p = 0,6, фиг. 6A). Однако фракция сложного эфира была выше у пчел без JH (CA-, n = 18) по сравнению с контрольной (n = 19) и фиктивной группами (n = 19; однофакторный дисперсионный анализ ANOVA F = 9,95, p <0,001, LSD апостериорный тест, p <0,01; рис.6Б). Уровни были аналогичными для контрольных пчел и пчел с ложной операцией (апостериорный тест LSD, p = 0,58). Эти результаты предполагают, что JH участвует в регуляции экзокринной активности железы Дюфура.
Рис. 6. Влияние аллатэктомии на количество эфиров в секрете железы Дюфура.
A. Общий объем секрета. Б . Относительное количество сложных эфиров из секрета железы Дюфура. Секрецию железы Дюфура анализировали в возрасте 7 дней с помощью газовой хроматографии / масс-спектрометрии (ГХ / МС).Показаны средние значения ± стандартная ошибка (SE), размер выборки в столбцах. Значение p суммирует результаты одностороннего дисперсионного анализа; группы с разными буквами значительно различаются в апостериорном ЛСД-тесте (p <0,05).
https://doi.org/10.1371/journal.pone.0100650.g006
Обсуждение
Наши результаты показывают, что JH необходим для развития ооцитов и откладки яиц у рабочих B. terrestris и, следовательно, является наиболее убедительным подтверждением гипотезы о том, что JH функционирует как гонадотропин у шмелей B.Территория . Эти результаты для шмелей контрастируют с доказательствами того, что у медоносных пчел JH не выполняет аналогичную функцию, и высвечивают эволюционную загадку, связанную с ролью сигнальных путей JH в эволюции социальности пчел.
Наши результаты подтверждают и расширяют предыдущие исследования, показывающие положительную корреляцию между JH и развитием ооцитов у B. terrestris , а также ускорение роста ооцитов у пчел, получавших JHI, JHIII или аналоги JH [28], [29], [ 32], [33], [44], [45].Настоящее исследование — первое, которое включает в себя манипуляции, которые снижают уровни JH и, таким образом, демонстрируют, что JH необходим для размножения шмелей. Титры JH гемолимфы были строго снижены у аллатэктомированных пчел (рис. 1), что показывает эффективность протокола удаления CA и позволяет предположить, что CA-железы являются единственным источником JH у шмелей, как это было также показано для других насекомых [46]. . Во всех проведенных экспериментах у аллатэктомированных пчел были неразвитые яичники, содержащие только ооциты на базальных стадиях развития (рис.2A, 2C, фиг. S1). Это открытие примечательно, учитывая, что пчелы содержались в небольших группах без маток, в социальной среде, в которой развитие яичников обычно происходит быстро [28], [43], [47] — [49]. Более сильное влияние двух методов лечения по сравнению с одной заменой JH (рис. 2) показывает, что ингибирование развития ооцитов у аллатэктомированных пчел было связано с отсутствием JH, а не другими факторами, которые могли быть скомпрометированы операцией аллатэктомии. Аллатэктомированные пчелы также показали пониженные уровни транскрипта Vg в жировом теле и уровни белка в гемолимфе; восстановление этих сокращений заместительной терапией (рис.3) согласуются с гипотезой о том, что JH регулирует оогенез, активируя продукцию белка желтка Vg в жировом теле [10]. Сильное и противоположное влияние аллатэктомии и заместительной терапии на экспрессию Kr-h2 в жировом теле позволяет предположить, что этот фактор транскрипции опосредует, по крайней мере, часть влияний JH на жировое тело. Эта предпосылка также согласуется с исследованиями, показывающими, что JH стимулирует экспрессию в мозге Kr-h2 в B.terrestris [33] (неопубликованные данные Шпиглера и Блоха) и что он является каноническим компонентом сигнальных путей JH у насекомых [50] — [53]. Основываясь на этих находках, мы предполагаем, что в B. terrestris JH регулирует оогенез путем активации транскрипции Vg в жировом теле в сигнальном пути, включающем JH-чувствительный фактор транскрипции Kr-h2 . После этой транскрипционной активации белок VG высвобождается в гемолимфу и транспортируется к яичникам, в которых он откладывается в развивающихся ооцитах.Еще предстоит определить, участвует ли JH также в дополнительных процессах (например, поступление Vg в развивающиеся фолликулы), которые необходимы для развития ооцитов [10], [11].
Наше исследование также показывает, что влияние JH на размножение шмелей не ограничивается активацией яичников. Секреция воска была серьезно нарушена у аллатэктомированных пчел, и это было частично вылечено заместительной терапией с двумя обработками JH (рис. 5C, 5D). Шмели используют воск, который они выделяют, для создания горшков и клеток, в том числе яиц и клеток расплода, поэтому секрецию воска необходимо координировать с другими видами репродуктивной деятельности.Действительно, аллатэктомированные пчелы не строили горшков и восковых клеток (Рис. 5 и Рис. S3). Еще предстоит определить, отражает ли это прямое влияние JH на восковые железы или косвенное влияние, опосредованное факторами, секретируемыми развивающимся ооцитом. Неспособность двух заместительных обработок JH восстановить секрецию парафина до уровней, наблюдаемых у контрольных пчел, можно объяснить влиянием операции аллатэктомии, не опосредованной JH, или относительно низкой чувствительностью восковых желез к JH (и, следовательно, более высокой Доза JH необходима для полного выздоровления).JH, по-видимому, участвует в регулировании дополнительной экзокринной функции, химии железы Дюфура. Железа Дюфура участвует в различных функциях у медоносных пчел, включая кастовые феромоны [54], [55] и передачу сигналов фертильности [56] — [58]. Уровни сложных эфиров в секрете положительно связаны с развитием яичников у репродуктивных работников [56]. В отличие от B. terrestris высокие уровни эфиров в железах Дюфура положительно коррелируют с низким репродуктивным состоянием [40], [59], [60].Наши данные о том, что железы Дюфура аллатэктомированных пчел содержат более высокую долю эфиров по сравнению с контрольными пчелами и пчелами с ложной операцией (рис. 6), предполагают, что JH влияет на сложноэфирно-биосинтетическую активность желез Дюфура. Взятые вместе, наши эксперименты подтверждают идею о том, что JH координирует функции различных тканей и множества физиологических систем, связанных с воспроизводством у шмелей. Это похоже на функции JH у других насекомых, у которых он является основным гонадотропином [7], [10].
Мощная манипуляция уровнями циркулирующего JH с помощью аллатэктомии и заместительной терапии позволяет нам впервые всесторонне сравнить функции JH у взрослых медоносных пчел ( A. mellifera ) и шмелей ( B. terrestris ). Наиболее очевидное различие между двумя видами пчел — это влияние JH на фертильность самок. Принимая во внимание, что мы ясно показываем здесь, что JH необходим для развития и размножения ооцитов у шмелей, аналогичные манипуляции с уровнями JH не повлияли на фертильность взрослых самок медоносных пчел (см. Введение; [12], [14], [15].Эти результаты также контрастируют с исследованиями, показывающими, что у взрослых медоносных пчел JH подавляет уровни Vg [17] — [19]. Что касается медоносной пчелы, есть данные, свидетельствующие о том, что основная физиологическая функция Vg у рабочих — это регулирование поведения медсестер, а не фертильности. К ним относятся Vg , функционирующий как эндокринный сигнал и как богатый источник белка для производства маточного молочка в гипофарингеальных железах [18]. Дополнительное различие заключается во влиянии JH на секрецию и переработку парафина.В отличие от наших результатов, предполагающих, что JH влияет на секрецию воска у B. terrestris , у медоносной пчелы аналогичная аллатэктомия и лечение JH-III не влияли на начало образования воска или количество произведенного воска [61]. Эти два вида также, по-видимому, различаются по участию JH в регуляции разделения труда. У медоносных пчел высокие уровни JH коррелируют с их поведением в поисках пищи; лечение JH, аналогами JH или имитаторами JH ускоряется, тогда как аллатэктомия задерживает переход от кормления к кормодобывающей деятельности [21], [22], [41], [62].Влияние JH на разделение труда у шмелей не изучалось с подобными деталями, но доступная литература [35], [36] и наши неопубликованные результаты (Siegel, Shpigler, Huang и Bloch, неопубликованные данные) предполагают, что JH не влияет на кормление или кормление у B. terrestris .
Не все влияния JH различаются между шмелями и медоносными пчелами. Например, у обоих видов JH увеличивает экспрессию фактора транскрипции Kr-h2 .Наше исследование, показывающее, что JH активирует экспрессию Kr-h2 в жировом теле шмеля, согласуется с предыдущими исследованиями, показавшими аналогичную активацию в мозге как медоносной пчелы, так и B. terrestris [33], [63], [64] . Также интересно отметить, что, несмотря на многие различия во влиянии JH на социальную физиологию B. terrestris и A. mellifera , регуляция титров JH в окружающей среде обнаруживает заметное сходство [2]. Присутствие матки подавляет биосинтез ЮГ и титры гемолимфы у рабочих медоносных пчел [65], [66] и шмелей [28], [43], [44], [48], [67].У обоих видов уровни JH у молодых рабочих также подавляются в присутствии более старых ( A. mellifera ; например, [68]) или доминантных ( B. terrestris ; [29], [49], [69]) ) рабочие.
Эволюция сложных черт, таких как те, которые связаны с развитой эусоциальностью, может потребовать многочисленных модификаций во многих тканях и в путях, контролирующих морфологические, физиологические и поведенческие процессы. Интегративный и координирующий характер эндокринной системы делает ее очень подходящей для приспособления к этим глубоким изменениям, которые могут потребоваться в течение относительно короткого эволюционного периода.Наше исследование, показывающее, что в отличие от медоносной пчелы, у шмеля B. terrestris JH регулирует репродуктивную физиологию, подтверждает более ранние предположения о том, что эволюция развитой эусоциальности у медоносных пчел была связана с серьезной модификацией передачи сигналов JH [5], [ 24] — [26]. Наше исследование закладывает основу для раскрытия молекулярных основ этих эволюционных модификаций сигнальных путей JH. Модификация в передаче сигналов JH в ходе эволюции развитой социальности может быть не уникальной для медоносных пчел, потому что есть доказательства связи между уровнями JH и разделением труда, а не состоянием яичников, а также у ранее эусоциальных муравьев и ос, у которых эусоциальность развивалась независимо от пчел [2].
Дополнительная информация
Рисунок S1.
Выживание пчел в эксперименте 1–3. День 1 — день вскрытия; пчелы, выжившие в первый день, были разделены на группы на 2-й день. На 7-й день пчел собирали для анализа. CA- = аллатэктомированные пчелы; Sham = ложные оперированные пчелы; CA- + JH = CA- пчелы с заместительной терапией. График показывает, что большая часть смертности аллатэктомированных пчел произошла в первые сутки после вскрытия.
https: // doi.org / 10.1371 / journal.pone.0100650.s001
(TIF)
Благодарности
Мы благодарим Яфита Бренера за помощь в сборе данных, Надава Яйона за изготовление хирургического стола, Алекса Кутового за помощь в биоинформатике и Гро В. Амдама за предоставление антител против AmVG. HS был поддержан докторской стипендией «Лидерство и ответственность Хоффмана» и наградой за постдокторскую стипендию Vaadia-BARD № FI-462-2012 от BARD.
Вклад авторов
Задумал и спроектировал эксперименты: HS GB.Проведены эксперименты: HS MC AJS. Проанализированы данные: HS. Предоставленные реагенты / материалы / инструменты анализа: ZYH EA AH. Написал бумагу: HS GB.
Список литературы
- 1. Вест-Эберхард MJ (2003) Пластичность развития и эволюция: Oxford University Press.
- 2. Блох Г., Шпиглер Х., Уиллер Д.Е., Робинсон Г.Е. (2009) Эндокринные влияния на организацию сообществ насекомых. Гормоны, мозг и поведение. 2-е изд. Сан-Диего: Academic Press. стр.1027–1068.
- 3. Уилсон EO (1971) Общества насекомых. Кембридж, Массачусетс: Belknap Press of Harvard University Press. 548 с.
- 4. Michener CD (1974) Социальное поведение пчел: сравнительное исследование. Кембридж, Массачусетс: Belknap Press. 404 с.
- 5. Робинсон Г.Е., Варго Е.Л. (1997) Ювенильный гормон у взрослых эусоциальных перепончатокрылых: гонадотропин и поведенческий кардиостимулятор. Arch Insect Biochem Physiol 35: 559–583.
- 6. Хартфельдер К. (2000) Ювенильный гормон насекомых: от «статус-кво» к высшему обществу.Braz J Med Biol Res 33: 157–177.
- 7. Риддифорд Л.М. (2008) Действие ювенильного гормона: перспектива 2007 года. J Insect Physiol 54: 895–901.
- 8. Де Луф А., Баггерман Дж., Брейер М., Клэйс И., Серстиенс А. и др. (2001) Гонадотропины у насекомых: обзор. Архивы биохимии и физиологии насекомых 47: 129–138.
- 9. Риддифорд Л.М. (2012) Как ювенильный гормон регулирует метаморфоз и размножение насекомых? Интегр Комп Биол 52: 477–484.
- 10. Wyatt GR, Davey KG (1996) Клеточные и молекулярные действия ювенильного гормона .2. Роль ювенильного гормона у взрослых насекомых. В: Эванс П.Д., редактор. Интегр Комп Биол, Том 26. С. 1–155.
- 11. Райхель А.С., Дхадиалла Т.С. (1992) Накопление белков желтка в ооцитах насекомых. Анну Преподобный Энтомол 37: 217–251.
- 12. Корона М., Веларде Р.А., Ремолина С., Моран-Лаутер А., Ван И и др. (2007) Вителлогенин, ювенильный гормон, передача сигналов инсулина и долголетие пчелиной матки.Proc Natl Acad Sci U S A 104: 7128–7133.
- 13. Robinson GE, Strambi C, Strambi A, Huang ZY (1992) Размножение рабочих медоносных пчел связано с низкими титрами ювенильных гормонов и скоростью биосинтеза. Gen Comp Endocrinol 87: 471–480.
- 14. Pinto LZ, Bitondi MMG, Simoes ZLP (2000) Ингибирование синтеза вителлогенина у рабочих Apis mellifera аналогом ювенильного гормона пирипроксифеном. J Insect Physiol 46: 153–160.
- 15.Энгельс В., Рамамурти П.С. (1976) Инициирование оогенеза у аллатэктомированных маток медоносных пчел путем обработки углекислым газом. J Insect Physiol 22: 1427–1432.
- 16. Гуидугли К.Р., Насименто А.М., Амдам Г.В., Барчук А.Р., Омхольт С. и др. (2005) Вителлогенин регулирует гормональную динамику в касте рабочих эусоциальных насекомых. FEBS Lett 579: 4961–4965.
- 17. Амдам Г.В., Омхольт С.В. (2003) Переход пчел от улья к собирателям в семьях медоносных пчел: гипотеза двойного репрессора.Дж. Теор Биол 223: 451–464.
- 18. Амдам Г. В., Норберг К., Хаген А., Омхольт С. В. (2003) Социальная эксплуатация вителлогенина. Proc Natl Acad Sci U S A 100: 1799–1802.
- 19. Amdam GV, Simoes ZLP, Guidugli KR, Norberg K, Omholt SW (2003) Нарушение функции гена вителлогенина у взрослых медоносных пчел путем внутрибрюшной инъекции двухцепочечной РНК. BMC Biotechnol 3.1: 1.
- 20. Nelson CM, Ihle KE, Fondrk MK, Page RE, Amdam GV (2007) Ген вителлогенин оказывает множество координирующих эффектов на социальную организацию.PLoS Biol 5: 673–677.
- 21. Робинсон Г.Е. (1985) Влияние аналога ювенильного гормона на пищевое поведение медоносных пчел и выработку феромонов тревоги. J Insect Physiol 31: 277–282.
- 22. Sullivan JP, Jassim O, Fahrbach SE, Robinson GE (2000) Ювенильный гормон влияет на поведенческое развитие взрослой медоносной пчелы. Хорм Поведение 37: 1–14.
- 23. Робинсон Г.Е. (1992) Регулирование разделения труда в сообществах насекомых. Анну Преподобный Энтомол 37: 637–665.
- 24. Хартфельдер К., Энгельс В. (1998) Социальный полиморфизм насекомых: гормональная регуляция пластичности в развитии и размножении медоносной пчелы. Curr Top Dev Biol 40: 45–77.
- 25. Блох Г., Уиллер Д.Е., Робинсон Г.Е., Пфафф Д.В., Арнольд А.П. и др. (2002) Эндокринные влияния на организацию сообществ насекомых. Гормоны, мозг и поведение Том третий: 195–235.
- 26. Вест-Эберхард М.Дж. (1996) Общества ос как микрокосм для изучения развития и эволюции.Естественная история и эволюция бумажных ос: 290–317.
- 27. Василевски О., Войцехович Т., Гейдаш К., Кришнан Н. (2011) Влияние метопрена и температуры на прекращение диапаузы у взрослых самок зимующей одиночной пчелы, Osmia rufa L. J. Физиология насекомых 57: 1682–1688.
- 28. Bloch G, Borst DW, Huang ZY, Robinson GE, Hefetz A (1996) Влияние социальных условий на репродуктивное развитие, опосредованное ювенильным гормоном, у рабочих Bombus terrestris .Physiol Entomol 21: 257–267.
- 29. Bloch G, Borst DW, Huang ZY, Robinson GE, Cnaani J, et al. (2000) Титры ювенильных гормонов, биосинтез ювенильных гормонов, развитие яичников и социальная среда в Bombus terrestris . J Insect Physiol 46: 47–57.
- 30. Smith AR, Kapheim KM, Perez-Ortega B, Brent CS, Wcislo WT (2013) Уровни ювенильных гормонов отражают социальные возможности у факультативно эусоциальной потовой пчелы Megalopta genalis (Hymenoptera: Halictidae).Horm Behav 63: 1–4.
- 31. Bell WJ (1973) Факторы, контролирующие начало вителлогенеза у примитивно социальной пчелы, Lasioglossum-zephyrum (Hymenoptera — halictidae). Насекомые Soc 20: 253–260.
- 32. Röseler PF (1977) Ювенильный гормональный контроль оогенеза у рабочих шмелей, Bombus-terrestris . J Insect Physiol 23: 985–992.
- 33. Шпиглер Х., Патч Х.М., Коэн М., Фан Ю.Л., Грозингер С.М. и др. (2010) Фактор транскрипции , гомолог Крюппеля 1 , связан с опосредованной гормонами социальной организацией пчел.BMC Evol Biol 10: 120–133.
- 34. Röseler PF, Röseler I (1988) Влияние ювенильного гормона на метаболизм жирового тела у овариоэктомированных маток шмелей, Bombus-terrestris . Биохимия насекомых 18: 557–563.
- 35. Cameron SA, Robinson GE (1990) Ювенильный гормон не влияет на разделение труда в семьях шмелей (Hymenoptera, Apidae). Ann Entomol Soc Am 83: 626–631.
- 36. van Doorn A (1987) Исследования регуляции доминирующего поведения и разделения труда в колониях шмелей ( Bombus-terrestris ).Нет Дж. Зул 37: 255–276.
- 37. Йерушалми С., Боденхаймер С., Блох Г. (2006) Установленное в процессе развития ослабление циркадных ритмов связывает хронобиологию с социальной организацией пчел. J Exp Biol 209: 1044–1051.
- 38. Медлер Дж. Т. (1962) Морфометрические исследования шмелей. Ann Entomol Soc Am 55: 212–218.
- 39. Hagai T, Cohen M, Bloch G (2007) Гены, кодирующие предполагаемые белки, связывающие вынос / ювенильный гормон у медоносной пчелы (Apis mellifera), и модуляция по возрасту и ювенильному гормону гена, подобного выносу GB19811.Ins Biochem Mol Biol 37: 689–701.
- 40. Амсалем Э., Твеле Р., Франк В., Хефец А. (2009) Репродуктивная конкуренция у шмеля Bombus terrestris : рекламируют ли рабочие бесплодие? Proc R Soc Lond B Biol Sci 276: 1295–1304.
- 41. Хуанг З.Й., Робинсон Г.Е., Тобе С.С., Яги К.Дж., Страмби С. и др. (1991) Гормональная регуляция поведенческого развития медоносной пчелы основана на изменениях скорости биосинтеза ювенильного гормона. J. Физиология насекомых 37: 733–741.
- 42. Блох Г., Тома Д.П., Робинсон Г.Е. (2001) Поведенческая ритмичность, возраст, разделение труда и выражение периода в мозге медоносной пчелы. Журнал Биол Ритм 16: 444–456.
- 43. Duchateau MJ, Velthuis HHW (1989) Развитие яичников и яйцекладка у рабочих Bombus-terrestris . Entomol Exp Appl 51: 199–213.
- 44. Röseler PF, Röseler I (1978) Исследования по регулированию титра ювенильных гормонов у рабочих шмелей, Bombus-terrestris .J Insect Physiol 24: 707–713.
- 45. Bortolotti L, Rosetello C, Micciarelli Sbrenna A, Sbrenna G (2000) Влияние аналогов ювенильного гормона на поведение рабочих шмелей Bombus terrestris L. (Hymenoptera, Apidae). Жизнь сообщества насекомых 3: 85–90.
- 46. Гилберт Л.И., Болленбахер В.Е., Грейнджер Н.А. (1980) Эндокринология насекомых: регуляция эндокринных желез, титр гормонов и метаболизм гормонов. Анну Рев Физиол 42: 493–510.
- 47.Гева С., Хартфельдер К., Блох Г. (2005) Репродуктивное разделение труда, доминирование и уровни экдистероидов в гемолимфе и яичнике шмеля Bombus terrestris . J Insect Physiol 51: 811–823.
- 48. Резелер П.Ф. (1974) Сравнительные исследования оогенеза у рабочих шмелей ( B-terrestris L) в колониях королевских и бескариевых. Насекомые Soc 21: 249–274.
- 49. van Doorn A (1989) Факторы, влияющие на доминирующее поведение у рабочих шмелей без маток ( Bombus-terrestris ).Physiol Entomol 14: 211–221.
- 50. Каюкава Т., Татейши К., Шинода Т. (2013) Создание универсальной клеточной линии для анализа передачи сигналов ювенильного гормона в Tribolium castaneum. Sci Rep 3: 1–8.
- 51. Каюкава Т., Минакучи К., Намики Т., Тогава Т., Йошияма М. и др. (2012) Транскрипционная регуляция опосредованной ювенильным гормоном индукции гомолога 1 Krüppel, репрессора метаморфоза насекомых. Proc Natl Acad Sci U S A 109: 11729–11734.
- 52. Minakuchi C, Namiki T, Shinoda T (2009) Гомолог Krüppel 1 , ген ответа на ранний ювенильный гормон ниже толерантности к метопрену, опосредует его антиметаморфическое действие у красного мучного жука Tribolium castaneum. Дев Биол 325: 341–350.
- 53. Grozinger CM, Robinson GE (2007) Эндокринная модуляция гена, отвечающего за феромон, в мозге медоносной пчелы. J Comp Physiol A 193: 461–470.
- 54. Кацав-Гозанский Т., Сорокер В., Хефец А. (2000) Пластичность в кастовом биосинтезе экзокринной секреции у медоносной пчелы ( Apis mellifera ).J Insect Physiol 46: 993–998.
- 55. Кацав-Гозанский Т., Сорокер В., Ибарра Ф., Франк В., Хефец А. (2001) Секреция железы Дюфура пчелиной матки ( Apis mellifera ): феромон-дискриминатор яйца или сигнал матки? Behav Ecol Sociobiol 51: 76–86.
- 56. Малка О., Шниор С., Кацав-Гозанский Т., Хефец А. (2008) Агрессивная репродуктивная конкуренция среди безнадежно лишенных матки рабочих медоносных пчел, вызванная сигнализацией феромонов.
- 57.Кацав-Гозанский Т., Сорокер В., Франк В., Хефец А. (2003) Рабочие, откладывающие яйца медоносными пчелами, имитируют сигнал матки. Насекомые Soc 50: 20–23.
- 58. Дор Р., Кацав-Гозанский Т., Хефец А. (2005) Феромон железы Дюфура как надежный сигнал фертильности среди рабочих медоносной пчелы (Apis mellifera). Behav Ecol Sociobiol 58: 270–276.
- 59. Амсалем Э., Хефец А. (2010) Умиротворяющий эффект сигнализации бесплодия в соревнованиях за доминирование среди Bombus terrestris рабочих.Behav Ecol Sociobiol 64: 1685–1694.
- 60. Амсалем Э., Шпиглер Х., Блох Г., Хефец А. (2013) Секреция железы Дюфура, бесплодие и пищевое поведение: коррелированные черты поведения у рабочих шмелей. J. Физиология насекомых 59: 1250–1255.
- 61. Muller WJ, Hepburn HR (1994) Ювенильный гормон-III и секреция парафина у медоносных пчел ( Apis-mellifera-capensis ). J Insect Physiol 40: 873–881.
- 62. Робинсон Г.Е. (1987) Регулирование возрастного полиэтиизма медоносных пчел с помощью ювенильного гормона.Behav Ecol Sociobiol 20: 329–338.
- 63. Fussnecker B, Grozinger C (2008) Анализ роли экспрессии гена мозга Kr-h2 в поведении медоносных пчел при кормлении ( Apis mellifera ). Насекомое Mol Biol 17: 515–522.
- 64. Grozinger CM, Robinson GE (2002) Анализ микроматрицы экспрессии гена, опосредованной феромонами, в мозге медоносной пчелы. Интегр Комп Биол 42: 1237–1237.
- 65. Kaatz HH, Hildebrandt H, Engels W (1992) Праймерный эффект феромона матки на биосинтез ювенильного гормона у взрослых рабочих медоносных пчел.J Comp Physiol B 162: 588–592.
- 66. Pankiw T, Huang ZY, Winston ML, Robinson GE (1998) Феромон нижней челюсти королевы влияет на медоносную пчелу ( Apis mellifera L .), Питаясь онтогенезом и титрами ювенильных гормонов. J Insect Physiol 44: 685–692.
- 67. Röseler PF, Röseler I, van Honk CGJ (1981) Доказательства ингибирования активности телесных тел у рабочих Bombus-terrestris феромоном из нижнечелюстных желез цариц.Experientia 37: 348–351.
- 68. Huang ZY, Robinson GE (1992) Интеграция пчелиной семьи — взаимодействие рабочего и рабочего опосредует гормонально регулируемую пластичность в разделении труда. Proc Natl Acad Sci U S A 89: 11726–11729.
- 69. Блох Г., Хефец А. (1999) Регулирование воспроизводства доминирующими рабочими в колониях королевских шмелей ( Bombus terrestris ). Behav Ecol Sociobiol 45: 125–135.
5. Гонадотропные гормоны
5.Гонадотропные гормоны5.1 Изоляция
5.2 Химия и иммунологические свойства
5.3 Один гонадотропин против двух
5.4 Плазменный гонадотропин профили
Гонадотропные гормоны (GtH) были изолированы с различной степенью чистоты из гипофиза нескольких костистых рыб, включая некоторые культивируемые виды, такие как карп обыкновенный, Cyprinus carpio (Burzawa-Gérard, 1971, 1974; Idler and Ng, 1979), чавычи, Oncorhynchus tshawytscha (Donaldson et al., 1972b; Pierce, Faith and Donaldson, 1976), сом, Heteropneustes fossilis (Sundararaj and Samy, 1974), осетр, Acipenser , stellatus (Burzawa-Gérard, Goncharovum, bontaine, 1975 и Fontaine). лосось, Oncorhynchus keta (Idler, Hwang and Bazar, 1975; Idler, Bazar and Hwang, 1975a, b; Yoneda, Yamazaki, 1976; Yoneda, Yamazaki, Ishihara, 1977; Ng and Idler, 1978b; Idler and Hwang, 1978b; Idler, , 1978; Idler and Ng, 1979), радужная форель, Salmo gairdneri (Breton, Jalabert and Reinaud, 1976), тилапия, Sarotherodon (Tilapia) mossambicus 910koff, 1977) и Mossambicus (Farmer) и Американская камбала, Hippoglossoides platessoides (Ng and Idler, 1978a, 1979), зимняя камбала, Pseudopleuronectes americanus (Ng and Idler, 1978a, 1979) и еще одна тилапия, Sarotherodon32) спирулус 9103 3 (Хайдер, Шах и Хартри, 1979).Кроме того, на гель-хроматографии были подвергнуты экстракты гипофиза белого амура, Ctenopharyngodon idella, пестрого амура, Aristichthys nobilis и сома, Heteropneustes fossilis, fossilis, fossilis, фракции получены; из них вторая фракция обладает гонадотропной активностью (Sinha, 1969, 1971; Sundararaj, Anand and Sinha, 1972; Nath and Sundararaj, 1977). Hattingh и du Toit (1973) и Haider and Blüm (1977), используя гипофизарный материал из ила, Labeo umbratus и золотой рыбки, соответственно, разделили электрофорезом в полиакриламидном геле две фракции, обладающие гонадотропной активностью.
Гонадотропины рыб являются гликопротеинами по своей природе (Fontaine and Burzawa-Gérard, 1978; Idler and Ng, 1979; Fontaine, 1980). Аминокислотный состав гонадотропинов карпа (Burzawa-Gérard, 1974; Idler and Ng, 1979), осетра (Burzawa-Gérard, Goncharov and Fontaine, 1975b), камбалы (Ng and Idler, 1979), радужной форели (Breton, Jalabert and Reinaud, 1976), и тилапия (Farmer and Papkoff, 1977), демонстрирует большое сходство с лютеинизирующим гормоном млекопитающих. Гонадотропины карпа, осетра и форели состоят каждый из двух субъединиц, альфа- и бета-цепей; аминокислотный и углеводный составы, длинные N-концевые последовательности и C-концевые аминокислоты двух субъединиц GtH карпа были определены (Jolles et al., 1977). Была продемонстрирована значительная степень гомологии между двумя субъединицами GtH карпа с субъединицами фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ) млекопитающих, и, кроме того, бета-субъединица GtH карпа более тесно связана с бета-субъединицей ЛГ, чем ФСГ (Fontaine and Burzawa-Gérard, 1978; Fontaine, 1980).
Тан и Додд (1978) изучали иммунологическое родство гонадотропинов у 35 видов костистых рыб, используя гомологичный радиоиммуноанализ лосось-лосось и гетерологичный радиоиммуноанализ лосось-карп.В гомологичном радиоиммуноанализе большинство протестированных видов лососей, за исключением пована и айу, перекрестно реагируют таким же образом, как и стандартные гормоны, тогда как виды, не являющиеся лососями, перекрестной реакции не показали. В гетерологичном радиоиммуноанализе все карповые и лососевые, за исключением ayu, дали кривые ингибирования, параллельные стандартному гонадотропину карпа. Таким образом, иммунологические свойства гонадотропинов рыб не соответствуют известным филогенетическим отношениям рыб. Изучение иммунологических свойств гипофизарного GtH и его субъединиц от рыб до млекопитающих дает дополнительные доказательства гомологии между гликопротеинами гипофиза рыб и млекопитающих, указывающие на эволюционное сходство между субъединицами одного и того же типа (Fontaine and Burzawa-Gérard, 1978; Burzawa-Gérard, Dufour and Фонтейн, 1980).Burzawa-Gérard и Fontaine (1976) создали гибридную молекулу, содержащую альфа-субъединицу GtH крупного рогатого скота и бета-субъединицу карпа, которая намного более эффективна в тесте на спермию амфибий; Интересно, что обратная гибридная молекула не действует ни на млекопитающих, ни на карпа.
Количество гонадотропинов, присутствующих в гипофизе рыб, часто обсуждается, обсуждается и до сих пор остается спорным. Более ранние исследования поддерживали гипотезу одного гормона (Burzawa-Gérard, 1971, 1974; Donaldson et al., 1972b; Fontaine, 1975, 1980), поскольку единственный гонадотропин, выделенный из гипофизов лосося и карпа, может вызывать полный гаметогенез, включая созревание ооцитов и образование сперматозоидов у гипофизэктомированных реципиентов (Donaldson, 1973; Billard, Burzawa-Gérard and Breton, 1970; Sundararaj et al., 1976). В 1975 году Idler и его сотрудники (Idler, Bazar and Hwang, 1975a, b) с помощью аффинной хроматографии сообщили о наличии более чем одного полоспецифичного гонадотропина в гипофизе кеты.Breton, Prunet и Reinaud (1978) подтвердили вышеупомянутое наблюдение на чавычи лосося, где гонадотропин, выделенный из мужских желез, более эффективен на семенниках, чем на яичниках, в то время как обратное верно для гонадотропинов, специфичных для самок. Сундарарадж и Сами (1974) приняли процедуры очистки, используемые для выделения гонадотропина млекопитающих, где сульфат аммония при 50-процентном насыщении, как известно, осаждает ЛГ млекопитающих, в то время как полное насыщение требуется для осаждения ФСГ (Papkoff et al., 1965; Papkoff, Gospodarowicz and Li, 1967) сома, Heteropneustes fossilis , гипофизарный материал. LH-подобный препарат с расширением. получена способность вызывать созревание и овуляцию у сома; осадок, полученный после полного насыщения, не активен в анализе овуляции сома. Однако он не тестировался на вителлогенную активность у сомов. Фармер и Папкофф (1977) получили гонадотропин из гипофиза тилапии, Sarotherodon (Tilapia) mossambicus , следуя процедурам очистки, используемым для выделения гонадотропинов млекопитающих.Они сообщили о LH-подобном гонадотропине, который стимулирует в vitro выработку тестостерона в клетках Лейдига крыс; О биологической активности другого препарата, который фракционируется идентично ФСГ млекопитающих и не млекопитающих, не сообщается. Их работа показывает, что если гипофиз рыб вырабатывает два гонадотропина, соответствующие ФСГ и ЛГ млекопитающих, то выделенный материал представляет собой ЛГ костистых животных. Хайдер, Шах и Хартри (1979) выделили из Sarotherodon (Tilapia) spirulus гипофиза мощную гонадотропную фракцию, способную индуцировать как сперматогенез, так и активность клеток Лейдига, которая по аналогии с млекопитающими будет содержать фракцию ФСГ; другая фракция не была столь же мощной.
Гликопротеиновая природа гонадотропина рыб была использована Idler и соавторами для удержания его на конканавалин A-сефарозе в некоторых недавних процедурах очистки (см. Campbell and Idler, 1976, 1977; Ng and Idler, 1978a, b, 1979; Idler and Ng, 1979). Недавно Ng и Idler (1979) и Idler and Ng (1979) выделили из гипофиза карпа, кеты, американской камбалы и зимней камбалы два гонадотропина, вителлогенный и гормон созревания.Фракция с низким содержанием углеводов, не обладающая сродством к конканавалин A-сефарозе, вызывает включение желтка в яичник озимой камбалы и ооциты форели в vitro , тогда как фракция с высоким содержанием углеводов, которая абсорбируется конканавалином A-сефарозой, вызывает созревание и овуляция. Кроме того, богатая углеводами фракция также обладает вителлогенной активностью в отношении самок камбалы (Idler and Ng, 1979). Вителлогенный гормон отличается от гормона созревания в.состав его белковой и углеводной частей. Были приготовлены антисыворотки к двум гонадотропным фракциям гипофиза кеты, способные блокировать гонадотропные действия в vivo (Ng, Campbell and Idler, 1980). Теперь вопрос состоит в том, чтобы определить, вырабатывает ли самец также два гонадотропина, как и самка.
Профили гонадотропинов в плазме были определены у радужной форели, ручейной форели, карпа, атлантического лосося, Salmo salar и нерки Oncorhynchus nerka с помощью специальных радиоиммуноанализов (см. Также раздел 2 о репродуктивных исследованиях). циклы и экологические подсказки).У лососевых обычно GtH секретируется в постепенно увеличивающихся количествах, чтобы стимулировать рецидивирование гонад, и резкое повышение уровня GtH происходит во время спермия или овуляции (Billard, Richard and Breton, 1977; Fostier et al. , 1978). Повышенные уровни GtH в плазме во время спермия и овуляции также наблюдаются у других видов (Peter and Crim, 1979).
Чувствительность гонад к GtH зависит от времени суток (de Vlaming and Vodicnik, 1977; Cook and Peter, 1980), и это может иметь некоторую связь с суточными колебаниями уровней GtH в плазме.Сообщалось о циркадных ритмических вариациях уровней GtH в плазме у золотых рыбок (Breton et , al. , 1972b; Peter and Hontela, 1978; Hontela and Peter, 1978). Циркадные ритмы в уровнях GtH почти отсутствуют или амплитуда меньше у самок золотой рыбки с половым регрессом, чем у новобранцев и беременных. Циркадные ритмы уровней GtH, по-видимому, важны для стимуляции активности гонад. Воздействие на золотых рыбок стимулирующих условий длительного фотопериода и высокой температуры повышает уровень GtH в плазме (Gillett, Billard and Breton, 1977; Gillet, Breton and Billard, 1978), а также вызывает большие циркадные колебания (Hontela and Peter, 1978).Поглощение введенного GtH из места инъекции в систему кровообращения у золотой рыбки выше при 20 ° C, чем при 12 ° C. Кроме того, более высокие температуры связаны с увеличением скорости метаболического клиренса введенного GtH у золотых рыбок (см. Cook and Peter, 1980). Таким образом, приведенные выше данные предполагают, что плохой успех в гипофизации основных индийских и китайских карпов (см.

 — 1969—1978
— 1969—1978 — 2000
— 2000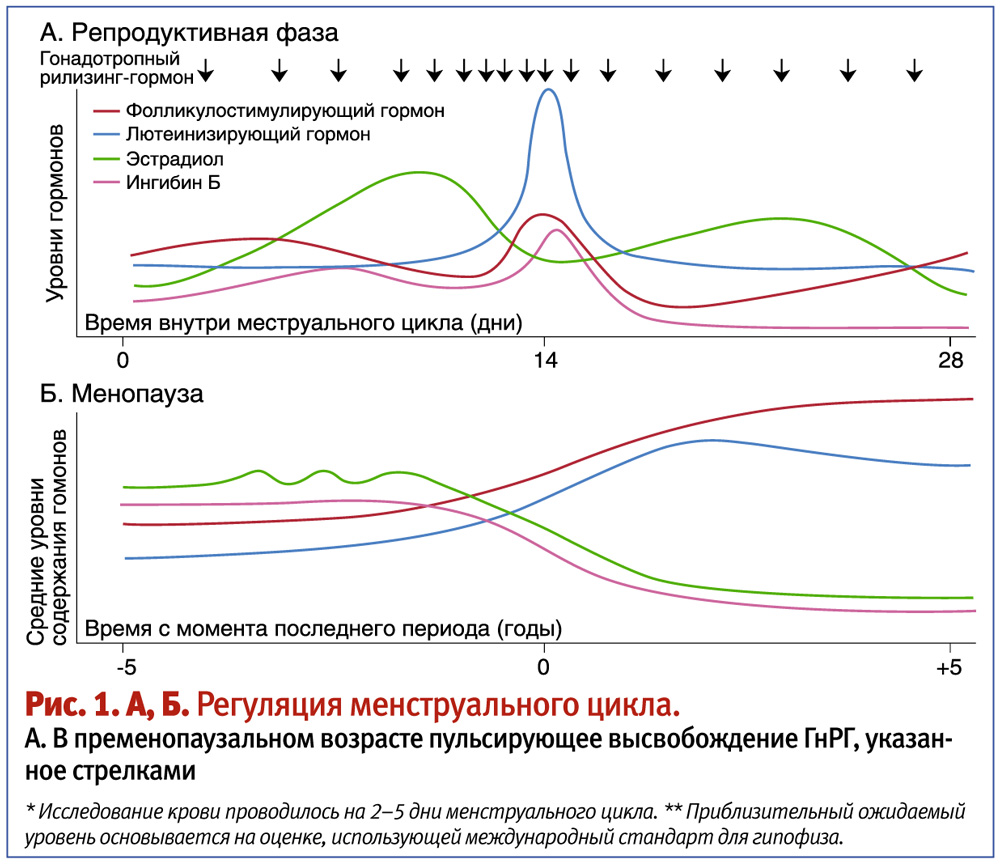

 Ведь именно он отвечает за пролиферацию эндометрия для подготовки к имплантации плодного яйца, поддерживает функциональную активность всех половых органов. А при его резком снижении речь идет не просто об эндокринном бесплодии, а уже о формировании менопаузы.
Ведь именно он отвечает за пролиферацию эндометрия для подготовки к имплантации плодного яйца, поддерживает функциональную активность всех половых органов. А при его резком снижении речь идет не просто об эндокринном бесплодии, а уже о формировании менопаузы.