Гликоген. Структура. Физические и химические свойства
1. Гликоген
Выполнилаученица 10 класса
Карпенко Екатерина
2. Гликоген
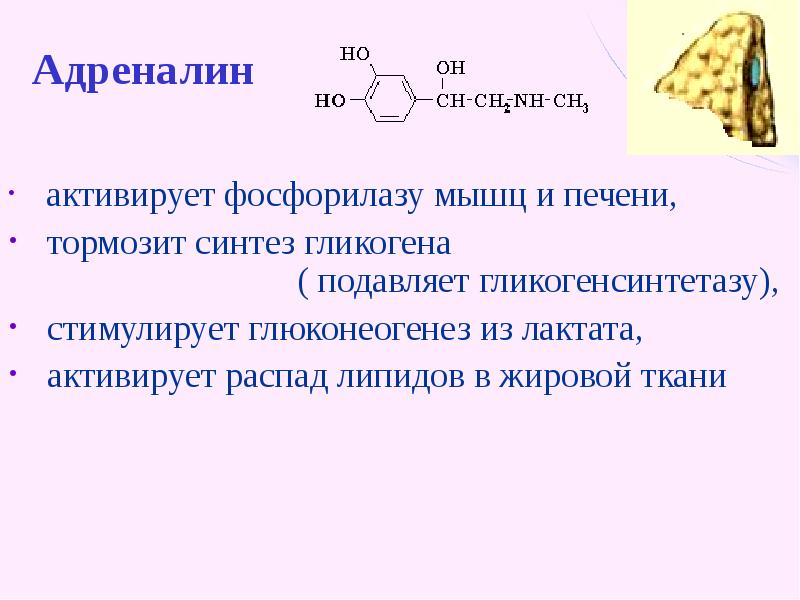
Гликоген — полисахарид состава (C6h20O5)n,образованный остатками глюкозы,
соединёнными связями α-1→4 (в местах
разветвления — α-1→6).
3. История
Гликоген был обнаружен Клодом Бернардом. Егоэксперименты показали, что в печени содержится
вещество, которое может привести к восстановлению
сахара под действием «фермента» в печени. К 1857
году он описал выделение вещества, которое он
назвал «la matière glycogène», или
«сахарообразующее вещество». Вскоре после
открытия гликогена в печени, А. Сансон обнаружил,
что мышечная ткань также содержит гликоген.
Эмпирическая формула для гликогена (C6h20O5)n
был установлен Кекуле в 1858 году.
4. Структура
Гликоген представляет собой разветвленныйбиополимер, состоящий из линейных цепей
глюкозных остатков с дальнейшими цепями,
разветвляющимися каждые 8-12 глюкоз или
около того. Глюкозы связаны линейно с помощью
следующей. Ветви связаны с цепями, от которых
они отделяются гликозидными связями α (1 → 6)
между первой глюкозой новой ветви и глюкозой
в цепочке стволовых клеток . Из-за того, как
синтезируется гликоген, каждая гликогенная
гранула имеет в своем составе гликогениновый
белок. Гликоген в мышцах, печени и жировых
клетках хранится в гидратированной форме,
состоящей из трех или четырех частей воды на
часть гликогена, связанной с 0,45 миллимолями
калия на грамм гликогена.
5. Физические свойства
Очищенный гликоген – белый аморфный порошок.Растворяется в воде с образованием опалесцирующих растворов,
спиртом или (Nh5)2SO4 (сульфат аммония).
Гликоген – полимолекулярный полисахарид с широким
молекулярно-массовым распределением.
 Молекулярная масса
Молекулярная массаобразцов гликогена, выделенного из различных природных
источников, варьирует в пределах М= 103- 107кДа. Молекулярномассовое распределение гликогена зависит от функционального
состояния ткани, времени года и др. факторов.
Гликоген является оптически активным полисахаридом.
Характеризуется положительной величиной удельного
оптического вращения .
6. Химические свойства
Гликоген довольно устойчив к действиюв водных растворах кислот.
Гидролиз гликогена в кислой среде.
Промежуточными продуктами реакции являются
декстрины, конечным продуктом – α-D-глюкоза:
Ферментативная деструкция гликогена. Ферменты,
расщепляющие гликоген называются фосфорилазами.
Фосфорилаза была обнаружена в мышцах и в других
тканях животных.
7. В организме ферментативная биодеградация гликогена протекает по двум направлениям.
В процессе пищеварения под действием ферментов амилазпроисходит гидролитическое расщепление гликогена, содержащегося в
поступившей в организм пище. Процесс начинается в ротовой полости
и заканчивается в тонком кишечнике(при рН = 7 — 8) с образованием
поступает в кровь. Избыток глюкозы в крови приводит к ее участию в
биосинтезе гликогена, который и откладывается в тканях различных
органов.
В клетках тканей также возможно гидролитическое расщепление
гликогена, но оно имеет меньшее значение. Основной путь
внутриклеточного превращения гликогена – фосфоролитическое
расщепление, происходящее под влиянием фосфорилазы и
приводящее к последовательному отщеплению от молекулы гликогена
остатков глюкозы с одновременным их фосфорилированием.
Образующийся при этом глюкозо-1-фосфат может вовлекаться в
процесс гликогенолиза.
8. Качественная реакция гликогена
Водные растворы гликогенаокрашиваются йодом в фиолетовокоричневый – фиолетово-красный
цвет с максимумом поглощения
зависимости А = f(λ) при длине
волны λмах= 410 — 490 нм.

9. Получение
Гликоген из тканей биомассы животного происхождения можно выделитьэкстракцией кипящим 60%-ным водным раствором щелочи, водой или
разбавленным холодным раствором трихлоруксусной кислоты. В последнем
случае получаются препараты гликогена с высоким значением молекулярной
массы и с узким молекулярно-массовым распределением. Поскольку
трихлоруксусная кислота осаждает белки, в получаемом экстракте
дальнейшем раствор очищают различными способами: диализом,
хроматографическими методами и др. Гликоген из очищенного экстракта
получают избирательным осаждением этиловым спиртом. Полученный
препарат гликогена повторно растворяют в трифторуксусной кислоте и
переосаждают спиртом. Получаемый в данных условиях гликоген частично
деструктирует. Нативный гликоген выделяют из биомассы экстракцией водой
на холоду в присутствии солей Hg.
10. Баланс гликогена
В организме человека может содержаться до 450 г гликогена,треть из которого накапливается в печени, а остальное –
главным образом в мышцах. Содержание гликогена в других
Гликоген печени служит прежде всего для поддержания
уровня глюкозы в крови в фазе пострезорбции. Поэтому
содержание гликогена в печени варьирует в широких пределах.
При длительном голодании оно падает почти до нуля, после
чего начинается снабжение организма глюкозой с помощью
глюконеогенеза.
Гликоген мышц служит резервом энергии и не участвует в
регуляции уровня глюкозы в крови. В мышцах отсутствует
глюкозо-6-фосфатаза, поэтому гликоген мышц не может быть
источником глюкозы в крови. По этой причине колебания
содержания гликогена в мышцах меньше, чем в печени.
11. Биологическая роль
Гликоген является резервным питательным материалом,низкомолекулярных углеводов.
 Гликоген пополняет убыль сахара в
Гликоген пополняет убыль сахара вкрови, т.е. поддерживает его процентное содержание на
определенном более или менее постоянном уровне. Функция
мышечного гликогена заключается в предоставлении гексозных
единиц, используемых в ходе гликолиза. Гликоген печени
используется главным образом для поддержания физиологических
концентраций глюкозы в крови, прежде всего в промежутках между
приемами пищи. Через 12 — 18 ч после приема пищи запас гликогена
гликогена заметно снижается после продолжительной и
напряженной физической работы.
Нарушение обмена гликогена приводит к заболеваниям
(гликогенозам), связанным с накоплением этого полисахарида в
организме в больших количествах (главным образом в печени и
сердце), что приводит к образованию молекул с отклонениями в
строении (мутагенез).
Гликоген — свойства, получение и применение
Гликоген — полисахарид составаn, образованный остатками глюкозы, соединёнными связями α-1→4. В клетках животных служит основным запасным углеводом и основной формой хранения глюкозы. Откладывается в виде гранул в цитоплазме в клетках многих типов.
| Гликоген | |
|---|---|
| Хим. формула | C24H42O21 и (C6H10O5)ₙ |
| Рег. номер CAS | 9005-79-2 |
| PubChem | 439177 |
| Рег. номер EINECS | 232-683-8 |
| SMILES |
C(C1C(C(C(C(O1)OCC2C(C(C(C(O2)OC3C(OC(C(C3O)O)O)CO)O)O)OC4C(C(C(C(O4)CO)O)O)O)O)O)O)O |
| InChI |
1S/C24h52O21/c25-1-5-9(28)11(30)16(35)22(41-5)39-4-8-20(45-23-17(36)12(31)10(29)6(2-26)42-23)14(33)18(37)24(43-8)44-19-7(3-27)40-21(38)15(34)13(19)32/h5-38H,1-4h3/t5-,6-,7-,8-,9-,10-,11+,12+,13-,14-,15-,16-,17-,18-,19-,20-,21+,22+,23-,24-/m1/s1 BYSGBSNPRWKUQH-UJDJLXLFSA-N |
| ChEBI | 28087 |
| ChemSpider | 388322 |
Описание
Гликоген иногда называют животным крахмалом, так как его строение похоже на амилопектин — компонент растительного крахмала.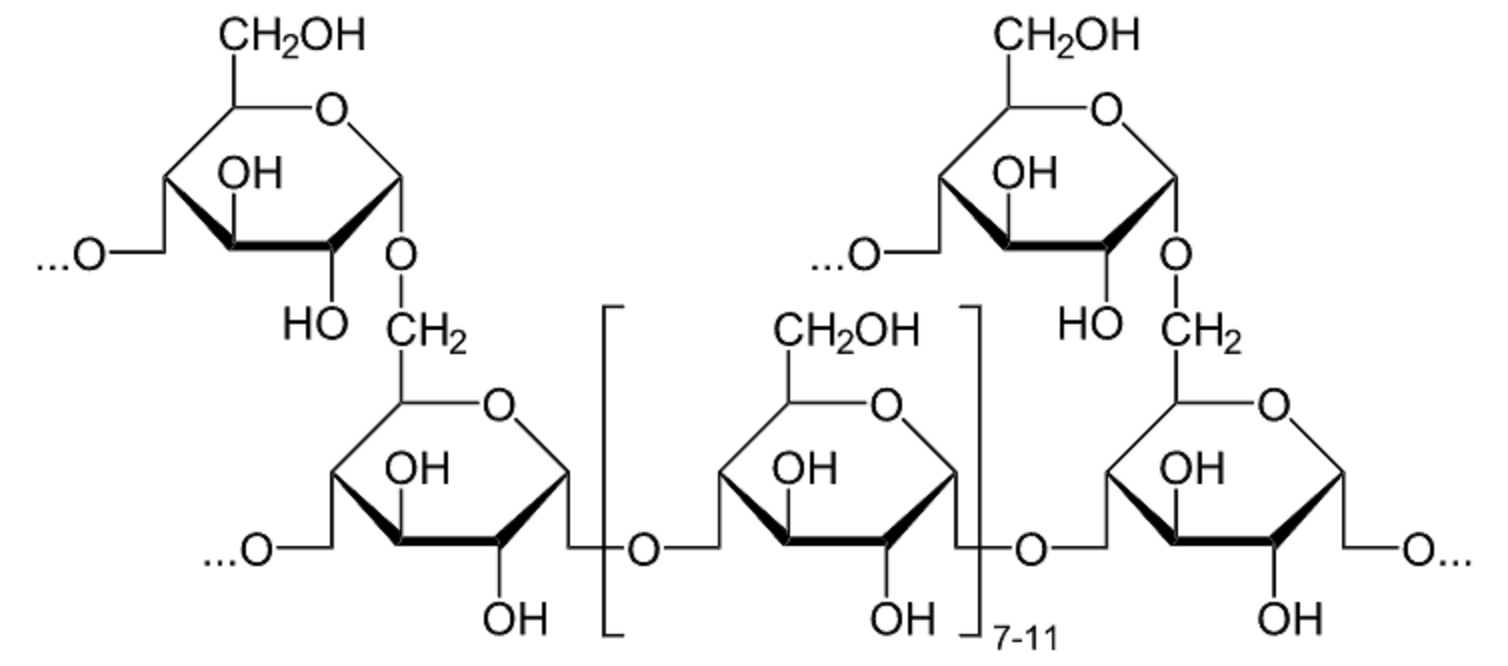 Отличается от крахмала более разветвлённой и компактной структурой, не дает синего цвета при окраске йодом.
Отличается от крахмала более разветвлённой и компактной структурой, не дает синего цвета при окраске йодом.
Гликоген образует энергетический резерв, который может быть быстро мобилизован при необходимости восполнить внезапный недостаток глюкозы. Гликогеновый запас, однако, не столь ёмок в калориях на грамм, как запас триглицеридов (жиров). Только гликоген, запасённый в клетках печени (гепатоциты), может быть переработан в глюкозу для питания всего организма. Содержание гликогена в печени при увеличении его синтеза может составить 5-6 % от массы печени. Общая масса гликогена в печени может достигать 100—120 граммов у взрослых. В мышцах гликоген перерабатывается в глюкозу исключительно для локального потребления и накапливается в гораздо меньших концентрациях (не более 1 % от общей массы мышц), в то же время его общий мышечный запас может превышать запас, накопленный в гепатоцитах. Небольшое количество гликогена обнаружено в почках, и ещё меньшее — в определённых видах клеток мозга (глиальных) и белых кровяных клетках.
В качестве запасного углевода гликоген присутствует также в клетках грибов.
Он содержится во всех клетках и тканях организма животного в двух формах: стабильный гликоген, прочно связанный в комплексе с белками, и лабильный в виде гранул, прозрачных капель в цитоплазме.
При недостатке в организме глюкозы гликоген под воздействием ферментов расщепляется до глюкозы, которая поступает в кровь. Регуляция синтеза и распада гликогена осуществляется нервной системой и гормонами. Наследственные дефекты ферментов, участвующих в синтезе или расщеплении гликогена, приводят к развитию редких синдромов — гликогенозов.
Роль в спорте
Запасы гликогена в силу своей легкодоступности служат главным источником энергии для работающей мускулатуры. Однако запасы гликогена в мышцах ограничены. Результатом недостатка гликогена может быть усталость и снижение результатов, а в перспективе — ослабление иммунитета и повышение риска заболеваний.
Баланс гликогена
В организме человека может содержаться до 450 г гликогена, треть из которого накапливается в печени, а остальное – главным образом в мышцах (рис.4). Содержание гликогена в других органах незначительно.
Рис.4.Схема, поясняющая баланс гликогена в живом организме. |
Гликоген печенислужит прежде всегодля поддержания уровня глюкозы в кровив фазе пострезорбции (см. рис.3). Поэтому содержание гликогена в печени варьирует в широких пределах. При длительном голодании оно падает почти до нуля, после чего начинается снабжение организма глюкозой с помощью глюконеогенеза.
Гликоген мышц служитрезервом энергиии не участвует в регуляции уровня глюкозы в крови (см. рис.3). В мышцах отсутствует глюкозо-6-фосфатаза, поэтому гликоген мышц не может быть источником глюкозы в крови. По этой причине колебания содержания гликогена в мышцах меньше, чем в печени.
Физические свойства
Очищенный гликоген – белый аморфный порошок. Растворяется в воде с образованием опалесцирующих растворов, в диметилсульфоксиде. Осаждается из растворов этиловым спиртом или (NH4)2SO4.
Гликоген – полимолекулярныйполисахарид с широким молекулярно-массовым распределением. Молекулярная масса образцов гликогена, выделенного из различных природных источников, варьирует в пределахМ= 103— 107кДа. Молекулярно-массовое распределение гликогена зависит от функциональногосостоянияткани, времени года и др. факторов.
Гликоген является оптически активным
полисахаридом. Характеризуется
положительной величиной удельного
оптического вращения
.
В таблице представлены такие важнейшие характеристики гликогена, выделенного из разных сырьевых источников, как молекулярная масса и удельное оптическое вращение водных растворов.
Таблица
Характеристика гликогена различных источников
Источник | Молекулярная масса М∙10-6 | Метод определенияМ | Оптическое вращение водных растворов , град |
Печень кошки Печень плода овцы Акула Простейшее Tetrachymena Моллюск Anodonta Моллюск Mutilus edulis Бактерии Aerobacter aerogenes Дрожжи | 10.0 14.8 3.6 9.8 6.1 3.8 9.2 2.4 | Светорассеяние Светорассеяние Светорассеяние Осмометрия Седиментация Седиментация Седиментация | +193 +196 +195 +195 +192 +196 +200 +198 |
Гликоген образует комплексы со многими
белками, например с альбумином и
конканавалином А.
Качественная реакция гликогена
Водные растворы гликогена окрашиваются йодом в фиолетово-коричневый – фиолетово-красный цвет с максимумом поглощения зависимости А = f(λ) при длине волны λмах= 410 — 490 нм.
Химические свойства
Гликоген довольно устойчив к действию концентрированных растворов щелочей. Гидролизуется в водных растворах кислот.
Гидролиз гликогена в кислой среде. Промежуточными продуктами реакции являются декстрины, конечным продуктом – α-D-глюкоза:
Ферментативная деструкция гликогена. Ферменты, расщепляющие гликоген называютсяфосфорилазами. Фосфорилаза была обнаружена в мышцах и в других тканях животных. Механизм реакции ферментативной деструкции гликогена см. в разделе «Метаболизм гликогена».
В организмеферментативная биодеградация гликогена протекает по двум направлениям.
В процессе пищеваренияпод действием ферментовамилазпроисходит гидролитическое расщепление гликогена, содержащегося в поступившей в организм пище. Процесс начинается в ротовой полости и заканчивается в тонкомкишечнике(при рН = 7 — 8) собразованиемдекстринов, а затеммальтозыиглюкозы. Образующаяся глюкоза поступает в кровь. Избыток глюкозы в крови приводит к ее участию в биосинтезе гликогена, который и откладывается в тканях различных органов.
В клетках тканейтакже возможно
гидролитическое расщепление гликогена,
но оно имеет меньшеезначение.
Основной путь внутриклеточногопревращениягликогена – фосфоролитическое
расщепление, происходящее под влияниемфосфорилазыи приводящее к последовательному
отщеплению отмолекулыгликогена остатков глюкозы с одновременным
ихфосфорилированием.
Образующийся при этом глюкозо-1-фосфат
может вовлекаться впроцессгликогенолиза.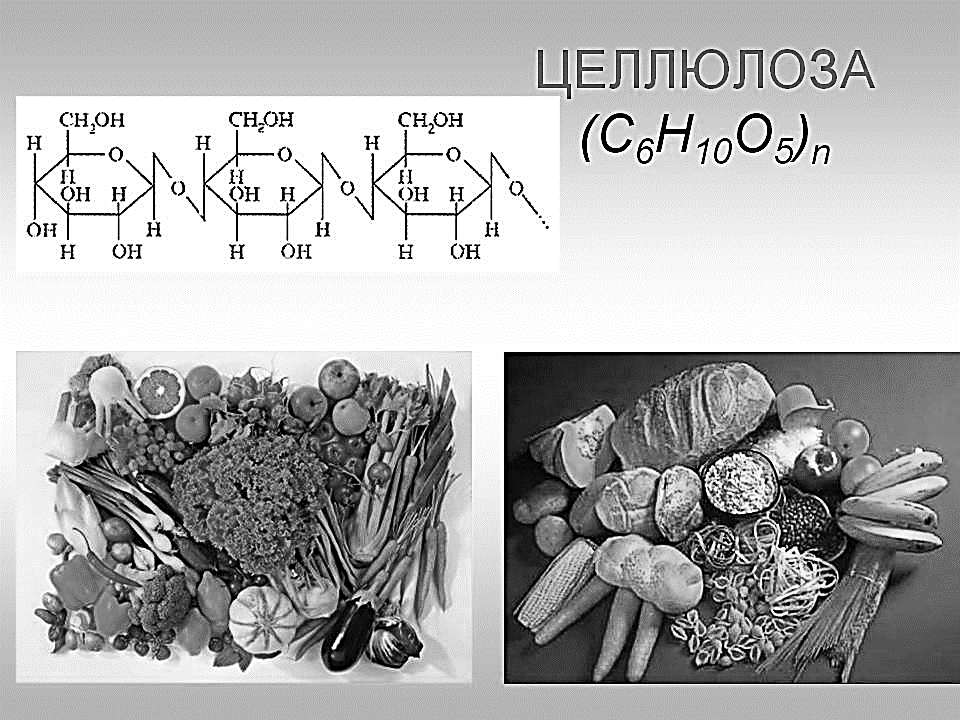
ХиМиК.ru — Гликоген (животный крахмал)
Гликоген (животный крахмал) — полисахарид (С6Н10О5)n животного организма. Его можно выделить путем обработки животных тканей 5—10%-ной трихлоруксусной кислотой на холоду с последующим осаждением извлеченного гликогена спиртом.
Все жизненные процессы сопровождаются гликолизом — биологическим расщеплением гликогена, приводящим к образованию молочной кислоты; для животных организмов гликоген является одним из важнейших источников энергии. Он содержится во всех клетках животного организма. Наиболее богаты гликогеном печень (у упитанных животных до 10—20% гликогена) и мышцы (до 4%). Он содержится также в некоторых низших растениях, например в дрожжах и грибах; крахмал некоторых высших растений по свойствам близок к гликогену.
Гликоген — белый аморфный порошок, растворяющийся в воде с образованием опалесцирующих растворов. Растворы гликогена дают с иодом окрашивание от винно-красного и красно-бурого до красно-фиолетового цвета (отличие от крахмала).
Окрашивание с иодом исчезает при кипячении раствора и вновь появляется при охлаждении. Гликоген оптически активен: удельное вращение [α]D=+ 196°. Он легко гидролизуется кислотами и ферментами (амилазами), давая в качестве промежуточных продуктов декстрины и мальтозу и при полном гидролизе превращаясь в глюкозу. Молекулярный вес гликогенов исчисляется миллионами.
Строение гликогена, так же как и строение компонентов крахмала, было выяснено главным образом при помощи метода метилирования в сочетании с изучением ферментативного расщепления. Полученные данные свидетельствуют о том, что гликоген построен по такому же типу, как и амилопектин.
Он представляет собой сильно разветвленную цепь, построенную из глюкозных остатков, соединенных главным образом связями α-1,4′; в точках ветвления имеются связи α-1,6′. Как показало изучение β-декстринов, образующихся при расщеплении гликогена β-амилазой, точки ветвления в центральных частях молекулы разделены лишь тремя-четырьмя глюкозными остатками; периферические цепи гликогена состоят в среднем из семи — девяти глюкозных остатков.
Как показало изучение β-декстринов, образующихся при расщеплении гликогена β-амилазой, точки ветвления в центральных частях молекулы разделены лишь тремя-четырьмя глюкозными остатками; периферические цепи гликогена состоят в среднем из семи — девяти глюкозных остатков.
β-Амилазой гликоген расщепляется обычно всего на 40—50%.
Гликоген еще более разветвлен, чем амилопектин. Строение молекулы гликогена можно изобразить схемой, приведенной на рис. 45, а строение части молекулы, обведенной на этой схеме четырехугольником, — формулой, приведенной ниже:
Гликоген, строение — Справочник химика 21
Гликоген, или животный крахмал, по составу и строению подобен крахмалу, накапливается в тканях, особенно в печени [c.173]Гликоген еще более разветвлен, чем амилопектин. Строение молекулы гликогена можно изобразить схемой, приведенной на рис. 45, а строение части молекулы, обведенной ва этой схеме четырехугольником, — формулой, приведенной ниже [c.712]
Гликоген имеет сходное строение, но его молекула более компактна и сильнее разветвлена. В. Строение точки ветвления цепи. [c.313]
Гликоген является резервным полисахаридом животных организмов. Он представляет собой разветвленный полисахарид, по строению близкий к амилопектину. Основная цепь его состоит из ангидридов глюкопиранозы, связанных а-глюкозидными связями в положении — -4, и содержит большое число ответвлений, присоединенных к основной цепи в положении 1- 6. Молекулярная масса гликогена колеблется от 300 ООО до 3 ООО ООО. [c.344]
По составу и строению гликоген подобен крахмалу и при гидролизе образует О-глюкозу но цепи его молекул, построенные из а-глюкопиранозных остатков, сильно разветвлены (еще больше, чем в амилопектине). Число циклических глюкозных звеньев в молекулах гликогена во много раз больше, чем в крахмале (6000— 24 ООО), и молекулярная масса его значительно выше (1 ООО ООО— 4 ООО ООО).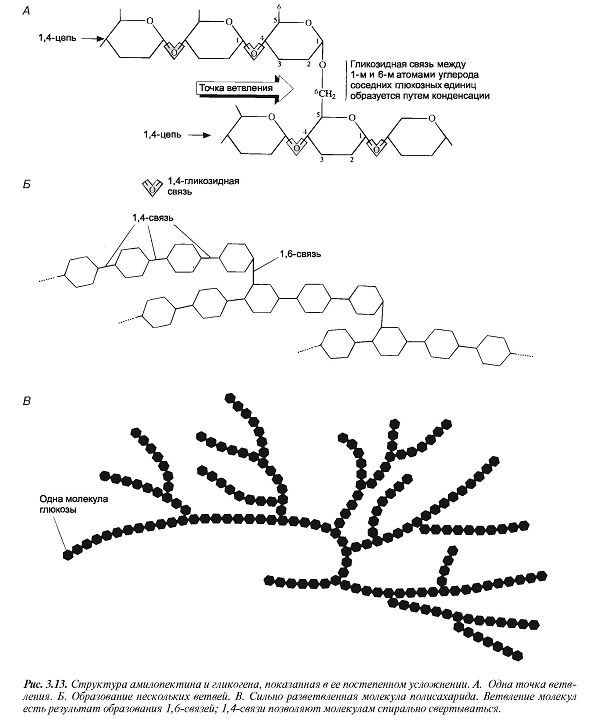 [c.263]
[c.263]
Амилопектин — сильно разветвленный полисахарид крахмала, построенный из 600—6000 остатков а О-глюко-зы, связанных между собой а—1,4-, а в местах ветвлений —1,6-глюкозидными связями. Молекулярная масса амилопектина 100 000— 1000 ООО, но может достигать 20-10 и даже — 5-10 . По строению амилопектин похож иа гликоген. [c.32]
Сходное с амилопектином строение имеет гликоген (животный крахмал). [c.310]
Сходное строение с амилопектином имеет животный полисахарид гликоген, разветвленность которого больше, чем амилопектина На рис. 15.7 схематично изображена структура амилопектина, где белыми кружками показаны остатки а-О-глюкопиранозы, связанные [c.405]
Классическими методами анализа, например метилированием, показано, что гликоген состоит из а-(1- 4)-связанных остатков О-глюкозы, и имеет а-(1,4,6)-связанные точки ветвления. Применение амилолитических ферментов для определения тонкой структуры гликогена показало, что он имеет ветвистое строение (см. рис. 26.3.5, й), причем каждая цепь состоит из 12 остатков D-глю-козы. Столь малая длина цепей в соединении, имеющем молекулярную массу порядка 10 —10 , свидетельствует о высокоразветвленной структуре, вследствие чего молекула гликогена поглощает Иод в еще меньшем количестве, чем молекула амилопектина. Области густого ветвления, устойчивые к действию а-амилазы, распределены по молекуле статистически [160]. С доступностью паракристаллического гликогена стало возможным применение физических методов для более детального изучения его строения 161]. Нахождению в природе, выделению, строению и ферментативному расщеплению гликогена посвящены обзоры [162—164]. [c.257]
Строение гликогена. Гликоген, запасной полисахарид животных организмов, очень сходен с амилопектином. В отличие от последнего он легко растворим в воде и не образует клейстера. С йодом он дает красно-коричневую окраску (причем некоторые гликогены вовсе пе окрашиваются).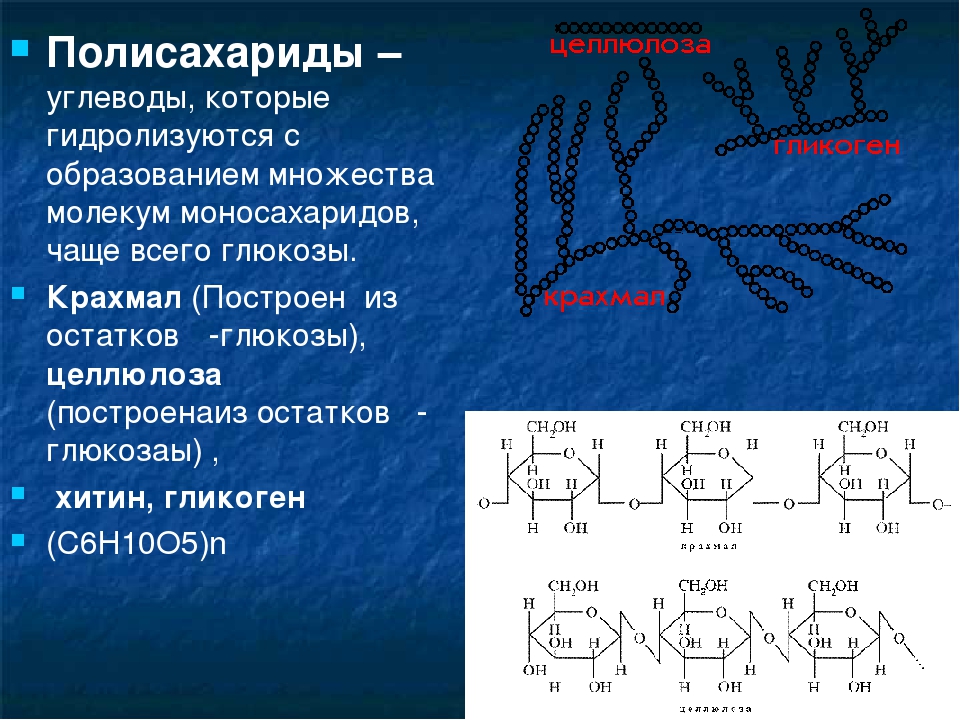 [c.316]
[c.316]
Гликоген. По строению он напоминает амилопектин, но степень разветвления значительно выше. Гликоген накапливается в организмах животных (преимущественно в печени и мышцах) как резервное вещество. Гтикоген легко расщепляется с образованием глюкозы и снабжает ею организм животных при физических нагрузках и в промежутках между приемами пишц. Кстати, одной из основных причин проблемы г ,чности людей является го, что ткани способны накапливать гликоген ишь в ограниченном количестве. Как только содержание гликогена на ( кт ткани достигнет 50…60 г, он перестает синтезироваться, а глюкоза испо ппьзуется уже щя образования жиров, [c.265]
Полисахариды гомо- и гетсрополисахарнды. Крахмал, химическое строение, химические и физико-химические свойства. Реакция с иодом. Расщепление крахмала. Пектиновые вещества, амилоза и амилопектин. Биологическая роль крахмала. Инулин, гликоген (животный крахмал). Целлюлоза как полимер глюкозы. Отличие целлюлозы от крахмала. Физические и химические свойства целлюлозы. [c.248]
Гликоген, или животный крахмал, имеет такое же разветвленное строение и такую же химическую структуру, как и амилопектин, но отличается от него морфологией макромолекулы. У амилопектина расстояния (средние) между ветвлениями составляют в средней части макромолекулы 8—9 глюкозных звеньев, а на ее внешней поверхности ( бахрома внешних групп) 15—18. У гликогена внутренние расстояния между ветвлениями составляют в среднем 3 глюкозных цикла, а внешняя бахрома 6—7. [c.35]
Результаты этих определений дают при исследовании неизвестного полисахарида лишь самое общее представление о его структуре. Измерение расхода окислителя в данном случае имеет смысл главным образом для установления конца реакции. Однако в случае полисахаридов хорошо изученного типа оно может давать дополнительные сведения о строении. Так, например, измерение расхода перйодата и образования муравьиной кислоты служит наиболее быстрым и удобным способом определения степени разветвления амилопектинов и гликогенов, полученных из различных биологических объектов . [c.498]
[c.498]
УГЛЕВОДЫ (глюциды, глициды)—важнейший класс органических соединений, распространенных в природе, состав которых соответствует общей формуле С (НзО) — По химическому строению У.— альдегидо- или кетоноспирты. Различают простые У.— моносахариды (сахара), например глюкоза, фруктоза, и сложные—полисахариды, которые делят на низкомолекулярные У.— дисахариды (сахароза, лактоза и др.) и высокомолекулярные, такие, например, как крахмал, клетчатка, гликоген. Характерным для У. является то, что моносахариды не гидролизуют, а молекулы полисахаридов при гидролизе расщепляются на две молекулы (дисахариды) или на большее число молекул (крахмал, клетчатка) моносахаридов. У. имеют огромное значение в обмене веществ организмов, являясь главным источником [c.255]
Очень близок по строению к амилопектину важнейший гомополиса-ларид животного происхождения — гликоген. Гликоген играет в животном организме роль резервного полисахарида. При избытке углеводов пище он, образуясь из избыточной глюкозы, откладывается в печени. Напротив, при недостатке углеводов в пище он распадается, и образующаяся при этом глюкоза поступает в кровь. [c.159]
Гликоген, запасный полисахарид животных, накапливающийся в печени, мышечных тканях, имеет молекулярную массу 1-15 млн и очень напоминает по строению амилопектин, но более разветвлен Разветвления, построенные по 1-6 типам, повторяются через каждые 8-16 остатков глюкозы Гликоген запасается в тканях в ограниченном количестве (50-60 г на 1 кг ткани) По достижении этого предела гликоген перестает синтезироваться, а глюкоза далее переводится животным организмом в жиры По этой причине избыточное потребление углеводов приводит к ожирению Строение крахмалоподобных сахаридов показано схематически на рис 23 2 [c.789]
Гликоген содержится в мускульной ткани и в пече1Ш. Он также принадлежит к числу резервных полисахаридов. Его относительная молекулярная масса составляет 5—15 миллионов.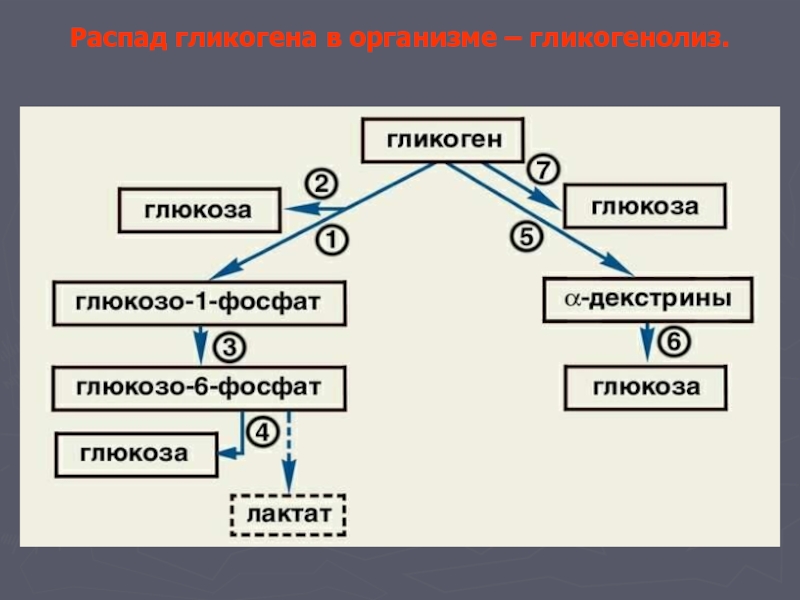 Гликоген по своему химическому строению напоминает крахмал, но имеет существенно большее число разветвлений, чем амилопектин. Разветвления повторяются через каждые 8—16 остатков глюкозы. [c.643]
Гликоген по своему химическому строению напоминает крахмал, но имеет существенно большее число разветвлений, чем амилопектин. Разветвления повторяются через каждые 8—16 остатков глюкозы. [c.643]
В гликогене молекулы построены по типу амилопектина, но обладают более короткими и частыми боковыми ветвями. Молекулярный вес гликогена составляет 1—4 млн. Строение и свойства гликогена подробно изучали Степаненко, Е. Розенфельд и др. [c.240]
Молекулярный вес гликогена порядка 10 . Поэтому принимают, что гликоген имеет строение, аналогичное строению амилопектина, но более разветвленное, включающее более короткие цепи. Ферментативное исследование подтверждает это строение. [c.317]
Биосинтез П. в живой клетке идет сложными путями, различными для разных П. характерным для этого процесса является ферментативный перенос гли-козильных остатков с участием уриди-новых коферментов. Синтез П., близких по строению гликогену, удалось осуществить вне организма, исходя из фосфорилированной глюкозы с применением системы специфич. ферментов. П.— основной источник углеводов в питании. [c.20]
Гликоген — это эквивалент крахмала, синтезируем ый в животном организме, т. е. это тоже резервный полисахарид, молекулы которого построены из больного числа остатков а-глюкозы. Содержится гликоген главным образом в печени и мышцах. По своему строению он очень 6.ЛИЧ0К амилопектину. [c.626]
Для иллюстрации рассмотрим строение одного из простейших представителей такого класса — амилопек-тина, полисахарида, который вместе с амилозой составляет крахмал. Аналогично амилопектину устроен животный крахмал (гликоген). Все цепи этих полисахаридов — и основная, и боковые, и разветвления в разветвлениях и т. д. — построены однотипно и состоят из а-1- 4-связан-ных остатков В-глюкопиранозы. Все узлы разветвлений — точки ветвления — построены также единообразно боковые цепи присоединены к другой цепи гликозидной связью в положение 6 остатка глюкозы (см. схему, с. 37). [c.36]
схему, с. 37). [c.36]
Гликоген но своему строению и свойствам очен , близок к компоненту крахмала — амилонектину. Он состоит из остатков — >-глюкозы, связанных в положении 1,4, а в местах разветвления — 1,6. [c.216]
Гликоген — еще один очень важный природный гомополисахарид, по строению сходный с крахмалом, поэтому его часто называют животный крахмал . Гликоген — разветвленная молекула полиглюкозы, аналогичная амилопектиновой части крахмала, но гликоген сильнее разветвлен и точки ветвления в нем встречаются в два-три раза чаще, чем в крахмале, а именно через каждые 8-10 остатков вдоль а-(1- 4)-цепи. В амилопектине крахмала точки ветвления встречаются через каждые 25-30 остатков. [c.69]
На рис. 2.12 изображена схема строения амилозы, состоящей из повторяющихся мальтозных (диглюкозных) единиц. Цепи амилопектина, в отличие от амилозы, разветвлены. Ту же роль, которую крахмал играет в растениях, в организмах животных выполняет гликоген, также построенный из глюкозных единиц, но имеющий сильно разветвленную структуру. Целлюлоза построена из повторяющихся единиц целлобиозы. [c.92]
Примером такого рода полисахаридов может служить гликоген из дрожжей (Sa haromy es erevisiae) При кислотном гидролизе его получена глюкоза с выходом 96% определение молекулярного веса ультрацентрифугированием дает значения порядка 2-10 . Результаты метилирования, периодатного окисления, частичного кислотного гидролиза и ферментативного гидролиза под действием а-амилазы и 3-амилазы указывают на высокоразветвленную структуру гликогена со средней длиной цепи 11 —13 остатков глюкозы внешние цепи содержат в среднем восемь остатков глюкозы. Близкие по строению полисахариды выделены из микроорганизмов самых различных классов. [c.545]
Гликоген. В животных организмах этот полисахари является структурным и функциональным аналого растительного крахмала. По строению подобен амиле X. пектину, но имеет еще большее разветвление цепе [c.416]
пектину, но имеет еще большее разветвление цепе [c.416]
Аналогично гликогену в животных организмах, в растениях гакую же роль резервного полисахарида выполняет амилопектин, имеющий менее разветвленное строение. Это связано с тем, что в растениях значительно медленнее протекают метаболические про-.цессы и не требуется быстрый приток энергии, как это иногда бывает необходимо животному организму (стрессовые ситуации, физическое или умственное напряжение). [c.417]
Полисахариды по строению делятся на линейные и разветвленные, а по составу — на гетерополисахариды, которые состоят из различных моносахаридов, и гомополисахариды, которые состоят из фрагментов одного и того же моносахарида. В случае глюкозы такие гомополисахариды называют глюканами крахмал, гликоген, целлюлоза. [c.494]
Гликоген (животный крахмал) имеет тот же состав, что и крахмал растений по строению подобен анилопектину (25 000 90 000 глюкозных остатков). Гидролизуется аналогично крахмалу. Гликоген выполняет ту же функцию в живых организмах, что крахмал в растениях. Все жизненные процессы сопровождаются и энергетически обеспечиваются биологическим расщеплениеи этого полисахарида, приводящим к образованию (+)-молочной кислоты. Гликоген содержится во всех клетках живого организма, наиболее богаты им печень и мышцы. [c.511]
Инсулин — белково-пептидный гормон, вырабатываемый островками поджелудочной железы. Является регулятором углеводного обмена в органиа-ме — стимулирует усвоение глюкозы и ее превращение в гликоген, при введении в организм понижает содержание сахара в крови. Молекула инсулина включает не менее 707 атомов и состоит из двух пептидных цепей, включающих 21 и 30 остатков аминокислот, цепи соединены двумя мостиками —8—5—, а один дисульфидный мостик имеется в более короткой цепи. Молекулы инсулина склонны к агрегации (с обраэованц от димеров до гексамеров) в присутствии ионов 2п +. Инсулин — первый белок, строение которого было расшифровано и воспроизведено в лаборатории. Используется для лечения диабета (сахарной болезни), [c.557]
Используется для лечения диабета (сахарной болезни), [c.557]
Целлюлоза является линейным, нераз-ветвленным гомополисахаридом, состоящим из 10000 и более остатков В-глю-козы, связанных друг с другом (1 -+4)-гликозидными связями в этом отношении она сходна с амилозой и линейными участками цепей гликогена. о между этими полисахаридами существует одно очень важное различие в целлюлозе (1 4)-связи имеют р-кон-фйгурацию, а в амилозе, амилопектине и гликогене-а-конфигурадию. Это, казалось бы, незначительное различие в строении целлюлозы и амилозы приводит к весьма существенным различиям в их свойствах (рис. 11-16). Благодаря геометрическим особенностям а(1 -> — 4)-связей лийейные участки полимерных цепей в молекулах гликогена и крахмала стремятся принять скрученную, спиральную конформацию, что способствует образованию плотных гранул, которые и обнаруживаются в больщин-стве животных и растительных клеток. [c.315]
Гликоген + продукты богатые гликогеном
Стойкость нашего организма к неблагоприятным условиям внешней среды объясняется его умением делать своевременные запасы питательных веществ. Одним из важных «запасных» веществ организма является гликоген – полисахарид, образуемый из остатков глюкозы.
При условии, что человек ежесуточно получает необходимую норму углеводов, то глюкоза, находящаяся в виде гликогена клеток, может быть оставлена про запас. Если же человек испытывает энергетический голод, в таком случае происходит активация гликогена, с его последующей трансформацией в глюкозу.
Продукты богатые гликогеном:
Общая характеристика гликогена
Гликоген в простонародье называют животным крахмалом. Он представляет
собой запасной углевод, который производится в организме животных
и человека. Его химическая формула — (C6H10O5)n. Гликоген является
соединением глюкозы, которая в виде мелких гранул откладывается в
цитоплазме клеток мышц, печени, почек, а также в клетках мозга и белых
кровяных тельцах. Таким образом, гликоген представляет собой энергетический
резерв, способный восполнить недостаток глюкозы, в случае отсутствия
полноценного питания организма.
Гликоген является
соединением глюкозы, которая в виде мелких гранул откладывается в
цитоплазме клеток мышц, печени, почек, а также в клетках мозга и белых
кровяных тельцах. Таким образом, гликоген представляет собой энергетический
резерв, способный восполнить недостаток глюкозы, в случае отсутствия
полноценного питания организма.
Это интересно!
Клетки печени (гепатоциты) являются лидерами по накоплению гликогена! Они могут на 8 процентов своего веса состоять из этого вещества. При этом клетки мышц и других органов, способны накапливать гликоген в количестве не более 1 – 1,5%. У взрослых общее количество гликогена печени может достигать 100—120 грамм!
Суточная потребность организма в гликогене
По рекомендации медиков, суточная норма гликогена не должна быть ниже 100 граммов в сутки. Хотя необходимо учесть, что гликоген состоит из молекул глюкозы, и расчет может осуществляться только на взаимозависимом основании.
Потребность в гликогене возрастает:
- В случае повышенных физических нагрузок, связанных с выполнением большого количества однообразных манипуляций. В результате этого, мышцы страдают от недостатка кровенаполнения, а также от нехватки глюкозы в крови.
- При выполнении работ, связанных с мозговой деятельностью. В данном случае, гликоген, содержащийся в клетках мозга, быстро преобразуется в энергию, необходимую для работы. Сами же клетки, отдав накопленное, требуют пополнения запасов.
- В случае ограниченного питания. В данном случае, организм, недополучая глюкозу из продуктов питания, начинает перерабатывать свои запасы.
Потребность в гликогене снижается:
- При употреблении большого количества глюкозы и глюкозоподобных соединений.
- При заболеваниях, связанных с повышенным употреблением глюкозы.
- При болезнях печени.

- При гликогенезах, вызванных нарушением ферментативной деятельности.
Усваиваемость гликогена
Гликоген относится к группе быстро усваиваемых углеводов, с отсрочкой к исполнению. Данная формулировка объясняется так: до тех пор, пока в организме достаточно прочих источников энергии, гликогеновые гранулы будут храниться в нетронутом виде. Но как только мозг подаст сигнал о недостатке энергетического обеспечения, гликоген под воздействием ферментов начинает преобразовываться в глюкозу.
Полезные свойства гликогена и его влияние на организм
Поскольку молекула гликогена представлена полисахаридом глюкозы, то его полезные свойства, а также влияние на организм соответствует свойствам глюкозы.
Гликоген является полноценным источником энергии для организма в период нехватки питательных веществ, необходим для полноценной умственной и физической деятельности.
Взаимодействие с эссенциальными элементами
Гликоген обладает способностью быстро преобразовываться в молекулы глюкозы. При этом он отлично контактирует с водой, кислородом, рибонуклеиновой (РНК), а также дезоксирибонуклеиновой (ДНК) кислотами.
Признаки нехватки гликогена в организме
- апатия;
- ухудшение памяти;
- снижение мышечной массы;
- слабый иммунитет;
- депрессивное настроение.
Признаки избытка гликогена
- сгущение крови;
- нарушения функций печени;
- проблемы с тонким кишечником;
- увеличение массы тела.
Гликоген для красоты и здоровья
Поскольку гликоген является внутренним источником энергии в организме, то его недостаток способен вызвать общее снижение энергетичности всего организма.
Это отражается на деятельности волосяных фолликулов, клеток кожи, а также проявляется в потере блеска глаз.
Достаточное же количество гликогена в организме, даже в период острой нехватки свободных питательных веществ, сохранит энергичность, румянец на щеках, красоту кожи и блеск волос!
Мы собрали самые важные моменты о гликогене в этой иллюстрации и будем благодарны, если вы поделитесь картинкой в социальной сети или блоге, с ссылкой на эту страницу:
Рейтинг:5.1/10
Голосов: 9
Другие популярные нутриенты:
углеводы — урок. Биология, Общие биологические закономерности (9–11 класс).
Углеводы, или сахариды, — одна из основных групп органических соединений. Они входят в состав клеток всех живых организмов.
Основная функция углеводов — энергетическая (при расщеплении и окислении молекул углеводов выделяется энергия, которая обеспечивает жизнедеятельность организма). При избытке углеводов они накапливаются в клетке в качестве запасных веществ (крахмал, гликоген) и при необходимости используются организмом в качестве источника энергии. Углеводы также используются и в качестве строительного материала.
Общая формула углеводов:
Cn(h3O)m.
Углеводы состоят из углерода, водорода и кислорода.
В состав производных углеводов могут входить и другие элементы.
Растворимые в воде углеводы. Моносахариды и дисахариды
Пример:
из моносахаридов наибольшее значение для живых организмов имеют рибоза, дезоксирибоза, глюкоза, фруктоза, галактоза.
Глюкоза — основной источник энергии для клеточного дыхания.
Фруктоза — составная часть нектара цветов и фруктовых соков.
Рибоза и дезоксирибоза — структурные элементы нуклеотидов, являющихся мономерами нуклеиновых кислот (РНК и ДНК).
Дисахариды образуются путём соединения двух молекул моносахаридов и по своим свойствам близки к моносахаридам. Например, и те и другие хорошо растворимы в воде и имеют сладкий вкус.
Пример:
сахароза (тростниковый сахар), мальтоза (солодовый сахар), лактоза (молочный сахар) — дисахариды, образовавшиеся в результате слияния двух молекул моносахаридов:
сахароза (глюкоза \(+\) фруктоза) — основной продукт фотосинтеза, транспортируемый в растениях.
Лактоза (глюкоза \(+\) галактоза) — входит в состав молока млекопитающих.
Мальтоза (глюкоза \(+\) глюкоза) — источник энергии в прорастающих семенах.
Функции растворимых углеводов: транспортная, защитная, сигнальная, энергетическая.
Нерастворимые в воде полисахариды
Полисахариды состоят из большого числа моносахаридов. С увеличением количества мономеров растворимость полисахаридов уменьшается и сладкий вкус исчезает.
Пример:
полимерные углеводы: крахмал, гликоген, целлюлоза, хитин.
Функции полимерных углеводов: структурная, запасающая, энергетическая, защитная.
Крахмал состоит из разветвлённых спирализованных молекул, образующих запасные вещества в тканях растений.
Целлюлоза является важным структурным компонентом клеточных стенок грибов и растений.
Целлюлоза нерастворима в воде и обладает высокой прочностью.
Хитин состоит из аминопроизводных глюкозы, входит в состав клеточных стенок некоторых грибов и формирует наружный скелет членистоногих животных.
Гликоген — резервный углевод животной клетки.
Источники:
http://www.bestreferat.ru/referat-100195.html
Свойства гликогеноподобного полисахарида, продуцируемого мутантом Escherichia coli, лишенным гликогенсинтазы и мальтодекстринфосфорилазы
Основные моменты
- •
Были проанализированы характеристики 3 полисахаридов (PS) из 10 мутантов Escherichia coli.

- •
PS имели меньшую молекулярную массу и более короткие боковые цепи, чем гликогены.
- •
Максимальная растворимость PS в воде составила 230 мг / мл при комнатной температуре.
- •
В эксперименте по гидролизу амилаз ФС значительно снизили усвояемость по сравнению с амилопектином.
- •
ФС проявляли иммуностимулирующее действие на макрофагальные клетки мыши.
Abstract
Мутант TBP38 Escherichia coli лишен гликогенсинтазы (GlgA) и мальтодекстринфосфорилазы (MalP). При выращивании на мальтозе в периодической ферментации с подпиткой TBP38 накапливал более чем в 50 раз больше полисахаридов гликогенового типа, чем его родительский штамм.Полисахариды экстрагировали на разных стадиях роста и мигрировали в виде одного пика при эксклюзионной хроматографии. TBP38 продуцировал полисахариды в диапазоне 2,6 × 10 6 –4,6 × 10 6 Да. Соотношение коротких боковых цепей (DP 12) в полисахаридах превышало 50%, а среднечисленная степень полимеризации варьировала от 9,8 до 8,4. Полисахариды показали в 70–290 раз большую растворимость в воде, чем амилопектин. K m при использовании α-амилаз поджелудочной железы свиньи и человека с полисахаридами были в 2–4 раза больше, чем для амилопектина. k cat Значения были одинаковыми для обеих α-амилаз. Полисахариды TBP38 имели на 40-60% более низкую перевариваемость амилоглюкозидазы, чем амилопектин. Интересно, что полисахариды показали сильные иммуностимулирующие эффекты на макрофагальные клетки мыши, сравнимые с липополисахаридами. Уровни загрязнения липополисахаридами были слишком низкими, чтобы учесть этот эффект.
Ключевые слова
Escherichia coli мутант
Внутриклеточный полисахарид
Гликоген
Амилаза
Кинетика усвояемости
Растворимость в воде .Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.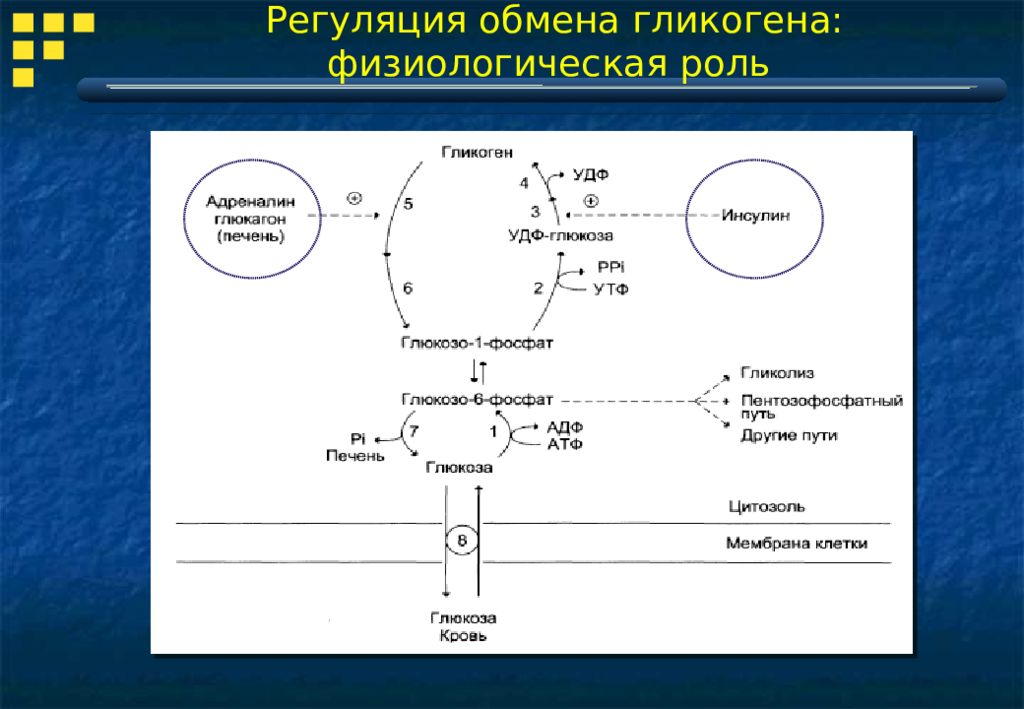
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
ГЛИКОГЕН | 9005-79-2
Свойства гликогена
- Точка плавления:
- 270-280 ° C (разл.)
- альфа
- D25 от +196 до + 197 °
- Плотность
- 1.629 г / см3 (температура: -5 ° C)
- темп хранения.
- 2-8 ° С
- растворимость
- H 2 O: 20 мг / мл, от прозрачного до мутного, светло-желтого цвета
- форма
- жидкость
- цвет
- Белый порошок
- Запах
- Без запаха
- Растворимость в воде
- Растворим в воде
- Мерк
- 4496
- Ссылка на базу данных CAS
- 9005-79-2 (Справочная база данных CAS)
- Оценки продуктов питания EWG
- 1
- FDA UNII
- 309GSC92U1
- Система регистрации веществ EPA
- Гликоген (9005-79-2)
БЕЗОПАСНОСТЬ
- Заявление о рисках и безопасности
| Заявление о рисках | 36/37/38 | ||
|---|---|---|---|
| Заявления о безопасности | 24 / 25-26 | ||
| WGK Германия | 3 | ||
| RTECS | MC2700000 | ||
| Ф | 3-10 | ||
| TSCA | Есть | ||
| Код ТН ВЭД | 300 | ||
| NFPA 704 |
| Производитель | Номер товара | Описание товара | Номер CAS | Упаковка | Цена | Обновлено | Купить |
|---|---|---|---|---|---|---|---|
| Сигма-Олдрич | G0885 | Гликоген из бычьей печени Тип IX | 9005-79-2 | 1г | 46 долларов США. 3 3 | 2020-08-18 | Купить |
| Сигма-Олдрич | 10 | Гликоген из мидий | 1 мл | $ 163 | 2021-03-22 | Купить | |
| Сигма-Олдрич | G1767 | Гликоген из Mytilus edulis (Голубая мидия) для осаждения ДНК | 1 флакон | $ 195 | 2021-03-22 | Купить | |
| Сигма-Олдрич | G0885 | Гликоген из бычьей печени Тип IX | 9005-79-2 | 5 г | 489 долл. США | 2020-08-18 | Купить |
| Сигма-Олдрич | G1765 | Гликоген из устриц типа XI | 25 мг | $ 583 | 2021-03-22 | Купить |
ГЛИКОГЕН Химические свойства, применение, производство
Химические свойства
Порошок от белого до кремовогоиспользует
Инертный носитель, который значительно увеличивает эффективность экстрагирования ДНК и РНК путем осаждения этанолом.
использует
гликоген — это кондиционирующее средство для кожи. Это высокомолекулярный полимер, распределенный по протоплазме клетки.Определение
А полисахарид, который является основным углеводом магазин животных. Он состоит из многие единицы глюкозы связаны аналогичным образом крахмал. Гликоген легко гидролизуется в поэтапный способ к самой глюкозе. это хранится в основном в печени и мышцах, но широко распространен в организме.Определение
Полисахарид глюкозы, запасной углевод организма животных, особенно находящийся в печени и отдохнувших мышцах.Методы очистки
Отфильтровывают 5% водный раствор (уголь) D (+) — гликогена и добавляют равный объем EtOH. После выдерживания в течение ночи при 30 ° С осадок собирают центрифугированием, промывают абсолютным EtOH, затем EtOH / диэтиловым эфиром (1: 1) и диэтиловым эфиром и сушат.[Sutherland & Wosilait J Biol Chem 218 459 1956.]Продукты и сырье для получения гликогена
Сырье
Препараты
Глобальные (141) Поставщики Бельгия 1 Китай 81 Европа 3 Германия 5 Индия 3 Япония 3 Швейцария 3 Великобритания 6 США 36 В мире 141
Посмотреть последнюю цену от производителей гликогена
9005-79-2 (ГЛИКОГЕН) Поиск по теме:
Кобальт этилендиамина хлорид Ацетилацетонат алюминия ФЕНИЛСЕЛЕНОЛ САЛЬКОМИН 2,4-ПЕНТАНДИОН, СЕРЕБРЯНОЕ ПРОИЗВОДНОЕ 1,1,3,3-ТЕТРАМЕТИЛБУТИЛИЗОЦИАНИД МЕТИЛИЗОЦИАНОАЦЕТАТ-N-БУТИЛИЗОЦИАН-ТРИЗОЦИАН-3,5 (III) Тозилметилизоцианид ТЕРТ-БУТИЛИЗОЦИАНИД Трис (2,4-пентандионато) хром (III) ДИХЛОРО (ЭТИЛЕНДИАМИН) ПЛАТИН (II) Ацетилацетонат меди Ацетилацетонат железа ТРИС (2,2,6,6-ТЕТРАМЕТИОН-ТРИС- ) БЕНЗИЛИЗОЦИАНИД ЕВРОПИЯ (III) Этилизоцианоацетат- Гликоген (Ⅲ) из печени кролика
- (2S, 3R, 4S, 5S, 6R) -2 — [[(2R, 3S, 4R, 5R, 6R) -4,5-дигидрокси-3 — [(2R, 3R, 4S, 5S, 6R) — 3,4,5-тригидрокси-6- (гидроксиметил) оксан-2-ил] окси-6 — [(2R, 3S, 4R, 5R, 6S) -4,5,6-тригидрокси-2- (гидроксиметил) оксан -3-ил] оксиоксан-2-ил] метокси] -6- (гидроксиметил) оксан-3,4,5-триол
- Гликоген из oyster Vetec ™ реактивная чистота, тип II
- Гликоген из устриц типа II
- Раствор гликогена (20 мг / мл) от Oyster, проверено нуклеазой
- крахмал для животных
- Гликоген Тип IX
- лиогликоген
- Гликоген типа III
- ГЛИКОГЕНОВАЯ ОЙСТРА
- ГЛИКОГЕНОВЫЕ ВЕСТИНИЦЫ
- ГЛИКОГЕН, ГОВЯДИНА
- ГЛИКОГЕН, D — (+)
- ГЛИКОГЕН, EX BOVINE LIVER
- ГЛИКОГЕН EX OYSTER
- ГЛИКОГЕН EX ПЕЧЕНЬ КРОЛИКА
- ГЛИКОГЕН (ИЗ УСТРИЦ)
- ГЛИКОГЕН (ПЕЧЕНЬ Млекопитающих)
- ГЛИКОГЕН, МИДИЯ
- ГЛИКОГЕН
- D — (+) — ГЛИКОГЕН
- ГЛИКОГЕН ТИПА IX ИЗ БЫЧЬЕЙ ПЕЧЕНИ
- Гликоген из печени млекопитающих
- ГЛИКОГЕН ТИПА III ИЗ ПЕЧЕНИ КРОЛИКА
- ГЛИКОГЕН ТИПА XI ИЗ ВЕЧНИК
- ГЛИКОГЕН ИЗ CREPIDULA FORNICATA (SLIPPER LIMPET), ТИП VIII
- ГЛИКОГЕН ТИПА II ОТ OYSTER
- ГЛИКОГЕН ТИПА VII ИЗ МИДИИ
- ГЛИКОГЕН ИЗ ПЕЧЕНИ КРОЛИКА
- ГЛИКОГЕН (ВНЕШНИЙ) БИОСИНТ
- ГЛИКОГЕН, МОЛЕКУЛЯРНЫЙ БИОЛОГИЧЕСКИЙ РЕАГЕНТ
- ГЛИКОГЕН ИЗ OYSTER
- ГЛИКОГЕН, D — (+) — (RG)
- Гликоген типа II
- Тип гликогена Ⅱ / Ⅲ
- печеночный крахмал
- Гликоген для биохимии
- GlycogenExOysterA.
 Р.
Р. - гликоген из crepidula fornicata (тапочки)
- гликоген из mytilus edulis (голубая мидия)
- ГЛИКОГЕН, ПОРОШОК
- (2R, 3R, 4S, 5S, 6R) -2 — [(2R, 3S, 4R, 5R, 6R) -4,5-дигидрокси-6 — [(2R, 3S, 4R, 5R, 6S) -4 , 5,6-тригидрокси-2- (гидроксиметил) оксан-3-ил] окси-2 — [[(2S, 3R, 4S, 5S, 6R) -3,4,5-тригидрокси-6- (гидроксиметил) оксан -2-ил] оксиметил] оксан-3-ил] окси-6- (гидроксиметил) оксан-3,4,5-триол
- Гликоген из устрицы типа Ⅱ
- Гликоген, ≥90%
- Гликоген — из устрицы для молекулярной биологии
- C: C и B45
- Гликоген из устрицы типа Ⅱ
- 9005-79-2
- Углеводы
- Биохимические продукты и реагенты
- Биохимия
- Сахар
- Полисахариды
- Полисахарид
- Биохимия
- Полисахариды
- Сахар
- Декстрины 、 сахар и углеводы
Гликоген как выгодный полимерный носитель в тераностике рака: прямые доказательства in vivo
Сайкс, Р. Химия и фармакология противоопухолевых препаратов. Br. J. Cancer 97 , 1713 (2007).
PubMed Central Google Scholar
Nussbaumer, S., Bonnabry, P., Veuthey, J. & Fleury-Souverain, S. Анализ противоопухолевых препаратов: обзор. Таланта 85 , 2265–89 (2011).
CAS PubMed Google Scholar
Грейш, К. Эффект повышенной проницаемости и удерживания (EPR) для нацеливания противораковых наномедицинских лекарств. Methods Mol. Биол. 624 , 25–37 (2010).
CAS PubMed Google Scholar
Дункан Р. Начало эры полимерной терапии. Nat. Rev. Drug Discov. 2 , 347–360 (2003).
CAS PubMed Google Scholar
Сеймур, Л. и др. . Опухолевый рост и противораковая эффективность пролекарств доксорубицина на полимерной основе при лечении подкожной мышиной меланомы B16F10. Br. J. Cancer 70 , 636–641 (1994).
CAS PubMed PubMed Central Google Scholar
Фанг, Дж., Накамура, Х. и Маэда, Х. Эффект ЭПР: уникальные особенности кровеносных сосудов опухоли для доставки лекарств, задействованные факторы, а также ограничения и усиление эффекта. Adv. Препарат Делив. Ред. 63 , 136–151 (2011).
CAS PubMed Google Scholar
Dadsetan, M. et al. . Контролируемое высвобождение доксорубицина из pH-чувствительных микрогелей. Acta Biomater. 9 , 5438–5446 (2014).
Google Scholar
Gao, S. et al. . Реагирующие на стимулы полимерные системы на биологической основе и их применение. J. Mater. Chem. B 7 , 709–729 (2019).
CAS PubMed Google Scholar
Bruneau, M. et al. . Системы для контролируемого выпуска стимулов: материалы и приложения. J. Control. Выпуск 294 , 355–371 (2019).
CAS PubMed Google Scholar
Джинхен, Х. Л. и Юн, Ю. Контролируемое высвобождение лекарственного средства из фармацевтических наноносителей. Chem. Англ. Sci. 125 , 75–84 (2015).
Google Scholar
Маеда, Х., Накамура, Х. и Фанг, Дж. Эффект ЭПР для доставки макромолекулярных лекарств к солидным опухолям: улучшение поглощения опухолью, снижение системной токсичности и визуализация отдельных опухолей in vivo . Adv. Препарат Делив. Ред. 65 , 71–9 (2013).
CAS PubMed Google Scholar
Acharya, S. & Sahoo, S.K. Наночастицы PLGA, содержащие различные противораковые агенты, и доставка опухоли с помощью эффекта ЭПР. Adv. Препарат Делив. Ред. 63 , 170–83 (2011).
CAS PubMed Google Scholar
Густафсон, Х. Х., Холт-Каспер, Д., Грейнджер, Д. В. и Гандехари, Х. Поглощение наночастиц: проблема фагоцитов. Нано сегодня 10 , 487–510 (2015).
CAS PubMed PubMed Central Google Scholar
Сук, Дж. С., Сюй, К., Ким, Н., Хейн, Дж. И Энсикн, Л. М. ПЭГилирование как стратегия улучшения доставки лекарств и генов на основе наночастиц. Adv. Препарат Делив. Ред. 99 , 28–51 (2016).
CAS PubMed Google Scholar
Luxenhofer, R. et al. . Поли (2-оксазолины) как полимерные терапевтические средства. Macromol. Rapid Commun. 33 , 1613–31 (2012).
CAS PubMed PubMed Central Google Scholar
Ulbricht, J., Jordan, R. & Luxenhofer, R. О способности к биоразложению полиэтиленгликоля, полипептоидов и поли (2-оксазолина) s. Биоматериалы 35 , 4848–4861 (2014).
CAS PubMed Google Scholar
Hrubý, M., Filippov, S. & Štepánek, P. Умные полимеры в системах доставки лекарств на перекрестках: какой путь заслуживает следующего? Eur. Polym. J. 65 , 82–97 (2015).
Google Scholar
Verbraeken, B., Monnery, B.D., Lava, K. & Hoogenboom, R. Химия поли (2-оксазолина) s. Eur. Polym. J. 88 , 451–469 (2017).
CAS Google Scholar
Bauer, M. et al. . Поли (2-этил-2-оксазолин) в качестве альтернативы скрытому полимеру поли (этиленгликоль): сравнение цитотоксичности и гемосовместимости in vitro с . Mascomolecular Biosci. 12 , 986–98 (2012).
CAS Google Scholar
Конради, Р., Пидхатика, Б., Мухлебах, А. и Текстор, М. Поли-2-метил-2-оксазолин: пептидоподобный полимер для белковотталкивающих поверхностей. Langmuir 24 , 613–616 (2008).
CAS PubMed Google Scholar
Амоозгар, З.& Йео, Ю. Последние достижения в области скрытого покрытия систем доставки лекарств с помощью наночастиц. Wiley Interdiscip. Преподобный Наномед. Nanobiotechnol. 4 , 219–33 (2012).
CAS PubMed PubMed Central Google Scholar
Гласснер М., Вергаелен М. и Хугенбум Р. Поли (2-оксазолин): всесторонний обзор полимерных структур и их физических свойств. Polym. Int. 67 , 32–45 (2018).
CAS Google Scholar
Sebak, S., Mirzaei, M., Malhotra, M., Kulamarva, A. & Prakash, S. Наночастицы сывороточного альбумина человека как эффективная система доставки носкапина для потенциального использования при раке груди: подготовка и in vitro анализ. Внутр. J. Nanomedicine 5 , 525–532 (2010).
CAS PubMed PubMed Central Google Scholar
Нгуен, П. М. и Хаммонд, П. Т. Амфифильные линейно-дендритные триблок-сополимеры, состоящие из поли (амидоамина) и поли (пропиленоксида), и их мицеллярная фаза и инкапсулирующие свойства. Langmuir 22 , 7825–32 (2006).
CAS PubMed Google Scholar
Рудольф К., Лозье Дж., Наундорф С., Мюллер Р. Х. и Розенекер Дж. Доставка гена in vivo в легкие с использованием полиэтиленимина и разрушенных дендримеров полиамидоамина. J. Gene Med. 2 , 269–278 (2000).
CAS PubMed Google Scholar
Sedlacek, O. et al. . 19F магнитно-резонансная томография инъекционных полимерных имплантатов с мультиреактивным поведением. Chem. Матер. 30 , 4892–4896 (2018).
CAS Google Scholar
Чжао, Дж., Ян, Х., Ли, Дж., Ван, Й. и Ван, X. Изготовление pH-чувствительных нанокапсул PLGA (UCNPs / DOX) с апконверсионной люминесценцией для доставки лекарств. Sci. Отчет 7 , 18014 (2017).
ADS PubMed PubMed Central Google Scholar
Ганджи, М. Д., Мирзаи, С. и Далиранде, З. Молекулярное происхождение высвобождения лекарственного средства при кипении воды внутри углеродных нанотрубок на основе моделирования реактивной молекулярной динамики и перспектив DFT. Sci. Отчет 7 , 4669 (2017).
ADS PubMed PubMed Central Google Scholar
Ларсон, Н. и Хамидреза, Г. Полимерные конъюгаты для доставки лекарств. Chem. Матер. 24 , 840–853 (2012).
CAS PubMed PubMed Central Google Scholar
Тянь, Х., Тан, З., Чжуан, X., Чен, X.& Jing, X. Биоразлагаемые синтетические полимеры: получение, функционализация и биомедицинское применение. Prog. Polym. Sci. 37 , 237–280 (2012).
CAS Google Scholar
Улери Б., Наир Л. и Лауренсин С. Биомедицинское применение биоразлагаемых полимеров. J. Polym. Sci. B. Polym. Phys. 49 , 832–864 (2011).
ADS CAS PubMed PubMed Central Google Scholar
Филиппов С. и др. . Гликоген как биоразлагаемый строительный наноматериал для использования in vivo . Macromol. Biosci. 12 , 1731–8 (2012).
CAS PubMed Google Scholar
Zhang, L. et al. . Декорированный фолатом полисахарид-доксорубицин-полимер: синтез, характеристика и активность в клетках HeLa. Бык. Korean Chem. Soc. 36 , 1999–2005 (2015).
CAS Google Scholar
Тоннесен, Х. Х. и Карлсен, Дж. Альгинат в системах доставки лекарств. Drug Dev. Ind. Pharm. 28 , 621–630 (2002).
CAS PubMed Google Scholar
Wang, H. et al. . Самосборка с помощью производства наногидрогелей на основе декстрана с восстановительно-расщепляемыми переходами для применения в качестве эффективных систем доставки лекарств. Sci. Отчет 7 , 40011 (2017).
ADS CAS PubMed PubMed Central Google Scholar
Huang, S. & Huang, G. Получение и доставка лекарственного средства комплекса декстран-лекарственное средство. Drug Deliv. 26 , 252–261 (2019).
CAS PubMed PubMed Central Google Scholar
Sreekumar, S., Goycoolea, F.М., Мершбахер, М. и Ривера-Родригес, Г. Параметры, влияющие на размер нано- и микрочастиц хитозан-ТФП. Sci. Отчет 8 , 4695 (2018).
ADS PubMed PubMed Central Google Scholar
Бабу А. и др. . Доставка химиопрепаратов с использованием нацеленных на интегрин наночастиц PLGA-хитозан для терапии рака легких. Sci. Отчет 7 , 14674 (2017).
ADS PubMed PubMed Central Google Scholar
Моррис Г., Кок М., Хардинг С. и Адамс Г. Системы доставки полисахаридных лекарственных средств на основе пектина и хитозана. Biotechnol. Genet. Англ. Ред. 27 , 257–284 (2010).
CAS PubMed Google Scholar
Кин Т. и Тану М. Биоразложение, биораспределение и токсичность хитозана. Adv. Препарат Делив. Ред. 62 , 3–11 (2010).
CAS PubMed Google Scholar
Варшосаз, Дж. Конъюгаты декстрана в доставке лекарств. Эксперт. Opin. Лекарство. Deliv. 9 , 509–23 (2012).
CAS PubMed Google Scholar
Cascone, M. & Maltinti, S. Гидрогели на основе хитозана и декстрана в качестве потенциальных систем доставки лекарств. J. Mater. Sci. Матер. Med. 10 , 301–307 (1999).
CAS PubMed Google Scholar
Палеос, К. М., Сидерату, З. и Циурвас, Д. Системы доставки лекарств на основе гидроксиэтилкрахмала. Биоконъюг. Chem. 28 , 1611–1624 (2017).
CAS PubMed Google Scholar
Xu, X., Jha, A., Harrington, D., Farach-Carson, M. & Jia, X. Гидрогели на основе гиалуроновой кислоты: от природного полисахарида до сложных сетей. Мягкое вещество 8 , 3280–3294 (2012).
ADS CAS PubMed PubMed Central Google Scholar
Смейкалова Д. и др. . Селективный in vitro противораковый эффект суперпарамагнитных наночастиц оксида железа, загруженных в полимерные мицеллы гиалуронана. Биомакромолекулы 15 , 4012–4020 (2014).
CAS PubMed Google Scholar
Джиратова, М. и др. . Биологическая характеристика новой системы носителя гибридного сополимера на основе гликогена. Drug Deliv. Пер. Res. 8 , 73–82 (2018).
CAS PubMed Google Scholar
Адева, М. М., Гонсален-Лукан, М., Донапетри-Гарсия, К., Фернандес, К. и Родригес, Е. А. Метаболизм гликогена в организме человека. Biochim. Биофиз. 5 , 85–100 (2016).
Google Scholar
Мацуи, М., Какут, М. и Мисаки, А. Тонкие структурные особенности устричного гликогена: способ множественного ветвления. Carbohydr. Polym. 31 , 227–235 (1997).
Google Scholar
Жан-Люк, П., Булеон, А., Борсали, Р. и Шанзи, Х. Ультраструктурные аспекты фитогликогена по данным криопропускающей электронной микроскопии и квазиупругому светорассеянию. Внутр. J. Biol. Макромол. 26 , 145–150 (1999).
Google Scholar
Vetrik, M. et al. . Разлагаемые нановолокна на основе биополимеров из возобновляемых источников, производимые методом сублимационной сушки. RSC Adv 3 , 15282–15289 (2013).
CAS Google Scholar
Галисова А. и др. . Платформа тримодальной визуализации для отслеживания жизнеспособных трансплантированных островков поджелудочной железы in vivo : F-19 MR, флуоресцентная и биолюминесцентная визуализация. Мол. Imaging Biol. 21 , 454–464 (2018).
PubMed Central Google Scholar
Bouvain, P. et al. . Диссоциация 19F и сигнала флуоресценции при поглощении клетками двойных контрастных перфторуглеродных наноэмульсий. Magn. Резон. Матер. Физика, биол. Med. 32 , 133–145 (2019).
CAS Google Scholar
Лин, С. П. и Браун, Дж. Дж. Контрастные вещества MR: физические и фармакологические основы. J. Magn. Резон. Imaging 25 , 884–99 (2007).
PubMed Google Scholar
Като, Ю. и др. . Кислотное внеклеточное микроокружение и рак. Cancer Cell Int. 13 , 89 (2013).
CAS PubMed PubMed Central Google Scholar
Создание конструкций гликоген-миРНК с биоактивными свойствами
Статус доступа
На этот товар действует эмбарго, и он будет доступен 23 сентября 2021 года.Описание
© 2019 Марцин Войнилович
Аннотация
Терапевтические средства на основеРНК, такие как малая интерферирующая РНК (миРНК), обладают большим потенциалом для лечения наследственных и приобретенных заболеваний, которые не поддаются лечению обычными методами. Доставка нового генетического материала в клетки дает возможность изменить экспрессию неисправных генов. Однако миРНК представляет собой гидрофильную и отрицательно заряженную молекулу, которая не может легко пересекать биологические мембраны и подвержена деградации нуклеазами, присутствующими в биологических жидкостях.Следовательно, терапевтическим средствам siRNA требуются носители, которые могут эффективно доставлять свой груз в клетки-мишени. Ранние составы для доставки миРНК включали системы на основе вирусных векторов, наночастиц на основе липидов и катионных полимеров. Однако эти составы часто проявляли высокую токсичность, иммуногенность, нестабильность в биологических средах, неспособность проникать в ткань и / или быстрое выведение из кровотока. Точный контроль над размером носителей и свойствами поверхности, использование упрощенных и воспроизводимых подходов к синтезу и более глубокое понимание взаимодействий между siRNA-наноконструкциями во внеклеточной и внутриклеточной среде может потенциально улучшить конструирование новых носителей.В этой диссертации исследовалось влияние структурных свойств мягких наночастиц гликогена на формирование конструкций siRNA и их доставку в сложной биологической среде. Гликоген — это гиперразветвленный биополимер глюкозы нанометрового размера, который можно выделить из различных тканей животных или растений. Он состоит из повторяющихся единиц глюкозы, соединенных линейными α-D- (1-4) гликозидными связями с разветвлением α-D- (1-6). В этой работе свойства мягких наночастиц гликогена были адаптированы для создания конструкций гликоген-миРНК.Эти конструкции были тщательно разработаны для эффективного проникновения в трехмерные многоклеточные опухолевые сфероиды и оказания значительного эффекта подавления генов. Полученные результаты позволяют предположить, что наночастицы гликогена размером 20 нм являются оптимальными для комплексообразования и эффективной доставки миРНК. Химический состав, поверхностный заряд и размер конструкций гликоген-миРНК тщательно контролировали, чтобы минимизировать взаимодействия с белками сыворотки, которые влияют на стабильность и целостность конструкций гликоген-миРНК. pH-чувствительные фрагменты были введены в конструкцию для улучшения раннего выхода из эндосом.Используя микроскопию одиночных молекул со сверхвысоким разрешением, мы демонстрируем, что архитектура конструкций гликоген-миРНК и жесткость катионных полимерных цепей являются ключевыми параметрами, которые контролируют механизм выхода из эндосом, вызванный эффектом протонной губки. Также были исследованы взаимодействия конструкций гликоген-миРНК с иммунными клетками, предполагая, что конструкции гликоген-миРНК могут выводиться из кровотока с помощью мононуклеарной фагоцитарной системы, но все же могут успешно доставлять терапевтический груз.
Ключевые слова
частицы гликогена; наночастицы; доставка генов; РНК-интерференция; эндосомный побег; микроскопия стохастической оптической реконструкции; мононуклеарные клетки периферической крови; биологические барьерыКинетические свойства гликоген-синтазы и фосфорилазы и структурные аспекты гликогена в печени мыши db / db
Реферат
Кинетические исследования проводили на гликогенсинтазе и фосфорилазе печени, выделенных из мышей с генетическим диабетом db / db .Ферменты гликогенсинтазы а и b от мышей с диабетом имели значения V max на 30% и 20% соответственно ниже, чем ферменты от нормальных мышей. Гликоген-синтаза b от мышей с диабетом также имела на 30% ниже l 0,5 для P i и АТФ при физиологических концентрациях UDP-глюкозы (0,25 мМ) по сравнению с нормальным ферментом. Кинетические исследования фосфорилазы а показали, что при низких концентрациях гликогена (0,25 мг / мл) V max диабетического фермента в два раза больше, чем у нормального фермента.Вероятно, это было связано с диабетической фосфорилазой А, имеющей более низкий кажущийся K m для гликогена. Этот фермент также имел немного более высокое значение l 0,5 для АТФ по сравнению с ферментом от нормальных мышей.
Структурные исследования гликогена печени, выделенного у этих мышей с диабетом, показали отличия от гликогена нормальных мышей. Пределы как α-, так и β-амилазы были ниже в диабетическом гликогене, а средняя длина цепи, длина внешней цепи и длина внутренней цепи, рассчитанные из этих пределов, были все короче в гликогене от диабетических мышей.Хотя как нормальный, так и диабетический гликоген поглощал свет максимально при 430 нм в комплексе с йодом, абсолютное значение поглощения было значительно ниже для диабетического гликогена. Эти данные предполагают измененный паттерн ветвления гликогена печени у мышей с диабетом, и предполагается, что эта измененная структура может в конечном итоге влиять на активность ферментов, метаболизирующих гликоген. Эти результаты обеспечивают дополнительную характеристику мышей db / db и показывают не описанные ранее изменения в кинетике фосфорилазы А и структуре гликогена, которые происходят при диабете.
- Получено 18 апреля 1985 г.
- Исправление получено 22 июля 1985 г.
- Авторское право © 1986 Американской диабетической ассоциации
Структура, синтез, возникновение и важность
Введение
Всем клеткам человека для правильного функционирования требуется постоянный запас глюкозы. Глюкоза используется в качестве источника энергии в большинстве клеток. Он необходим для нормального функционирования клеток мозга, красных кровяных телец и скелетных мышц.Глюкозу в крови получают в основном из трех источников; диета, глюконеогенез и деградация гликогена.
Гликоген — макромолекула, относящаяся к категории полисахаридов. Это единственная молекула хранения глюкозы, обнаруженная в клетках животных. Гликоген может синтезироваться в некоторых клетках животных в процессе гликогенеза. В этой статье мы подробно изучаем структуру, свойства, синтез, метаболизм и важность гликогена. Итак, продолжайте читать.
Структура
Гликоген — это полимер альфа-D-глюкозы.Тысячи молекул глюкозы в гликогене связаны друг с другом через гликозидные связи альфа 1-4 и альфа 1-6. Гликоген состоит из длинных цепочек молекул глюкозы, которые сильно разветвляются.
Все молекулы глюкозы в линейной цепи гликогена связаны через альфа-1-4 гликозидные связи. Разветвления возникают из этой линейной цепи через альфа-1-6 гликозидную связь. Это означает, что молекула глюкозы в точке разветвления присоединена к основной цепи через альфа-связь 1-6. Остальные молекулы глюкозы в ответвлении имеют связи альфа 1-4.
Ветвление происходит с интервалом от 8 до 12 субъединиц глюкозы.
Молекула гликогена также имеет в своем центре белок, известный как белок гликогенин. Этот белок образует ядро молекулы гликогена.
Молекула гликогена образует сферическую форму вокруг гликогена в белке таким образом, что вся структура выглядит как дерево с ветвями, выходящими из центра.
В цитоплазме живых клеток гликоген присутствует в виде гранул.Эти гранулы образованы гликогеном с водой, присутствующей в цитоплазме.
Синтез
Гликоген синтезируется в основном в клетках печени и мышц в процессе, известном как гликогенез. Этот процесс происходит в цитозоле и использует энергию в виде АТФ и УТФ.
Гликогенез — это процесс, при котором молекулы гликогена синтезируются из мономеров глюкозы. Эти мономеры глюкозы соединены гликозидными связями с образованием линейной цепи. Позже образуются ветви.Таким образом, гликогенез включает два этапа;
- Синтез линейной цепи гликогена
- Образование разветвлений
Синтез линейной цепи гликогена
Линейная цепь гликогена состоит из молекул UDP-глюкозы. Он включает в себя следующие шаги;
- Синтез UDP-глюкозы
Уридиндифосфат-глюкоза (UDP-глюкоза) действует как предшественник всех молекул глюкозы, содержащихся в гликогене.Он синтезируется из молекулы глюкозо-1-фосфата и UTP ферментом UDP-глюкозопирофосфорилаза. В этом процессе также образуется молекула пирофосфата (PP i ).
Молекула глюкозо-1-фосфата, используемая в этой реакции, производится из глюкозо-6-фосфата ферментом фосфоглюкомутазой. Этот фермент переносит фосфатную группу с последнего углерода на первый углерод глюкозы.
- Синтез праймера
На следующем этапе создается праймер в форме белка гликогенина.Это необходимо, потому что фермент гликогенсинтаза может присоединять молекулы глюкозы только к уже существующему праймеру, который может быть уже существующим фрагментом гликогена или белка гликогенина.
Белок гликогенин содержит тирозиновые аминокислоты. Гидроксильная группа, присутствующая в боковой цепи тирозина, действует как акцептор первой молекулы глюкозы. Процесс катализируется самим белком гликогенином.
- Удлинение цепи гликогена
После создания праймера линейная цепь гликогена конструируется путем соединения молекул глюкозы через альфа-1-4 гликозидные связи.Он включает перенос молекулы глюкозы от UDP-глюкозы к невосстанавливающему концу цепи гликогена. Невосстанавливающий конец цепи гликогена — это тот, который имеет концевой сахар без свободной функциональной группы. Аномерный углерод концевого сахара связан с другой глюкозой через гликозидную связь.
Весь этот процесс катализируется ферментом гликогенсинтаза. Молекулы UDP, высвобождаемые в этом процессе, повторно превращаются в UTP под действием фермента нуклеозиддифосфаткиназы.
Формирование филиалов
Молекула, полученная в результате описанных выше этапов, представляет собой полимер субъединиц глюкозы, связанных в линейную цепь.Такая молекула содержится в растениях и называется амилозой.
У людей и других животных эта линейная молекула подвергается обширному древовидному ветвлению с образованием гликогена.
Разветвления гликогена образуются специальным ферментом, называемым амило-альфа (1-4) -> альфа (1-6) -трансглюкозидаза. Этот фермент имеет две активности;
- Альфа-1-4-глюкозидазная активность
- Альфа-1-6-глюкозидная активность
Процесс ветвления включает два этапа;
- На первом этапе фермент разветвления удаляет фрагмент, содержащий от шести до восьми остатков глюкозила, с невосстанавливающего конца цепи гликогена.Этот процесс включает гидролиз альфа-1-4 гликозидной связи.
- На следующем этапе указанный выше фрагмент присоединяется к невосстанавливающему глюкозильному остатку путем образования альфа-1-6 гликозидной связи.
В результате этого процесса образуются два невосстанавливающих конца. Удлинение цепи продолжается на обоих концах. После удлинения с помощью того же процесса создаются дополнительные ветви.
Процесс повторяется несколько раз, и образуется молекула гликогена с многочисленными древовидными ветвями, берущими свое начало от центрального протеина ядра, гликогенина.
происшествие
Гликоген встречается только у животных. У людей он в больших количествах содержится в основном в печени и скелетных мышцах. Другие клетки тела также содержат гликоген в небольших количествах для собственных нужд.
У нормального человека в скелетных мышцах присутствует 400 граммов гликогена, что составляет 1-2% от мышечной массы покоя. Печень сытого мужчины содержит около 100 граммов гликогена, что составляет около 10% его веса.
Запасы гликогена в печени колеблются в зависимости от уровня глюкозы в крови.Его количество увеличивается в сытом состоянии и истощается во время голодания. С другой стороны, запасы гликогена в мышцах почти постоянны. Они претерпевают небольшие изменения только в случае физических упражнений, и на них не влияет голодание. Однако голодание истощает запасы гликогена как в печени, так и в скелетных мышцах.
Гликогенолиз
Гликоген, присутствующий в тканях животных, расщепляется с высвобождением молекул глюкозы в процессе гликогенолиза. Этот разрушительный путь — не просто обращение вспять гликогенеза, реакции синтеза гликогена.На этом пути требуются разные ферменты.
Процесс гликогенолиза происходит в цитозоле клеток, имеющих запасы гликогена. Он состоит из двух этапов;
- Укорочение цепи
- Удаление разветвлений
Для каждого из этих двух процессов требуются разные типы ферментов.
Укорочение цепи
Это включает разрыв альфа-1-4 гликозидных связей между остатками глюкозы, присутствующими в гликогене.Эта реакция осуществляется ферментом гликогенфосфорилазы.
Этот фермент отщепляет остатки глюкозы на невосстанавливающем конце цепи гликогена и высвобождает их в виде молекул глюкозо-1-фосфата.
Процесс продолжается до тех пор, пока 4 субъединицы глюкозы не останутся в конце цепи перед точкой ветвления.
Образованная таким образом структура, имеющая четыре остатка глюкозы перед точкой разветвления, называется предельным декстрином.
Этот предельный декстрин подвергается дальнейшей деградации после процесса разветвления.
Удаление веток
Процесс разветвления осуществляется специальным ферментом, который называется ферментом разветвления гликогена.
Этот фермент имеет две активности;
- Активность олиго-альфа (1-4) в альфа (1-4) глюкантранферазы
- Активность амило-альфа (1-6) глюкозидазы
В соответствии с двойной активностью фермента, процесс расщепления ветвей включает два этапа;
- На первом этапе фермент удаляет последние три из четырех глюкозильных остатков на ответвлении и переносит их на невосстанавливающий конец другого ответвления, удлиняя цепь.Эта цепь снова расщепляется ферментом гликогенфосфорилазы до тех пор, пока не останутся четыре остатка, и процесс повторяется.
- На втором этапе фермент расщепляет альфа-1-6 гликозидную связь в точке разветвления гликогена и высвобождает свободную молекулу глюкозы.
В процессе гликогенолиза образуются два продукта;
- Глюкозо-1-фосфат
- Глюкоза
Молекула глюкозо-1-фосфата является основным продуктом гликогенолиза.Если он не превращается в глюкозо-6-фосфат, он не может использоваться в гликолитических путях для получения энергии. Это преобразование осуществляется ферментом фосфоглюкомутазой.
В клетках печени эта молекула глюкозо-6-фосфата переносится в ER, где фермент фосфатаза расщепляет ее до глюкозы. Образовавшаяся глюкоза попадает в цитозоль. В печени молекулы глюкозы, полученные в результате разложения гликогена, попадают в кровь.
В скелетных мышцах отсутствует фермент глюкозо-6-фосфатаза.Они не могут генерировать свободную глюкозу из гликогена и, следовательно, не являются источниками свободной глюкозы.
Лизосомная деградация
Небольшая часть гликогена постоянно разлагается лизосомальным ферментом альфа-1-4-глюкозидазой. Это разложение высвобождает свободные молекулы глюкозы из гликогена. Хотя важность этого пути неизвестна, его отсутствие может привести к одной из нескольких болезней накопления гликогена.
Клиническая важность
Гликоген — это самый важный запас энергии в нашем организме.Он обеспечивает наш организм глюкозой во время голодания. Любое нарушение синтеза или разложения гликогена может привести к различным метаболическим состояниям.
Любой дефект в процессе деградации гликогена приводит к его аномальному накоплению внутри клеток. Эти метаболические дефекты известны как болезни накопления гликогена. Все это наследственные заболевания, при которых один или несколько ферментов метаболизма гликогена недостаточны или отсутствуют. Некоторые из этих болезней накопления обсуждаются ниже.
Болезнь фон Гирке
Он также известен как болезнь накопления гликогена типа 1a. при этом заболевании фермент глюкозо-6-фосфатаза недостаточен. В результате, свободные молекулы глюкозы не могут быть произведены печенью из гликогена и не могут попасть в кровь.
Потребность организма в глюкозе не может быть удовлетворена во время голодания. Таким образом, это приводит к гипогликемии натощак.
Поражает как печень, так и почки, вызывая прогрессирующую гепатомегалию, спленомегалию и почечную недостаточность.У больных также наблюдается задержка роста и задержка полового созревания.
Это наиболее тяжелая болезнь накопления гликогена, которая также приводит к молочнокислой ацидемии, гиперлипидемии и гиперурикемии.
Дефицит глюкозо-6-фосфаттранслоказы
Как видно из названия, фермент глюкозо-6-фосфаттранслоказы недостаточен при этом заболевании. Другое название этого заболевания — болезнь накопления гликогена типа 1b.
Признаки и симптомы этой болезни аналогичны симптомам болезни фон Гирке.Кроме того, при этом нарушении обмена веществ также наблюдаются нейтропения и рецидивирующие инфекции.
Болезнь Помпе
Это лизосомная болезнь накопления. При этом заболевании лизосомальный фермент альфа-1-4-глюкозидаза недостаточен. Хотя это генерализованное заболевание, оно в первую очередь поражает сердце, печень и мышцы.
При этом заболевании в лизосомах могут наблюдаться чрезмерные аномальные вакуоли хранения гликогена. Хотя уровень глюкозы в крови в норме, это приводит к массивной кардиомегалии.Обычно смерть наступает в раннем возрасте из-за сердечной недостаточности.
Болезнь Кори
Это болезнь накопления гликогена 3 типа, характеризующаяся дефицитом фермента разветвления. При этом заболевании в клетках обнаруживается гликоген с аномальной структурой. Это может привести к гипогликемии натощак.
Синдром Макардла
Это болезнь накопления гликогена 5 типа с дефицитом фермента гликоген-миофосфорилазы. Поражаются только скелетные мышцы. Для него характерны временная слабость и спазмы скелетных мышц после тренировки.
Мышечное развитие у таких людей нормальное. Однако у таких пациентов иногда наблюдается миоглобинурия и миоглобинемия.
Сводка
Гликоген — это сильно разветвленный полимер глюкозы, встречающийся только у животных.
Он состоит из субъединиц альфа-D-глюкозы, связанных 1-4 гликозидными связями. Гликозидная связь альфа 1-6 видна в точках ветвления.
Молекула гликогена показывает многочисленные древовидные ветвления, исходящие из центрального ядра, которое содержит белок, называемый гликогенином.
Синтез гликогена происходит в цитозоле. Он включает в себя следующие шаги;
- Синтез UDP-глюкозы, которая обеспечивает все остатки глюкозы в гликогене
- Синтез праймера, на котором построена цепь гликогена
- Удлинение цепи гликогена
- Образование ветвей
Гликоген в большом количестве присутствует в печени и скелете мышцы животных. Запасы гликогена в печени выделяют глюкозу в кровь во время голодания.
Гликоген метаболизируется в организме человека в процессе гликогенолиза. Это происходит в два этапа;
- Укорочение цепи
- Удаление ветвей
Продуктом гликогенолиза являются глюкозо-1-фосфат и глюкоза. В печени глюкозо-1-фосфат превращается в глюкозу и попадает в кровь.
Любая аномалия в деградационном пути гликогена приводит к аномальному накоплению гликогена в клетках.Эти расстройства известны как болезни накопления гликогена.
Некоторые из болезней, обсуждаемых в этой статье:
- Болезнь фон Гирке
- Дефицит глюкозо-6-фосфаттранслоказы
- Болезнь Помпе
- Болезнь Кори
- Болезнь Макардла
Ссылки
- Крейцман С.Н., Коксон А.Ю., Саз К.Ф. (1992). «Накопление гликогена: иллюзии легкой потери веса, избыточного восстановления веса и искажения оценок состава тела» (PDF). Американский журнал клинического питания . 56 (1 доп.): 292–93. doi : 10.1093 / ajcn / 56.1.292S . PMID 1615908 .
- Guyton, Arthur C .; Джон Эдвард Холл (2011). Учебник медицинской физиологии Гайтона и Холла . Нью-Йорк, Нью-Йорк: Saunders / Elsevier. ISBN 978-5-98657-013-6 .
- Moses SW, Bashan N, Gutman A (декабрь 1972 г.



 Р.
Р.