ВСЕ, ЧТО ВЫ ХОТЕЛИ ЗНАТЬ О ВСАА
Сегодня аминокислоты с разветвленными цепями (BCAA) — одна из самых популярных спортивных добавок. Увеличение мышечной массы, силы, энергии и даже эффективное сжигание жира — вот неполный список целей, в достижении которых BCAA оказываются незаменимыми помощниками.
НА СЧЕТ ТРИ
Начнем с теории: BCAA включает в себя три незаменимые аминокислоты — лейцин, изолейцин и валин. В каждой из них имеется разветвленная боковая цепь, напоминающая «ветку дерева», отсюда и название — «аминокислоты с разветвленными цепями». Несмотря на тот факт, что существует порядка 20 аминокислот, которые мышцы используют для своего роста, BCAA составляют почти треть от всех аминокислот, находящихся в мышцах тела человека.
После поступления любых аминокислот в организм (как в виде добавок, так и в составе белков), они оказываются в печени, которая немедленно разлагает их на элементы и использует для выработки энергии или восстановления мышц и других тканей тела.
ЗАЧЕМ ПРИНИМАТЬ ВСАА
Для дополнительной энергии во время тренировок
Мышцы с готовностью используют аминокислоты с разветвленными цепями в качестве топлива во время тренировок.
Интенсивные и длительные тренировки приводят к окислению аминокислот в мышцах и уменьшению их концентрации. Чтобы этому противостоять, необходимо принимать ВСАА непосредственно перед тренировкой. В таком случае они будут доступны мышцам в качестве прямого источника энергии.
Французские ученые нашли еще одно доказательство тому, что прием ВСАА способен вывести ваши тренировки на новый уровень: аминокислоты с разветвленными цепями влияют на количество поступающего в мозг триптофана, что в свою очередь снижает уровень особого гормона 5-HT, отвечающего за усталость. Это позволит вам заниматься дольше и интенсивнее.
Это позволит вам заниматься дольше и интенсивнее.
Еще одно важное действие аминокислот — повышение аэробной и анаэробной производительности. Экспериментально доказано, что после 10 недель регулярного потребления ВСАА (по 12 г/день) производительность спортсменов на пике активности увеличивается примерно на 19% по сравнению с плацебо.
Для роста мышечной массы и быстрого восстановления после тренировок
Прием ВСАА стимулирует синтез белков, усиливая рост мышц. Исследование, опубликованное в издании Frontiers Physiology, показало, что у людей, принимающих добавку BCAA после силовой тренировки, фиксировали на 22% выше синтез мышечного белка, чем у контрольной группы, не получавшей порцию аминокислот до занятия.
Во время и сразу после физических нагрузок, потребности в аминокислотах резко возрастают, тогда как их запас расходуется намного быстрее, чем в состоянии покоя. Получение дополнительной порции аминокислот позволяет поддерживать высокий уровень мышечного гликогена во время тренировки и стимулирует рост мышечной массы после ее завершения.
Для усиления жиросжигающего эффекта тренировок
Доказано, что прием аминокислот с разветвленными цепями при соблюдении низкокалорийного рациона, способствует более эффективному сжиганию жира. Дело в том, что при регулярных физических нагрузках и соблюдении диеты, количество гормона лептина снижается, что приводит к повышению аппетита и замедлению метаболизма: таким образом организм пытается сохранить запасы энергии. BCAA подавляют аппетит, увеличивают расход калорий за счет сжигания жира и повышают скорость обменных процессов.
Из трех аминокислот скорее всего именно лейцин обеспечивает сжигание жира. В исследовании California State University было отмечено, что регулярное употребление лейцина в течение шести недель значительно снизило объем телесного жира у участников эксперимента. Ученые предположили, что усиление синтеза белков, стимулированное лейцином, увеличивает расход энергии, помогая организму эффективнее избавляться от жировой ткани. Таким образом, прием аминокислот позволяет увеличить расход калорий за счет сжигания жира, повысить метаболизм, и, главное, защитить мышцы от разрушения.
СООТНОШЕНИЕ АМИНОКИСЛОТ
Самая распространенная формула ВСАА 2:1:1. Это означает, что на две части лейцина в составе добавки содержится по одной части валина и изойлецина. Многие производители изменяют соотношение в пользу лейцина, выпуская добавки с пропорцией действующих веществ 4:1:1, 8:1:1 и даже 10:1:1.
В ход научного исследования одна группа участников принимала до и после тренировок лейцин, другая — добавку BCAA с соотношением 2:1:1 кислот в составе, третья — плацебо. Эксперимент показал, что синтез белка в мышцах проходил лучше у группы, принимающей BCAA, что в очередной раз доказало важность всех трех аминокислот в процессе роста мышечной массы и восстановления после тренировок. Добавки с увеличенным содержанием лейцина подходят тем, кто испытывает дефицит аминокислоты в рационе (например, при веганской диете).
ПРАВИЛЬНЫЙ ПРИЕМ АМИНОКИСЛОТ
В зависимости от цели (набор мышечной массы, сжигание жира, увеличение энергии) эксперты рекомендуют принимать примерно 4-8 г ВСАА до четырех раз в день: утром после сна, за полчаса до тренировки, в течение получаса сразу после тренировки и с последним приемом пищи.
| Время | Преимущества |
| Утром сразу после сна | Остановка разрушения мышечной ткани из-за ночного голодания Быстрый рост энергии Снижение чувства голода |
| Перед тренировкой | Быстрый рост энергии Сила мышц |
| После тренировки | Восстановление мышц Рост мышц Снижение степени крепатуры |
| Между приемами пищи | Быстрый рост энергии Снижение чувства голода |
| Последний прием пищи | Снижение чувства голода Замедление процесса разрушения мышечной ткани ночью |
Для чего нужны BCAA и как правильно их принимать?
Что такое ВСАА
ВСАА – это комплекс из трех незаменимых аминокислот: лейцин, изолейцин и валин. Они называются незаменимыми, так как не синтезируются в организме человека, а поступают только с пищей.
Для взрослого человека незаменимыми являются 8 аминокислот, но только три из них имеют особою молекулярную структуру с разветвленной боковой цепочкой. Именно эти аминокислоты и входят в комплекс ВСАА.
Почему именно они? Потому что эти соединения являются основным материалом для построения мышечных тканей и составляют около 35% от числа всех аминокислот в мышцах.
Дефицит незаменимых аминокислот, в частности БЦАА, запускает в организме катаболические процессы, что приводит к разрушению мышечных волокон, тканей и внутренних органов.
Зачем принимать ВСАА?
Спортсменам, чья цель построение красивого мускулистого тела, необходимо больше аминокислот, чем не тренирующемуся человеку. Но получить нужное количество ВСАА вместе с пищей довольно сложно, так как в пищевых белках содержится всего 20-25 % указанных аминокислот. Поэтому если вы хотите нарастить мышцы, привести их в тонус и ускорить процесс восстановления после тренировки, то оптимизируйте свой рацион приемом ВСАА.
Помимо восстановления мышц, прием ВСАА способствует замедлению катаболических процессов в организме. После тренировки концентрация аминокислот в мышцах существенно снижается. И для того, чтобы восполнить их запасы, организм начинает разрушать белковые соединения, то есть мышечные волокна. Прием добавки после тренировки предотвратит процесс разрушения и ускорит восстановление мышц.
Если ваш рацион составлен с дефицитом калорий или вы ограничиваете количество животных белков в еде, то мышечные ткани сильнее разрушаются во время тренировок. Дополнительная порция аминокислот сможет предотвратить этот процесс и ускорить восстановление.
Также стоит отметить, что ВСАА помогают организму справиться со стрессом и укрепить иммунитет.
Помогает ли прием ВСАА худеть?
Проведенные исследования доказали, что незаменимые аминокислоты стимулируют процессы жиросжигания в организме. Лейцин, входящий в состав ВСАА, участвует в секреции лептина – гормона, который определяет скорость жиросжигания, вес тела и аппетит.
Когда наступает дефицит аминокислот, лептин перестает вырабатываться, так как мозг думает, что наступили «голодные времена» и не время избавляться от лишнего. При избытке лейцина организм «считает», что поступает калорийная пища и запасы можно не делать.
Кроме того, БЦАА увеличивает расход калорий за счет сжигания жировых отложений и ускоряет метаболизм.
Сколько грамм ВСАА принимать в день
Профессиональные тренеры советуют принимать 4-8 гр аминокислот за один раз, как для похудения, так и для набора мышечной массы. Кратность приема: 1-3 раза в сутки.
Что лучше выбрать: таблетки или порошок?
Наиболее распространёнными формами ВСАА являются таблетки/капсулы и порошок.
Таблетированная форма, на первый взгляд, кажется удобнее порошковой. Ведь таблетки можно выпить в любое удобное время без шейкера. Кроме того, чистые аминокислоты имеют горький вкус, который не чувствуется при приеме таблеток.
Но максимальная доза ВСАА в одной таблетке – не более 1000 мг. А это значит, что вам надо выпить минимум 15 таблеток, чтобы получить 15 гр аминокислот.
Порошковая форма дешевле, так как требует меньше производственных процессов. При этом для получения суточной дозы необходимо выпить всего 3 порции порошка. Кроме того, ВСАА в порошке часто выпускают с различными вкусовыми добавками, и готовые коктейли с легкостью заменят привычные прохладительные напитки.
Когда правильно пить ВСАА
При наборе мышечной массы рекомендуется принимать 3 порции аминокислот в день:
- утром,
- за 30-40 минут до тренировки,
- сразу после тренировки.
Некоторые спортсмены принимают ВСАА еще и во время тренинга, чтобы обеспечить мышцы постоянным питанием. В дни отдыха рекомендуется пить аминокислоты с утра и днем между приемами пищи.
При похудении или сушке схема приема ВСАА остается такой же. При активном жиросжигании можно добавить несколько порций в перерывах между едой для подавления чувства голода и катаболизма. Но опытные тренеры рекомендуют для этих целей использовать протеин.
При активном жиросжигании можно добавить несколько порций в перерывах между едой для подавления чувства голода и катаболизма. Но опытные тренеры рекомендуют для этих целей использовать протеин.
Противопоказания и вред ВСАА
Прежде чем принимать аминокислотные комплексы, следует ознакомиться с противопоказаниями, к которым относятся острые и хронические заболевания органов ЖКТ, печени, почек, поджелудочной железы и желчевыводящих путей. Чтобы не нанести вред организму, соблюдайте инструкцию по применению ВСАА.
Также может наблюдаться индивидуальная непереносимость одного из компонентов комплекса. Но, как показывает опыт, большинство людей хорошо переносят прием аминокислот.
Рекомендации экспертов PRIME KRAFT
Аминокислотные комплексы ВСАА – это ваш надежный помощник в процессе построения красивого и здорового тела. Не экономьте на себе и покупайте продукцию проверенных производителей.
BCAA от Prime Kraft имеют безопасный состав и проходят строгий производственный контроль, поэтому мы уверены в их качестве.
Помните, что спортивные добавки не творят чудеса, а только помогают добиваться поставленных целей. Регулярные тренировки и правильное питание помогут качественно преобразить ваше тело, а комплекс ВСАА ускорит этот процесс.
По промокоду BLOG в официальном интернет-магазине primekraft.ru скидка на весь ассортимент 10%! Доставка по всей России.
Удачи!
Как правильно принимать аминокислоты BCCA, высчитывать дозировку препарата и совмещать его с другими спортивными добавками?
Белки необходимы для восстановления мышечной массы после интенсивных тренировок. Обычно они образуются из двадцати стандартных аминокислот. Подавляющую их часть организм способен синтезировать самостоятельно, но существуют и те, которые должны поступать в него с пищей. Отсюда их название – незаменимые.
К самым нужным для строительства мышечных тканей незаменимым аминокислотам с разветвленной цепью относят лейцин, валин и изолейцин. Они и объединены в комплекс BCAA (branched chain amino acids).
Они и объединены в комплекс BCAA (branched chain amino acids).
Разновидности
Препараты с BCAA производятся в капсульной, таблетированной и порошковой форме. Капсулы, как и таблетки, удобны в употреблении и имеют нейтральный вкус, в отличие от порошка, оставляющего во рту горьковатое послевкусие.
Некоторые порошки плохо растворяются в воде, поэтому лучше принимать их так: положить на язык порцию средства и проглотить, запив обильным количеством жидкости. Но есть и водорастворимые варианты с подсластителями и ароматизаторами.
Внимание! При покупке БАД проверяйте соотношение аминокислот. Оптимальным считается такое: 2 части лейцина, 1 – валина, 1 – изолейцина.
Правила приема
Схемы приема биокомплекса в тренировочные и посттренировочные дни разнятся. При повышенной физической нагрузке в организме запускаются противоречащие процессы: анаболические – формирование новых мышечных волокон, катаболические – разрушение старых. Задача – простимулировать первые и притормозить вторые.
Задача – простимулировать первые и притормозить вторые.
Во время занятий спортом организму нужен вспомогательный источник энергии. Если не обеспечить его поступление извне, он начнет использовать резервные запасы внутри. Сперва расходует весь гликоген, а затем примется за аминокислоты в мышцах. В качестве их защитника и выступают БЦАА. Они быстро усваиваются и вовлекаются в процесс, не позволяя организму «поедать» собственные мышцы.
Внимание! Чтобы получить максимальную пользу от BCAA, принимайте их до и после занятий. Если оно длится больше часа, можно понемногу употреблять добавку на протяжении тренировки.
Катаболические процессы наиболее агрессивны в ходе спортивных занятий, но продолжаются и в последующие дни. Особенно молниеносно они развиваются после сна. Если съесть на завтрак белковую пищу, организм будет долго расщеплять ее до аминокислот. На помощь в этой ситуации приходит BCAA, компоненты которого моментально проникают в толщу мышц. Рекомендуемая дозировка – 50% от ежедневной дозы.
Рекомендуемая дозировка – 50% от ежедневной дозы.
По сколько принимать?
Дозировку спортивного питания можно узнать из указанной на его упаковке инструкции по применению. Но желательно рассчитать ее с учетом своего веса. Идеальная норма потребления лейцина для проведения эффективной тренировки составляет 33 мг на 1 кг массы тела человека. Учитывая правильное соотношение составляющих BCAA (2:1:1), можно с легкость определить объем биодобавки.
BCAA 💪 для мышц 👍
Основные свойства BCAA
ВСАА – комплекс, состоящий из трех аминокислот. Они являются важным компонентом белка. Отличие bcaa от других аминокислот в том, что организм их не синтезирует. Три аминокислоты объединены в один комплекс, потому что их действие происходит одновременно и они взаимодополняют друг друга.
Топливо для мышц
Аминокислоты bcaa являются незаменимыми и должны поступать в организм в достаточных объёмах, особенно при больших физических нагрузках. Под понятием «незаменимые» понимается то, что организм не может самостоятельно их синтезировать.
Они являются расщеплёнными элементами протеина в виде таких аминокислот, как валин, лейцин, а также изолейцин. Это означает, что организму не нужно тратить энергию на их усвоение, которое происходит намного быстрее, чем при употреблении обычного белка.
BCAA необходим мышцам
Мышц на теле человека много и они отличаются по своим функциям и возможностям. Но структура схожая: самые весомые составляющие — вода (70-80%) и аминоклислоты (10-20%).
Эти три аминокислоты составляют порядка 35% в структуре всех аминокислот, из которых состоят мышцы. Если рассматривать только незаменимые, то доля будет 42%.
Это довольно много. До двадцати пяти процентов энергии при занятиях выделяется как раз из bcaa. При потреблении пищи, богатой протеином, первыми в кровь поступают именно эти аминокислоты.
При потреблении пищи, богатой протеином, первыми в кровь поступают именно эти аминокислоты.
Иными словами, если нет bcaa, мышцы начинают голодать. Регулярные занятия тяжелой атлетикой или пауэрлифтингом приводят к разрушению части сократительного белка. Очень важно в это время принимать именно тот белок, который необходим.
BCAA снимают усталость мышц, уменьшают потери других аминокислот, которые содержатся в организме. Если принимать bcaa непосредственно перед тренировкой, выносливость мышц повысится, а усталость снизится. Если принимать аминокислоты сразу после тренировки, начнет понижаться уровень кортизола и запас других аминокислот в мышцах увеличится при условии, что они не будут расщеплены для восстановления запасов энергии.
Но сразу нужно учесть тот факт, что в качестве заменителя протеиновых коктейлей, БЦАА не подходят. Это просто невыгодно — выпивая один коктейль, вы доставляете 40-50 грамм белка, а при приёме незаменимых аминокислот это число в 2-3 раза меньше. Конечно, вероятность усвоения организмом БЦАА намного выше, но и цена значительно дороже.
Конечно, вероятность усвоения организмом БЦАА намного выше, но и цена значительно дороже.
Поэтому такую роскошь себе могут позволить только бодибилдеры, которые готовы тратить на своё спортивное питание приличные суммы денежных средств. А так, зачастую их используют исключительно во время сушки, когда нежелательно принимать углеводы, которые в избытке могут превратиться жир. С функцией энергоснабжения, а также для сохранения набранной мышечной массы отлично подходят незаменимые аминокислоты, которые никак не смогут отложиться организмом в жировой ткани.
Функции BCAA
1. Прежде всего, БЦАА — это незаменимые аминокислоты, которые являются расщеплённым белком. То есть они являются строительным материалом для мышц.
2. Bcaa способствуют образованию других аминокислот, которые нужны организму для нормального функционирования. Другими словами, они помогают из аминокислот простой формы сделать более сложную структуру. Аминокислоты bcaa положительно влияют на выработку инсулина, который обеспечивает циркуляцию сахара в крови, а он, в свою очередь, питает клетки мышечных волокон энергией. А когда вырабатывается инсулин, усвоение аминокислот происходит быстрее.
А когда вырабатывается инсулин, усвоение аминокислот происходит быстрее.
3. Аминокислоты BCAA поддерживают кортизол и тестостерон на благоприятном уровне, увеличивают синтез белка, стимулируют выработку инсулина и гормонов роста.
4. BCAA предотвращает расщепление белка и блокирует потерю мышечных волокон. Это очень важно при низкокалорийной диете.
Исследования
Как показали исследования, чтобы уменьшить истощение мышечной ткани спортсменам необходимо употреблять достаточное количество незаменимых аминокислот.
Также было установлено, что у спортсменов, после тяжелой силовой тренировки, восстановление мышц проходит в две фазы следующие фазы.
Сначала идет катаболизм, после чего наступает анаболизм – рост мышечной ткани. Если анаболизм длится дольше катаболизма, то мышцы начнут усиленно расти. Если катаболизм будет длиться дольше, то наоборот. Если сократить период катаболизма, то можно достичь быстрого роста мышечной ткани. Как раз такому сокращению и могут поспособствовать БЦАА.
Однако, максимальную пользу можно извлечь, если принимать аминокислоты после тренировки одновременно с быстрыми углеводами, которые, в свою очередь, дадут мышцам дополнительный источник энергии и активизируют выработку инсулина. Приготовить такой коктейль просто. Достаточно смешать 25 грамм углеводов с десятью граммами белка. Пища будет способствовать вашему насыщению, а bcaa сократит катаболизм и увеличит эффект от тренировки.
Побочные действия
Многие недооценивают данный комплекс аминокислот. Кто-то считает, что принимать его опасно. Но это все идет от незнания внутренней работы организма. Аминокислоты bcaa – это те же аминокислоты, из которых состоит пища, к примеру, молоко или мясо. Поэтому вся опасность заключается лишь в том, насколько качественный продукт вы употребите.
Bcaa: как принимать?
Есть оптимальная доза, которая подходит большинству – это от четырех до восьми граммов как при наборе мышечной массы, так и при сжигании жира. Принимать аминокислоты необходимо до трех раз в сутки.
Можно потреблять и меньшее количество, но его не хватит, чтобы насытить организм. Многие производители понимают, что некоторые люди не знают всех нюансов и осознанно обманывают покупателей. В частности они выпускают аминокислоты в маленьких дозах, а цены при этом держат высокими. Чтобы не попасться на удочку, при покупке всегда обращайте внимание на количество порций и размер дозы. Перерывы при приеме не требуются.
Чтобы добиться более высоких результатов, необходимо принимать комплекс аминокислот BCAA отдельно от других аминокислот. Дело в том, что так они быстрее поступят в организм.
Поскольку аминокислоты намного лучше усваиваются при повышенном уровне инсулина, принимать их необходимо одновременно с пищей за полчаса до и после тренировки.
За это время восстановительные процессы успеют активизироваться и создадутся благоприятные условия для анаболизма.
Какие bcaa лучше?
Есть несколько комплексов аминокислот. Наиболее популярные из них:
Xtend от SciVation. Это очень сильная добавка, которая уменьшает фазу катаболизма, при этом мышцы начинают расти в несколько раз быстрее. Она содержит в себе все необходимые ингредиенты, которые доказали свою эффективность на практике. Глютамин, цитруллин, а также пиридоксин содержатся в ней в достаточных дозах. Эта добавка считается лучшей по следующим причинам:
Это очень сильная добавка, которая уменьшает фазу катаболизма, при этом мышцы начинают расти в несколько раз быстрее. Она содержит в себе все необходимые ингредиенты, которые доказали свою эффективность на практике. Глютамин, цитруллин, а также пиридоксин содержатся в ней в достаточных дозах. Эта добавка считается лучшей по следующим причинам:
— усиленное подавление катаболизма;
— ускорение синтеза белков;
— стимулирование гормона роста;
— ускорение репарации и многое другое.
Intra Fuel от SAN. Принимать препарат можно на протяжении тренировочного процесса. Его прием предотвращает разрушение мышечной ткани и повышает общую выносливость организма. Это также хороший вариант, который поможет вам вовремя доставить нужное количество аминокислот в организм.
SuperPump MAX от Gaspari Nutrition. Эта добавка очень популярна у спортсменов запада. Принимается она до начала тренировки и занимает лидирующие позиции на рынке продаж уже несколько лет. Однако при детальном исследовании выяснилось, что эта добавка может занимать максимум третье место, поскольку не содержит в себе достаточного количества активных веществ. Помимо этого, кроме аминокислот в комплекс входят многие другие компоненты. Это сказывается на стоимости добавки.
Однако при детальном исследовании выяснилось, что эта добавка может занимать максимум третье место, поскольку не содержит в себе достаточного количества активных веществ. Помимо этого, кроме аминокислот в комплекс входят многие другие компоненты. Это сказывается на стоимости добавки.
Если вы хотите максимально быстро восстанавливаться после тренировки, быть выносливее и сильнее, то вам просто необходимо принимать комплекс аминокислот bcaa. Никакого вреда от его приема нет, однако перед тем, как отправиться в магазин за товаром, почитайте о нем отзывы.
Также не стоит покупать препарат в подозрительных местах, поскольку вместо bcaa, там могут быть опасные для жизни вещества.
BCAA — для чего? Узнай, что такое BCAA (БЦАА)
Что такое bcaa, для чего нужен протеин, стоит ли пить гейнер? Такие вопросы вы можете задать своему тренеру, если недавно записались в спортзал и, освоив технику, решили узнать, как быстрее нарастить мышечную массу. Этот интерес совершенно логичен – зачем перетруждаться в зале, если можно выпить «волшебную пилюлю» и стать похожим на Геркулеса? Можем поспорить, что ваш тренер наверняка скажет, что употреблять такие добавки просто необходимо, и даже предложит вам что-то купить. Это и не удивительно — зарплата сотрудников фитнесс-зала зависит не столько даже от занятий с клиентами, сколько от прямых продаж спортивной фармакологии. А как дела обстоят на самом деле, есть ли необходимость в приеме аминокислот или протеиновых коктейлей?
Это и не удивительно — зарплата сотрудников фитнесс-зала зависит не столько даже от занятий с клиентами, сколько от прямых продаж спортивной фармакологии. А как дела обстоят на самом деле, есть ли необходимость в приеме аминокислот или протеиновых коктейлей?
Добавки и спортивное питание
Прежде чем спрашивать у тренера, стоит ли вам употреблять протеин, креатин или optimum bcaa, столь популярный сегодня, подумайте вот над чем.
Культуризм удит корнями ко временам героев античной Греции и Рима. Ахиллес, Геракл, боги Олимпийского пантеона из мифологии, да и обычные греки и римляне имели великолепные тела, не употребляя никаких добавок к своему обычному питанию. Их внешний вид обуславливался постоянным тренингом – боями и подготовкой к ним. Наверняка, подрастающие спартанцы не спрашивали про bcaa, для чего их употреблять, а просто работали над собой.
К чему все эти рассуждения? На самом деле получить красивое тело с естественной прорисовкой мышц реально для каждого. Спортивная фармакология – это бизнес, который зачастую предлагает фанатам бодибилдинга безвредное плацебо. Все препараты можно заменить обычным здоровым питанием (речь не идет, конечно, о стероидах).
Спортивная фармакология – это бизнес, который зачастую предлагает фанатам бодибилдинга безвредное плацебо. Все препараты можно заменить обычным здоровым питанием (речь не идет, конечно, о стероидах).
Аминокислоты – что это такое
Если вам интересно знать значение термина «bcaa», что такое этот препарат и что он даст вашему организму, обратимся к физиологии.
Мы не можем нормально существовать и развиваться без ежедневного поступления в наш организм белков. Отчасти причина кроется в том, что белки содержат аминокислоты. Нужно отметить, что аминокислоты содержат все белки, как животного происхождения (мясо, птица, рыба, молочная продукция), так и растительного (бобовые и злаки).
Ученые выделяют более чем двести аминокислот, и из них двадцать две аминокислоты являются очень важными для здорового обмена веществ.
Заменимые и незаменимые аминокислоты
Большую часть необходимых аминокислот организм может синтезировать самостоятельно из других видов аминокислот (они являются заменимыми), но есть девять аминокислот, которые организм не может производить самостоятельно.![]() Чтобы получать их, мы должны регулярно употреблять продукты, содержащих их. Какова потребность организма в этих девяти незаменимых аминокислотах? Ежедневно мы должны употреблять от 10 до 15 грамм аминокислот, то есть, потребляя с пищей более 70 грамм белка, мы покрываем имеющуюся потребность организма для здорового функционирования.
Чтобы получать их, мы должны регулярно употреблять продукты, содержащих их. Какова потребность организма в этих девяти незаменимых аминокислотах? Ежедневно мы должны употреблять от 10 до 15 грамм аминокислот, то есть, потребляя с пищей более 70 грамм белка, мы покрываем имеющуюся потребность организма для здорового функционирования.
Но эта дозировка является нормальной для обычного человека. Тому же, кто занимается силовыми видами спорта, необходимо съедать каждый день в два раза больше белка (от 140 грамм), чтобы покрывать потребность организма в аминокислотах.
bcaa: что такое и сколько его нужно?
ВСАА (БЦАА) – это комбинация всего из трех видов незаменимых аминокислот. К ним относятся валин, изолейцин и лейцин. Сколько нужно употреблять БЦАА в день? Если речь идет о взрослом мужчине, чей вес составляет около 80 кг, то ему нужно 7 граммов этих аминокислот. Без БЦАА развитие организма затормаживается, все процессы прекращаются, в том числе и способность организма к регенерации и восстановлению. БЦАА – это важный продукт для каждого, но неужели мы должны принимать таблетки, чтобы получить его?
БЦАА – это важный продукт для каждого, но неужели мы должны принимать таблетки, чтобы получить его?
Можно ли получить ВСАА из еды?
Если и в продуктах питания содержится bcaa, что такое нужно есть, чтобы доставить аминокислоты в организм? Давайте разберемся!
Мясо курицы – 300 грамм в день достаточно, чтобы покрыть дневную норму в лизине, триптофане, гистидине, фениланине и ВСАА.
Фасоль, бобы, горох — богаты валином, триптофаном, треонином, метионином. 150 грамм в день будет достаточно для получения нормы аминокислот.
Творог, сыр – содержат триптофан, лизин, аргинин, валин, фенилаланин.
Яйцо – привычный нам продукт великолепно усваивается, богат ВСАА, метионином и фенилаланином.
Рыба – изолейцин, лизин и фенилаланин содержатся в этом продукте в больших количествах.
Крупа – гречка, пшено, овес являются источниками изолейцина, валина, гистидина, лейцина.
Орехи – кроме того, что они содержат в себе комплекс белковых соединений, орехи также богаты гистидином, изолейцином, треонином, лизином.
Смысл употребления ВСАА в добавках
Если незаменимые и самые лучшие bcaa содержатся в пище, то зачем употреблять добавки?
Как говорят производители спортивного питания и препаратов, те аминокислоты, которые содержатся в еде, имеют нестабильную форму. Это значит, что аминокислоты не усваиваются в чистом виде, а перед этим могут вступать в реакции и образовывать новые соединения. Следовательно, содержание полезных веществ не является величиной постоянной. Чтобы избежать потери аминокислот, спортсмены могут употреблять биологически активные добавки, к которым и относятся аминокислотные комплексы (содержат до 18-ти типов аминокислот), выделенные аминокислоты (добавка содержит всего одну аминокислоту) или ВСАА (как вы уже знаете, они содержат всего три вида аминокислот).
Как влияют ВСАА на рост мышц?
Известен факт, что человек является белковой формой жизни. Следовательно, аминокислоты, из которых состоят белки, необходимы организму. Особенно важно употребление важнейших аминокислот bcaa, для чего вы можете есть вышеперечисленные продукты или принимать определенные комплексы. — Читайте подробнее на FB.ru: http://fb.ru/article/146008/bcaa—dlya-chego-uznay-chto-takoe-bcaa-btsaa
Особенно важно употребление важнейших аминокислот bcaa, для чего вы можете есть вышеперечисленные продукты или принимать определенные комплексы. — Читайте подробнее на FB.ru: http://fb.ru/article/146008/bcaa—dlya-chego-uznay-chto-takoe-bcaa-btsaa
Эти аминокислоты замедляют процессы разрушений мышечной ткани, стимулируют образование новой, ускоряют метаболические процессы и сжигание подкожного жира.
Прием ВСАА
Любопытно заметить, что описывая все преимущества использования комплексов ВСАА, производители фармакологических добавок «случайно» забывают сказать о том, что все эти свойства имеет обычная повседневная пища. Безусловно, употребляя ВСАА в капсулах, вы получите положительный эффект, но его воздействие будет необычайным только в том случае, если вы вообще не употребляете белков. К тому же одна пилюля столь популярного bcaa 1000 содержит всего-навсего 1 грамм белка.
Нужно ли употреблять ВСАА?
Внимательные читатели, прочитав про свойства аминокислот, могут задатся таким вопросом — препараты bcaa для чего употреблять, если тот же протеин состоит на третью часть из аминокислот? И они будут правы.
Если вы употребляете протеиновые коктейли, так как не можете получать необходимый белок из пищи, так зачем вам дополнительно еще платить за комплекс аминокислот?
Вам стоит знать про bcaa, что это всего лишь возможность увеличить длительность вашей тренировки, но не более того. Такой препарат также может дать позитивный эффект, когда вы покрываете суточную необходимость организма в белке из продуктов питания. Тем же, кто только начал заниматься в спортзале, вовсе нет необходимости принимать ВСАА.
Если же вы давно и увлеченно занимаетесь «строительством» своего тела и привыкли пользоваться спортивной фармой, то вам стоит задуматься – не тратите ли вы деньги впустую? Ведь вместо того, чтобы приобрести очередную порцию amino bcaa, вы можете с тем же успехом потратить средства на несколько килограмм мяса.
Никогда изобретения человека не превзойдут то, что дает нам природа. Соблюдая правила здорового, полноценного и сбалансированного питания, вы полностью насытите свой организм всем необходимым. Добавки же в виде аминокислот не повредят вам, но переплачивать за них нет никакого смысла.
Добавки же в виде аминокислот не повредят вам, но переплачивать за них нет никакого смысла.
Чем отличаются аминокислоты и БЦАА, что лучше?
Чем отличаются аминокислоты и БЦАА, что лучше?
Многие спортсмены не могут выбрать, какую добавку употреблять на постоянной основе. Часто их сомнения колеблются между аминокислотными комплексами и БЦАА.
Человеческий организм состоит из белков, которые образуются из аминокислот с пептидной связью. Часть вырабатывается в теле (незаменимые), часть поступает вместе с пищей. БЦАА и аминокислоты – это похожие понятия. Но к первым относятся только три компонента.
Что такое БЦАА?
БЦАА – это аминокислоты, которые имеют разветвленное строение. В состав комплекса входят лейцин, изолейцин, валин. Их прием показан профессиональным спортсменам, так как в процессе тренировок организм сильно истощается. Данный комплекс представляет собой спортивное питание в виде порошка.
Польза БЦАА для организма
Спортивное питание выполняет следующие функции:
- Укрепляет мышцы, препятствует их износу, разрушению.
- Является строительным материалом для мышц.
- Борется с жировой прослойкой.
- Увеличивает силу человека, его выносливость во время занятий спортом.
- Активизирует действие дополнительного спортивного питания.
- Создает основу для синтеза белка в мышечных волокнах.
- Стимулирует выработку инсулина.
- Поддерживает гормоны на нормальном уровне.
Польза аминокислотных комплексов для организма
Данный вид добавки имеет более широкий спектр действия:
- улучшает состояние костной, хрящевой ткани;
- поддерживает здоровье, крепость волос и ногтей;
- стимулирует работу иммунной системы;
- улучшает память, мыслительные способности человека;
- борется с возрастными изменениями;
- активизирует выработку гормонов;
- помогает восстановиться после тяжелого заболевания;
- выводит из организма вредные вещества.

Отличия аминокислот от БЦАА
Эти вещества имеют ряд различий. В чем они заключаются?
- Количество добавок. В состав БЦАА входят только 3 аминокислоты, а аминокислотные комплексы содержат весь спектр активных веществ.
- Время приема. Белковые комплексы рекомендованы к приему рано утром сразу после пробуждения, и вечером перед отходом ко сну. Прием БЦАА привязан к продолжительности спортивных тренировок.
- Время усвоения. БЦАА имеют гораздо более высокую скорость усвоения организмом.
- Дозировка. Средняя доза аминокислотного комплекса – 20 г в день. БЦАА – 5–10г.
- Способ воздействия. Аминокислоты отвечают за иммунитет, состояние волос, ногтей, структуру костей. БЦАА предназначены только для поддержания мышечного корсета организма и повышения выносливости во время занятий спортом.
- Рекомендации по употреблению. Комплексы с белками рекомендуют к употреблению людям, которые далеки от спорта, но стремятся к поддержанию собственного здоровья.
 БЦАА выпускают исключительно для атлетов, спортсменов.
БЦАА выпускают исключительно для атлетов, спортсменов. - Способ получения. Многие аминокислоты организм способен вырабатывать самостоятельно. БЦАА не синтезируются организмом.
-
Содержание в продукте главной аминокислоты – лейцина.
 Исследования показывают, что лейцин жизненно важен для стимуляции роста мышц и стимуляции синтеза белка. Доказано, что употребление от 5 до 20 грамм лейцина в день приводит к увеличению массы мышц, лучшему синтезу белка, ускоренному восстановлению после тренировок и массе других преимуществ. Исследования показали, что употребление 12 грамм лейцина в день увеличило массу мышц у пожилых женщин, которые не тренировались с отягощениями вовсе. Рекомендуется употреблять как минимум 5 грамм этой аминокислоты во время тренировочного процесса. Поэтому важный момент, который вы должны посмотреть – соотношение этой аминокислоты с двумя другими аминокислотами.
Исследования показывают, что лейцин жизненно важен для стимуляции роста мышц и стимуляции синтеза белка. Доказано, что употребление от 5 до 20 грамм лейцина в день приводит к увеличению массы мышц, лучшему синтезу белка, ускоренному восстановлению после тренировок и массе других преимуществ. Исследования показали, что употребление 12 грамм лейцина в день увеличило массу мышц у пожилых женщин, которые не тренировались с отягощениями вовсе. Рекомендуется употреблять как минимум 5 грамм этой аминокислоты во время тренировочного процесса. Поэтому важный момент, который вы должны посмотреть – соотношение этой аминокислоты с двумя другими аминокислотами. Как правило, продукты BCAA выпускаются с большим количеством лейцина, чем изолейцина и валина. Это отношение часто пишется на этикетке как 2:1:1 (классика), или 4:1:1, или 3:1:2, которое читается как отношение лейцин: изолейцин: валин. Некоторые производители выпускают такие продукты, содержание лейцина в котором настолько высоко, как 8:1:1 или 12:1:1 (BCAA 8:1:1 от VP Laboratory, BCAA Complex от Scitec Nutrition и другие).

-
Содержание в продукте глютамина. Глютамин – условно заменимая аминокислота, человеческий организм может вырабатывать ее самостоятельно и получать из других источников. Это – самая большая по содержанию в мышечной ткани аминокислота (в мышцах ее до 60%). Глютамин подавляет катаболизм, ускоряет восстановление синтез белка после тренировок и даже служит источником энергии. Поэтому многие продукты ВСАА обогащены глютамином, среди них Modern BCAA от USPlabs, BCAA Xplode от Olimp Sport Nutrition, BCAA-Pro от SAN и другие.
-
Содержание в продукте важных витаминов и электролитов – это следующее, на что вы должны обратить внимание при покупке BCAA. Обезвоживание на тренировке – огромная проблема, ведь и BCAA не смогут усваиваться с нужной скоростью, так как калий, натрий и другие минералы, участвующие в обмене, выводятся с потерей воды. Отсутствие необходимых электролитов приведет к уменьшению функциональности мышц, увеличению чувствительности и восприимчивости к судорогам.
 Поэтому рекомендуем вам обращать внимание присутствие в составе витаминов и минералов. Например, Monster Amino от CytoSport содержит калий, натрий и витамин B6, также многие комплексы имеют в составе витамин С и витамины группы B.
Поэтому рекомендуем вам обращать внимание присутствие в составе витаминов и минералов. Например, Monster Amino от CytoSport содержит калий, натрий и витамин B6, также многие комплексы имеют в составе витамин С и витамины группы B.
- «Структура сывороточного альбумина: дисульфидные мостики.»
Brown JR
Fed. Proc. 33: 1389-1389 (1974)Процитировано для: ДИСУЛЬФИДНЫХ СВЯЗЕЙ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607 ДИСУЛЬФИДОВ , ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
 ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ. - «Структура сывороточного альбумина: дисульфидные мостики.
 «
«
Brown JR
Fed. Proc. 33: 1389-1389 (1974)Процитировано для: ДИСУЛЬФИДНЫХ СВЯЗЕЙ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607 ДИСУЛЬФИДОВ , ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ. ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- «Структура сывороточного альбумина: дисульфидные мостики.
 .»
.»
Brown JR
Fed. Proc. 33: 1389-1389 (1974)Процитировано для: ДИСУЛЬФИДНЫХ СВЯЗЕЙ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607 ДИСУЛЬФИДОВ , ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ. ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- «Структура сывороточного альбумина: дисульфидные мостики».
Brown J. R.
R.
Fed. Proc. 33: 1389-1389 (1974)Цитируется по: ДИСУЛЬФИДНЫЕ СВЯЗИ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607, ДИСУЛЬФИДНЫЕ СВЯЗИ, ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,65 АНГСТРОМА) 25-607 В КОМПЛЕКСЕ С ДИСУЛЬФИДНЫМИ СВЯЗЯМИ КАЛЬЦИЯ.
- Цитируется по: СТРУКТУРА ЯМР 148-154, ГЛИКАЦИЯ НА LYS-151.

- «Структура сывороточного альбумина: дисульфидные мостики».
Brown J.R.
Fed. Proc. 33: 1389-1389 (1974)Цитируется по: ДИСУЛЬФИДНЫЕ СВЯЗИ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607, ДИСУЛЬФИДНЫЕ СВЯЗИ, ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,65 АНГСТРОМА) 25-607 В КОМПЛЕКСЕ С ДИСУЛЬФИДНЫМИ СВЯЗЯМИ КАЛЬЦИЯ.

- «Структура сывороточного альбумина: дисульфидные мостики.»
Brown JR
Fed. Proc. 33: 1389-1389 (1974)Процитировано для: ДИСУЛЬФИДНЫХ СВЯЗЕЙ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607 ДИСУЛЬФИДОВ , ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ. ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- «Структура сывороточного альбумина: дисульфидные мостики.
 «
«
Brown JR
Fed. Proc. 33: 1389-1389 (1974)Процитировано для: ДИСУЛЬФИДНЫХ СВЯЗЕЙ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607 ДИСУЛЬФИДОВ , ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ. ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- «Структура сывороточного альбумина: дисульфидные мостики».
Brown J. R.
R.
Fed. Proc. 33: 1389-1389 (1974)Цитируется по: ДИСУЛЬФИДНЫЕ СВЯЗИ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607, ДИСУЛЬФИДНЫЕ СВЯЗИ, ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,65 АНГСТРОМА) 25-607 В КОМПЛЕКСЕ С ДИСУЛЬФИДНЫМИ СВЯЗЯМИ КАЛЬЦИЯ.
- «Структура сывороточного альбумина: дисульфидные мостики .
 «
«
Brown JR
Fed. Proc. 33: 1389-1389 (1974)Процитировано для: ДИСУЛЬФИДНЫХ СВЯЗЕЙ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607 ДИСУЛЬФИДОВ , ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ. ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- «Структура сывороточного альбумина: дисульфидные мостики».
Brown J. R.
R.
Fed. Proc. 33: 1389-1389 (1974)Цитируется по: ДИСУЛЬФИДНЫЕ СВЯЗИ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607, ДИСУЛЬФИДНЫЕ СВЯЗИ, ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,65 АНГСТРОМА) 25-607 В КОМПЛЕКСЕ С ДИСУЛЬФИДНЫМИ СВЯЗЯМИ КАЛЬЦИЯ.
- «Структура сывороточного альбумина: дисульфидные мостики.
 «
«
Brown JR
Fed. Proc. 33: 1389-1389 (1974)Процитировано для: ДИСУЛЬФИДНЫХ СВЯЗЕЙ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607 ДИСУЛЬФИДОВ , ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ. ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- «Структура сывороточного альбумина: дисульфидные мостики».
Brown J. R.
R.
Fed. Proc. 33: 1389-1389 (1974)Цитируется по: ДИСУЛЬФИДНЫЕ СВЯЗИ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607, ДИСУЛЬФИДНЫЕ СВЯЗИ, ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,65 АНГСТРОМА) 25-607 В КОМПЛЕКСЕ С ДИСУЛЬФИДНЫМИ СВЯЗЯМИ КАЛЬЦИЯ.
- «Структура сывороточного альбумина: дисульфидные мостики.
 «
«
Brown JR
Fed. Proc. 33: 1389-1389 (1974)Процитировано для: ДИСУЛЬФИДНЫХ СВЯЗЕЙ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607 ДИСУЛЬФИДОВ , ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ. ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- «Структура сывороточного альбумина: дисульфидные мостики».
Brown J. R.
R.
Fed. Proc. 33: 1389-1389 (1974)Цитируется по: ДИСУЛЬФИДНЫЕ СВЯЗИ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607, ДИСУЛЬФИДНЫЕ СВЯЗИ, ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,65 АНГСТРОМА) 25-607 В КОМПЛЕКСЕ С ДИСУЛЬФИДНЫМИ СВЯЗЯМИ КАЛЬЦИЯ.
- «Структура сывороточного альбумина: дисульфидные мостики.
 «
«
Brown JR
Fed. Proc. 33: 1389-1389 (1974)Процитировано для: ДИСУЛЬФИДНЫХ СВЯЗЕЙ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607 ДИСУЛЬФИДОВ , ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ. ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- «Структура сывороточного альбумина: дисульфидные мостики .
 «
«
Brown JR
Fed. Proc. 33: 1389-1389 (1974)Процитировано для: ДИСУЛЬФИДНЫХ СВЯЗЕЙ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607 ДИСУЛЬФИДОВ , ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ. ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- «Структура сывороточного альбумина: дисульфидные мостики.
 «
«
Brown JR
Fed. Proc. 33: 1389-1389 (1974)Процитировано для: ДИСУЛЬФИДНЫХ СВЯЗЕЙ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,47 АНГСТРОМА) 25-607 ДИСУЛЬФИДОВ , ВАРИАНТ THR-214.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (2,70 АНГСТРОМА) ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ФУНКЦИЕЙ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ. ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
 Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Siddiqui, K. S. et al. Роль дисульфидных мостиков в активности и стабильности холодоактивной α-амилазы.
 J. Bacteriol. 187, 6206–6212 (2005).
J. Bacteriol. 187, 6206–6212 (2005).CAS Статья Google ученый
Zhang, L., Chou, C.P. и Moo-Young, M.Образование дисульфидной связи и его влияние на биологическую активность и стабильность рекомбинантных терапевтических белков, продуцируемых системой экспрессии Escherichia coli. Biotechnol. Adv. 29, 923–929, (2011).
CAS Статья Google ученый
Frand, A. R., Cuozzo, J. W. & Kaiser, C. A. Пути образования дисульфидной связи белка. Trends Cell Biol. 10. С. 203–210 (2000).
CAS Статья Google ученый
Триведи, М.В., Лоуренс, Дж.
 С. и Сиахан, Т. Дж. Роль тиолов и дисульфидов в химической и физической стабильности белков. Curr. Protein Pept. Sc. 10, 614–625, (2009).
С. и Сиахан, Т. Дж. Роль тиолов и дисульфидов в химической и физической стабильности белков. Curr. Protein Pept. Sc. 10, 614–625, (2009).CAS Статья Google ученый
Ho, S. B. et al. Богатые цистеином домены муцина кишечника muc3 способствуют миграции клеток, ингибируют апоптоз и ускоряют заживление ран. Гастроэнтерология 131, 1501–1517, (2006).
CAS Статья Google ученый
Лоу, Э.K. et al. Перераспределение дисульфидных связей в белках молока под действием тепла. 2. Дисульфидные связи между бета-лактоглобулином крупного рогатого скота и каппа-казеином. J. Agric. Food Chem. 52, 7669–7680, (2004).
CAS Статья Google ученый
- org/ScholarlyArticle»>
Creamer, L. K. et al. Перераспределение дисульфидных связей в белках молока под действием тепла. 1. Бета-лактоглобулин крупного рогатого скота. J. Agric. Food Chem. 52, 7660–7668, (2004).
CAS Статья Google ученый
Ван дер Планкен, И., Van Loey, A. & Hendrickx, M. E. G. Изменения содержания сульфгидрила в белках яичного белка из-за обработки нагреванием и давлением. J. Agric. Food Chem. 53, 5726–5733, (2005).
CAS Статья Google ученый
Арнтфилд, С. Д., Мюррей, Э. Д. и Исмонд, М. А. Х. Роль дисульфидных связей в определении реологических и микроструктурных свойств индуцированных нагреванием белковых сетей из овальбумина и вицилина. J. Agric. Food Chem.
 39, 1378–1385, (1991).
39, 1378–1385, (1991).CAS Статья Google ученый
Опстведт, Дж., Миллер, Р., Харди, Р.В. и Спинелли, Дж. Вызванные нагреванием изменения сульфгидрильных групп и дисульфидных связей в рыбном белке и их влияние на усвояемость белков и аминокислот у радужной форели (Salmo gairdneri ). J. Agric. Food Chem. 32, 929–935, (1984).
CAS Статья Google ученый
Лагрейн, Б., Brijs, K. & Delcour, J. A. Кинетика реакции сшивки глиадин-глютенин в модельных системах и при выпечке хлеба. J. Agric. Food Chem. 57, 10660–10666, (2008).
Артикул Google ученый
Guillon, B.
 et al. Роль дисульфидных мостиков в протеолитической восприимчивости и аллергенности Ara H 6, основного аллергена арахиса. J. Allergy Clin. Иммунол. 127, AB236 (2011).
et al. Роль дисульфидных мостиков в протеолитической восприимчивости и аллергенности Ara H 6, основного аллергена арахиса. J. Allergy Clin. Иммунол. 127, AB236 (2011).Артикул Google ученый
Бьюкенен, Б.B. et al. Связанное с тиоредоксином смягчение аллергических реакций на пшеницу. P. Natl. Акад. Sci. USA 94, 5372–5377, (1997).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Ло Конте, М. и Кэрролл, К. С. [Химия окисления и обнаружения тиолов] Окислительный стресс и редокс-регулирование. (ред. У. Якоба и Д. Райхмана)] [гл. 1, 1–62] (Springer, 2012).
Google ученый
- org/ScholarlyArticle»>
Торнтон, Дж.М. Дисульфидные мостики в глобулярных белках. J. Mol. Биол. 151, 261–287, (1981).
CAS Статья Google ученый
Xin, F. & Radivojac, P. Посттрансляционные модификации вызывают значительные, но не экстремальные изменения в структуре белка. Биоинформатика 28, 2905–2913, (2012).
CAS Статья Google ученый
Дженсен, О. Н. Модификационная протеомика: характеристика посттрансляционных модификаций с помощью масс-спектрометрии.Curr. Мнение. Chem. Биол. 8, 33–41, (2004).
Артикул Google ученый
Витце, Э.
 С., Олд, В. М., Ресинг, К. А. и Ан, Н. Г. Картирование посттрансляционных модификаций белков с помощью масс-спектрометрии. Nat. Meth. 4, 798–806, (2007).
С., Олд, В. М., Ресинг, К. А. и Ан, Н. Г. Картирование посттрансляционных модификаций белков с помощью масс-спектрометрии. Nat. Meth. 4, 798–806, (2007).CAS Статья Google ученый
Манн М. и Дженсен О. Н. Протеомный анализ посттрансляционных модификаций.Nat Biotech 21, 255–261, (2003).
CAS Статья Google ученый
Гедес, С., Виторино, Р., Домингес, Р., Амадо, Ф. и Домингес, П. Окисление бычьего сывороточного альбумина: идентификация продуктов окисления и структурных модификаций. Rapid Commun. Масс-спектрометрия. 23. С. 2307–2315 (2009).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
- org/ScholarlyArticle»>
Шей, К.Л. и Финли, Е. Л. Идентификация окисления пептидов с помощью тандемной масс-спектрометрии. Accounts Chem. Res. 33, 299–306, (2000).
CAS Статья Google ученый
Jacob, C. et al. Контроль окислительных посттрансляционных модификаций цистеина: от сложной химии до широко распространенных биологических и медицинских приложений. Chem. Res. Toxicol. 25, 588–604, (2011).
Артикул Google ученый
Surroca, Y., Хаверкамп, Дж. И Хек, А. Дж. Р. К пониманию молекулярных механизмов на ранних стадиях индуцированной нагреванием агрегации бета-лактоглобулина AB. J. Chromatogr. А 970, 275–285, (2002).
CAS Статья Google ученый
- org/ScholarlyArticle»>
Zhang, Y., Fonslow, B.R., Shan, B., Baek, M.-C. И Йейтс, Дж. Р. Анализ протеина методом дробовика / восходящей протеомики. Химические обзоры 113, 2343–2394, (2013).
CAS Статья Google ученый
Зубарев Р.A. et al. Диссоциация с захватом электронов газообразных многозарядных белков предпочтительна по дисульфидным связям и другим участкам с высоким сродством к атому водорода. Варенье. Chem. Soc. 121, 2857–2862, (1999).
CAS Статья Google ученый
Кларк, Д. Ф., Го, Э. П. и Десайр, Х. Простой подход для определения дисульфидной связности с использованием хроматограмм экстрагированных ионов спектров диссоциации с переносом электрона. Анальный. Chem. 85, 1192–1199, (2013).

CAS Статья Google ученый
Микеш, Л. М. и др. Полезность масс-спектрометрии ETD в протеомном анализе. Biochimica et Biophysica Acta (BBA) — Proteins & Proteomics 1764, 1811–1822, (2006).
CAS Статья Google ученый
Wiesner, J., Premsler, T. & Sickmann, A. Применение диссоциации с переносом электрона (ETD) для анализа посттрансляционных модификаций.Proteomics 8, 4466–4483, (2008).
CAS Статья Google ученый
Nili, M., Mukherjee, A., Shinde, U., David, L. & Rotwein, P. Определение дисульфидных связей белка-5, связывающего инсулиноподобный фактор роста, с помощью тандемной масс-спектрометрии с переносом электрона диссоциация и диссоциация, вызванная столкновением.
 J. Biol. Chem. 287, 1510–1519, (2012).
J. Biol. Chem. 287, 1510–1519, (2012).CAS Статья Google ученый
Лутц, Э., Визер, Х. и Кёлер, П. Идентификация дисульфидных связей в белках глютена пшеницы с помощью масс-спектрометрии / диссоциации с переносом электрона. J. Agric. Food Chem. 60, 3708–3716 (2012).
CAS Статья Google ученый
Гонсалес, В. Д., Гульотта, Л. М., Джакомелли, К. Э. и Мейра, Г. Р. Латекс иммунодиагностики для выявления болезни Шагаса: II. Химическое связывание антигена Ag36 с карбоксилированными латексами.J. Mater Sci. Mater Med. 19, 789–795, (2008).
CAS Статья Google ученый
- org/ScholarlyArticle»>
Фрэнсис, Г. Альбумин и культура клеток млекопитающих: значение для приложений биотехнологии. Цитотехнология 62, 1–16, (2010).
CAS Статья Google ученый
Doumas, B. T., Bayse, D. D., Carter, R.J., Peters, T. & Schaffer, R. Кандидатный эталонный метод для определения общего белка в сыворотке.I. Разработка и проверка. Clin. Chem. 27, 1642–1650, (1981).
CAS PubMed Google ученый
Brown, J. R. et al. Аминокислотная последовательность бычьего и свиного сывороточного альбумина. Кормили. Proc. 30, 1241, (1971).
Google ученый
Hirayama, K.
 , Akashi, S., Furuya, M. & Fukuhara, K. Быстрое подтверждение и пересмотр первичной структуры бычьего сывороточного альбумина с помощью ESIMS и Frit-FAB LC / MS.Biochem. Биофиз. Res. Commun. 173, 639–646, (1990).
, Akashi, S., Furuya, M. & Fukuhara, K. Быстрое подтверждение и пересмотр первичной структуры бычьего сывороточного альбумина с помощью ESIMS и Frit-FAB LC / MS.Biochem. Биофиз. Res. Commun. 173, 639–646, (1990).CAS Статья Google ученый
Paris, G., Kraszewski, S., Ramseyer, C. & Enescu, M. О структурной роли дисульфидных мостиков в сывороточных альбуминах: данные по моделированию разворачивания белков. Биополимеры 97, 889–898, (2012).
CAS Статья Google ученый
Джордан, Г. М., Йошиока, С.& Терао, Т. Агрегация бычьего сывороточного альбумина в растворе и в твердом состоянии. J. Pharm. Pharmacol. 46, 182–185, (1994).
CAS Статья Google ученый
- org/ScholarlyArticle»>
Moriyama, Y. et al. Вторичное структурное изменение бычьего сывороточного альбумина при термической денатурации до 130 ° C и защитное действие додецилсульфата натрия на это изменение. J. Phys. Chem. B 112, 16585–16589, (2008).
CAS Статья Google ученый
Мураяма, К.И Томида М. Вызванные нагреванием вторичная структура и изменение конформации бычьего сывороточного альбумина, исследованные с помощью инфракрасной спектроскопии с преобразованием Фурье. Biochemistry-US 43, 11526–11532, (2004).
CAS Статья Google ученый
Канг, Ю. Н., Ким, Х., Шин, В. С., Ву, Г. и Мун, Т. В. Влияние уменьшения дисульфидной связи на гель эмульсии, стабилизированной бычьим сывороточным альбумином, образованный микробной трансглутаминазой.
 J. Food Sci.68, 2215–2220, (2003).
J. Food Sci.68, 2215–2220, (2003).CAS Статья Google ученый
Александер П. и Гамильтон Л. Д. Изменения реакционной способности дисульфидных связей в альбумине бычьей сыворотки при денатурации. Arch. Biochem. Биофиз. 88, 128–135, (1960).
CAS Статья Google ученый
Wetzel, R. et al. Температурное поведение сывороточного альбумина человека. Евро. J. Biochem.104, 469–478, (1980).
CAS Статья Google ученый
Халл, Х., Чанг, Р. и Каплан, Л. Дж. О расположении сульфгидрильной группы в альбумине бычьей плазмы. Биохим. Биофиз.
 Acta 400, 132–136, (1975).
Acta 400, 132–136, (1975).CAS Статья Google ученый
Majorek, K. A. et al. Структурная и иммунологическая характеристика альбуминов сыворотки крови крупного рогатого скота, лошади и кролика.Мол. Иммунол. 52, 174–182, (2012).
CAS Статья Google ученый
Bujacz, A. Структура бычьего, лошадиного и лепоринового сывороточного альбумина. Acta Crystallogr D Biol Crystallogr 68, 1278–1289, (2012).
CAS Статья Google ученый
Wilson, J. M., Wu, D., Motiu-DeGrood, R. & Hupe, D. J. Спектрофотометрический метод изучения скоростей реакции дисульфидов с тиоловыми группами белка, применяемый к бычьему сывороточному альбумину.
 Варенье. Chem. Soc. 102, 359–363, (1980).
Варенье. Chem. Soc. 102, 359–363, (1980).CAS Статья Google ученый
Бриджман, М. М., Марсден, М., Макни, В., Фленли, Д. К. и Райл, А. П. Концентрации цистеина и глутатиона в плазме и жидкости бронхоальвеолярного лаважа после лечения N-ацетилцистеином. Thorax 46, 39–42, (1991).
CAS Статья Google ученый
де Фрутос, М., Cifuentes, A., Diez-Masa, J.C., Camafeita, E. & Mendez, E. Множественные пики белков при ВЭЖХ: бычий сывороточный альбумин, элюированный в системе с обращенной фазой. Hrc-J. Высокое разрешение. Хром. 21, 18–24, (1998).
CAS Статья Google ученый
- org/ScholarlyArticle»>
Barone, G. et al. Температурная денатурация бычьего сывороточного альбумина, его олигомеров и производных рН-зависимость. J. Therm. Анальный. 45, 1255–1264, (1995).
CAS Статья Google ученый
Леви, В.И Гонсалес Флеча, Ф. Л. Обратимая быстрая димеризация бычьего сывороточного альбумина, обнаруженная с помощью флуоресцентного резонансного переноса энергии. BBA-Proteins Proteom. 1599, 141–148, (2002).
CAS Статья Google ученый
Rombouts, I., Lagrain, B., Brijs, K. & Delcour, J. A. Реакции бета-элиминирования и образование ковалентных поперечных связей в глиадине во время нагревания при щелочном pH. J. Cereal Sci. 52, 362–367, (2010).
CAS Статья Google ученый
- org/ScholarlyArticle»>
AACC.[Влажность: метод воздушной печи, сушка при 135 ° (44-19.01).] Утвержденные методы анализа. 11-е изд] (AACC International, 1999).
АОАС. [Белок (сырой) в кормах для животных: метод сжигания (990.03)] Официальные методы анализа. 16-е изд] (Ассоциация официальных химиков-аналитиков, 1995).
Ганисл, Б. и Брейкер, К. Расщепляет ли диссоциация с захватом электронов дисульфидные связи белков? ChemistryOpen 1, 260–268, (2012).
CAS Статья Google ученый
Картер Д.C. & Ho, J. X. [Структура сывороточного альбумина] Достижения в химии белков; Липопротеины, аполипопротеины и липазы. [изд. В.Н. Шумакер)] [153–203] (Academic Press, Inc.
 , 1250 Sixth Ave., Сан-Диего, Калифорния 92101, США; Academic Press Ltd., 14 Belgrave Square, 24-28 Oval Road, London NW1 70X, England, Великобритания, 1994).
, 1250 Sixth Ave., Сан-Диего, Калифорния 92101, США; Academic Press Ltd., 14 Belgrave Square, 24-28 Oval Road, London NW1 70X, England, Великобритания, 1994).Коул, С. Р., Ма, X., Чжан, X. и Ся, Ю. Диссоциация с переносом электрона (ETD) пептидов, содержащих внутрицепочечные дисульфидные связи. Варенье. Soc. Масс-спектрометрия.23, 310–320, (2012).
CAS ОБЪЯВЛЕНИЯ Статья Google ученый
Rombouts, I., Lagrain, B., Brunnbauer, M., Delcour, J. A. & Koehler, P. Улучшенная идентификация белков глютена пшеницы посредством алкилирования остатков цистеина и масс-спектрометрии на основе пептидов. Sci. Отчет 3, 10.1038 / srep02279, (2013).
Сильва, А.
 М. Н., Марсал, С. Л., Виторино, Р., Домингес, М. Р. М. и Домингес, П.Характеристика окисления белка in vitro с использованием масс-спектрометрии: изучение динамики окисленной альфа-амилазы. Arch. Biochem. Биофиз. 530, 23–31, (2013).
М. Н., Марсал, С. Л., Виторино, Р., Домингес, М. Р. М. и Домингес, П.Характеристика окисления белка in vitro с использованием масс-спектрометрии: изучение динамики окисленной альфа-амилазы. Arch. Biochem. Биофиз. 530, 23–31, (2013).CAS Статья Google ученый
Lagrain, B., Brijs, K., Veraverbeke, W. S. & Delcour, J. A. Влияние нагрева и охлаждения на физико-химические свойства суспензий пшеничной клейковины в воде. J. Cereal Sci. 42, 327–333, (2005).
CAS Статья Google ученый
Хуанг, Б.X., Kim, H. Y. & Dass, C. Исследование трехмерной структуры бычьего сывороточного альбумина с помощью химического сшивания и масс-спектрометрии. Варенье. Soc. Масс-спектрометрия. 15, 1237–1247, (2004).

CAS Статья Google ученый
электронная или физическая подпись лица, уполномоченного действовать от имени владельца авторских прав;
описание работы, защищенной авторским правом, в отношении которой были нарушены ваши претензии;
идентификация URL-адреса или другого конкретного места на Сайте, где находится материал, который, по вашему мнению, нарушает авторские права;
ваш адрес, номер телефона и адрес электронной почты;
заявление, что у вас есть добросовестное предположение, что спорное использование не разрешено владельцем авторского права, его агентом или законом; и
ваше заявление, сделанное под страхом наказания за лжесвидетельство, о том, что приведенная выше информация в вашем уведомлении является точной и что вы являетесь владельцем авторских прав или уполномочены действовать от имени владельца авторских прав.

Внимание! Белковые комплексы не требуют введения в рацион дополнительных витаминов. Главное условие – беречь пищеварительную систему. При использовании БЦАА хуже усваиваются некоторые витамины, поэтому их приходится употреблять дополнительно.
Что лучше принимать?
Делая выбор между аминокислотами и БЦАА, следует опираться на цели, которые преследуются при приеме спортивного питания. Обычно люди, занимающиеся силовыми видами спорта, предпочитают БЦАА. Если нагрузки более легкие, то аминокислоты. Можно принимать оба комплекса одновременно.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
BCAA и аминокислоты — в чём разница?
Пытаться достичь хороших результатов в спорте, не используя при этом качественное спортивное питание, по сути, так же наивно, как и стремиться к новой точке маршрута на автомобиле с пустым бензобаком. Огромную роль в подготовке спортсмена играет ВСАА и различные комплексы аминокислот — что это такое? В чем их отличие? И для чего они нужны? Об этом мы расскажем в нашей статье!
Итак! Как много аминокислот мы можем назвать? Ученым удалось открыть миру существование 26 различных аминокислот, из которых 20 считаются простейшими компонентами, образующими белок. Каждая аминокислота играет особую роль и необходима человеку.
Каждая аминокислота играет особую роль и необходима человеку.
Существует интересная градация аминокислот
· 12 из 20 являются условно заменимыми. Это значит, что наш организм способен самостоятельно продуцировать их, восполняя нехватку.
· 8 из 20 — незаменимы. Это значит, что данные нутриенты можно получить либо из пищевых продуктов, либо из специализированного спортивного питания
· ВСАА (изолейцин, лейцин, валин) — незаменимые аминокислоты особого плана, названия которых знает наизусть каждый уважающий себя бодибилдер. Именно они — ключевой материал для построения мышц.
Но только ли? Разумеется, нет.
Избрав для себя подходящую программу, мы подвергаем организм перенапряжению, в результате чего он начинает интенсивно тратить ресурсы полезных веществ. Расходуются
· витамины
· важнейшие микроэлементы
· и, конечно, энергия
Атлету как можно скорее необходимо компенсировать критическую потерю аминокислот. Для чего в этот момент нужны аминокислоты извне? Без преувеличения, аминокислоты для людей, ведущих активный образ жизни, являются жизненно важными веществами. Так происходит, потому что их дефицит приводит к
Для чего в этот момент нужны аминокислоты извне? Без преувеличения, аминокислоты для людей, ведущих активный образ жизни, являются жизненно важными веществами. Так происходит, потому что их дефицит приводит к
· возникновению катаболических (деструктивных) процессов в мышцах
· ослаблению иммунной системы
· общему упадку сил.
Что же такое приносят организму аминокислоты?
· организму атлета гарантируется ускоренный рост мышечных волокон
· происходит восстановление запасов сил
· восполняются запасы энергии.
Но, быть может, достаточно комплекса из трех аминокислот ВСАА, который, нередко, стоит дешевле, при этом, судя по этикетке, гарантирует примерно тот же результат?
Отличие между аминокислотным комплексом и ВСАА, всё же, существует!
Аминокислоты — более сложные белковые соединения, носители карбосильных и аминных групп. Они не имеют побочных эффектов и нужны не только для того, чтобы обеспечить рост мышц, но и для оптимизации работы нашего мозга, укрепления скелета и иммунитета.
Они не имеют побочных эффектов и нужны не только для того, чтобы обеспечить рост мышц, но и для оптимизации работы нашего мозга, укрепления скелета и иммунитета.
ВСАА — 3 незаменымые аминокислоты, обладающие разветвленной цепочкой, которые не могут быть продуцированы нашим организмом. Они
· усваиваются значительно быстрее
· уже через полчаса достигают волокон наших мышц
· и питают их в полной мере.
Но дело в том, что дефицит других аминокислот — лизина и аргинина, гистидина и других веществ может негативно сказаться на здоровье спортсмена, поэтому применение BCAA и полных аминокислотных комплексов можно (и даже нужно!) совмещать.
Ответив на вопросы что такое ВСАА и для чего нужны аминокислоты, мы можем сделать вывод
· ВСАА — важнейшие и незаменимые аминокислоты (лейцин, изолейцин, валин) — это «скорая помощь» для развития мышц в процессе тренировки и после нее
· Аминокислотный комплекс — общее название (в том числе, и ВСАА-аминокислот!). В его состав, как правило, входят и другие нужные для полноценного и продуктивного функционирования организма человека (заменимые и незаменимые) нутриенты.
В его состав, как правило, входят и другие нужные для полноценного и продуктивного функционирования организма человека (заменимые и незаменимые) нутриенты.
Что же предпочесть?
Стоит руководствоваться теми целями и задачами, которые Вы ставите перед собой:
· Общее (всестороннее!) укрепление организма потребует приобретения расширенного аминокислотного комплекса
· ВСАА поможет нарастить мышцы и избавиться от жировых отложений.
Как выбрать BCAA? Советы от Fit Health.ru
Аминокислоты BCAA (аминокислоты с разветвленными боковыми цепочками) относятся к разряду незаменимых, то есть тех, которые организм человека самостоятельно вырабатывать не может. К ним относят 3 аминокислоты: изолейцин, валин и лейцин. Каждый серьезный производитель имеет их в своей линейке, что, безусловно, затрудняет выбор. Мы поможем вам разобраться в огромной массе добавок BCAA.
Зачем принимать ВСАА?
В последние годы аминокислоты BCAA стали очень популярны в фитнес и бодибилдинг сообществах. Причина тому – главная заслуга BCAA – способность защищать мышцы от процессов катаболизма (разрушения мышц) в условиях физической активности и низкого потребления калорий. Это сделало BCAA необходимым продуктом как для тех, кто желает изменить их телосложение в сторону набора мышц, так и для тех, кто просто желает избавиться от лишнего жира, но при этом сохранить мышцы.
Однако вы можете задаться вопросом: «Для чего мне покупать BCAA, если я могу положиться на свою диету, удовлетворяющую суточную норму белка»? Отчасти этот вопрос резонен, ведь некоторым людям, действительно, ни к чему потреблять эти аминокислоты дополнительно – тем кто не тренируется в зале или не занимается спортом вовсе. Но для тех, чей образ жизни активен, они, по меньшей мере, желательны.
Три главных правила при выборе BCAA
Вот то, на что вы должны обратить внимание, выбирая добавку этих незаменимых аминокислот:Формы выпуска BCAA
Аминокислоты BCAA выпускаются в основном в двух видах: таблеток и порошка. Таблетированные формы не имеют вкуса, но есть производители, выпускающие BCAA в жевательных таблетках со вкусом. На сегодняшний день вкусовая гамма порошковых BCAA очень широка, они даже бывают насыщены азотом, что делает их похожими на газированный лимонад. Но есть и производители, которые выпускают BCAA без подсластителей, но неподготовленным атлетам мы не рекомендуем покупать такие ВСАА, так как эти аминокислоты без ароматизаторов имеют ярко-выраженный горький вкус.
Так какие BCAA выбрать: таблетированные или порошок? Все зависит от ваших субъективных предпочтений, но мы советуем приобретать и ту, и другую форму в зависимости от внешних условий.
Таблетированная форма очень удобна в применении во время тренировки или при обстоятельствах, когда шейкера под рукой нет – достаточно просто запить их водой. Но вы должны иметь в виду, что не стоит принимать таблетки и капсулы сразу перед тренировкой, ведь, скорее всего, желудок не сразу сможет их переварить, поэтому рекомендуется делать это за полчаса или использовать перед тренировкой порошок.
Бычий сывороточный альбумин — обзор
4.1.6 Наночастицы бычьего сывороточного альбумина (BSA)
Бычий сывороточный альбумин (BSA) широко применяется в доставке лекарств из-за его низкой стоимости, переносимости и простоты приготовления. Структурные особенности BSA, который имеет множество аминокислотных остатков, позволяют связывать лекарственные препараты или биоактивные соединения с различными физико-химическими характеристиками. БСА является наиболее распространенным белком плазмы крупного рогатого скота и состоит из одной цепи из 583 аминокислотных остатков.
BSA представляет собой потенциальную коллоидную систему доставки, поскольку она биоразлагаема, биосовместима, нетоксична и неиммуногенна. Более того, учитывая его низкую стоимость, простоту очистки и растворимость в воде, он является привлекательным в качестве матрицы для наночастиц. Благодаря сайтам связывания лекарств в молекуле BSA наночастицы BSA могут загружать различные лекарственные средства и биоактивные соединения (Elzoghby, Samy, & Elgindy, 2012). Однако связывание альбумина нековалентными силами более ограничено гидрофобными и гидрофильными лекарственными средствами или пептидными / белковыми лекарственными средствами, обладающими низкой аффинностью связывания (Lee & Youn, 2016).Одной из важных характеристик является то, что связывание лекарственного средства является обратимым, и, таким образом, наночастицы BSA транспортируются в организме и высвобождают лекарство / соединение в клетке (на поверхности или в цитоплазме). Однако во время этого переноса положительно или отрицательно заряженные молекулы могут связываться с поверхностью наночастиц за счет электростатической адсорбции из-за большого количества заряженных аминокислот. Кроме того, некоторые функциональные группы (например, карбоксильные и аминогруппы) присутствуют на поверхности наночастиц БСА и могут обеспечивать ковалентное присоединение нацеленных на клетки агентов, таких как фолат, трансферрин, моноклональные антитела, катионные полимеры и т. Д. (Galisteo -Гонсалес и Молина-Боливар, 2014; Хао, Ма, Хуанг, Хэ и Яо, 2013).Эта возможность улучшает способность наночастиц достигать более селективной цели. Наконец, период полувыведения BSA в крови составляет около 19 дней, что может улучшить фармакокинетический профиль загруженного лекарственного средства (Lee & Youn, 2016).
Кроме того, некоторые функциональные группы (например, карбоксильные и аминогруппы) присутствуют на поверхности наночастиц БСА и могут обеспечивать ковалентное присоединение нацеленных на клетки агентов, таких как фолат, трансферрин, моноклональные антитела, катионные полимеры и т. Д. (Galisteo -Гонсалес и Молина-Боливар, 2014; Хао, Ма, Хуанг, Хэ и Яо, 2013).Эта возможность улучшает способность наночастиц достигать более селективной цели. Наконец, период полувыведения BSA в крови составляет около 19 дней, что может улучшить фармакокинетический профиль загруженного лекарственного средства (Lee & Youn, 2016).
Различные методы приготовления и характеристики наночастиц БСА, нагруженных биоактивными веществами, и некоторые недавние примеры применения БСА для доставки биоактивных компонентов пищевых продуктов были объяснены в главе 7.
Модуляция термостабильности нативного и химически развернутого состояния крупного рогатого скота сывороточный альбумин по аминокислотам
rsc.org/schema/rscart38″> Клетки переполнены различными соколами, включая соли, осмолиты, нуклеиновые кислоты, пептиды и белки.Эти совы по-разному модулируют равновесие сворачивания белков, однако объединяющая концепция остается неуловимой. Чтобы прояснить косолютный размерный эффект, макромолекулярные краудеры обычно сравнивают с их мономерными строительными блоками (, например, декстран, против глюкозы или полиэтиленгликоля с различной степенью полимеризации). Насколько нам известно, таких исследований для краудинга белков не существует, поэтому возникает вопрос, как отдельные аминокислоты модулируют равновесие фолдинга.Поэтому мы исследуем влияние глицина, аланина, пролина и аргинина на стабильность модельного глобулярного белка бычьего сывороточного альбумина (БСА) при термическом и индуцированном мочевиной разворачивании. Мы используем три дополнительных метода: флуоресцентную спектроскопию (как локальный сайт-специфический зонд), круговой дихроизм (как глобальный зонд для α-спиральной структуры) и дифференциальную сканирующую калориметрию (чтобы исследовать энергетику разворачивания). Мы обнаружили, что аминокислоты модулируют стабильность и разворачивание BSA, однако, не следуя определенной тенденции в отношении шкалы гидрофобности или доступной для растворителя площади поверхности (SASA) добавленных аминокислот.Наши данные скорее указывают на то, что сольватационные эффекты играют роль в понимании косольвентного эффекта.
Мы обнаружили, что аминокислоты модулируют стабильность и разворачивание BSA, однако, не следуя определенной тенденции в отношении шкалы гидрофобности или доступной для растворителя площади поверхности (SASA) добавленных аминокислот.Наши данные скорее указывают на то, что сольватационные эффекты играют роль в понимании косольвентного эффекта.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуйте еще раз?ALB — предшественник альбумина — Bos taurus (Bovine)
125 1| Обозначение характеристик | Позиция (я) | Описание Действия | Графический вид | Длина | |
|---|---|---|---|---|---|
Этот подраздел раздела «PTM / Обработка» обозначает присутствие N-концевого сигнального пептида. | 1–18 | Утверждение вручную на основе эксперимента в i Добавить BLAST | 18 | ||
В этом подразделе раздела PTM / Processing описывается пропептид, который является частью белка. который расщепляется во время созревания или активации.После расщепления пропептид обычно не имеет независимой биологической функции. Пропептид i PRO_0000001057 | 19-24 | 6 | |||
В этом подразделе раздела «PTM / Обработка» описывается протяженность полипептидной цепи в зрелом белке после процессинга или протеолитического расщепления. | 25 — 607 | Альбумин Добавить BLAST | 583 | ||
| Функциональная клавиша | Позиция (я) | Описание Действия | Графический вид | Длина | |
В этом подразделе раздела «PTM / Обработка» указываются положение и тип каждого модифицированного остатка, за исключением липиды , гликаны и протеиновые перекрестные ссылки . Изменено остаток i | 29 | Phosphoserine Ручное утверждение, выведенное из сходства последовательностей с i | 1 | ||
Этот подраздел раздела PTM / Processing «: / help / ptm_processing_section» описывает положения остатков цистеина, участвующих в дисульфидных связях. | 77 ↔ 86 | Проверенная вручную информация, созданная автоматической системой аннотаций UniProtKB. Ручное утверждение в соответствии с правилами iРучное утверждение, выведенное из комбинации экспериментальных и расчетных данных i Ручное утверждение, основанное на эксперименте в i | |||
| Модифицированный остаток i | 82 | Фосфосерин Ручное утверждение, выведенное из сходства последовательностей с i | 1 | ||
| Модифицированный остаток i | 89 900 | Фосфосерин Ручное утверждение, выведенное из сходства последовательности с i | 1 | ||
| Дисульфидная связь i | 99 ↔ 115 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинация экспериментальных и расчетных данных i Ручное утверждение на основе эксперимента i | |||
| Модифицированный остаток i | 107 | Фосфотреонин Ручное утверждение, выведенное из сходства последовательности с i | 1 | ||
| Дисульфидная связь i | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i Ручное утверждение, основанное на эксперименте в i | ||||
| Дисульфидная связь i | 147 ↔ 192 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i Ручное утверждение на основе в эксперименте i | |||
Этот подраздел PTM / Processing указываются положение и тип каждой ковалентно присоединенной гликановой группы (моно-, ди- или полисахарид). Гликозилирование i | 151 | N-связанный (Glc) (гликирование) лизин; in vitro На основе ручного утверждения на эксперименте в i | 1 | ||
| Дисульфидная связь i | 191 ↔ 200 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i Руководство Утверждение, основанное на эксперименте i | |||
| Дисульфидная связь i | 223 ↔ 269 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i Ручное утверждение на основе в эксперименте и | |||
| Модифицированный остаток i | 228 | N6-сукциниллизин Ручное утверждение, выведенное из сходства последовательности с i | 1 | ||
| Дисульфидная связь i 268 ↔ 276 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и вычислительных данных i Ручное утверждение, основанное на эксперименте в i | ||||
| Дисульфидная связь i | 288 ↔ 302 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i Ручное утверждение на основе в эксперименте i | |||
| Модифицированный остаток i | 296 | Фосфосерин Ручное утверждение, выведенное из сходства последовательности с i | 1 | ||
| Дисульфидная связь 30 i | 312 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i Ручное утверждение, основанное на эксперименте в i | |||
| Дисульфидная связь i | 339 ↔ 384 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i Ручное утверждение на основе в эксперименте i | |||
| Дисульфидная связь i | 383 ↔ 392 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i Ручное утверждение в эксперименте и | |||
| Дисульфидная связь i | 415 ↔ 461 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i Ручное утверждение, основанное в эксперименте i | |||
| Модифицированный остаток i | 442 | Фосфосерин Ручное утверждение, выведенное из сходства последовательностей с i | 1 | ||
| Модифицированный остаток i | Фосфотреонин Ручное утверждение, выведенное из сходства последовательности с i | 1 | |||
| Модифицированный остаток i | 445 | Фосфотреонин Ручное утверждение, выведенное из сходства последовательности с i 9 | |||
| Дисульфидная связь i | 460 ↔ 471 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i Ручное утверждение, основанное на эксперименте в i | |||
| Дисульфидная связь i | 484 ↔ 500 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i Ручное утверждение на основе в эксперименте i | |||
| Дисульфидная связь i | 499 ↔ 510 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное на основе комбинации экспериментальных и вычислительных данных i Ручное утверждение на основе в эксперименте и | |||
| Модифицированный остаток i | 512 | Фосфосерин Ручное утверждение, выведенное из сходства последовательности с i | 1 | ||
| Дисульфидная связь i | 53 582 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i Ручное утверждение, основанное на эксперименте в i | |||
| Модифицированный остаток i | 557 | N6-метиллизин Ручное утверждение, выведенное из сходства последовательности с i | 1 | ||
| Модифицированный остаток i | 569 | Фосфотреонин Ручное утверждение, выведенное из сходства последовательности с i | 1 | ||
| Дисульфидная связь i | 581 ↔ 590 | Ручное утверждение в соответствии с правилами i 9000 выведено из комбинации экспериментальных и расчетных данных iРучное утверждение на основе эксперимента i | |||
| Модифицированный остаток i | 587 | N6-сукциниллизин Ручное утверждение, выведенное из сходства последовательностей с i | 1 |
Бычий сывороточный альбумин Растворимый протеин пшеницы (SWP)
Бычий сывороточный альбумин (BSA) и растворимый протеин пшеницы (SWP)ВЗАИМОДЕЙСТВИЕ SWP с альбумином бычьей сыворотки (BSA)
Введение
Сывороточный альбумин — один из наиболее широко изучаемых белков и наиболее
обильный белок в плазме с типичной концентрацией 5 г / 100 мл. Различные исследователи изучали структуру и свойства сыворотки.
альбумин и его взаимодействие с другими белками, чтобы понять, как
сывороточный альбумин влияет на функциональность продуктов, в которых они были
включены, а также новые приложения. Последняя причина привела к исследованию
взаимодействия между растворимым белком пшеницы и бычьим сывороточным альбумином.
Структура и свойства SWP описаны в главах 2, 3 и 4.
В следующих разделах описывается структура и свойства BSA.
Различные исследователи изучали структуру и свойства сыворотки.
альбумин и его взаимодействие с другими белками, чтобы понять, как
сывороточный альбумин влияет на функциональность продуктов, в которых они были
включены, а также новые приложения. Последняя причина привела к исследованию
взаимодействия между растворимым белком пшеницы и бычьим сывороточным альбумином.
Структура и свойства SWP описаны в главах 2, 3 и 4.
В следующих разделах описывается структура и свойства BSA.
Бычий сывороточный альбумин (BSA)
Под альбумином обычно понимается сывороточный альбумин или плазменный альбумин.
(Следует проявлять осторожность, чтобы различать белок, который относится к яичным белкам,
из альбумина или сывороточного альбумина). Слово альбумин также используется для описания
белок или группа белков, определяемых растворимостью в воде, например
альбуминовая фракция пшеницы (глава 2). Альбумин самый распространенный
белок в кровеносной системе и составляет 80% коллоидного осмотического
артериальное давление (Картер и Хо, 1994). Она имеет
в настоящее время установлено, что сывороточный альбумин в основном отвечает за
поддержание pH крови (Figge et al .,
1991). У млекопитающих альбумин первоначально синтезируется как препроальбумин.
печень. После удаления сигнального пептида полученный проальбумин
далее обрабатывается удалением пропептида с шестью остатками из нового
N-конец. Альбумин, выпущенный в обращение, имеет период полураспада
19 дней (Waldmann, 1977).
Она имеет
в настоящее время установлено, что сывороточный альбумин в основном отвечает за
поддержание pH крови (Figge et al .,
1991). У млекопитающих альбумин первоначально синтезируется как препроальбумин.
печень. После удаления сигнального пептида полученный проальбумин
далее обрабатывается удалением пропептида с шестью остатками из нового
N-конец. Альбумин, выпущенный в обращение, имеет период полураспада
19 дней (Waldmann, 1977).
Структура BSA
Обширная информация о сывороточном альбумине привела к некоторым противоречивым
Результаты и обсуждения.Основано в основном на гидродинамических экспериментах
(Хьюз, 1954;
Squire et al., , 1968; Райт и
Thompson, 1975) и малоугловое рассеяние рентгеновских лучей (Bloomfield, 1966), сывороточный альбумин был постулирован как
сплюснутый эллипсоид размером 140 × 40 Å (рис. 5.1). Эксперименты
продолжали поддерживать эти измерения (
Bendedouch and Chen, 1983; Фэн и др. . , 1988). Браун и Шокли (1982) составили
разнообразных данных и построил модель альбумина как имеющего
форма сигары.
, 1988). Браун и Шокли (1982) составили
разнообразных данных и построил модель альбумина как имеющего
форма сигары.
Рисунок 5.1: Классическое представление о структуре сывороточного альбумина. (Питерс, 1985).
Однако исследования с использованием 1H ЯМР показали, что сплюснутая эллипсоидная структура
альбумина было маловероятно; скорее была предложена структура в форме сердца
(Bos и др. ., 1989). Это было согласовано
с рентгеноструктурными данными (Carter et al ., 1989). Предыдущие исследования показали, что вторичная структура
содержал около 68% — 50% альфа-спирали и 16% -18% бета-листа
(Sjoholm and Ljungstedt, 1973;
Рид и др. ., 1975; Фостер, 1977).
В отличие от рентгеновской кристаллографии, бета-лист в
структура нативного сывороточного альбумина (Carter et al ., 1989).
Райли и Арндт (1952, 1953) предположили, что
термически денатурированный бычий сывороточный альбумин, вероятно, имеет те же основные
тип сворачивания полипептидных цепей как нативный, что составляет 55%
альфа-спираль и 45% случайной конформации по данным исследований рассеяния рентгеновских лучей. Хармсен и Браам (1969), используя инфракрасное и
По спектрам ORD сделан вывод о том, что денатурация щелочью или нагреванием вызывает частичное
потеря альфа-спиральной структуры без образования бета-листа, но от
В их инфракрасных спектрах появилось плечо для БСА, нагретого выше 72 ° C при 1620 см. -1 указывает на формирование бета-листа.Кларк и др. .
(1981b) проверка теории Эстбери (Astbury и др. .,
1935), что возникли гели, образованные из тепла или химически денатурированных белков.
от взаимодействия регионов бета-листов, проведены тесты на BSA
с использованием инфракрасного и рамановского спектров. На их плече было видно плечо.
инфракрасные спектры при 1620 см -1 для BSA, нагретого до 75 ° C и
над. Спектры комбинационного рассеяния показали увеличение при 1235 см -1 и
уменьшение на 940 см -1 для геля BSA, что указывает на падение альфа-спирали
контент с формированием бета-листа.Лин и Кениг (1976) исследовали тепло, кислоту
и щелочная денатурация BSA с помощью спектроскопии комбинационного рассеяния света и обнаружила, что нагревание
до 70 ° C или изменение pH ниже 5 или выше 10 вызвали увеличение
полоса 1246 см -1 и уменьшение полосы 938 см -1 .
Хармсен и Браам (1969), используя инфракрасное и
По спектрам ORD сделан вывод о том, что денатурация щелочью или нагреванием вызывает частичное
потеря альфа-спиральной структуры без образования бета-листа, но от
В их инфракрасных спектрах появилось плечо для БСА, нагретого выше 72 ° C при 1620 см. -1 указывает на формирование бета-листа.Кларк и др. .
(1981b) проверка теории Эстбери (Astbury и др. .,
1935), что возникли гели, образованные из тепла или химически денатурированных белков.
от взаимодействия регионов бета-листов, проведены тесты на BSA
с использованием инфракрасного и рамановского спектров. На их плече было видно плечо.
инфракрасные спектры при 1620 см -1 для BSA, нагретого до 75 ° C и
над. Спектры комбинационного рассеяния показали увеличение при 1235 см -1 и
уменьшение на 940 см -1 для геля BSA, что указывает на падение альфа-спирали
контент с формированием бета-листа.Лин и Кениг (1976) исследовали тепло, кислоту
и щелочная денатурация BSA с помощью спектроскопии комбинационного рассеяния света и обнаружила, что нагревание
до 70 ° C или изменение pH ниже 5 или выше 10 вызвали увеличение
полоса 1246 см -1 и уменьшение полосы 938 см -1 . Интерпретация была аналогична интерпретации Кларка и др. .,
(1981b), что представляет собой уменьшение содержания альфа-спирали, сопровождающееся
увеличение бета-листа.
Интерпретация была аналогична интерпретации Кларка и др. .,
(1981b), что представляет собой уменьшение содержания альфа-спирали, сопровождающееся
увеличение бета-листа.
Аминокислотный состав
Альбумины характеризуются низким содержанием триптофана и метионина и высокое содержание цистина и заряженных аминокислот, аспарагиновой и глутаминовая кислота, лизин и аргинин.Содержание глицина и изолейцина в BSA ниже, чем в среднем по белку (Peters, 1985) (Таблица 5.1).
Первичная, вторичная и третичная структура
На рис. 5.2 показана аминокислотная последовательность бычьего альбумина. Молекула БСА — это
состоящий из трех гомологичных доменов (I, II, III), которые разделены на
девять петель (L1-L9) по 17 дисульфидным связям. Циклы в каждом домене сделаны
из последовательности петель большой-маленький-большой, образующих тройку.Каждый домен
в свою очередь является продуктом двух подобластей (IA, IB и т. д.). Главная
структура альбумина необычна среди внеклеточных белков, поскольку
одиночная сульфгидрильная (Cys-34) группа. В свете новой информации, т.е.
рентгеновские кристаллографические данные (Картер и Хо, 1994)
структура альбумина преимущественно альфа-спиральная (67%) с остальными
полипептид, встречающийся по очереди, и протяженные или гибкие области между
поддомены без бета-листов (рисунок 5.3). Каждый из доменов может быть
разделен на 10 спиральных сегментов, 1-6 для подобласти A и 7-10 для
подобласть B (рисунок 5.4). Мотив для субдомена A показан на рисунке 5.5.
и для подобласти B на рисунке 5.6. Домены I и II и домены II и III
соединены через винтовые удлинители 10 (I) — 1 (II) и 10 (II) — 1 (III),
создание двух самых длинных спиралей в альбумине.
д.). Главная
структура альбумина необычна среди внеклеточных белков, поскольку
одиночная сульфгидрильная (Cys-34) группа. В свете новой информации, т.е.
рентгеновские кристаллографические данные (Картер и Хо, 1994)
структура альбумина преимущественно альфа-спиральная (67%) с остальными
полипептид, встречающийся по очереди, и протяженные или гибкие области между
поддомены без бета-листов (рисунок 5.3). Каждый из доменов может быть
разделен на 10 спиральных сегментов, 1-6 для подобласти A и 7-10 для
подобласть B (рисунок 5.4). Мотив для субдомена A показан на рисунке 5.5.
и для подобласти B на рисунке 5.6. Домены I и II и домены II и III
соединены через винтовые удлинители 10 (I) — 1 (II) и 10 (II) — 1 (III),
создание двух самых длинных спиралей в альбумине.
Дисульфидные связи
В BSA дисульфидные связи расположены в следующих положениях:
(1) 77-86; (2) 99-115; (3) 114–125; (4) 147–192; (5) 191-200; (6) 223-269;
(7) 268–276; (8) 288-302; (9) 301–312; (10) 339-384; (11) 383-392;
(12) 415-461; (13) 460-471; (14) 484-500; (15) 499-510; (16) 537-582;
(17) 581-590.
Конформации дисульфидов в основном гош-гош-гош и Cß 1 -S1-S2-Cß 2 , с торсионными углами, составляющими около ± 80 °. Дисульфид пары расположены почти исключительно между спиральными сегментами.
Рисунок 5.7: Расположение дисульфидных связей ( Он и Картер, 1992)
Ни одна из дисульфидных связей не была доступна для восстановителей pH.
диапазон 5-7, но постепенно становился доступным по мере повышения pH или
понижен.Katchalski et al .,
(1957) поэтому пришли к выводу, что дисульфиды в альбумине защищены
при нейтральном pH от восстановителей. Это также заметно по структуре,
что показывает, что большинство дисульфидов хорошо защищены и большинство из них
труднодоступен для растворителя. Блокирование свободного сульфгидрила, Cys-34,
с йодацетамидом, цистеином или глутатионом предотвращает возникновение
смешанные дисульфиды в старом альбумине, а также наличие альбумина
димер (Peters, 1985).Во время разворачивания
конформация некоторых из дисульфидных связей меняется от гош-гош-гош
к гош-гош-транс формам, как это наблюдается в исследованиях лазерного комбинационного рассеяния
(Аоки и др. ., 1982).
., 1982).
Физико-химические свойства
Молекула альбумина в первичной структуре заряжена неравномерно. При нейтральном pH Петерс (1985) рассчитал чистую заряд -10, -8 и 0 для доменов I, II и III для бычьего сывороточного альбумина.Распределение поверхностного заряда показано на рисунке 5.8.
ABCD
Рисунок 5.8: Модель заполнения пространства молекулы сывороточного альбумина с основным остатки окрашены в синий цвет, кислотные остатки — в красный, а нейтральные — в желтый. (A) вид спереди, (B) вид сзади, (C) левая сторона и (D) правая сторона (Картер и Хо, 1994).
В отличие от асимметричного распределения заряда на первичной структуре, распределение по третичной структуре кажется довольно равномерным.
Вязкость
Вязкость белкового раствора зависит от его внутренних характеристик,
такие как молекулярная масса, размер, объем, форма, поверхностный заряд и легкость
деформация (Бык, 1940;
Ян, 1961). Кроме того, на вязкость влияют условия окружающей среды.
такие факторы, как pH, температура, ионная сила, тип иона, условия сдвига
и термическая обработка (Tung, 1978;
Ли и Ра, 1979; Херманссон,
1979b).Сообщается, что сывороточный альбумин имеет значения характеристической вязкости.
3,7-4,2 мл г-1 (Peters, 1985;
Кунц и Каузманн, 1974; Маркус и др. , 1964;
Рейнольдс и др. ., 1967).
Kolthoff и др. ., (1958) сообщили о
увеличение вязкости при увеличении разрыва дисульфидных связей БСА.
Вязкость растворов БСА линейно увеличивалась с увеличением концентрации.
до 65 мг / мл и экспоненциально при более высоких концентрациях (
Ветцель и др. ., 1980) в соответствии с результатами
Мендживар и Ра, (1980).
Кроме того, на вязкость влияют условия окружающей среды.
такие факторы, как pH, температура, ионная сила, тип иона, условия сдвига
и термическая обработка (Tung, 1978;
Ли и Ра, 1979; Херманссон,
1979b).Сообщается, что сывороточный альбумин имеет значения характеристической вязкости.
3,7-4,2 мл г-1 (Peters, 1985;
Кунц и Каузманн, 1974; Маркус и др. , 1964;
Рейнольдс и др. ., 1967).
Kolthoff и др. ., (1958) сообщили о
увеличение вязкости при увеличении разрыва дисульфидных связей БСА.
Вязкость растворов БСА линейно увеличивалась с увеличением концентрации.
до 65 мг / мл и экспоненциально при более высоких концентрациях (
Ветцель и др. ., 1980) в соответствии с результатами
Мендживар и Ра, (1980).
Влияние pH
Сывороточный альбумин претерпевает обратимую конформационную изомеризацию с изменениями в pH.
E F N B A pH перехода: 2,7 4,3 8 10 Название: Расширенный Быстрый Нормальный Базовый В возрасте % Спирали: 35 45 55 48 48
Рисунок 5. 9: Взаимосвязь изомерных форм бычьего сывороточного альбумина
(Фостер, 1977).
9: Взаимосвязь изомерных форм бычьего сывороточного альбумина
(Фостер, 1977).
Переход N-F включает разворачивание области III ( Гейсов и Бивен, 1977; Хан, 1986). Форма F характеризуется резким увеличением вязкости, намного более низкой растворимость и значительная потеря спирального содержимого ( Фостер, 1960). При значениях pH ниже 4 альбумин подвергается еще одной расширение с потерей внутридоменных спиралей (10) домена I, который соединены со спиралью (1) домена II и спиралью (10) домена II соединены со спиралью (1) домена III (рисунок 5.10). Эта развернутая форма известная как форма (E), которая имеет повышенную характеристическую вязкость, и увеличение гидродинамического отношения осей примерно с 4 до 9 (Harrington и др. ., 1956). При pH 9 альбумин изменяется соответствие основной форме (B). Если сохраняются растворы альбумина при pH 9 и низкой ионной силе при 3 ° C в течение 3-4 дней, еще одна изомеризация происходит, что известно как форма (A).
Форма N ФормаЭлектронная форма
Рисунок 5. 10: Ленточная диаграмма сывороточного альбумина в его N-форме и в его
предложенные формы F и E (Картер и Хо, 1994)
10: Ленточная диаграмма сывороточного альбумина в его N-форме и в его
предложенные формы F и E (Картер и Хо, 1994)
Эффект тепла
Сывороточный альбумин при термообработке проходит две структурные стадии.
Первая стадия обратима, а вторая стадия необратима, но
не обязательно приводит к полному уничтожению заказанного
структура (Kuznetsow et al ., 1975;
Лин и Кениг, 1976;
Оукс, 1976).Нагрев до 65 ° С можно рассматривать как первый этап, с последующим
нагрев выше этого в качестве второй ступени (Wetzel et al .,
1980). Температура начала изменения конформации, определенная методом ДСК, составила 58,1 ° C.
(Poole et al ., 1987) и температура
денатурации 62 ° C (Ruegg et al .,
1977). Результаты КД и ИК-спектроскопии показали, что бета-листы были
образуется при нагревании альбумина выше 65 ° C (
Ветцель и др. ., 1980), 70 ° С (Линь и
Кениг, 1976; Кларк и др. ., 1981b).
Образовавшийся бета-лист был более выраженным при охлаждении и концентрировался. зависимый. Wetzel et al ., (1980) обнаружено
плечо в полосе бета-листа в концентрации 50 мг / мл при 70 ° C,
1,4 мг / мл при 80 ° C, но не 0,5 мг / мл при 75 ° C. Потому что бета-лист
структуры не были указаны в разбавленном растворе, это говорит о том, что
бета-листы межмолекулярны.
зависимый. Wetzel et al ., (1980) обнаружено
плечо в полосе бета-листа в концентрации 50 мг / мл при 70 ° C,
1,4 мг / мл при 80 ° C, но не 0,5 мг / мл при 75 ° C. Потому что бета-лист
структуры не были указаны в разбавленном растворе, это говорит о том, что
бета-листы межмолекулярны.
Коэффициент седиментации альбумина при нейтральном pH составляет около 4–4.5 с.
Если образцы альбумина нагревают до температуры более 60 ° C и снова охлаждают,
кроме нативного белка, более быстрое осаждение, но гетерогенное
фракции с коэффициентами седиментации 26 — 36 S. Формирование
этих высокомолекулярных комплексов была температура и концентрация
зависимые (Wetzel et al ., 1980). Вращение
мечение Cys-34 (Hull et al. ., 1975;
Wetzel et al ., 1980) и флуоресценции.
Исследования показали, что Cys-34 находится в кармане.Рентгеновская кристаллография
указали, что Cys-34 расположен в щели на поверхности белка
и что реактивная сера защищена несколькими остатками (рис. 5.11).
Cys-34 оказался наиболее реакционноспособным сульфгидрилом с pKSH 5.
по сравнению с 8,5 и 8,9 для цистеина и глутатиона (Pedersen and Jacobsen, 1980). Блокирование Cys-34 цистеином,
глутатион или другие химические вещества, такие как стабилизированный N-йодсукцинимидом альбумин
против образования димеров (Peters, 1985).Измерения электронного спинового резонанса показали, что карман вокруг Cys-34
разворачивается во время термической денатурации (Wetzel et al., 1980). Следовательно, димер
образование при нагревании, вероятно, связано с дисульфидными связями.
5.11).
Cys-34 оказался наиболее реакционноспособным сульфгидрилом с pKSH 5.
по сравнению с 8,5 и 8,9 для цистеина и глутатиона (Pedersen and Jacobsen, 1980). Блокирование Cys-34 цистеином,
глутатион или другие химические вещества, такие как стабилизированный N-йодсукцинимидом альбумин
против образования димеров (Peters, 1985).Измерения электронного спинового резонанса показали, что карман вокруг Cys-34
разворачивается во время термической денатурации (Wetzel et al., 1980). Следовательно, димер
образование при нагревании, вероятно, связано с дисульфидными связями.
Таким образом, можно сделать вывод, что на обратимой структурной стадии некоторые из
альфа-спирали превращаются в случайные витки. Если боковые цепи
соседние остатки двух пептидных цепей указывают в противоположных направлениях
и перпендикулярны плоскости, так что водородные связи могут образовываться между
нити, то ИК, КД и спектроскопия комбинационного рассеяния увидят их как
бета-листы.Это означает, что агрегаты образуются за счет водорода. соединение бета-листов между мономерами. Сформированные бета-листы наиболее
вероятно, будут антипараллельны, поскольку они обязательно должны находиться на поверхности
мономеры. Параллельные листы менее скручены, чем антипараллельные, и всегда
похороненный. Антипараллельные листы могут выдерживать большие деформации (скручивание и
бета-выступы) и большее воздействие растворителя. При повышении температуры
после обратимой стадии раскрытие кармана, обнажающего Cys-34, требует
место, дающее легкий доступ к образованию дисульфидных мостиков.С
дисульфидные мостики — ковалентные связи, эта стадия необратима.
соединение бета-листов между мономерами. Сформированные бета-листы наиболее
вероятно, будут антипараллельны, поскольку они обязательно должны находиться на поверхности
мономеры. Параллельные листы менее скручены, чем антипараллельные, и всегда
похороненный. Антипараллельные листы могут выдерживать большие деформации (скручивание и
бета-выступы) и большее воздействие растворителя. При повышении температуры
после обратимой стадии раскрытие кармана, обнажающего Cys-34, требует
место, дающее легкий доступ к образованию дисульфидных мостиков.С
дисульфидные мостики — ковалентные связи, эта стадия необратима.
Рисунок 5.11: Стереомодель структуры сывороточного альбумина в область вокруг остатка Cys-34. Красный, кислород; желтый, угольный; синий, азот; зеленый, сера. (Картер и Хо, 1994)
Ричардсон и Росс-Мерфи (1981) положили
выдвинуть гипотезу из своей модели двух пересекающихся линий, что две
процессы, разворачивание и агрегирование.Ниже 57 ° C,
разворачивание было определяющим, тогда как выше этой температуры агрегация
был определяющим.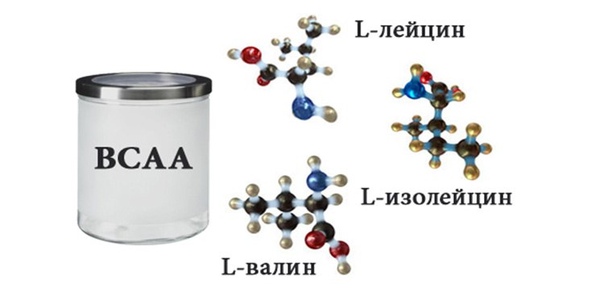
Функциональные свойства BSA
Вспенивание
Вспенивание можно определить как образование и стабилизацию пузырьков газа в
жидкость. Белки диффундируют к границе раздела воздух-вода и уменьшают поверхность
напряжение. В интерфейсе они частично разворачиваются и объединяются, чтобы произвести
межмолекулярная связная пленка с некоторой степенью эластичности.Мыло
расширение и стабильность улучшаются, когда BSA взаимодействует с основными белками
как лизоцим и клубеин (Poole et al .,
1984) из-за перекрестных связей, образованных между BSA и лизоцимом на границе раздела.
Сам по себе BSA лучше всего работает вблизи своей изоэлектрической точки при электростатическом
отталкивание минимально. Когда он взаимодействует с лизоцимом, наибольшая
расширение и стабильность были обнаружены между pH 8 и 9, что находится между
изоэлектрическая точка БСА (4.7) и лизоцим (10.7), когда белки
противоположно заряженный. Клупеин с pI 12 оказался более эффективным
чем лизоцим. Липиды подавляют пенообразование, вытесняя молекулы белка из
граница раздела воздух-жидкость и нарушение целостности белковой пленки
(Росс, 1950). Это ингибирование липидов было нейтрализовано
когда BSA взаимодействовал с клубеином на границе раздела воздух-жидкость (
Пул и др. , 1986).
Клупеин с pI 12 оказался более эффективным
чем лизоцим. Липиды подавляют пенообразование, вытесняя молекулы белка из
граница раздела воздух-жидкость и нарушение целостности белковой пленки
(Росс, 1950). Это ингибирование липидов было нейтрализовано
когда BSA взаимодействовал с клубеином на границе раздела воздух-жидкость (
Пул и др. , 1986).
Свойства гелеобразования BSA
БСА при нагревании образует растворимые агрегаты через дисульфид и нековалентность.
облигации.Альфа-лактальбумин, с другой стороны, не образует растворимых агрегатов на
сам по себе, но взаимодействует с BSA посредством дисульфидного обмена с образованием
растворимые агрегаты (Matsudomi et al ., 1993).
Растворимые агрегаты полимеризованных молекул образовывались на раннем этапе
стадии гелеобразования белков, вызванного нагреванием, и последующая полимеризация
привело к образованию жесткой гелевой сетки (
Накамура и др. , 1986;
Китабатаке и др. ., 1989). Добавление альфа-лактальбумина к
БСА снижает гелеобразующую способность БСА, что измеряется комплексным модулем упругости.
G * (Паулссон и др. , 1986).
., 1989). Добавление альфа-лактальбумина к
БСА снижает гелеобразующую способность БСА, что измеряется комплексным модулем упругости.
G * (Паулссон и др. , 1986).
Гелеобразование по Ферри (1948) состоит из двух этапов.
механизм. Этап инициации, включающий раскрытие или диссоциацию
молекулы белка, после чего следует стадия агрегации, на которой ассоциация или
происходят реакции агрегации, приводящие к образованию геля при соответствующем
условия.Для образования высокоупорядоченного геля важно, чтобы
этап агрегации происходит медленнее, чем этап развертывания
(Германссон, 1978; 1979а). В
температура денатурации БСА методом дифференциального термического анализа (ДТА) составляла
оказалось, что составляет 64 ° C (Itoh et al ., 1976)
и 62 ° C методом дифференциальной сканирующей калориметрии (
Ruegg и др. ., 1977). Температура денатурации БСА увеличилась.
когда он связывается с жирными кислотами (Бернал и Джелен, 1985)
но уменьшается при взаимодействии с клубеином (Poole et al . , 1987).
Следовательно, кажется, что взаимодействие одного биополимера, например. жирная кислота
к BSA привело к стабильности молекулы BSA, тогда как другая молекула, например.
clupeine взаимодействует и способствует инициации развертывания BSA.
, 1987).
Следовательно, кажется, что взаимодействие одного биополимера, например. жирная кислота
к BSA привело к стабильности молекулы BSA, тогда как другая молекула, например.
clupeine взаимодействует и способствует инициации развертывания BSA.
Связывание лиганда
Пожалуй, самым выдающимся свойством альбумина является его способность связывать
обратимо невероятное разнообразие лигандов (Goodman, 1958;
Даугадей, 1959 г .; Йетс и Ургухарт, 1962;
Якобсен, 1969; Клопфенштейн, 1969;
Берк и др. ., 1971; Унгер, 1972;
Вестфаль и Хардинг, 1973; Beaven и др. , 1974;
Якобсен, 1977; Richardson et al., , 1977;
Спектор и Флетчер, 1978; Бродерсен, 1979;
Адамс и Берман, 1980; Savu et al., , 1981;
Рода и др. ., 1982). BSA является основным
переносчик жирных кислот, которые иначе нерастворимы в циркулирующей плазме.
Он также выполняет множество других функций, таких как изоляция без кислорода
радикалы и инактивация различных токсичных липофильных метаболитов, таких как
билирубин (Emerson, 1989). Альбумин имеет
высокое сродство к жирным кислотам, гематину, билирубину и широкое сродство
для небольших отрицательно заряженных ароматических соединений. Образует ковалентные аддукты
с пиридоксилфосфатом, цистеином, глутатионом и различными металлами, такими как
в виде Cu (II), Ni (II), Hg (II), Ag (II) и Au (I). Как многофункциональный
транспортный белок, альбумин является основным переносчиком или резервуаром оксида азота,
который был вовлечен в ряд важных физиологических процессов,
включая нейротрансмиссию (Stamler et al ., 1992). Он также принадлежит
мультигенное семейство белков, которые включают альфа-фетопротеин (AFP) и витамин
D-связывающий белок (VDP), также известный как белок G-комплемента (GC).
Хотя AFP считается фетальным аналогом альбумина, его связывание
свойства различны, и было высказано предположение, что AFP может иметь более высокие
сродство к некоторым неизвестным лигандам, важным для развития плода. VDP
играет важную роль в регуляции кальция.
Альбумин имеет
высокое сродство к жирным кислотам, гематину, билирубину и широкое сродство
для небольших отрицательно заряженных ароматических соединений. Образует ковалентные аддукты
с пиридоксилфосфатом, цистеином, глутатионом и различными металлами, такими как
в виде Cu (II), Ni (II), Hg (II), Ag (II) и Au (I). Как многофункциональный
транспортный белок, альбумин является основным переносчиком или резервуаром оксида азота,
который был вовлечен в ряд важных физиологических процессов,
включая нейротрансмиссию (Stamler et al ., 1992). Он также принадлежит
мультигенное семейство белков, которые включают альфа-фетопротеин (AFP) и витамин
D-связывающий белок (VDP), также известный как белок G-комплемента (GC).
Хотя AFP считается фетальным аналогом альбумина, его связывание
свойства различны, и было высказано предположение, что AFP может иметь более высокие
сродство к некоторым неизвестным лигандам, важным для развития плода. VDP
играет важную роль в регуляции кальция. ADP и VDP оба взаимодействуют
с основным комплексом гистосовместимости класса II, предполагающим, что эти
белки могут играть важную роль в модуляции иммунной системы
(Ван Орс и др. ., 1989). В циркулирующей плазме примерно 30% свободного
сульфгидрил, Cys-34, окисляется цистеином и глутатионом (Peters, 1985).
ADP и VDP оба взаимодействуют
с основным комплексом гистосовместимости класса II, предполагающим, что эти
белки могут играть важную роль в модуляции иммунной системы
(Ван Орс и др. ., 1989). В циркулирующей плазме примерно 30% свободного
сульфгидрил, Cys-34, окисляется цистеином и глутатионом (Peters, 1985).
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Образование и перестановка дисульфидных связей в альбумине бычьей сыворотки продемонстрировано с помощью тандемной масс-спектрометрии с диссоциацией, вызванной столкновениями и переносом электрона.
Бычий сывороточный альбумин (BSA) | VWR
Положения и условия
Спасибо, что посетили наш сайт. Эти условия использования применимы к веб-сайтам США, Канады и Пуэрто-Рико (далее «Веб-сайт»), которыми управляет VWR («Компания»).Если вы заходите на веб-сайт из-за пределов США, Канады или Пуэрто-Рико, пожалуйста, посетите соответствующий международный веб-сайт, доступный по адресу www.vwr.com, для ознакомления с применимыми условиями. На всех пользователей веб-сайта распространяются следующие положения и условия использования веб-сайта (настоящие «Условия использования»). Пожалуйста, внимательно прочтите эти Условия использования перед доступом или использованием любой части веб-сайта. Заходя на веб-сайт или используя его, вы соглашаетесь с тем, что прочитали, поняли и соглашаетесь соблюдать настоящие Условия использования с поправками, которые время от времени вносятся, а также Политику конфиденциальности компании, которая настоящим включена в настоящие Условия. использования. Если вы не желаете соглашаться с настоящими Условиями использования, не открывайте и не используйте какие-либо части Веб-сайта.
использования. Если вы не желаете соглашаться с настоящими Условиями использования, не открывайте и не используйте какие-либо части Веб-сайта.
Компания может пересматривать и обновлять настоящие Условия использования в любое время без предварительного уведомления, разместив измененные условия на веб-сайте. Продолжение использования вами веб-сайта означает, что вы принимаете и соглашаетесь с пересмотренными Условиями использования. Если вы не согласны с Условиями использования (в которые время от времени вносятся поправки) или недовольны Веб-сайтом, ваше единственное и исключительное средство правовой защиты — прекратить использование Веб-сайта.
Использование сайта
Информация, содержащаяся на этом веб-сайте, предназначена только для информационных целей. Хотя считается, что информация верна на момент публикации, вам следует самостоятельно определить ее пригодность для вашего использования. Не все продукты или услуги, описанные на этом веб-сайте, доступны во всех юрисдикциях или для всех потенциальных клиентов, и ничто в настоящем документе не предназначено как предложение или ходатайство в какой-либо юрисдикции или какому-либо потенциальному покупателю, где такое предложение или продажа не соответствует требованиям.
Приобретение товаров и услуг
Настоящие Условия и положения распространяются только на использование Веб-сайта. Обратите внимание, что условия, касающиеся обслуживания, продаж продуктов, рекламных акций и других связанных мероприятий, можно найти по адресу https://us.vwr.com/store/content/externalContentPage.jsp?path=/en_US/about_vwr_terms_and_conditions.jsp , и эти условия регулируют любые покупки продуктов или услуг у Компании.
Интерактивные функции
Веб-сайт может содержать службы досок объявлений, области чата, группы новостей, форумы, сообщества, личные веб-страницы, календари и / или другие средства сообщения или коммуникации, предназначенные для того, чтобы вы могли общаться с общественностью в целом или с группой ( вместе «Особенность сообщества»).Вы соглашаетесь использовать функцию сообщества только для публикации, отправки и получения сообщений и материалов, которые являются надлежащими и связаны с конкретной функцией сообщества. Вы соглашаетесь использовать веб-сайт только в законных целях.
Вы соглашаетесь использовать веб-сайт только в законных целях.
A. В частности, вы соглашаетесь не делать ничего из следующего при использовании функции сообщества:
1. Оскорблять, оскорблять, преследовать, преследовать, угрожать или иным образом нарушать законные права (например, право на неприкосновенность частной жизни и гласность) других.
2. Публиковать, размещать, загружать, распространять или распространять любую неуместную, непристойную, дискредитирующую, нарушающую авторские права, непристойную, непристойную или незаконную тему, название, материал или информацию.
3. Загружайте файлы, содержащие программное обеспечение или другие материалы, защищенные законами об интеллектуальной собственности (или правами на неприкосновенность частной жизни), если вы не владеете или не контролируете права на них или не получили все необходимое согласие.
4. Загрузите файлы, содержащие вирусы, поврежденные файлы или любое другое подобное программное обеспечение или программы, которые могут повредить работу чужого компьютера.
5. Перехватить или попытаться перехватить электронную почту, не предназначенную для вас.
6. Рекламировать или предлагать продавать или покупать какие-либо товары или услуги для любых деловых целей, если такая функция сообщества специально не разрешает такие сообщения.
7. Проводите или рассылайте опросы, конкурсы, финансовые пирамиды или письма счастья.
8. Загрузите любой файл, опубликованный другим пользователем функции сообщества, который, как вы знаете или разумно должен знать, не может распространяться на законных основаниях таким образом или что у вас есть договорное обязательство сохранять конфиденциальность (независимо от его доступности на веб-сайте).
9. Подделывать или удалять любые ссылки на авторов, юридические или иные надлежащие уведомления, обозначения собственности или ярлыки происхождения или источника программного обеспечения или других материалов, содержащихся в загружаемом файле.
10. Представление ложной информации о принадлежности к какому-либо лицу или организации.
11. Участвовать в любых других действиях, которые ограничивают или препятствуют использованию веб-сайта кем-либо, или которые, по мнению Компании, могут нанести вред Компании или пользователям веб-сайта или подвергнуть их ответственности.
12. Нарушать любые применимые законы или постановления или нарушать любой кодекс поведения или другие правила, которые могут быть применимы к любой конкретной функции Сообщества.
13. Собирать или иным образом собирать информацию о других, включая адреса электронной почты, без их согласия.
B. Вы понимаете и признаете, что несете ответственность за любой контент, который вы отправляете, вы, а не Компания, несете полную ответственность за такой контент, включая его законность, надежность и уместность. Если вы публикуете сообщения от имени или от имени вашего работодателя или другой организации, вы заявляете и гарантируете, что у вас есть на это право. Загружая или иным образом передавая материалы в любую область веб-сайта, вы гарантируете, что эти материалы являются вашими собственными или находятся в общественном достоянии или иным образом свободны от проприетарных или иных ограничений, и что вы имеете право размещать их на веб-сайте.
Кроме того, загружая или иным образом передавая материалы в любую область веб-сайта, вы предоставляете Компании безотзывное, бесплатное, всемирное право на публикацию, воспроизведение, использование, адаптацию, редактирование и / или изменение таких материалов любым способом, в любые и все средства массовой информации, известные в настоящее время или обнаруженные в будущем во всем мире, в том числе в Интернете и World Wide Web, для рекламных, коммерческих, торговых и рекламных целей, без дополнительных ограничений или компенсации, если это не запрещено законом, и без уведомления, проверки или одобрения.
C. Компания оставляет за собой право, но не принимает на себя никакой ответственности (1) удалить любые материалы, размещенные на веб-сайте, которые Компания по своему собственному усмотрению сочтет несовместимыми с вышеуказанными обязательствами или иным образом неуместными по любой причине ; и (2) прекратить доступ любого пользователя ко всему или к части веб-сайта.
Однако Компания не может ни просмотреть все материалы до того, как они будут размещены на веб-сайте, ни обеспечить быстрое удаление нежелательных материалов после их размещения.Соответственно, Компания не несет ответственности за какие-либо действия или бездействие в отношении передач, сообщений или контента, предоставленных третьими сторонами. Компания оставляет за собой право предпринимать любые действия, которые сочтет необходимыми для защиты личной безопасности пользователей этого веб-сайта и общественности; тем не менее, Компания не несет ответственности ни перед кем за выполнение или невыполнение действий, описанных в этом параграфе.
D. Несоблюдение вами положений пунктов (A) или (B) выше может привести к прекращению вашего доступа к веб-сайту и может привести к гражданской и / или уголовной ответственности.
Особое примечание о содержании функций сообщества
Любой контент и / или мнения, загруженные, выраженные или отправленные с помощью любой функции сообщества или любого другого общедоступного раздела веб-сайта (включая области, защищенные паролем), а также все статьи и ответы на вопросы, кроме контента, явно разрешенного Компания, являются исключительно мнениями и ответственностью лица, представляющего их, и не обязательно отражают мнение Компании. Например, любое рекомендованное или предлагаемое использование продуктов или услуг, доступных от Компании, которое публикуется через функцию сообщества, не является признаком одобрения или рекомендации Компании. Если вы решите следовать любой такой рекомендации, вы делаете это на свой страх и риск.
Например, любое рекомендованное или предлагаемое использование продуктов или услуг, доступных от Компании, которое публикуется через функцию сообщества, не является признаком одобрения или рекомендации Компании. Если вы решите следовать любой такой рекомендации, вы делаете это на свой страх и риск.
Ссылки на сторонние сайты
Веб-сайт может содержать ссылки на другие веб-сайты в Интернете. Компания не несет ответственности за контент, продукты, услуги или методы любых сторонних веб-сайтов, включая, помимо прочего, сайты, связанные с Веб-сайтом или с него, сайты, созданные внутри Веб-сайта, или стороннюю рекламу, и не делает заявлений относительно их качество, содержание или точность.Наличие ссылок с веб-сайта на какой-либо сторонний веб-сайт не означает, что мы одобряем, поддерживаем или рекомендуем этот веб-сайт. Мы отказываемся от всех гарантий, явных или подразумеваемых, в отношении точности, законности, надежности или действительности любого контента на любых сторонних веб-сайтах. Вы используете сторонние веб-сайты на свой страх и риск и в соответствии с условиями использования таких веб-сайтов.
Вы используете сторонние веб-сайты на свой страх и риск и в соответствии с условиями использования таких веб-сайтов.
Права собственности на контент
Вы признаете и соглашаетесь с тем, что все содержимое веб-сайта (включая всю информацию, данные, программное обеспечение, графику, текст, изображения, логотипы и / или другие материалы), а также его дизайн, выбор, сбор, расположение и сборка являются являются собственностью Компании и защищены законами США и международными законами об интеллектуальной собственности.Вы имеете право использовать содержимое веб-сайта только в личных или законных деловых целях. Вы не можете копировать, изменять, создавать производные работы, публично демонстрировать или исполнять, переиздавать, хранить, передавать, распространять, удалять, удалять, дополнять, добавлять, участвовать в передаче, лицензировать или продавать какие-либо материалы в Интернете. Сайт без предварительного письменного согласия Компании, за исключением: (а) временного хранения копий таких материалов в ОЗУ, (б) хранения файлов, которые автоматически кэшируются вашим веб-браузером в целях улучшения отображения, и (в) печати разумного количество страниц веб-сайта; в каждом случае при условии, что вы не изменяете и не удаляете какие-либо уведомления об авторских правах или других правах собственности, включенные в такие материалы. Ни название, ни какие-либо права интеллектуальной собственности на любую информацию или материалы на Веб-сайте не передаются вам, а остаются за Компанией или соответствующим владельцем такого контента.
Ни название, ни какие-либо права интеллектуальной собственности на любую информацию или материалы на Веб-сайте не передаются вам, а остаются за Компанией или соответствующим владельцем такого контента.
Товарные знаки
Название и логотип компании, а также все связанные названия, логотипы, названия продуктов и услуг, появляющиеся на веб-сайте, являются товарными знаками компании и / или соответствующих сторонних поставщиков. Их нельзя использовать или воспроизводить повторно без предварительного письменного согласия Компании.
Отказ от ответственности
Компания не несет никакой ответственности за материалы, информацию и мнения, предоставленные или доступные через Веб-сайт («Контент сайта»). Вы полагаетесь на Контент сайта исключительно на свой страх и риск. Компания не несет никакой ответственности за травмы или убытки, возникшие в результате использования любого Контента Сайта.
ВЕБ-САЙТ, СОДЕРЖАНИЕ САЙТА, ПРОДУКТЫ И УСЛУГИ, ПРЕДОСТАВЛЯЕМЫЕ ИЛИ ДОСТУПНЫЕ ЧЕРЕЗ САЙТ, ПРЕДОСТАВЛЯЮТСЯ НА УСЛОВИЯХ «КАК ЕСТЬ» И «ПО ДОСТУПНОСТИ», СО ВСЕМИ ОТКАЗАМИ.НИ КОМПАНИЯ, НИ ЛИБО, СВЯЗАННОЕ С КОМПАНИЕЙ, НЕ ДАЕТ НИКАКИХ ГАРАНТИЙ ИЛИ ЗАЯВЛЕНИЙ В ОТНОШЕНИИ КАЧЕСТВА, ТОЧНОСТИ ИЛИ ДОСТУПНОСТИ ВЕБ-САЙТА. В частности, НО БЕЗ ОГРАНИЧЕНИЯ ВЫШЕИЗЛОЖЕННОГО, НИ КОМПАНИЯ И НИ ЛИБО, СВЯЗАННОЕ С КОМПАНИЕЙ, НЕ ГАРАНТИРУЕТ ИЛИ ЗАЯВЛЯЕТ, ЧТО ВЕБ-САЙТ, СОДЕРЖАНИЕ САЙТА ИЛИ УСЛУГИ, ПРЕДОСТАВЛЯЕМЫЕ НА САЙТЕ ИЛИ ЧЕРЕЗ САЙТ, БУДУТ ТОЧНЫМИ, НАДЕЖНЫМИ ИЛИ БЕСПЛАТНЫМИ ЧТО ДЕФЕКТЫ БУДУТ ИСПРАВЛЕНЫ; ЧТО ВЕБ-САЙТ ИЛИ СЕРВЕР, ДЕЛАЮЩИЙ ЕГО ДОСТУПНЫМ, СВОБОДНЫ ОТ ВИРУСОВ ИЛИ ДРУГИХ ВРЕДНЫХ КОМПОНЕНТОВ; ИЛИ ЧТО ВЕБ-САЙТ ИНАЧЕ ОТВЕЧАЕТ ВАШИМ ПОТРЕБНОСТЯМ ИЛИ ОЖИДАНИЯМ.КОМПАНИЯ ОТКАЗЫВАЕТСЯ ОТ ВСЕХ ГАРАНТИЙ, ЯВНЫХ ИЛИ ПОДРАЗУМЕВАЕМЫХ, ВКЛЮЧАЯ ЛЮБЫЕ ГАРАНТИИ КОММЕРЧЕСКОЙ ЦЕННОСТИ, ПРИГОДНОСТИ ДЛЯ ОПРЕДЕЛЕННОЙ ЦЕЛИ И НЕ НАРУШЕНИЯ.
НИ ПРИ КАКИХ ОБСТОЯТЕЛЬСТВАХ КОМПАНИЯ ИЛИ ЕЕ ЛИЦЕНЗИАРЫ ИЛИ ПОДРЯДЧИКИ НЕ НЕСЕТ ОТВЕТСТВЕННОСТИ ЗА ЛЮБЫЕ УБЫТКИ ЛЮБОГО РОДА, ПРИ КАКИХ-ЛИБО ЮРИДИЧЕСКИХ ТЕОРИЯХ, ВЫЗВАННЫЕ ИЛИ В СВЯЗИ С ИСПОЛЬЗОВАНИЕМ ВАМИ ИЛИ НЕВОЗМОЖНОСТЬЮ ИСПОЛЬЗОВАТЬ ВЕБ-САЙТ, СОДЕРЖИМОЕ САЙТА, ЛЮБЫЕ УСЛУГИ, ПРЕДОСТАВЛЯЕМЫЕ НА САЙТЕ ИЛИ ЧЕРЕЗ ВЕБ-САЙТ ИЛИ ЛЮБОЙ САЙТ, ВКЛЮЧАЮЩИЙ ПРЯМЫЙ, КОСВЕННЫЙ, СЛУЧАЙНЫЙ, СПЕЦИАЛЬНЫЙ, КОСВЕННЫЙ ИЛИ КАРАТЕЛЬНЫЙ УБЫТК, ВКЛЮЧАЯ, НО НЕ ОГРАНИЧИВАЯСЬ, ЛИЧНЫЕ ТРАВМЫ, ПОТЕРЯ ПРИБЫЛИ ИЛИ УБЫТКОВ , ВИРУСЫ, УДАЛЕНИЕ ФАЙЛОВ ИЛИ ЭЛЕКТРОННЫХ СООБЩЕНИЙ, ИЛИ ОШИБКИ, УПУЩЕНИЯ ИЛИ ДРУГИЕ НЕТОЧНОСТИ НА ВЕБ-САЙТЕ ИЛИ СОДЕРЖАНИИ САЙТА, ИЛИ УСЛУГАХ, НЕОБХОДИМО ИЛИ НЕТ НЕОБХОДИМОСТЬ КОМПАНИИ И ПРЕДОСТАВЛЯЛА ЛИ КОМПАНИЯ ВОЗМОЖНОСТЬ ЛЮБЫЕ ТАКИЕ УБЫТКИ, ЕСЛИ НЕ ЗАПРЕЩЕНЫ ПРИМЕНИМЫМ ЗАКОНОДАТЕЛЬСТВОМ.
Компенсация
Вы соглашаетесь возместить и обезопасить Компанию и ее должностных лиц, директоров, агентов, сотрудников и других лиц, участвующих в работе Веб-сайта, от любых обязательств, расходов, убытков и издержек, включая разумные гонорары адвокатам, возникающих в результате любое нарушение вами настоящих Условий использования, использование вами веб-сайта или любых продуктов, услуг или информации, полученных с веб-сайта или через него, ваше подключение к веб-сайту, любой контент, который вы отправляете на веб-сайт через любые Функция сообщества или нарушение вами каких-либо прав другого лица.
Применимое право; Международное использование
Настоящие условия регулируются и толкуются в соответствии с законами штата Пенсильвания без учета каких-либо принципов коллизионного права. Вы соглашаетесь с тем, что любые судебные иски или иски, вытекающие из настоящих Условий использования или связанные с ними, будут подаваться исключительно в суды штата или федеральные суды, расположенные в Пенсильвании, и вы тем самым соглашаетесь и подчиняетесь личной юрисдикции таких судов для цели судебного разбирательства по любому из таких действий.
Настоящие Условия использования применимы к пользователям в США, Канаде и Пуэрто-Рико. Если вы заходите на веб-сайт из-за пределов США, Канады или Пуэрто-Рико, пожалуйста, посетите соответствующий международный веб-сайт, доступный по адресу www.vwr.com, для ознакомления с применимыми условиями. Если вы решите получить доступ к этому веб-сайту из-за пределов указанных юрисдикций, а не использовать доступные международные сайты, вы соглашаетесь с настоящими Условиями использования и тем, что такие условия будут регулироваться и толковаться в соответствии с законами США и штата. Пенсильвании и что мы не делаем никаких заявлений о том, что материалы или услуги на этом веб-сайте подходят или доступны для использования в этих других юрисдикциях.В любом случае все пользователи сами несут ответственность за соблюдение местных законов.
Общие условия
Настоящие Условия использования, в которые время от времени могут вноситься поправки, представляют собой полное соглашение и понимание между вами и нами, регулирующее использование вами веб-сайта. Наша неспособность реализовать или обеспечить соблюдение какого-либо права или положения Условий использования не означает отказ от такого права или положения. Если какое-либо положение Условий использования будет признано судом компетентной юрисдикции недействительным, вы тем не менее соглашаетесь с тем, что суд должен попытаться реализовать намерения сторон, отраженные в этом положении и других положениях Условия использования остаются в полной силе.Ни ваши деловые отношения, ни поведение между вами и Компанией, ни какая-либо торговая практика не может считаться изменением настоящих Положений и условий использования. Вы соглашаетесь с тем, что независимо от какого-либо закона или закона об обратном, любые претензии или основания для иска, вытекающие из или связанные с использованием Сайта или Условий использования, должны быть поданы в течение одного (1) года после такой претензии или причины. иска возникла или будет навсегда запрещена. Любые права, прямо не предоставленные в настоящем документе, сохраняются за Компанией.
Наша неспособность реализовать или обеспечить соблюдение какого-либо права или положения Условий использования не означает отказ от такого права или положения. Если какое-либо положение Условий использования будет признано судом компетентной юрисдикции недействительным, вы тем не менее соглашаетесь с тем, что суд должен попытаться реализовать намерения сторон, отраженные в этом положении и других положениях Условия использования остаются в полной силе.Ни ваши деловые отношения, ни поведение между вами и Компанией, ни какая-либо торговая практика не может считаться изменением настоящих Положений и условий использования. Вы соглашаетесь с тем, что независимо от какого-либо закона или закона об обратном, любые претензии или основания для иска, вытекающие из или связанные с использованием Сайта или Условий использования, должны быть поданы в течение одного (1) года после такой претензии или причины. иска возникла или будет навсегда запрещена. Любые права, прямо не предоставленные в настоящем документе, сохраняются за Компанией. Мы можем прекратить ваш доступ или приостановить доступ любого пользователя ко всему сайту или его части без предварительного уведомления за любое поведение, которое мы, по нашему собственному усмотрению, считаем нарушением какого-либо применимого закона или наносящим ущерб интересам другого пользователя. , стороннего поставщика, поставщика услуг или нас. Любые вопросы относительно настоящих Условий использования следует направлять по адресу solutions@vwr.com.
Мы можем прекратить ваш доступ или приостановить доступ любого пользователя ко всему сайту или его части без предварительного уведомления за любое поведение, которое мы, по нашему собственному усмотрению, считаем нарушением какого-либо применимого закона или наносящим ущерб интересам другого пользователя. , стороннего поставщика, поставщика услуг или нас. Любые вопросы относительно настоящих Условий использования следует направлять по адресу solutions@vwr.com.
Жалобы на нарушение авторских прав
Мы уважаем интеллектуальную собственность других и просим наших пользователей поступать так же.Если вы считаете, что ваша работа была скопирована и доступна на Сайте способом, который представляет собой нарушение авторских прав, вы можете уведомить нас, предоставив нашему агенту по авторским правам следующую информацию:


 БЦАА выпускают исключительно для атлетов, спортсменов.
БЦАА выпускают исключительно для атлетов, спортсменов. Исследования показывают, что лейцин жизненно важен для стимуляции роста мышц и стимуляции синтеза белка. Доказано, что употребление от 5 до 20 грамм лейцина в день приводит к увеличению массы мышц, лучшему синтезу белка, ускоренному восстановлению после тренировок и массе других преимуществ. Исследования показали, что употребление 12 грамм лейцина в день увеличило массу мышц у пожилых женщин, которые не тренировались с отягощениями вовсе. Рекомендуется употреблять как минимум 5 грамм этой аминокислоты во время тренировочного процесса. Поэтому важный момент, который вы должны посмотреть – соотношение этой аминокислоты с двумя другими аминокислотами.
Исследования показывают, что лейцин жизненно важен для стимуляции роста мышц и стимуляции синтеза белка. Доказано, что употребление от 5 до 20 грамм лейцина в день приводит к увеличению массы мышц, лучшему синтезу белка, ускоренному восстановлению после тренировок и массе других преимуществ. Исследования показали, что употребление 12 грамм лейцина в день увеличило массу мышц у пожилых женщин, которые не тренировались с отягощениями вовсе. Рекомендуется употреблять как минимум 5 грамм этой аминокислоты во время тренировочного процесса. Поэтому важный момент, который вы должны посмотреть – соотношение этой аминокислоты с двумя другими аминокислотами. 
 Поэтому рекомендуем вам обращать внимание присутствие в составе витаминов и минералов. Например, Monster Amino от CytoSport содержит калий, натрий и витамин B6, также многие комплексы имеют в составе витамин С и витамины группы B.
Поэтому рекомендуем вам обращать внимание присутствие в составе витаминов и минералов. Например, Monster Amino от CytoSport содержит калий, натрий и витамин B6, также многие комплексы имеют в составе витамин С и витамины группы B.



 ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ.
ИЗ 25-607 В КОМПЛЕКСЕ С КАЛЬЦИЕМ, ДИСУЛЬФИДНЫМИ СВЯЗЯМИ. «
«  .»
.»  R.
R. 

 «
«  R.
R.  «
«  R.
R.  «
«  R.
R.  «
«  R.
R.  «
«  «
«  Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. J. Bacteriol. 187, 6206–6212 (2005).
J. Bacteriol. 187, 6206–6212 (2005). С. и Сиахан, Т. Дж. Роль тиолов и дисульфидов в химической и физической стабильности белков. Curr. Protein Pept. Sc. 10, 614–625, (2009).
С. и Сиахан, Т. Дж. Роль тиолов и дисульфидов в химической и физической стабильности белков. Curr. Protein Pept. Sc. 10, 614–625, (2009). 39, 1378–1385, (1991).
39, 1378–1385, (1991). et al. Роль дисульфидных мостиков в протеолитической восприимчивости и аллергенности Ara H 6, основного аллергена арахиса. J. Allergy Clin. Иммунол. 127, AB236 (2011).
et al. Роль дисульфидных мостиков в протеолитической восприимчивости и аллергенности Ara H 6, основного аллергена арахиса. J. Allergy Clin. Иммунол. 127, AB236 (2011). С., Олд, В. М., Ресинг, К. А. и Ан, Н. Г. Картирование посттрансляционных модификаций белков с помощью масс-спектрометрии. Nat. Meth. 4, 798–806, (2007).
С., Олд, В. М., Ресинг, К. А. и Ан, Н. Г. Картирование посттрансляционных модификаций белков с помощью масс-спектрометрии. Nat. Meth. 4, 798–806, (2007).
 J. Biol. Chem. 287, 1510–1519, (2012).
J. Biol. Chem. 287, 1510–1519, (2012). , Akashi, S., Furuya, M. & Fukuhara, K. Быстрое подтверждение и пересмотр первичной структуры бычьего сывороточного альбумина с помощью ESIMS и Frit-FAB LC / MS.Biochem. Биофиз. Res. Commun. 173, 639–646, (1990).
, Akashi, S., Furuya, M. & Fukuhara, K. Быстрое подтверждение и пересмотр первичной структуры бычьего сывороточного альбумина с помощью ESIMS и Frit-FAB LC / MS.Biochem. Биофиз. Res. Commun. 173, 639–646, (1990). J. Food Sci.68, 2215–2220, (2003).
J. Food Sci.68, 2215–2220, (2003). Acta 400, 132–136, (1975).
Acta 400, 132–136, (1975). Варенье. Chem. Soc. 102, 359–363, (1980).
Варенье. Chem. Soc. 102, 359–363, (1980). , 1250 Sixth Ave., Сан-Диего, Калифорния 92101, США; Academic Press Ltd., 14 Belgrave Square, 24-28 Oval Road, London NW1 70X, England, Великобритания, 1994).
, 1250 Sixth Ave., Сан-Диего, Калифорния 92101, США; Academic Press Ltd., 14 Belgrave Square, 24-28 Oval Road, London NW1 70X, England, Великобритания, 1994). М. Н., Марсал, С. Л., Виторино, Р., Домингес, М. Р. М. и Домингес, П.Характеристика окисления белка in vitro с использованием масс-спектрометрии: изучение динамики окисленной альфа-амилазы. Arch. Biochem. Биофиз. 530, 23–31, (2013).
М. Н., Марсал, С. Л., Виторино, Р., Домингес, М. Р. М. и Домингес, П.Характеристика окисления белка in vitro с использованием масс-спектрометрии: изучение динамики окисленной альфа-амилазы. Arch. Biochem. Биофиз. 530, 23–31, (2013).


 Кроме того, загружая или иным образом передавая материалы в любую область веб-сайта, вы предоставляете Компании безотзывное, бесплатное, всемирное право на публикацию, воспроизведение, использование, адаптацию, редактирование и / или изменение таких материалов любым способом, в любые и все средства массовой информации, известные в настоящее время или обнаруженные в будущем во всем мире, в том числе в Интернете и World Wide Web, для рекламных, коммерческих, торговых и рекламных целей, без дополнительных ограничений или компенсации, если это не запрещено законом, и без уведомления, проверки или одобрения.
Кроме того, загружая или иным образом передавая материалы в любую область веб-сайта, вы предоставляете Компании безотзывное, бесплатное, всемирное право на публикацию, воспроизведение, использование, адаптацию, редактирование и / или изменение таких материалов любым способом, в любые и все средства массовой информации, известные в настоящее время или обнаруженные в будущем во всем мире, в том числе в Интернете и World Wide Web, для рекламных, коммерческих, торговых и рекламных целей, без дополнительных ограничений или компенсации, если это не запрещено законом, и без уведомления, проверки или одобрения. Однако Компания не может ни просмотреть все материалы до того, как они будут размещены на веб-сайте, ни обеспечить быстрое удаление нежелательных материалов после их размещения.Соответственно, Компания не несет ответственности за какие-либо действия или бездействие в отношении передач, сообщений или контента, предоставленных третьими сторонами. Компания оставляет за собой право предпринимать любые действия, которые сочтет необходимыми для защиты личной безопасности пользователей этого веб-сайта и общественности; тем не менее, Компания не несет ответственности ни перед кем за выполнение или невыполнение действий, описанных в этом параграфе.
Однако Компания не может ни просмотреть все материалы до того, как они будут размещены на веб-сайте, ни обеспечить быстрое удаление нежелательных материалов после их размещения.Соответственно, Компания не несет ответственности за какие-либо действия или бездействие в отношении передач, сообщений или контента, предоставленных третьими сторонами. Компания оставляет за собой право предпринимать любые действия, которые сочтет необходимыми для защиты личной безопасности пользователей этого веб-сайта и общественности; тем не менее, Компания не несет ответственности ни перед кем за выполнение или невыполнение действий, описанных в этом параграфе.