Бром
| Бром | |
|---|---|
| Атомный номер | 35 |
| Внешний вид простого вещества | красно-бурая жидкость с сильным неприятным запахом |
| Свойства атома | |
|
Атомная масса (молярная масса) |
79,904 а. е. м. (г/моль) |
| Радиус атома | n/a пм |
|
Энергия ионизации (первый электрон) |
1142,0 (11,84) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s2 4p5 |
| Химические свойства | |
| Ковалентный радиус | 114 пм |
| Радиус иона | (+5e)47 (-1e)196 пм |
|
Электроотрицательность (по Полингу) |
2,96 |
| Электродный потенциал | 0 |
| Степени окисления | 7, 5, 3, 1, -1 |
| Термодинамические свойства простого вещества | |
| Плотность | |
| Молярная теплоёмкость | 75,69 Дж/(K·моль) |
| Теплопроводность | 0,005 Вт/(м·K) |
| Температура плавления | 265,9 K |
| Теплота плавления | (Br—Br) 10,57 кДж/моль |
| Температура кипения | 331,9 K |
| Теплота испарения | (Br—Br) 29,56 кДж/моль |
| Молярный объём | 23,5 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Параметры решётки | a=6,67 b=4,48 c=8,72 Å |
| Отношение c/a | — |
| Температура Дебая | n/a K |
| Br | 35 |
| 79,904 | |
| [Ar]3d104s24p5 | |
| Бром | |
Бром — элемент главной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 35. Обозначается символом Br (лат. Bromum). Химически активный неметалл, относится к группе галогенов. Простое вещество бром (CAS-номер: 7726-95-6) при нормальных условиях — тяжёлая жидкость красно-бурого цвета с сильным неприятным запахом. Молекула брома двухатомна (формула Br2).
И. Менделеева, атомный номер 35. Обозначается символом Br (лат. Bromum). Химически активный неметалл, относится к группе галогенов. Простое вещество бром (CAS-номер: 7726-95-6) при нормальных условиях — тяжёлая жидкость красно-бурого цвета с сильным неприятным запахом. Молекула брома двухатомна (формула Br2).
История
Схема атома брома
Бром был открыт в 1826 году молодым преподавателем колледжа города Монпелье А. Ж. Баларом. Открытие Балара сделало его имя известным всему миру. Из одной популярной книги в другую кочует утверждение, что огорченный тем, что в открытии брома никому неизвестный Антуан Балар опередил самого Юстуса Либиха, Либих воскликнул, что, дескать, не Балар открыл бром, а бром открыл Балара. Однако это неправда, или, точнее, не совсем правда. Фраза-то была, но принадлежала она не Ю. Либиху, а Шарлю Жерару, который очень хотел, чтобы кафедру химии в Сорбонне занял Огюст Лоран, а не избранный на должность профессора А.
Происхождение названия
Название элемента происходит βρῶμος — зловоние.
Получение
Бром получают химическим путём из рассола Br—:
Физические свойства
При обычных условиях бром — красно-бурая жидкость с резким неприятным запахом, ядовит, при соприкосновении с кожей образуются ожоги. Плотность при 0 °C — 3, 19 г./см³. Температура плавления (затвердевания) брома −7,2 °C, кипения 58,8 °C, при кипении бром превращается из жидкости в буро-коричневые пары, при вдыхании раздражающие дыхательные пути. Стандартный электродный потенциал Br²/Вr
Обычный бром состоит из изотопов 79Br (50,56 %) и 81Br (49,44 %). Искусственно получены радиоактивные изотопы.
Химические свойства
В свободном виде существует в виде двухатомных молекул Br2. Заметная диссоциация молекул на атомы наблюдается при температуре 800 °C и быстро возрастает при дальнейшем росте температуры. Диаметр молекулы Br2 равен 0,323 нм, межъядерное расстояние в этой молекуле — 0,228 нм.
Диаметр молекулы Br2 равен 0,323 нм, межъядерное расстояние в этой молекуле — 0,228 нм.
Бром немного, но лучше других галогенов растворим в воде (3,58 г в 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
Br2 + H2O → HBr + HBrO.
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод:
Br2 + 2KI → I2↓ + 2KBr.
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
Cl2 + 2NaBr → Br2 + 2NaCl.
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF3 и BrF5, с иодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец.
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т.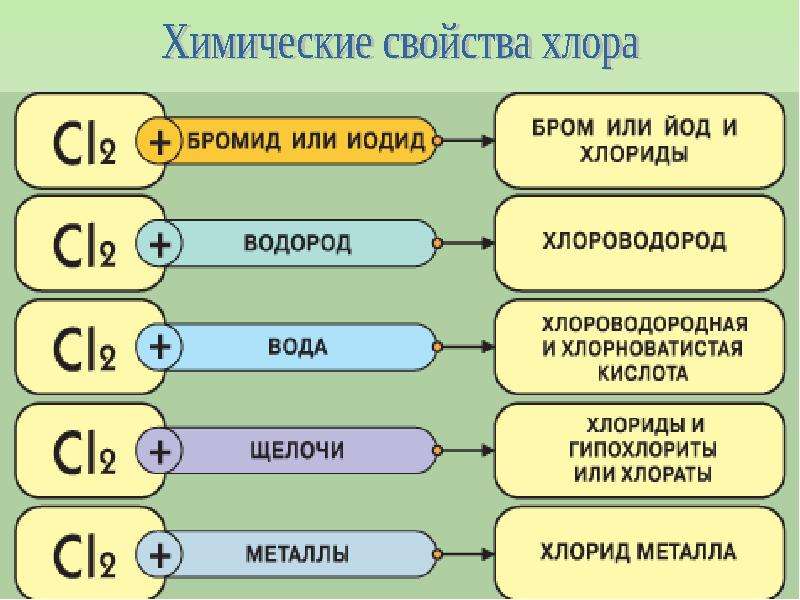
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
C2H4 + Br2 → C2H4Br2.
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через нее газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
3Br2 + 3Na2CO3 → 5NaBr + NaBrO3+ 3CO2↑.
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO2, бромноватистую HBrO.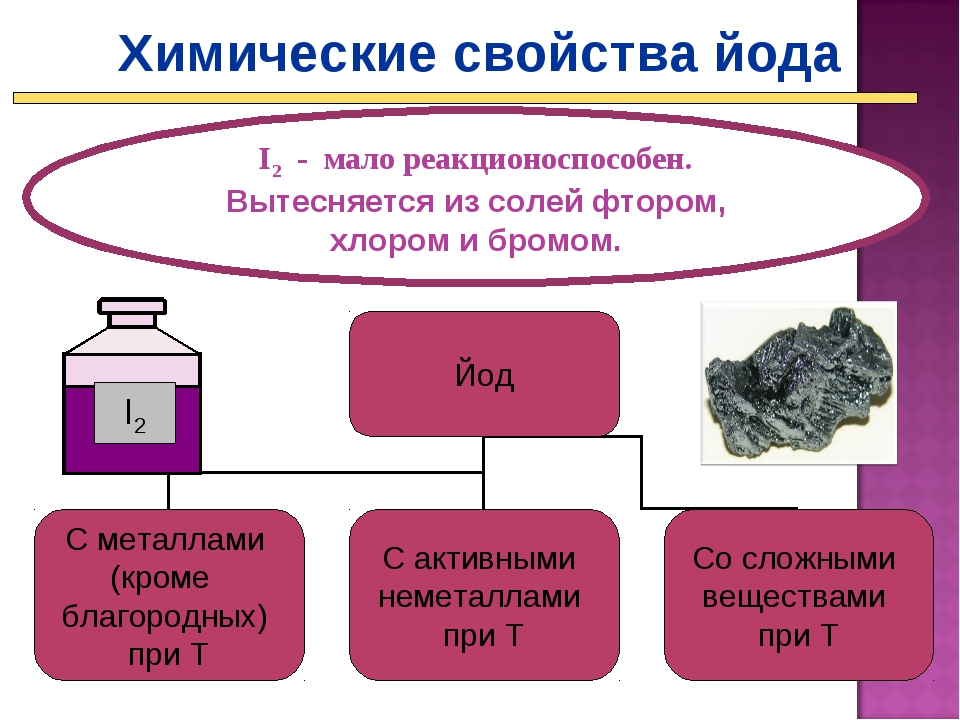
Применение
В химии
Вещества на основе брома широко применяются в основном органическом синтезе.
В технике
— Бромид серебра AgBr применяется в фотографии как светочувствительное вещество.
— Используется для создания антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам.
— Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива.
— 1,2-дибромэтан в настоящее время применяют как антидетонирующую добавку в моторном топливе, взамен тетраэтилсвинца.
— Растворы бромидов используются в нефтедобыче.
В медицине
В медицине бромид натрия и бромид калия применяют как успокаивающие средства.
В производстве оружия
Со времен Первой Мировой войны бром используется для производства боевых отравляющих веществ.
Физиологическое действие
Уже при содержании брома в воздухе в концентрации около 0,001 % (по объёму) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях — спазмы дыхательных путей, удушье. ПДК паров брома 0,5 мг/м³. При попадании в организм токсическая доза составляет 3 г, летальная — от 35 г. При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух; для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Дальнейшее лечение должно проводиться под наблюдением врача. Жидкий бром при попадании на кожу вызывает болезненные ожоги.
ПДК паров брома 0,5 мг/м³. При попадании в организм токсическая доза составляет 3 г, летальная — от 35 г. При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух; для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Дальнейшее лечение должно проводиться под наблюдением врача. Жидкий бром при попадании на кожу вызывает болезненные ожоги.
Особенности работы
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками. Из-за высокой химической активности и токсичности, как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде. Склянки с бромом располагают в ёмкостях с песком, который предохраняет склянки от разрушения при встряхивании. Из-за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
Для нейтрализации пролитого брома поверхность с ним надо залить раствором сульфита натрия Na2SO3
Мифы и легенды
Существует широко распространенная легенда о том, что в армии будто бы добавляют бром в еду для снижения полового влечения. Этот миф не имеет под собой никаких оснований — влечение успешно снижают физические нагрузки, а действительно добавляемые в еду добавки чаще всего оказываются аскорбиновой кислотой для предотвращения авитаминоза. К тому же, препараты брома соленые на вкус и не влияют ни на влечение, ни на потенцию. Они обладают снотворным и успокаивающим эффектом.
№35 Бром
src=»Cl-2.jpg» width=180 height=162 border=0 title=»хлорат калия + сахар + серная кислота»>
История открытия:К открытию брома привели исследования французского химика А. Балара, который в 1825 году, действуя хлором на водный раствор, полученный после промывания золы морских водорослей, выделил темно-бурую дурно пахнущую жидкость. Нахождение в природе, получение:Содержание брома в земной коре (1,6*l0-4% по массе) оценивается в 1015-1016 т. Бром — постоянный спутник хлора. Бромистые соли (NaBr, KBr, MgBr2) встречаются в отложениях хлористых солей (в поваренной соли до 0,03%, в калийных солях — сильвине и карналлите — до 0,3%), а также в морской воде (0,065%), рапе соляных озёр (до 0,2%) и подземных рассолах, обычно связанных с соляными и нефтяными месторождениями (до 0,1%). Физические свойства:Бром — единственный неметалл, жидкий при комнатной температуре. Простое вещество представляет собой тяжелую красно-бурую жидкость с неприятным запахом (плотность при 20°C — 3,1 г/см3, температура кипения +59,82°C), пары брома имеют желто-бурый цвет. При температуре -7,25°C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском. В воде бром растворим лучше других галогенов (3,58 г/100 г Н2О при 20°С) — «бромная вода«. Химические свойства: Бром является сильным окислителем, он непосредственно реагирует почти со всеми неметаллами (за исключением инертных газов, кислорода, азота и углерода) и многими металлами: Важнейшие соединения: Бромоводород HBr — ядовитый бесцветный газ с резким запахом, дымящий на воздухе из-за взаимодействия с парами воды. Хорошо растворим в воде: при 0° C в одном объеме воды растворяется 612 объемов бромоводорода. Раствор — сильная одноосновная бромоводородная кислота. Соли — бромиды бесцветные кристаллы, хорошо растворимые в воде (нерастворим AgBr, бледно-желтого цвета). Применение:Бром и его соединения широко применяются в основном органическом синтезе. Бромид серебра AgBr применяется в фотографии как светочувствительное вещество. Соединения брома используются для создания антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам. Биологическая роль и токсичность:Бром в виде простого вещества ядовит. Жидкий бром вызывает трудно заживающие ожоги. Пары брома в концентрации 1 мг/м3 вызывают раздражение слизистых оболочек, кашель, головокружение и головную боль, а в более высокой (>60 мг/м3) — удушье и смерть. Петрова М.А., Пухова М.С. Источники:Неорганическая химия: В 3 т./ Под ред. Ю.Д. Третьякова. Т.2/ — М.: «Академия», 2004. Энциклопедия «Кругосвет»: http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/BROM.  html htmlСайт «WebElements»: http://webelements.narod.ru/elements/Br.htm | |
| КонТрен – Химия для школьников, студентов, учителей … подготовка к экзаменам и олимпиадам |
Бром и его действие на организм человека. Справка
При обычных условиях бром – тяжелая жидкость с резким запахом, в отраженном свете темно фиолетового, почти черного цвета, в проходящем – темно красного; легко образует желто бурые пары. Температура плавления 7,25 °С, температура кипения 59,2 °С.
Бром растворим в воде (3,58 г в 100 г при 20 °С), в присутствии хлоридов (химические соединения хлора) и особенно бромидов (химические соединения брома) растворимость повышается, а в присутствии сульфатов понижается.
По реакционной способности бром занимает промежуточное положение между хлором и йодом. С другими галогенами (фтором, хлором, йодом) образует неустойчивые соединения, отличающиеся высокой химической активностью.
С другими галогенами (фтором, хлором, йодом) образует неустойчивые соединения, отличающиеся высокой химической активностью.
С кислородом и азотом бром непосредственно не реагирует даже при повышенных температурах, его нестойкие соединения с этими элементами получают косвенными методами. Бром также не вступает в реакцию с углеродом.
При взаимодействии со многими металлами бром образует бромиды. К действию брома устойчивы тантал и платина, в меньшей степени — серебро, титан и свинец.
Бром – сильный окислитель.
Бром – довольно редкий в земной коре элемент. Его содержание в ней оценивается в 0,37х10 4 (примерно 50 е место).
Химически бром высоко активен и поэтому в свободном виде в природе не встречается. Входит в состав большого числа различных соединений (бромиды натрия, калия, магния и др.), сопутствующих хлоридам натрия, калия и магния. Собственные минералы брома – бромаргирит (бромид серебра) и эмболит (смешанный хлорид и бромид серебра) – чрезвычайно редки.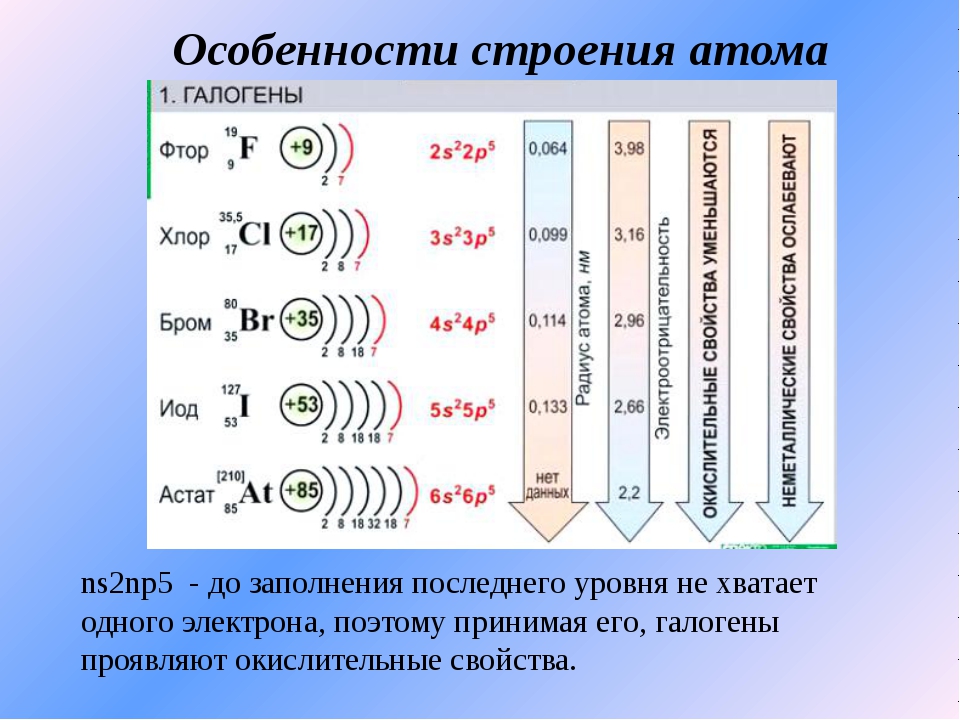
Источником брома служат воды горьких озер, соляные рассолы, сопутствующие нефти и различным соляным месторождениям, и морская вода. В настоящее время бром обычно извлекают из вод некоторых горьких озер, одно из которых расположено, в частности, в Кулундинской степи на Алтае.
Бром применяют при получении ряда неорганических и органических веществ, в аналитической химии. Соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения. Широко известны содержащие бром лекарственные препараты.
Бром ядовит: токсическая доза для организма составляет 3 г, летальная – от 35 г.
При содержании брома в воздухе 0,001% наблюдаются раздражение слизистых оболочек, головокружение, кровотечение из носа. При концентрации 0,02% – удушье, спазмы, заболевание дыхательных путей. Попадание на кожу жидкого брома вызывает зуд, при длительном действии образуются медленно заживающие язвы.
Бром оказывает очень глубокое действие на лимфатические железы, в особенности на околоушную железу, яичники и яички.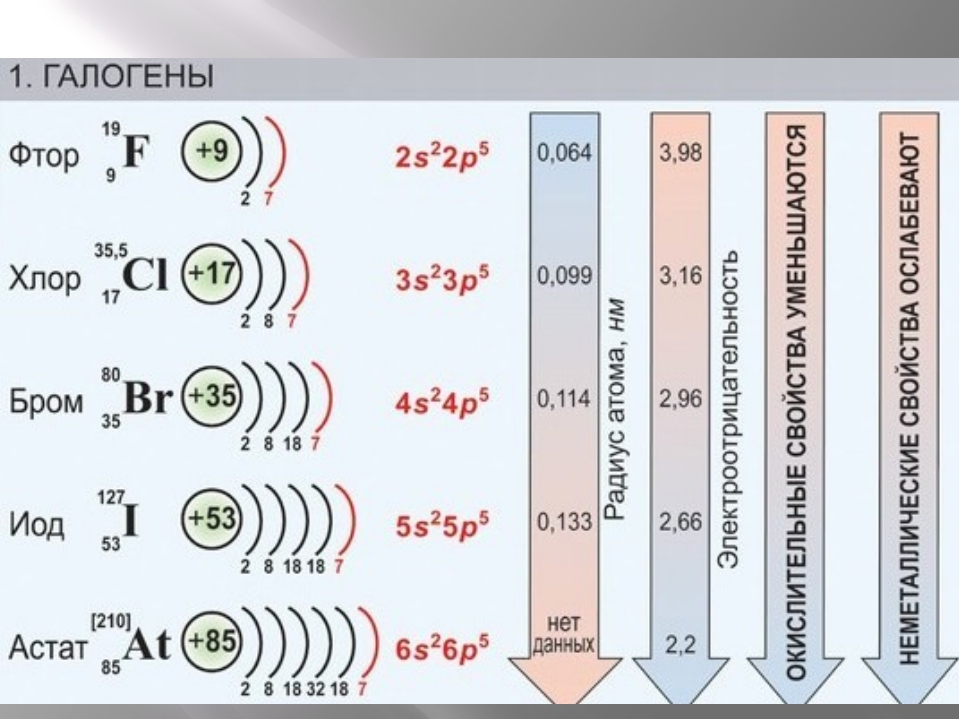 Он вызывает быстрое увеличение их в объеме и особого рода затвердение: пораженная железа тверда, как камень. Важная характеристика: поражаются железы только на левой стороне.
Он вызывает быстрое увеличение их в объеме и особого рода затвердение: пораженная железа тверда, как камень. Важная характеристика: поражаются железы только на левой стороне.
При внутреннем употреблении малых доз и очень высоких разведений бром производит своеобразное действие на головной и спинной мозг – он понижает интеллектуальную работоспособность и подавляет рефлекторную возбудимость, возбуждает сонливость.
При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух. Для восстановления дыхания можно пользоваться тампоном, смоченным нашатырным спиртом, периодически поднося его к носу пострадавшего на короткое время. Дальнейшее лечение должно проводиться под наблюдением врача.
При бытовом отравлении бромом или бромидами, принятыми внутрь: дать пострадавшему молока с размешанным в нем яйцом, несколько раз вызвать рвоту, контролируя, чтобы рвотные массы не попали в дыхательные пути. Можно также дать выпить теплый крахмальный или мучной клейстер и активированный уголь. Внутрь для выведения брома из организма в течение дня необходимо принять 10 30 г поваренной соли в большом количестве воды (3 5 л). Дальнейшее лечение – симптоматическое.
Кожа, обожженная жидким бромом, промывается многократно водой.
Из-за высокой химической активности и ядовитости как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде. Склянки с бромом располагают в емкостях с песком, который предохраняет склянки от разрушения при встряхивании. Из за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда ядовитая жидкость окажется на полу).
Мерами индивидуальной защиты являются применение фильтрующих промышленных противогазов, резиновых перчаток, сапог, фартуков, строгое выполнение правил техники безопасности.
Материал подготовлен на основе информации открытых источников
Краткая характеристика соединений брома и йода
Физические свойства
Вr2 при обычной температуре — буровато-коричневая тяжелая жидкость, образующая ядовитые пары красно-бурого цвета с резким запахом. Растворимость в воде брома выше, чем у хлора. Насыщенный раствор Вr2 в воде называют «бромной водой».
Свободный I2 при обычной температуре-черно-серое с фиолетовым оттенком твердое вещество, имеет заметный металлический блеск. Йод легко возгоняется, обладает своеобразным запахом (пары йода, как и брома, очень ядовиты). Растворимость I2 в воде наименьшая среди всех галогенов, но он хорошо растворяется в спирте и других органических растворителях.
Способы получения
1. Бром и йод извлекают из морской воды, подземных рассолов и буровых вод, где они содержатся в виде анионов Вr— и I—. Выделение свободных галогенов осуществляют с помощью различных окислителей, чаще всего пропускают газообразный хлор:
2NaI + Cl2 = I2 + 2NaCl
2NaBr + Cl2 = Br2+ 2NaCI
2. В лабораторных условиях для получения Br2 и I2 используют, например, следующие реакции:
2NaBr + МnO2 + 2H2SO4 = Br2↓ + MnSO4 + Na2SO4 + 2Н2O
бНВг + 2H2SO4 = 3Br2↓ + S↓ + 4Н2O
2HI + H2SO4 = I2↓ + SO2↑ + 2Н2O
Химические свойства
По химическим свойствам бром и йод сходны с хлором. Различия связаны, главным образом, с условиями протекания реакций. Отметим некоторые важные особенности химических реакций с участием Br2 и I2.
Бром — жидкость, в отличие от газообразного Cl2, поэтому концентрация молекул в нем выше. Этим объясняется более сильное окисляющее действие жидкого брома. Например, при соприкосновении с ним железа и алюминия происходит возгорание даже при обычной температуре.
Бромная вода имеет желто-бурую окраску, которая быстро исчезает, если растворенный Br2 прореагирует с каким-либо веществом. «Обесцвечивание бромной воды» — тест на присутствие в растворе целого ряда неорганических и органических веществ.
Газообразные и растворенные в воде SO2 и H2S, а также растворимые сульфиты и сульфиды обесцвечивают бромную воду:
Br2 + SO2 + 2Н2O = 2НВr + H2SO4
Br2 + Na2SO3 + Н2O = 2HBr + Na2SO4
Br2 + H2S = 2НВr + S↓
3Br2 + Na2S + ЗН2O = 6HBr + Na2SO3
Качественная реакция на непредельные органические соединения — обесцвечивание бромной воды:
R-CH=CH-R’ + Br2 → R-CHBr-CHBr-R’
Фенол и анилин легко взаимодействуют с бромной водой, причем продукты реакций не растворяются в органических растворителях, поэтому образуют осадки:
С6Н5ОН + ЗBr2 → С6Н2Вг3ОН↓ + ЗНВr
С6Н5NH2 + ЗВr2 → С6H2Br3NH2↓ + ЗНВr
Анионы I— очень легко окисляются как сильными, так и слабыми окислителями:
2I—-2e— → I2
Обнаружить выделяющийся I2 даже в малых количествах можно с помощью крахмального раствора, который приобретает характерную грязно-синюю окраску в присутствии I2. Иод-крахмальная реакция используется при проведении не только качественного анализа, но и количественного.
Атомы иода имеют более низкие значения энергии сродства к электрону и ЭО по сравнению с другими галогенами. С другой стороны, проявление некоторой металличности у йода объясняется существенным снижением энергии ионизации, благодаря чему его атомы гораздо легче отдают электроны. В реакциях с сильными окислителями йод ведет себя как восстановитель, например:
I2 + I0HNO3 = 2НIO3 + 10NO2 + 4Н2O
I2 + 5Н2O2 = 2НIO3 + 4Н2O
I2 + 5Cl2 + 6Н2O = 2НIO3 + 10HCl
Бромоводород и йодоводород
НВr и HI по физическим и химическим свойствам очень сходны с HCl, поэтому следует обратить внимание только на практически важные отличия, которые необходимо учитывать при получении этих веществ.
Молекулы НВr и HI менее устойчивы, чем HCl, поэтому синтез их из простых веществ затруднен вследствие обратимости реакции (особенно в случае HI).
Н2 + I2 → 2HI
HCI получают действием конц. H2SO4 на хлориды (например, твердый NaCl). Бромоводород и йодоводород таким образом не удается получить, поскольку они окисляются конц. H2SO4 до свободных галогенов:
2КВг + 2H2SO4 = Вr2↑ + SO2↑ + 2Н2O + K2SO4
6KI + 4H2SO4 = 3I2 + S + 4Н2O + 3K2SO4
1) из бромидов и йодидов
Необходимо вытеснять НВr и HI из их солей нелетучей неокисляющей ортофосфорной кислотой
КВг + H3PO4 = НВr↑ + КН2PO4
2) гидролиз галогенидов неметаллов
KI + H3PO4 = HI↑ + КН2PO4
3) восстановление свободных галогенов в водных растворах
РВr3 + ЗН2O = H3PO3 + ЗНВr↑
РI3 + ЗН2O = H3PO3 + 3HI↑
Br2 + SO2 + 2Н2O = 2НВr↑ + H2SO4
l2 + H2S = 2HI↑ + S↓
4Br2 + BaS + 4Н2O = 8HBr↑ + BaSO4
Галогены – СУНЦ МГУ
♥ Опыты
1. Получение хлора и хлорной воды
В колбу или пробирку Вюрца насыпать растертый в ступке и слегка смоченный водой (* для чего?) KMnO4, а через капельную воронку налить конц. HCl. Пропустить выделяющийся хлор через промывалку с дистиллированной водой (* для чего?) и через осушитель (* какой и в каком узле?).
* Как доказать, что выделяется хлор?
Пропустить хлор в пробирку с водой, охлаждаемой снегом.
Поднести к выделяющемуся хлору фильтровальную бумагу, смоченную раствором KI. Фиксировать происходящие изменения.
Наполнить хлором несколько банок (* сколько? – см. опыт 2) и закрыть их стеклянными пластинками. * Как определить окончание заполнения банки?
После окончания выделения хлора проверить, что находится в колбе Вюрца. * Как это сделать?
* Какими еще способами можно получить хлор в лаборатории?
** Какой процесс лежит в основе этих способов получения хлора?
2. Свойства хлора и хлорной воды
А) Поместить на листок бумаги немного порошка сурьмы и медленно высыпать ее в банку с хлором.
Фото В.В. Загорского:
Б) Поместить на листок бумаги немного порошка алюминия и медленно высыпать его в банку с хлором.
В) Положить в ложечку для сжигания немного красного фосфора, поджечь его и внести в банку с хлором. * Чем отличается характер и продукты горения фосфора на воздухе и в хлоре?
Г) 1 каплей хлорной воды (* где она образовалась? – см. опыт 1) смочить лакмусовую бумажку. * Каков состав хлорной воды?
** Какие химические свойства характерны для хлора? Какие химические свойства проявляет хлорная вода? А какие свойства проявляет хлор при образовании хлорной воды?
3. Свойства брома и бромной воды
А) Налить в термостойкую пробирку немного брома, закрепить ее вертикально в лапке штатива над песчаной баней и бросить в пробирку несколько зачищенных наждачной бумагой кусочков алюминия. * Сразу или нет начинается реакция? Почему?
Б) Поместить в пробирку немного сухого красного фосфора. Капнуть с помощью пипетки 1-2 капли жидкого брома. * Как отличается состав продуктов по высоте пробирки?
В) Капнуть 1 каплю жидкого брома в пробирку с водой.
Отлить 2-3 мл полученного раствора в другую пробирку и добавить по каплям 1 М раствор NaOH. Добавить к полученному раствору несколько капель 1 М раствора H2SO4. * Каков состав бромной воды? Какое влияние оказывают щелочь и кислота на смещение равновесия в бромной воде и почему?
** Какие химические свойства характерны для брома? Сравните взаимодействие алюминия и фосфора с хлором и бромом. Объясните различие.
4. Плавление и сублимация иода
А) Поместить несколько кристалликов иода в широкий стакан. Закрыть часовым стеклом. Осторожно нагреть.
Б) Насыпать в узкую пробирку иод (слой 1,5-2 см в высоту), заткнуть кусочком ваты. Нагреть горелкой дно пробирки, покачать и, наклонив, дать остыть.
** Чем обусловлено различие протекающих процессов в опытах А и Б?
5. Растворимость галогенов
А) Налить в пробирки по 2-3 мл хлорной, бромной и иодной воды (* какова растворимость галогенов в воде?) и прилить около 0,5 мл неполярного растворителя (* приведите 2 примера таковых). Закрыть пробирки пробками, встряхнуть, дать отстояться. * Вспомните, что такое экстракция.
До:
После:
Б) По одному кристаллику иода растворить в 1 мл CCl4, гексана, бензола, этилового спирта. * Объясните различие в окраске растворов. Иод в спирте, гексане, бензоле:
В) По одному кристаллику иода растворить в 1 мл растворов KI, KBr, KCl. * За счет чего происходит растворение иода в этих растворах? Иод в растворе KCl, KBr, KI:
** В каких растворителях лучше растворяются галогены – полярных или неполярных, – и почему?
6. Сравнение окислительных свойств галогенов
В пробирку с раствором KBr прилить 0,5 мл неполярного растворителя (* зачем?) и постепенно, при взбалтывании, добавлять хлорную воду из опыта 1. Повторить с раствором KI.
Cl2 + избыток KI:
Сl2 + мало KI (иод на стенках):
В пробирку с раствором KCl постепенно добавлять бромную воду.
** Как изменяются окислительные свойства галогенов в группе?
7. Взаимодействие галогенидов с концентрированной серной кислотой
В одну пробирку поместить немного сухого KCl, в другую – KBr, в третью – KI. Смочить соли 1-2 каплями конц. серной кислоты. К отверстию каждой пробирки поднести поочередно лакмусовой бумажку; бумажку, смоченную раствором KMnO4; и бумажку, смоченную раствором нитрата или ацетата свинца. * Для чего?
** Какие свойства галогенидов можно сравнить на основании этого опыта?
8. Получение и свойства хлороводорода
А) В колбу Вюрца насыпать 5-10 г NaCl так, чтобы поверхность соли была скошена (* зачем?). На выходе поставить U-образную трубку. * Какой осушитель в нее поместить? Через капельную воронку прилить в колбу конц. H2SO4. Осторожно нагреть колбу через асбестовую сетку. Наполнить хлороводородом сухую толстостенную банку. * Как это сделать? Как определить окончание ее заполнения?
Б) Проделать опыт «фонтан». * Какими индикаторами можно подкрасить воду – лакмусом, метилоранжем, фенолфталеином?
** О каких свойствах хлороводорода говорит опыт Б? Можно ли использовать опыт А для получения бромоводорода, иодоводорода?
9. Качественные реакции на галогенид-ионы
А) Подействовать на растворы хлорида, бромида и иодида калия раствором нитрата серебра. Проверить растворимость осадков в 1 М растворе аммиака.
Б) Подействовать на растворы хлорида, бромида и иодида калия раствором нитрата или ацетата свинца.
** Как различить хлорид и бромид? Бромид и иодид?
ICSC 0107 — БРОМ
ICSC 0107 — БРОМ| БРОМ | ICSC: 0107 |
| Март 2009 |
| CAS #: 7726-95-6 | |
| UN #: 1744 |
|
| EINECS #: 231-778-1 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее, но способствует возгоранию других веществ. Многие реакции могут привести к пожару или взрыву. Нагревание приводит к повышению давления с риском взрыва. При пожаре выделяет раздражающие или токсичные пары (или газы). Риск пожара или взрыва. См. Химические Опасности. | НЕ допускать контакта с несовместимыми материалами: См. Химические Опасности | В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. В случае пожара: охлаждать баллон распыляя воду. |
| ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! ВО ВСЕХ СЛУЧАЯХ ОБРАТИТЬСЯ К ВРАЧУ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Боли в горле. Сбивчивое дыхание. Одышка. Затрудненное дыхание. Симптомы могут проявляться позже. | Применять средства защиты органов дыхания, замкнутую систему или вентиляцию. | Свежий воздух, покой. Полусидячее положение. Может потребоваться искусственное дыхание. Немедленно обратиться за медицинской помощью. См. Примечания. |
| Кожа | Покраснение. Ощущение жжения. Боль. Серьезные ожоги кожи. | Защитные перчатки. Защитная одежда. | Сначала промыть большим количеством воды в течение не менее 15 минут, затем удалить загрязненную одежду и снова промыть. Поместить одежду в закрывающийся контейнер. Обратиться за медицинской помощью. |
| Глаза | Слезотечение из глаз. Покраснение. Помутнение зрения. Боль. Ожоги. | Использовать закрытые защитные очки, маску для лица или средства защиты глаз в комбинации со средствами защиты органов дыхания.. | Промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений). Немедленно обратиться за медицинской помощью. |
| Проглатывание | Ожоги в полости рта и горле. Ощущение жжения в горле и груди. Боль в животе. Шок или сильная слабость. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. НЕ вызывать рвоту. Обратиться за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Покинуть опасную зону! Проконсультироваться со специалистом! Индивидуальная защита: газонепроницаемый костюм химической защиты, включая автономный дыхательный аппарат. Вентилировать. НЕ допускать попадания этого химического вещества в окружающую среду. Удалить пар при помощи водного аэрозоля. Собрать подтекающую жидкость в герметичные контейнеры. Удалить оставшуюся жидкость при помощи сухого песка или инертного абсорбента. НЕ засыпать древесными опилками или другими горючими абсорбентами. Затем хранить и утилизировать в соответствии с местными правилами. |
Согласно критериям СГС ООН ОПАСНО Может вызывать коррозию металловСмертельно при вдыхании Может причинить вред при проглатывании Вызывает серьезные ожоги кожи и повреждения глаз Может вызвать раздражение дыхательных путей Может вызвать повреждения легких в результате длительного или многократного воздействия при вдыхании Очень токсично для водной флоры и фауны Транспортировка |
| ХРАНЕНИЕ | |
| Предотвратить попадание продуктов пожаротушения в сточные воды. Отдельно от пищевых продуктов и кормов. См. химические опасности. Прохладное место. Хранить сухим. Хорошо закрывать. Хранить в хорошо проветриваемом помещении. Хранить только в оригинальной упаковке. Хранить в местах не имеющих сливов или доступа к канализации | |
| УПАКОВКА | |
| Специальный материал. Небьющаяся упаковка. Поместить бьющуюся упаковку в небьющийся контейнер. Не перевозить с продуктами питания и кормами для животных. |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: Br2 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
TLV: 0.1 ppm как TWA; 0.2 ppm как STEL. EU-OEL: 0.7 mg/m3, 0.1 ppm как TWA |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| Вещество очень токсично для водных организмов. Настоятельно рекомендуется не допускать попадания вещества в окружающую среду. |
| ПРИМЕЧАНИЯ |
|---|
| Симптомы отека легких часто не проявляются, пока не пройдет несколько часов, и они усугубляются физическими усилиями. Поэтому крайне важны отдых и медицинское наблюдение. Следует рассмотреть возможность немедленного проведения соответствующей ингаляционной терапии врачом или уполномоченным на это лицом. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: T+, C, N; R: 26-35-50; S: (1/2)-7/9-26-45-61 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Бром (Br, Bromum) — влияние на организм, польза и вред, описание
История брома
Открытие брома произошло в первой трети XIX столетия, независимо друг от друга немецкий химик Карл Якоб Лёвих в 1825 году, а француз Антуан Жером Балар – в 1826 представили миру новый химический элемент. Интересный факт – изначально Балар назвал свой элемент муридом (от латинского muria – рассол), потому что открытие своё сделал, изучая средиземноморские соляные промыслы.
Общая характеристика Брома
Бром (от древне-греческого βρῶμος , в дословном переводе «вонючий», «зловоние», «вонючка») является элементом главной подгруппы VII группы четвёртого периода периодической системы химических элементов Д.И. Менделеева (в новой классификации – элементом 17-й группы). Бром – галоген, химически активный неметалл, с атомным номером 35 и молекулярной массой 79,904. Для обозначения применяется символ Br (от латинского Bromum).
Нахождение брома в природе
Бром – широко распространённый химический элемент, во внешней среде встречается практически везде. Особенно много брома находится в солёной воде – морей и озёр, там он имеется в виде бромида калия, бромида натрия и бромида магния. Наибольшее количество брома образуется при испарении морской воды, есть он и в некоторых горных породах, а также в растениях.
В организме человека находятся до 300 мг брома, в основном в щитовидной железе, так же бром содержит кровь, почки и гипофиз, мышцы и костная ткань.
Физические и химические свойства брома
Бром обычно представляет собой едкую тяжёлую жидкость, имеет красно-бурый цвет и резкий, очень неприятный (зловонный) запах. Является единственным из неметаллов, при комнатной температуре находящийся в жидком состоянии.
Бром (а также – пары брома)– токсичное и ядовитое вещество, при работе с ним необходимо применять средства химической защиты, потому что при попадании на кожу и слизистые человека бром образует ожоги.
Состав природного брома – два стабильных изотопа (79Br и 81Br), молекула брома состоит из двух атомов и имеет химическую формулу Br2.
Суточная потребность организма в броме
Потребность здорового организма в броме – не более 0,8-1 г.
Продукты питания богатые бромом
Наряду с имеющимся в организме, бром человек получает с пищевыми продуктами. Основными поставщиками брома являются орехи (миндаль, фундук, арахис), бобовые (фасоль, горох и чечевица), пшеница и макаронные изделия из твёрдых сортов пшеницы, ячневая крупа, молочные продукты, водоросли и практически все виды морской рыбы.
Опасность и вред брома
Элементарный бром – сильнодействующий яд, принимать внутрь его категорически запрещено. Пары брома могут вызвать отёк лёгких, особенно у тех, кто склонен к аллергическим реакциям или имеет заболевания лёгких и дыхательных путей (очень опасны пары брома для астматиков).
Не рекомендуется применять препараты брома людям, в силу специфики работы нуждающимся в стабильной концентрации внимания (водителям, альпинистам, монтажникам-высотникам).
Признаки избытка брома
Переизбыток данного вещества обычно бывает при передозировке препаратов брома, для людей категорически нежелательна, потому что может представлять реальную опасность для здоровья. Основные признаки избытка брома в организме – воспаления и высыпания на коже, сбои в работе пищеварительной системы, общая вялость и подавленность, постоянные бронхиты и риниты, не связанные с простудами и вирусами.
Признаки нехватки брома
Нехватка в организме брома проявляется бессонницей, замедлением роста у детей и подростков, понижением уровня гемоглобина в крови, но, не всегда эти симптому связывают именно с недостаточным количеством брома, поэтому для подтверждения подозрений, нужно посетить доктора и сдать необходимые анализы. Часто из-за нехватки брома повышается риск самопроизвольного прерывания беременности (выкидыш на разных сроках, вплоть до третьего триместра).
Полезные свойства брома и его влияние на организм
Бром (в виде бромидов) применяется при различных заболеваниях, основное его действие – седативное, поэтому препараты брома часто назначаются при нервных расстройствах и нарушениях сна. Соли брома являются эффективным средством для лечения заболеваний, вызывающих судороги (особенно эпилепсии), а также нарушений деятельности сердечно-сосудистой системы и некоторых желудочно-кишечных недугов (язвы желудка и двенадцатиперстной кишки).
Усвояемость брома
Усвояемость брома замедляют хлор, алюминий, йод и фтор, поэтому принимать препараты, содержащие соли брома нужно только после консультации с врачом.
Бром и его влияние на мужскую потенцию
Вопреки ничем не подтверждённым слухам (больше похожим на анекдоты), бром не оказывает угнетающего воздействия на половое влечение и потенцию мужчин. Якобы бром в виде белого порошка добавляют в еду молодым бойцам в армии, а также пациентам мужского пола в псих-диспансерах и заключённым в тюрьмах и колониях. Этому нет ни одного научного подтверждения, а слухи можно объяснить способностью брома (его препаратов) оказывать успокаивающее воздействие.
По некоторым источникам, бром способствует активизации половой функции у мужчин и увеличению как объёма эякулянта, так и количества сперматозоидов, в нём содержащихся.
Применение брома в жизни
Бром применяется не только в медицине (бромид калия и бромид натрия), но и в других областях, например в фотографии, нефтедобыче, в производстве моторного топлива. Бром используется при изготовлении боевых отравляющих веществ, что ещё раз подчёркивает необходимость осторожного обращения с данным элементом.
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
| Свойства, использование и факты
Бром (Br) , химический элемент, темно-красная ядовитая жидкость и член галогеновых элементов или Группы 17 (Группа VIIa) периодической таблицы.
бромБром.
Британская энциклопедия, Inc.Британская викторина
118 Названия и символы из таблицы Менделеева
Периодическая таблица Менделеева состоит из 118 элементов.Насколько хорошо вы знаете их символы? В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 35 |
|---|---|
| атомный вес | [79,901, 79,907] |
| точка плавления | −7,2 ° C (19 ° F) |
| точка кипения | 59 ° C (138 ° F) |
| удельный вес | 3.12 при 20 ° C (68 ° F) |
| степени окисления | −1, +1, +3, +5, +7 |
| электронная конфигурация | (Ar) 3 d 10 4 s 2 4 p 5 |
История
Бром был обнаружен в 1826 году французским химиком Антуаном-Жеромом Баларом в остатках (биттерах) производства морской соли в Монпелье. Он освободил элемент, пропустив хлор через водный раствор остатков, который содержал бромид магния.Перегонка материала с диоксидом марганца и серной кислотой дает красные пары, которые конденсируются в темную жидкость. Сходство этой процедуры с получением хлора подсказало Баларду, что он получил новый элемент, похожий на хлор. (Немецкий химик Юстус фон Либих, кажется, получил этот элемент раньше Баларда, но он ошибочно принял его за хлорид йода.) Из-за неприятного запаха элемента Французская академия наук предложила название бром от греческого слова bromos , что означает «неприятный запах» или «вонь.
Возникновение и распространение
Редкий элемент, бром, встречается в природе и рассредоточен по всей земной коре только в виде растворимых и нерастворимых бромидов. Некоторое обогащение происходит в океанской воде (65 частей на миллион по весу), в Мертвом море (примерно 5 граммов на литр [0,7 унции на галлон]), в некоторых термальных источниках и в редких нерастворимых минералах бромида серебра (таких как бромирит, найдено в Мексике и Чили). Природные солевые отложения и рассолы являются основными источниками брома и его соединений.Иордания, Израиль, Китай и Соединенные Штаты были мировыми лидерами по производству брома в начале 21 века; другие важные страны-производители брома в этот период включают Японию, Украину и Индию.
Природный бром представляет собой смесь двух стабильных изотопов: брома-79 (50,54 процента) и брома-81 (49,46 процента). Из 17 известных радиоактивных изотопов элемента бром-77 имеет самый длинный период полураспада (57 часов).
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчасФизические и химические свойства
Свободный бром представляет собой красновато-коричневую жидкость с заметным давлением пара при комнатной температуре. Пары брома имеют янтарный цвет. Бром имеет резкий запах и раздражает кожу, глаза и дыхательную систему. Воздействие концентрированных паров брома даже на короткое время может быть смертельным. Как и другие галогены, бром существует в виде двухатомных молекул во всех агрегатных состояниях.
Около 3,41 грамма (0,12 унции) брома растворяется в 100 миллилитрах (0.1 л) воды комнатной температуры. Раствор известен как бромная вода. Как и хлорная вода, это хороший окислитель, и он более полезен, потому что не так легко разлагается. Освобождает свободный йод из йодидсодержащих растворов и серу из сероводорода. Сернистая кислота окисляется бромной водой до серной кислоты. На солнечном свете бромная вода разлагается с выделением кислорода, как в следующем уравнении:
Из бромной воды можно выделить гидрат (клатрат), который содержит 172 молекулы воды и 20 полостей, способных вместить молекулы брома.Бром растворяется в водных растворах гидроксида щелочного металла с образованием бромидов, гипобромитов или броматов, в зависимости от температуры. Бром легко экстрагируется из воды органическими растворителями, такими как четыреххлористый углерод, хлороформ или сероуглерод, в которых он хорошо растворим. В органических растворителях дает оранжевый раствор.
Сродство к электрону у брома высокое и аналогично сродству хлора. Однако это менее мощный окислитель, главным образом из-за более слабой гидратации бромид-иона по сравнению с хлорид-ионом.Точно так же связь металл-бром слабее, чем соответствующая связь металл-хлор, и это различие отражается в химической реакционной способности брома, которая находится между реакционной способностью хлора и йода. Броморганическое соединение похоже на соответствующее хлорпроизводное, но обычно является более плотным, менее летучим, менее горючим и менее стабильным.
Бром сильно соединяется со щелочными металлами и фосфором, мышьяком, алюминием и сурьмой, но в меньшей степени с некоторыми другими металлами.Бром вытесняет водород из насыщенных углеводородов и присоединяется к ненасыщенным углеводородам, хотя и не так легко, как хлор.
Самая стабильная степень окисления элемента -1, в которой бром встречается в природе. Но степени окисления 0 (элементарный бром, Br 2 ), +1 (гипобромит, BrO — ), +3 (бромит, BrO — 2 ), +5 (бромат, BrO — 3 ) и +7 (пербромат, BrO — 4 ).Первая энергия ионизации брома высока, и соединения, содержащие бром с положительной степенью окисления, стабилизируются соответствующими лигандами, в основном кислородом и фтором. Все соединения с степенями окисления +1, +3, +4, +5 и +7 содержат ковалентные связи.
Производство и использование
Основным коммерческим источником брома является океаническая вода, из которой элемент извлекается путем химического замещения (окисления) хлором в присутствии серной кислоты посредством реакции
реакция представляет собой разбавленный раствор брома, из которого удаляют элемент, продувая через него воздух.Затем свободный бром смешивается с диоксидом серы, и смешанные газы проходят вверх по колонне, по которой струйкой стекает вода. В колонне происходит следующая реакция:
, в результате чего образуется смесь кислот, которая намного богаче бромид-ионом, чем морская вода. Вторая обработка хлором высвобождает бром, который освобождается от хлора и очищается путем пропускания через влажные железные опилки.
Технический бром обычно содержит до 0,3% хлора. Обычно его хранят в стеклянных бутылках или бочках, покрытых свинцом или монелем.
В промышленном использовании брома преобладала смесь этиленбромида (C 2 H 4 Br 2 ), которую однажды добавляли в бензин с тетраэтилсвинцом для предотвращения осаждения свинца в двигателе. После отказа от этилированного бензина соединения брома в основном использовались в антипиренах, но бромистый этилен по-прежнему является важным соединением из-за его использования для уничтожения нематод и других вредителей в почве. Бром также используется в производстве катализаторов, таких как бромид алюминия.
Бром используется и для других целей, например, для изготовления различных красителей и соединений тетрабромэтана (C 2 H 2 Br 4 ) и бромоформа (CHBr 3 ), которые используются в качестве жидкостей в датчиках из-за их высокого содержания. удельный вес. До появления барбитуратов в начале 20 века бромиды калия, натрия, кальция, стронция, лития и аммония широко использовались в медицине из-за их седативного действия. Бромид серебра (AgBr), важный компонент фотопленки, подобно хлориду и йодиду серебра, чувствителен к свету.Следы бромата калия (KBrO 3 ) добавляют в пшеничную муку для улучшения выпечки. Другие важные соединения брома включают бромистый водород (HBr), бесцветный газ, используемый в качестве восстановителя и катализатора в органических реакциях. Раствор газа в воде называется бромистоводородной кислотой, сильной кислотой, которая по своей активности по отношению к металлам, их оксидам и гидроксидам напоминает соляную кислоту.
Бром (Br) — химические свойства, воздействие на здоровье и окружающую среду
БромПри температуре окружающей среды бром представляет собой коричневато-красную жидкость.Он имеет пар аналогичного цвета с неприятным удушающим запахом. Это единственный неметаллический элемент, который в обычных условиях является жидким, он легко испаряется при стандартной температуре и давлении в виде красного пара с сильным неприятным запахом, напоминающим запах хлора. Бром менее активен химически, чем хлор и фтор, но более активен, чем йод; его соединения аналогичны соединениям других галогенов. Бром растворим в органических растворителях и в воде. Области примененияБром используется в промышленности для производства броморганических соединений.Основным из них был дибромэтан, агент для этилированного бензина, до того, как они были в значительной степени прекращены из-за экологических соображений. Другие броморганические соединения используются в качестве инсектицидов, в огнетушителях и в фармацевтических препаратах. Бром используется в производстве фумигантов, красителей, огнезащитных составов, составов для очистки воды, дезинфицирующих средств, лекарственных средств, средств для фотографии и в бромированных растительных маслах, используемых в качестве эмульгатора во многих растворимых напитках со вкусом цитрусовых. Бром в окружающей средеБром — это природный элемент, который можно найти во многих неорганических веществах.Однако люди много лет назад начали внедрение органического брома в окружающую среду. Все это ненатуральные соединения, которые могут нанести серьезный вред здоровью человека и окружающей среде. В диффузных породах земной коры бром в природе встречается в виде бромидных солей. Соли брома накапливаются в морской воде (85 частей на миллион), из которой извлекается бром.
Вернуться к Периодическая диаграмма . |
Бром — Информация об элементе, свойства и применение
Расшифровка:
Химия в ее элементе: бром
(Promo)
Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет, добро пожаловать в Химию в ее стихии, где на этой неделе мы вынюхиваем химическое вещество, названное в честь греческого слова, означающего зловоние, и это вещество, безусловно, имеет в свое время сам по себе вонял, потому что проделывает дыры в озоновом слое. Но это не так уж и плохо, поскольку нам также дают лекарства, инсектициды и огнетушители и рассказывают историю элемента номер 35, это химик и писатель Джон Эмсли.
Джон Эмсли
Пятьдесят лет назад бром производился в массовом масштабе и превращался в множество полезных соединений. Фотография опиралась на светочувствительность бромида серебра, врачи прописывали бромид калия в качестве транквилизатора, этилированному бензину требовался дибромметан, чтобы обеспечить удаление свинца с выхлопными газами, бромметан широко использовался для фумигации почвы и складских помещений, а огнетушители содержали летучие вещества. броморганические соединения. Сегодня это использование практически исчезло.
Мировое производство жидкого брома когда-то превышало 300 000 тонн в год, значительная часть из которых была произведена на заводе на побережье Англси в Уэльсе, закрытом в 2004 году. Этот элемент извлекался из морской воды, содержащей 65 частей на миллион. бромида, и это было сделано с использованием газообразного хлора для преобразования бромида в бром, который затем удаляли продувкой воздуха через воду.
История брома началась с 24-летнего студента Антуана-Жерома Балара. Он обнаружил, что остатки соли, оставшиеся после испарения рассола из Монпелье, Франция, при обработке кислотой давали маслянистую красную жидкость.Он понял, что это новый элемент, и сообщил об этом Французской академии, которая подтвердила его открытие. Когда они поняли, что он химически похож на хлор и йод, они предложили название бром, основанное на греческом слове bromos , означающем зловоние.
В то время как некоторые виды использования брома сократились, поскольку продукты, изготовленные из него, больше не нужны, другие не приветствуются из-за ущерба, который этот элемент может нанести озоновому слою. Летучие броморганические соединения способны выживать в атмосфере достаточно долго, чтобы достичь верхнего озонового слоя, где их атомы брома в 50 раз более разрушительны, чем атомы хлора, что является основной угрозой, поскольку они исходят от широко используемых хлорфторуглеродов, ХФУ. .Монреальский протокол, объявивший ХФУ вне закона, попытался также запретить использование всех летучих броморганических соединений к 2010 году, и это ограничение особенно применялось к фумиганту бромметану и таким соединениям, как CBrClF 2 , которые использовались в огнетушителях для электрических пожаров или в замкнутых пространствах .
Бромметан был особой причиной для беспокойства, но запретить его оказалось невозможно, потому что он имеет некоторые применения, альтернативы которым не найдены. Часто обозначается как бромистый метил, CH 3 Br (точка кипения 3.5 o C), это широко используется для уничтожения вредителей в почве, в хранилищах и для обработки древесины перед ее экспортом. В почве он убивает нематод, насекомых, бактерии, клещи и грибки, угрожающие посевам, таким как семенные культуры, салат, клубника, виноград и цветы, такие как гвоздики и хризантемы.
На самом деле бромметан не так опасен, как может показаться на первый взгляд. Экологические исследования показали неожиданный результат: половина бромметана, распыляемого на почву, никогда не испаряется в воздух, потому что он потребляется бактериями.Искусственные броморганические соединения также не являются основным источником этих соединений в атмосфере. Морской планктон и водоросли выделяют около полумиллиона тонн различных бромметанов в год и, в частности, трибромметана (также известного как бромоформ, CHBr 3 ).
Еще более удивительным было открытие, что в Мировом океане производят пентабромдифениловый эфир. Он использовался в качестве антипирена, и когда в 2005 году было обнаружено, что он присутствует в китовом жире, поначалу считалось, что это разновидность, созданная руками человека.Однако содержащиеся в нем атомы углерода имели обнаруживаемые количества 14 C, что означает, что они были недавнего происхождения, в то время как антипирен сделан полностью из ископаемых ресурсов и не содержит 14 C. Еще одно сложное соединение брома из моря — это пурпурный краситель, который когда-то использовался для одежды римских императоров. Тирский пурпур, как его называли, был извлечен из средиземноморского моллюска Murex brandaris , и эта молекула содержит два атома брома и является 6,6′-диброминдиго.
Этот элемент, даже если он выглядит в воде доброкачественным, как ионы бромида, может представлять угрозу для здоровья. Озонирование питьевой воды с целью ее стерилизации превращает любой бромид в бромат (BrO 3 —), который предположительно является канцерогеном и поэтому не должен превышать 10 p.p.b. И некоторые водоемы в Калифорнии, где это превышено, пришлось осушить из-за этого.
Когда-то столь полезный бром, теперь кажется, не доставляет ничего, кроме неприятностей. Тем не менее, невидимыми способами, например, в фармацевтической промышленности, он по-прежнему используется в качестве промежуточных звеньев при производстве жизненно важных лекарств.
Крис Смит
Джон Эмсли раскрывает секреты коричневого элемента Брома. Вы можете узнать больше о некоторых других любимых элементах Джона из серии, которую он написал для RSC’s Education in Chemistry, и которая находится на сайте rsc.org/education. В следующий раз о химии в ее стихии химик Кэри Маллис, лауреат Нобелевской премии, объясняет, почему душа из железа так важна.Кэри Маллис
Для человеческого мозга железо важно, но смертельно опасно.Углерод, сера, азот, кальций, магний, натрий, возможно, десять других элементов также участвуют в жизни, но ни один из них не обладает способностью железа перемещать электроны, и ни один из них не способен полностью разрушить всю систему. Железо делает.
Крис Смит
И вы можете увидеть, как Кэри Маллис разглаживает морщины в самом важном элементе метаболизма на следующей неделе в программе «Химия в ее элементе». Я Крис Смит, спасибо за внимание, увидимся в следующий раз.
(Промо)
(Окончание промо)
Недвижимость и использование — StudiousGuy
Бром — третий по легкости галоген, расположенный между хлором и йодом в 17-й группе периодической таблицы. Свойство, которое делает бром исключительно особенным по сравнению с другими галогенами, заключается в его существовании в виде красно-коричневой жидкости при комнатной температуре. Фактически, бром — один из двух элементов, которые существуют в жидком состоянии при комнатной температуре, а вторым является ртуть.Красно-коричневый жидкий бром является вязким и токсичным по своей природе и имеет удушающий запах. Как и другие галогеновые элементы, бром также обладает высокой реакционной способностью и, следовательно, не существует в своей элементарной форме в естественной земной коре. Однако на дне океана он довольно распространен в сложных формах. Как и хлор, бром также образует минеральные соли, растворимые в воде и органических растворителях. Приблизительное содержание соединений брома в океанах составляет почти одну треть от содержания соединений хлора, обнаруженных в океанах.В земной коре это 44-й элемент по распространенности с приблизительной плотностью 2,4 частей на миллион.
Указатель статей (Нажмите, чтобы перейти)
Открытие и присвоение именАнтуан Жером Балар, 1870-е годы
Первым, кто официально объявил об открытии брома, был Антони Балард. Однако он был не первым, кто это обнаружил. В 1825 году Карл Лоуиг, ученый-исследователь из Гейдельбергского университета в Цюрихе, приготовил жидкость из соленой воды, смешав ее с диэтиловым эфиром и пропустив через нее хлор.После отгонки эфира из раствора у него осталась красно-коричневая жидкость, которую он принес в лабораторию своему профессору Леопольду Гмелину. Гмелин попросил его приготовить этот раствор в больших количествах, чтобы они могли изучить его свойства. Тем временем другой профессор химии в College De France, Антони Балар, объявил об открытии брома в своей статье «Annales de Chimie et Physique». Он проводил эксперименты с золой морских водорослей для получения йода, но, к своему удивлению, он также обнаружил бром в дистиллированном растворе золы морских водорослей, когда он насытил его хлором.
Карл Якоб Лоуиг
Имя брома так же сложно, как и его открытие. Некоторые источники предполагают, что Антони Баллард изменил название с «мурид» на «бром» в связи с греческим словом, обозначающим зловоние в одной из его следующих статей о броме, тогда как другие предполагают, что французский химик и физик Жозеф-Луи Гей-Лузак предложил название «бром» из-за резкого запаха. Более того, крупномасштабное производство брома не производилось до 1858 года, когда открытие большого хранилища солей в Штасфурте сделало это возможным.{81} {Br} имеют значительные периоды полураспада 17,7 мин, 4,421 часа и 35,28 часа соответственно. Эти радиоактивные изотопы могут быть произведены в лаборатории путем захвата электронов. Пока радиоизотопов с массой нет. менее 79 предпочитают распадаться на селен в процессе захвата электронов, а те, у которых масса нет. более 81 предпочитают распадаться на криптон в процессе бета-распада.
Свойства бромаБром принадлежит к 17-й группе периодической таблицы Менделеева, иначе известной как семейство галогенов.Как и другие члены семейства галогенов, такие как фтор, хлор, йод и астат, бром также на один электрон меньше, чем его оптимальная электронная конфигурация, из-за чего он показывает много сходств по своим свойствам с другими элементами 17-й группы.
Физические свойства
Бром — это элемент периодической таблицы с атомным номером. {5}.Как и другим галогеновым элементам, брому нужно либо получить 1 электрон, либо потерять 5 электронов, чтобы достичь стабильной электронной конфигурации. Таким образом, наиболее распространенные окислительные состояния брома — -1 и +5. Однако в некоторых случаях также может наблюдаться степень окисления +3, +1 и +7. Электроотрицательность брома меньше, чем у хлора и фтора, поэтому он умеренно окисляет по сравнению с последними. И наоборот, это лучший восстановитель, чем хлор. Давайте разберемся в этих свойствах с помощью следующих реакций.{-} + {HOBr}
2. Реакция брома с воздухомБром не реагирует с молекулой кислорода {O} _ {2} и молекулой азота {N} _ {2} в воздухе. Однако он реагирует с озоном при -78 ° C, образуя оксид брома (IV), {BrO} _ {2}
.{Br} _ {2} (l) + 2 {O} _ {3} (g) → 2 {BrO} _ {2} (s) + {O} _ {2} (g)
Бром реагирует с оксидом углерода CO, образуя {COBr} _ {2}.
{Br} _ {2} (l) + {CO} (g) → {COBr} _ {2} (l)
3. Реакция брома с водородомВодород реагирует с {Br} _ {2} с образованием бромистого водорода.Реакция протекает медленно при комнатной температуре и ускоряется с повышением температуры.
{H} _ {2} (г) + {Br} _ {2} (г) → 2 {HBr} (г)
4. Реакция брома с галогенамиБром, {Br} _ {2}, реагирует с фтором, {F} _ {2} в газовой фазе, образуя BrF. Продукт трудно получить в чистом виде, поскольку BrF реагирует сам с собой, образуя {Br} _ {2}, {BrF} _ {3} и {BrF} _ {5}.
{Br} _ {2} (г) + {F} _ {2} (г) → 2 {BrF} (г)
3 {BrF} (г) → {Br} _ {2} (l) + {BrF} _ {3} (l)
5 {BrF} (г) → 2 {Br} _ {2} (л) + {BrF} _ {5} (л)
Используя избыток фтора при 150 ° C, бром реагирует с фтором с образованием {BrF} _ {5}.
{Br} _ {2} (l) + 5 {F} _ {2} (g) → 2 {BrF} _ {5} (l)
Из фтористых соединений брома (BrF, BrF3, BrF5) наибольшее практическое значение имеет BrF3, поскольку он используется для фторирования органических веществ.
Хлор, {Cl} _ {2}, реагирует с бромом, {Br} _ {2}, в газовой фазе, образуя нестабильный хлорид брома (I), {ClBr}.
{Cl} _ {2} (г) + {Br} _ {2} (г) → 2 {ClBr} (г)
Бром, {Br} _ {2}, реагирует с йодом, {I} _ {2}, при комнатной температуре, образуя иодид брома (I), {BrI}.
{Br} _ {2} (l) + {I} _ {2} (s) → 2 {BrI} (s)
5. Реакция брома с органическими соединениямиБром легко присоединяется к непредельным соединениям. Такие реакции обычно проводят при низкой температуре, чтобы избежать побочных реакций замещения. Хотя катализатор обычно не требуется, для ускорения реакции можно использовать ультрафиолетовое излучение или высокую температуру. Реакция электрофильного ароматического замещения на сегодняшний день является наиболее важным типом ароматического бромирования.В присутствии катализатора бром реагирует с ароматическими соединениями с образованием арилбромидов и бромистого водорода.
{ArH} + {Br} _ {2} → {ArBr} + {HBr}
Бром эффективно используется в реакциях ароматического замещения для получения соляной кислоты с помощью хлора.
2 {ArH} + {Br} _ {2} + {Cl} _ {2} → 2 {ArBr} + {HCl}
Бромирование насыщенных углеводородов и боковых алкильных цепей ароматических соединений происходит в результате цепной реакции свободных радикалов.
{Br} _ {2} → 2 {Br⋅}
Диссоциация брома может быть достигнута термически, фотолитически, с помощью гамма-лучей и с помощью пероксидных инициаторов.
{RH} + {Br⋅} → {R⋅} + {HBr}
{R⋅} + {Br} _ {2} → {RBr} + {Br⋅}
6. Реакция брома с металламиБром реагирует со многими металлами с образованием бромидов. Натрий устойчив в сухом броме, но пары натрия активно реагируют. Калий и цезий бурно реагируют с бромом. Бром также очень реактивен с алюминием и титаном. Алюминий реагирует испусканием света. Магний, серебро, никель и свинец покрываются их бромидами, что предотвращает дальнейшую реакцию.{2 +} (вод.) + {Br} _ {2} (вод.) + 2 {H} _ {2} {O} (l)
Использование брома 1. Присадки к бензинуНаибольшее промышленное применение брома с начала 1920-х до конца 1980-х было в топливной промышленности в виде 1,2-дибромэтана ({C} _ {2} {H} _ {4} {Br} _ {2}). Этилендибромид или EDB широко использовался в качестве поглотителя свинца с тетралкилами для уменьшения разрушительного явления, известного как детонация двигателя. Однако после открытия канцерогенных свойств EDB его использование в качестве добавки к бензину было заменено другой менее вредной альтернативой — метил-трет-бутиловым эфиром.
2. АнтипиреныОгнезащитные составы (FR) добавляются или наносятся на материал для повышения огнестойкости этого продукта. Большинство товаров повседневной жизни, таких как одежда, мебель, электроника, автомобили и компьютеры, представляют собой полимерные материалы на нефтяной основе и, следовательно, они горючие. Чтобы соответствовать правилам пожарной безопасности, к этим материалам обычно применяют бромированные антипирены (BFR), чтобы повысить их огнестойкость. BFR делятся на три подгруппы в зависимости от способа включения этих соединений в полимеры: бромированные мономеры, реакционноспособные и аддитивные.Бромированный мономер, такой как бромированный стирол или бромированный бутадиен, добавляется перед полимеризацией, тогда как реактивные антипирены, такие как тетрабромбисфенол A (TBBPA), и дополнительные антипирены, такие как полибромированные дифениловые эфиры (PBDE) и гексабромциклододекан) представляют собой просто HBCDD. во время процесса.
3. Пестициды1,2-дибромэтан ({C} _ {2} {H} _ {4} {Br} _ {2}) был впервые использован в 1952 году для борьбы с вредителями в зернохранилищах.Его эффективность сделала его пригодным для использования в качестве пестицида против многих почвенных вредителей, таких как нематоды, почвенные грибы, дикие сорняки, паразитические растения и некоторые почвенные насекомые. Однако использование EBD в качестве пестицида впоследствии во многих странах сократилось из-за осознания необходимости чистой окружающей среды.
Потребность в пестициде для предотвращения деградации сельскохозяйственных культур и создания пахотных земель была удовлетворена с помощью другого соединения брома, известного как бромметан (широко известный как бромистый метил, {CH} _ {3} {Br}).Благодаря низкой температуре кипения это активный газ даже при относительно низких температурах, который может проникать в почву на значительную глубину.
4. Используется в установках для бурения нефтяных и газовых скважинЗавод по добыче природного газа
Нефть и газ — это углеводороды, которые находятся в пористых камнях. Для извлечения этих масел снизу используется тяжелое буровое оборудование. Бурение требует удельного веса, необходимого для компенсации давления, чтобы избежать закрытия пор при сохранении проницаемости.Из-за их более высокой плотности, чем пресная вода, рассолы (солевые жидкости) используются при проникновении в продуктивную зону (пласт или часть пласта, содержащую экономически добываемые углеводороды). Бромид кальция, бромид натрия и бромид цинка вместе называются прозрачными рассольными жидкостями. Они используются в индустрии бурения нефтяных и газовых скважин для заканчивания, пакера и жидкостей для ремонта скважин, не содержащих твердых частиц, с высокой плотностью, чтобы снизить вероятность повреждения ствола скважины и продуктивной зоны.
5. Фотографическая химияБромид серебра (AgBr) используется в фотографии как компонент эмульсии, которая помогает в проявлении фотографического изображения. Бромид серебра чувствителен к свету, и, будучи взвешенными в желатине, зерна бромида серебра создают фотографическую эмульсию. Под воздействием света бромид серебра разлагается и в результате сохраняет фотографическое изображение. После того, как бромид серебра создает фотографическое изображение, его нужно проявить.Зерна бромистого серебра, которые прореагировали на свет, становятся металлическим серебром, тогда как те, на которые не влияет свет, не изменяются. Эти оставшиеся зерна смываются фиксирующим раствором.
6. КрасителиДревние римляне в пурпурной одежде
Возможно, самое раннее упоминание об использовании брома восходит к библейской эпохе, когда римляне использовали красновато-пурпурный натуральный краситель под названием Тирский пурпур для окрашивания своей одежды. При производстве этого красителя они использовали морских улиток.Это был очень ценный краситель, так как потребовались тысячи улиток и большой труд, чтобы произвести всего несколько граммов его; Кроме того, он не тускнеет легко. Фактически, дорогая природа этого красителя стала символом статуса среди королевских особ двадцатого века. Позже было обнаружено, что химическим веществом, ответственным за этот королевский оттенок, было 6,6-диброминдиго. Многие соединения брома до сих пор используются в текстильной промышленности для создания элегантных оттенков одежды.
7. Фармацевтические препаратыХотя элементарный бром токсичен по своей природе, многие безрецептурные спасающие жизнь лекарства содержат соединения брома в качестве основного ингредиента.Многие броморганические соединения используются в качестве седативных средств, поскольку ионы бромида обладают способностью снижать чувствительность центральной нервной системы. Соединения брома используются в производстве седативных, анальгетических и антигистаминных препаратов. Также они используются в различных препаратах для лечения пневмонии, кокаиновой зависимости; более того, они также используются в качестве катализатора для ускорения реакции на лекарства внутри тела. Помимо этих применений, лекарства на основе брома также поставляются тем, кто страдает сердечными заболеваниями, гиперактивностью щитовидной железы и истерией.Некоторые органические бромиды также используются в производстве дизайнерских лекарств, которые могут излечивать многие неизлечимые заболевания. Например, 5-бромурацил используется в качестве искусственного мутагена, который помогает ученым модифицировать генетические материалы, такие как ДНК.
Биологические аспектыС физиологической точки зрения в парообразном состоянии бром очень похож на хлор. Из-за его окислительного действия вдыхание 10 ppm и более высоких концентраций брома может вызвать сильное раздражение всех дыхательных путей, слизистых оболочек и глаз; вызывающие такие симптомы, как кашель, кровотечение из носа, чувство подавленности, головокружение, головная боль и, возможно, отсроченная боль в животе и диарея.Пневмония также может быть поздним осложнением тяжелого заражения.
Жидкий бром вызывает ощущение легкого охлаждения при первом контакте с кожей, за которым следует ощущение тепла. Он может оставить на коже сильные волдыри и ожоги, если сразу не удалить его путем обливания водой области контакта. Контакт с концентрированным паром также может вызвать ожоги и волдыри. Для обработки крошечных участков контакта в лаборатории 10% раствор тиосульфата натрия в воде может нейтрализовать бром, и такой раствор должен быть доступен при работе с бромом.
Свойства галогенов | Введение в химию
Цель обучения
- Опишите физические и химические свойства галогенов.
Ключевые моменты
- Галогены — неметаллы 17 (или VII) группы периодической таблицы Менделеева. Вниз по группе размер атома увеличивается. Как двухатомная молекула, фтор имеет самую слабую связь из-за отталкивания электронов малых атомов.
- Из-за увеличения силы Ван-дер-Ваальса, понижающей группу, температуры кипения галогенов увеличиваются. Следовательно, физическое состояние элементов в группе изменяется с газообразного фтора на твердый йод.
- Из-за высокого эффективного ядерного заряда галогены обладают высокой электроотрицательностью. Следовательно, они обладают высокой реакционной способностью и могут получить электрон в результате реакции с другими элементами. Галогены в достаточных количествах могут быть вредными или смертельными для биологических организмов.
Условия
- галогены Группа 17 (или VII) в периодической таблице, состоящая из фтора (F), хлора (Cl), брома (Br), йода (I) и астата (At). У них схожие химические свойства.
- электроотрицательность: тенденция атома притягивать к себе электроны.
Галогены представляют собой ряд неметаллических элементов из 17 группы периодической таблицы (ранее VII). Галогены включают фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At).Искусственно созданный элемент 117 (ununseptium) также может считаться галогеном.
Физические свойства
Атомы увеличиваются в группе по мере заполнения дополнительных электронных оболочек. Когда фтор существует в виде двухатомной молекулы, связь F – F оказывается неожиданно слабой. Это связано с тем, что атомы фтора являются наименьшими из галогенов — атомы тесно связаны друг с другом, что приводит к отталкиванию между свободными электронами в двух атомах фтора.
Точки кипения галогенов повышаются вниз по группе из-за увеличения силы Ван-дер-Ваальса по мере увеличения размера и относительной атомной массы атомов.Это изменение проявляется в изменении фазы элементов с газовой (F 2 , Cl 2 ) на жидкую (Br 2 ), на твердую (I 2 ). Галогены — единственная группа периодической таблицы, содержащая элементы во всех трех известных состояниях вещества (твердое, жидкое и газообразное) при стандартной температуре и давлении.
Физические состояния галогенов Галогены представляют собой все три знакомых состояния вещества: (слева направо) хлор — газ, бром — жидкость, а йод — твердое тело.Высокоактивный фтор на рисунке не представлен.Химические свойства
Электроотрицательность — это способность атома притягивать электроны или электронную плотность к себе внутри ковалентной связи. Электроотрицательность зависит от притяжения между ядром и связывающими электронами во внешней оболочке. Это, в свою очередь, зависит от баланса между числом протонов в ядре, расстоянием между ядром и связывающими электронами и экранирующим эффектом внутренних электронов.В галогенидах водорода (HX, где X — галоген) связь H-X удлиняется по мере увеличения числа атомов галогена. Это означает, что общие электроны находятся дальше от ядра галогена, что увеличивает экранирование внутренних электронов. Это означает, что электроотрицательность уменьшается по группе.
Галогены обладают высокой реакционной способностью и в достаточных количествах могут быть вредными или смертельными для биологических организмов. Эта реактивность обусловлена высокой электроотрицательностью и высоким эффективным зарядом ядра. Галогены могут получить электрон, вступая в реакцию с атомами других элементов.
Фтор — один из самых реактивных элементов. Он реагирует с инертными материалами, такими как стекло, и образует соединения с более тяжелыми инертными газами. Это едкий и очень токсичный газ. Реакционная способность фтора означает, что, как только он вступает в реакцию с чем-либо, он связывается настолько прочно, что образующаяся молекула становится инертной и нереактивной. Фтор может реагировать со стеклом в присутствии небольшого количества воды с образованием тетрафторида кремния (SiF4). Таким образом, с фтором необходимо обращаться с такими веществами, как инертное фторорганическое соединение тефлон.
Фтор бурно реагирует с водой с образованием кислорода (O 2 ) и фтороводорода:
[латекс] 2 F_2 (г) + 2 H_2O (l) \ вправо O_2 (г) + 4 HF (водн.) [/ Латекс]
Хлор имеет максимальную растворимость 7,1 г на кг воды при температуре окружающей среды (21 ° C). Растворенный хлор реагирует с образованием соляной кислоты (HCl) и хлорноватистой кислоты (HClO), раствора, который можно использовать в качестве дезинфицирующего средства или отбеливателя:
[латекс] Cl_2 (г) + H_2O (л) \ стрелка вправо HCl (водн.) + HClO (водн.) [/ Латекс]
Бром имеет растворимость 3.41 г на 100 г воды. Он медленно реагирует с образованием бромистого водорода (HBr) и бромистоводородной кислоты (HBrO):
[латекс] Br_2 (г) + H_2O (l) \ rightarrow HBr (водн.) + HBrO (водн.) [/ Латекс]
Йод минимально растворим в воде, его растворимость составляет 0,03 г на 100 г воды. Однако йод образует водный раствор в присутствии иодид-иона. Это происходит при добавлении йодида калия (KI) с образованием трииодид-иона.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
фактов о броме | Живая наука
Элемент № 35 с запахом, бром, является элементом в довольно большом количестве, но обладает редким свойством: это единственный неметалл, существующий в жидкой форме при комнатной температуре, и один из двух элементов (второй — ртуть), который является жидким при комнатной температуре. комнатная температура и давление.
Это 44-й по частоте элемент в земной коре согласно Периодической таблице с содержанием 2.4 части на миллион по весу, согласно Chemicool. Бром присутствует в соединениях, присутствующих в морской воде, природных рассолах и соленых озерах. Месторождения брома в Соединенных Штатах находятся в скважинах с естественным рассолом в Мичигане и Арканзасе. Мировое производство оценивается примерно в 330 000 тонн в год. По данным Коалиции по образованию в области минералов, он также добывается в Израиле, России, Франции и Японии.
Бром очень вреден для атмосферы. Согласно Chemicool, атомы брома в озоновом слое в 40-100 раз более разрушительны, чем атомы хлора.До половины потерь озона над Антарктидой происходит из-за реакций с участием брома. Бромистый метил, используемый в качестве фумиганта, является крупнейшим источником озоноразрушающего брома. Около 30% брома в атмосфере образуется в результате деятельности человека, остальное — естественного происхождения.
Только факты
- Атомный номер (количество протонов в ядре): 35
- Символ атома (в периодической таблице элементов): Br
- Атомный вес (средняя масса атома): 79,904
- Плотность : 1.805 унций на кубический дюйм (3,122 грамма на куб см)
- Фаза при комнатной температуре: жидкость
- Точка плавления: 19,4 градуса по Фаренгейту (минус 7 градусов Цельсия)
- Точка кипения: 138,0 F (58,9 C)
- Количество натуральных изотопы (атомы одного и того же элемента с разным числом нейтронов): 2. В лаборатории также создано не менее 24 радиоактивных изотопов.
- Наиболее распространенные изотопы: Br-79 (50,7% естественного содержания), Br-81 (49,3% естественного содержания.
История
Два ученых, работавшие независимо друг от друга, открыли бром в 1820-х годах, по словам голландского историка Питера ван дер Крогта.
Карл Лёвиг, немецкий студент-химик, учившийся у немецкого химика Леопольда Гмелина, выделил жидкий бром в 1825 году, взяв образец воды из соляного источника в Бад-Кройцнахе и добавив хлор, согласно Chemicool. После встряхивания раствора с эфиром Лёвиг обнаружил в растворе красно-коричневое вещество и выделил его, выпарив эфир.Гмелин посоветовал своему ученику произвести больше вещества, чтобы его можно было изучить более подробно. К тому времени, когда Лёвиг произвел больше вещества, после того, как его работа замедлилась между зимними экзаменами и отпусками, другие ученые уже опубликовали свои выводы.
По словам Питера ван дер Крогта, этот ученый, французский химик Антуан-Жером Балар, выделил бром при изучении бурых морских водорослей, известных как фукус. Согласно Chemicool, Балард взял образец рассола, в котором были обнаружены водоросли, и перегонял смесь рассола с хлором, чтобы получить темно-красную жидкость.Первоначально он думал, что это соединение хлора или йода, и когда он не смог выделить ни один элемент, он предположил, что фактически обнаружил новый элемент. Балард предложил название «мурид» от латинского слова «мурия» или рассол для своего нового элемента. Его результаты были опубликованы в 1826 году.
Кто знал?
- Бром — это галоген, согласно Chemicool. Согласно «Объясненной химии», галогеновые элементы (фтор, хлор, бром, йод и астат) никогда не встречаются в природе в одиночку и образуют соли при реакции с металлами.
- Название бром происходит от греческого слова «бромос», означающего зловоние, согласно данным Лос-Аламосской национальной лаборатории. Красновато-коричневая жидкость легко испаряется, превращаясь в красный пар с сильным запахом, напоминающим хлор.
- Согласно Lenntech, бром опасен. Он разъедает человеческие ткани в жидком состоянии, раздражает глаза и горло и очень токсичен при вдыхании в парообразном состоянии. Бром повреждает многие основные органы, включая печень, почки, легкие и желудок, а в некоторых случаях может вызвать рак.
- По данным Центров по контролю за заболеваниями, бром может всасываться в организм через загрязненную воду и пищу, вдыхая его и через кожу.
- По данным Cameo Chemicals, бром может вызвать самовоспламенение в сочетании с калием, фосфором и оловом, а также со многими химическими веществами.
- По данным Королевского химического общества, бром находит широкое применение в различных областях, включая сельскохозяйственные химикаты, инсектициды, красители, фармацевтические препараты, антипирены, мебельную пену, бензин, пластиковые корпуса для электроники и пленочную фотографию.
- По данным Лос-Аламосской национальной лаборатории, бром используется для очистки воды, в лекарствах и в качестве дезинфицирующих средств.
- По данным Bromine Science Environmental Forum, бром также используется для сокращения выбросов ртути на 90 процентов от угольных электростанций. Бром, добавленный в процесс, окисляет ртуть, облегчая извлечение с помощью оборудования для контроля выбросов.
- По данным Королевского химического общества, из-за токсичности и экологических проблем использование брома в качестве антипиренов и в сельском хозяйстве постепенно прекращается.
- Древние цивилизации производили дорогой пурпурный краситель из органических соединений брома, выделенных из мурекса, морской мидии, по данным лаборатории Джефферсона.
- По данным Minerals Education Coalition, человеческое тело содержит около 0,0004% брома, хотя использование брома в организме человека не известно.
Текущие исследования
Одна из областей исследований, в которой изучается бром, — это то, как бром влияет на атмосферу. Ресурс, опубликованный Национальным управлением океанических и атмосферных исследований (NOAA), описывает, как бром, а также хлор разрушают молекулы озона в течение трех циклов реакции.В первом цикле реакции между хлором или монооксидом хлора, взаимодействующими с озоном, приводят к монотонному (O) или двухатомному кислороду (O 2 ). Во втором цикле хлор также реагирует с озоном, в результате чего образуется двухатомный кислород. Третий цикл показывает реакцию брома с озоном с образованием двухатомного кислорода. Во всех этих случаях для реакций необходим солнечный свет, поэтому истощение озонового слоя сильнее в летние месяцы и значительно замедляется или прекращается в зимние месяцы, когда солнечный свет достигает полюсов минимально или вовсе отсутствует.
Существует несколько исследований, в том числе одно исследование, опубликованное в 2017 году в журнале «Атмосферная химия и физика» Бодо Вернером и др., Группой ученых из Германии, США и Великобритании. В исследовании использовались различные методы для расчета количества брома, присутствующего в атмосфере. Исследование показало, что примерно одна треть истощения озонового слоя происходит из-за брома. Согласно исследованию, соединения брома в атмосфере имеют четыре основных источника:
- естественные и антропогенные источники
- галоны
- так называемые очень короткоживущие виды (VSLS)
- неорганический бром, который был перенесен в верхние слои тропосфера
Начиная с пика 2000 года, когда уровень брома составлял примерно 20 частей на миллион, уровень брома в атмосфере снижался со скоростью 0.6 процентов в год. В расчетах авторов использовалось несколько ресурсов, которые были сосредоточены в тропических и субтропических регионах.
В конце 2016 года NOAA также сообщило, что уровни брома и других озоноразрушающих газов в атмосфере снижаются. В исследовании рассматривалась атмосфера над Антарктидой и средними широтами, а текущие значения сочетались с данными наблюдений, относящихся к 1970-м годам, и прогнозируемыми значениями до 2080 года. Используя значения 1980 года в качестве ориентира, исследователи прогнозируют, что озоноразрушающие газы, в основном содержащие бром и хлор , снизится до уровней 1980 года между 2040 и 2050 годами в средних широтах и примерно до 2070 года над Антарктидой.Снижение уровней этих газов в атмосфере является частью продолжающихся усилий по замедлению изменения климата и содействию регенерации защитного озонового слоя.
Дополнительные ресурсы
Бром | Encyclopedia.com
Примечание: эта статья, первоначально опубликованная в 1998 году, была обновлена в 2006 году для электронной книги.
Обзор
Бром относится к семейству галогенов. Галогены — это элементы, которые составляют группу 17 (VIIA) периодической таблицы.Периодическая таблица — это диаграмма, которая показывает, как элементы связаны друг с другом. Галогены также известны как солеобразователи. Фтор, хлор, бром, йод, и астатин образуют соли при химическом соединении с металлом.
Бром был открыт почти одновременно в 1826 году двумя людьми, немецким химиком Карлом Ловигом (1803-90) и французским химиком Антуаном-Жеромом Баларом (1802-76). В то время как Балард первым объявил о своем открытии, Лоуиг просто не завершил изучение элемента, когда Балард сделал свое объявление.
СИМВОЛ
Br
АТОМНОЕ ЧИСЛО
35
АТОМНАЯ МАССА
79.904
СЕМЕЙСТВО
Группа 17 (VIIA)
всего производимого брома поступает из США, Израиля или Великобритании. В 1996 году во всем мире было произведено около 450 000 000 килограммов (один миллиард фунтов) этого элемента. В наибольшей степени этот элемент используется в производстве антипиренов.Антипирены — это химические вещества, добавляемые к материалам, чтобы предотвратить горение или чтобы они не вышли из-под контроля. Другие основные области применения — производство буровых растворов, пестицидов, химикатов для для очистки воды, фотохимии, а также в качестве добавки к резине.
Открытие и присвоение названия
Соединения брома были известны за сотни лет до открытия этого элемента. Одним из самых известных таких соединений был тирский пурпур, также называемый королевским пурпуром.(Тириан происходит от слова Тир, древнего финикийского города.) Только очень богатые люди или члены королевской семьи могли позволить себе купить ткань, окрашенную в тирский пурпур. Он был получен из моллюска (моллюска), найденного на берегу Средиземного моря (большого водоема, граничащего с Европой, Азией и Африкой).
В 1825 году Левиг поступил в Гейдельбергский университет в Германии, чтобы изучать химию. Он продолжил начатый дома эксперимент, в котором он добавил хлор в родниковую воду. Добавление эфира к этой смеси дает красивый красный цвет.Лёвиг подозревал, что он открыл новое доброе вещество. Профессор поддержал его, предложив изучить вещество более подробно.
По мере продвижения этих исследований Балард опубликовал в химическом журнале отчет, в котором было объявлено об открытии нового элемента — брома. Элемент обладал всеми свойствами новой субстанции Лёвига. Два химика сделали открытие почти одновременно! Балар, однако, считается первооткрывателем брома, потому что ученые признают, что первый человек опубликовал своих открытий.
По-гречески слово bromos означает «зловоние» (сильный неприятный запах). Бром соответствует описанию. Запах интенсивный и сильно раздражает глаза и легкие.
Химики обнаружили, что бром принадлежит к семейству галогенов. Они знали, что он имеет свойства, аналогичные другим галогенам, и поместили его ниже фтора и хлора в периодической таблице.
Физические свойства
Существуют только два жидких элемента — бром и ртуть. При комнатной температуре бром представляет собой жидкость глубокого красновато-коричневого цвета.Он легко испаряется, выделяя сильные пары, раздражающие горло и легкие. Бром кипит при 58,8 ° C (137,8 ° F), а его плотность составляет 3,1023 грамма на кубический сантиметр. Бром замерзает при -7,3 ° C (18,9 ° F).
Бром хорошо растворяется в органических жидкостях, таких как эфир, спирт и четыреххлористый углерод, но лишь незначительно в воде. Органические соединения содержат элемент углерод.
Химические свойства
Бром — очень реактивный элемент. Хотя он менее активен, чем фтор или хлор, он более активен, чем йод.Реагирует со многими металлами, иногда очень активно. Например, с калием , реагирует взрывоопасно. Бром даже соединяется с относительно инертными металлами, такими как платина и палладий.
Встречается в природе
Бром слишком реакционноспособен, чтобы существовать как свободный элемент в природе. Вместо этого он встречается в соединениях, наиболее распространенными из которых являются бромид натрия, (NaBr) и бромид калия (KBr). Эти соединения встречаются в морской воде и подземных соляных пластах.Эти соляные пласты образовались в регионах, где когда-то сушу покрывали океаны. Когда океаны испарились (высохли), остались соли — в первую очередь хлорид натрия (NaCl), хлорид калия (KCl) и бромид натрия и калия. Позже движения земной коры погребли солевые отложения. Теперь они похоронены на много миль под землей. Соли выводятся на поверхность почти так же, как добывают уголь.
Бром — элемент с умеренным содержанием. Его распространенность в земной коре оценивается примерно в 1.От 6 до 2,4 частей на миллион. Его гораздо больше в морской воде, где, по оценкам, около 65 частей на миллион.
В некоторых регионах содержание брома еще выше. Например, Мертвое море (граничащее с Израилем и Иорданией) имеет высокий уровень растворенных солей. Количество брома оценивается в 4000 частей на миллион. Соленость или содержание соли настолько высоки, что в воде ничего не живет. Вот почему его называют Мертвым морем.
Изотопы
Существуют два естественно существующих изотопа брома, бром-79 и бром-81.Изотопы — это две или более формы элемента. Изотопы отличаются друг от друга по своему массовому числу. Число, написанное справа от названия элемента, является массовым числом. Массовое число представляет собой количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого элемента может варьироваться. Каждая вариация — изотоп.
Известно также по крайней мере 16 радиоактивных изотопов брома.Радиоактивный изотоп — это изотоп, который распадается и испускает некоторую форму излучения. Радиоактивные изотопы образуются, когда очень маленькие частицы стреляют по атомам. Эти частицы прилипают к атомам и делают их радиоактивными.
Ни один изотоп брома не имеет важного коммерческого использования.
Соленость или содержание соли настолько высоки, что в воде ничего не живет. Вот почему его называют Мертвым морем.
Экстракция
Метод, используемый Лоуигом и Балардом для сбора брома, используется и сегодня.Хлор добавляется в морскую воду, содержащую бромид натрия или бромид калия. Хлор более активен, чем бром, и заменяет бром в реакции:
Использует
Наиболее важным применением брома сегодня является производство огнестойких материалов. Многие материалы, используемые для изготовления одежды, ковров, штор и занавесок, легко воспламеняются, и если их коснется пламя, они очень быстро воспламенится. Химики научились делать материалы более устойчивыми к пожарам, погружая их в соединение брома.Состав покрывает волокна материала. Соединение брома также может быть химически включено в материал.
Соединения брома, используемые в антипиренах, часто бывают сложными. Одно такое соединение называется трис (дибромопропил) фосфат ((Br 2 C 3 H 5 O) 3 PO). Однако было обнаружено, что это соединение является канцерогеном (веществом, вызывающим рак). Поэтому его использование строго ограничено.
Около 20 процентов всего брома используется в бурении скважин.Бромид кальция (CaBr 2 ), бромид натрия (NaBr) или бромид цинка (ZnBr 2 ) добавляют в скважину для повышения эффективности процесса бурения.
Бром также важен при производстве пестицидов, химических веществ, используемых для уничтожения вредителей. Бромистый метил (CH 3 Br) в течение многих лет использовался для обработки посевных площадей. Бромистый метил распыляют на поверхность или впрыскивают прямо в землю.
Некоторое количество бромистого метила всегда испаряется в воздух, повреждая озоновый слой.Озон (O 3 ) отфильтровывает часть ультрафиолетового (УФ) излучения солнца. УФ-излучение вызывает рак кожи, солнечный ожог и повреждение растений и хрупких организмов.
Мировое производство бромистого метила прекратится в 2001 году из-за его воздействия на озоновый слой. США планируют прекратить производство препарата еще раньше. Фермеры считают, что ничто не помогает лучше, чем бромистый метил в уничтожении определенных вредителей. Они обеспокоены тем, что в случае запрета бромистого метила пострадает растениеводство.
Наиболее важным применением брома в настоящее время является производство огнестойких материалов.
Дибромид этилена (C 2 H 4 Br 2 ) представляет собой бромидное соединение, добавляемое в этилированный бензин. Свинец в «этилированном бензине» представляет собой тетраэтил свинец (Pb (C 2 H 5 )) 4 ). Он способствует более чистому сгоранию топлива и предохраняет двигатели автомобилей от «детонации». «Стук» — это повторяющийся металлический стук, который возникает при проблемах с зажиганием. с автомобильным двигателем.«Стук» снижает КПД автомобильного двигателя.
Но этилированный бензин при горении выделяет свободный свинец. Свободный свинец — очень токсичный элемент, вызывающий поражение нервной системы. Дибромид этилена добавляется для реакции со свободным свинцом и превращения его в безопасное соединение.
Дибромид этилена полностью не решает проблему. Некоторое количество свободного свинца все еще улетучивается в атмосферу. Этилированный бензин был запрещен в Соединенных Штатах в течение многих лет, но до сих пор используется в других странах.
Самым популярным элементом для очистки водопроводной воды и бассейнов был хлор. Соединения брома стали более популярными благодаря своей превосходной способности убивать бактерии.
Воздействие на здоровье
Бром токсичен при вдыхании или проглатывании.

 Эту жидкость он назвал муридом (от лат. muria -рассол) и послал сообщение о своем открытии в Парижскую академию наук. Комиссия назвала новый элемент бромом в связи с тем, что у брома тяжелый, неприятный запах паров (от греческого brwmoz — зловоние).
Эту жидкость он назвал муридом (от лат. muria -рассол) и послал сообщение о своем открытии в Парижскую академию наук. Комиссия назвала новый элемент бромом в связи с тем, что у брома тяжелый, неприятный запах паров (от греческого brwmoz — зловоние). Для этого применяют растворы бромистого железа. Из полученных полупродуктов бром выделяют действием хлора или кислоты. Далее бром отделяют от воды и очищают от примеси хлора дистилляцией.
Для этого применяют растворы бромистого железа. Из полученных полупродуктов бром выделяют действием хлора или кислоты. Далее бром отделяют от воды и очищают от примеси хлора дистилляцией. Значительно лучше растворим бром в органических растворителях, чем пользуются для извлечения его из
водных растворов.
Значительно лучше растворим бром в органических растворителях, чем пользуются для извлечения его из
водных растворов.
 Соли — броматы. Бромноватая кислота и броматы являются сильными окислителями:
Соли — броматы. Бромноватая кислота и броматы являются сильными окислителями:  Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива. 1,2-дибромэтан применяют как антидетонирующую добавку в моторном топливе. Растворы бромидов используются в нефтедобыче.
В медицине бромид натрия и калия применяют как успокаивающие средства.
Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива. 1,2-дибромэтан применяют как антидетонирующую добавку в моторном топливе. Растворы бромидов используются в нефтедобыче.
В медицине бромид натрия и калия применяют как успокаивающие средства.