Гликогеногенез — Википедия
Материал из Википедии — свободной энциклопедии
Гликогеногене́з — метаболический путь синтеза гликогена из глюкозы, происходящий с расходованием энергии в виде ATP и UTP. Гликогеногенез происходит во всех тканях животных, однако в основном он имеет место в печени и мышцах. Синтез гликогена происходит в период пищеварения (в абсорбтивный период, т. е. 1—2 часа после приёма углеводной пищи[1][2].
«Стартовой точкой» гликогеногенеза служит глюкозо-6-фосфат. Глюкозо-6-фосфат может быть получен из глюкозы в ходе реакции, катализируемой изоферментами гексокиназой I и гексокиназой II в мышцах и гексокиназой IV (глюкокиназой) в печени:
- D-глюкоза + ATP → D-глюкозо-6-фосфат + ADP.
Однако поглощённая с пищей глюкоза может проделывать более сложный путь до глюкозо-6-фосфата. Сначала она попадает в эритроциты, где гликолитически превращается в лактат. Затем лактат поступает в печень, где в ходе глюконеогенеза превращается в глюкозу, а потом и глюкозо-6-фосфат
Для инициации синтеза гликогена глюкозо-6-фосфат должен быть переведён в глюкозо-1-фосфат ферментом фосфоглюкомутазой:
- Глюкозо-6-фосфат ⇌ глюкозо-1-фосфат[2].
Глюкозо-1-фосфат далее превращается в UDP-глюкозу[en] под действием UDP-глюкозопирофосфорилазы[en], это является ключевым этапом в синтезе гликогена[3].
- Глюкозо-1-фосфат + UTP → UDP-глюкоза + PPi
Эта реакция образования нуклеотид-сахара в клеточных условиях необратима, поэтому необратим и гликогеногенез. Конденсация уридинтрифосфата с глюкозо-1-фосфатом имеет небольшое положительное изменение энергии Гиббса, однако в ходе этой реакции выделяется пирофосфат (PP
UDP-глюкоза является непосредственным донором глюкозных остатков в реакции, катализируемой
Гликогенсинтаза создаёт (α1→4)-гликозидные связи, однако она неспособна создавать (α1→6)-гликозидные связи, которые располагаются в точках ветвления гликогена. Эти связи образует гликогеноразветвляющий фермент[en], или амило-(1→4)-(1→6)-трансгликозилаза, или гликозил-(4→6)-трансфераза. Гликогеноразветвляющий фермент катализирует перенос терминального фрагмента длиной 6 или 7 глюкозных остатков с нередуцирующего конца ветви гликогена длиной не менее 11 остатков на гидроксильную группу при шестом атоме остатка глюкозы, располагающегося ниже, причём он может принадлежать как той же самой, так и другой цепи. Таким образом создаётся новая ветвь гликогена
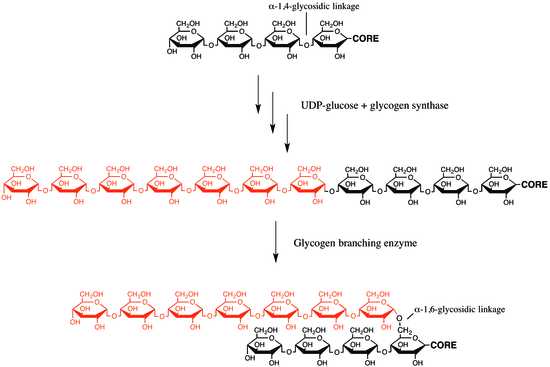
Дополнительные остатки глюкозы могут добавляться на новую ветвь гликогена под действием гликогенсинтазы. Биологический момент разветвления молекулы гликогена состоит в том, что это повышает растворимость гликогена и увеличивает число его нередуцирующих концов, которые являются сайтами активности гликогенфосфорилазы (главный фермент гликогенолиза) и гликогенсинтазы[5].
 Гликогениновый димер, окружённый двумя молекулами гликогена
Гликогениновый димер, окружённый двумя молекулами гликогенаРегуляция гликогеногенеза осуществляется совместно с гликогенолизом (расщеплением гликогена) по типу переключения. Это переключение происходит при переходе из абсорбтивного состояния в постабсортивное, а также при смене состояния покоя на режим физической работы. В печени оно осуществляется при участии гормонов инсулина, глюкагона и адреналина, а в мышцах — инсулина и адреналина. Их действие на синтез и распад гликогена опосредовано изменением в противоположном направлении активности двух ключевых ферментов: гликогенсинтазы
- ↑ Северин, 2011, с. 241.
- ↑ 1 2 3 Nelson, Cox, 2008, p. 599.
- ↑ 1 2 Nelson, Cox, 2008, p. 600.
- ↑ Nelson, Cox, 2008, p. 598.
- ↑ 1 2 3 Nelson, Cox, 2008, p. 601.
- ↑ Северин, 2011, с. 245.
- David L. Nelson, Michael M. Cox. Lehninger Principles of biochemistry. — Fifth edition. — New York: W. H. Freeman and company, 2008. — 1158 p. — ISBN 978-0-7167-7108-1.
- Биологическая химия с упражнениями и задачами / Под ред. С. Е. Северина. — М.: Издательская группа «ГЭОТАР-Медиа», 2011. — 624 с.
ru.wikipedia.org
Гликогенез – это процесс преобразования глюкозы в гликоген
В организме человека постоянно протекают различные процессы и химические реакции. На поддержание жизнедеятельности необходима энергия. Гликогенез – это такой процесс, благодаря которому происходит обеспечение каждой клетки, ткани и органа, необходимой энергией. В чем особенность процесса, как протекает, и к чему приводят нарушения – далее.
Что такое гликогенез
Гликогенез – комплекс биохимических превращений в организме, которые протекают в период усвоения потребленной пищи. На протяжении первых двух часов после приема пищи, поступившие питательные вещества усваиваются и проходят через ряд преобразований. На одном из этапов преобразования поглощенных веществ осуществляется и гликогенез.
По своей сути синтез гликогена – это процесс накопления небольшого энергетического потенциала, который мобилизуется в клетках в случае резкого увеличения нагрузки. Сначала расходуется запасенная в клетках мышц энергия, которая поддерживает функционирование этой ткани. После этого начинается расходование резерва из печени, который уже распределяет энергию не только в мышцы, но и по всему организму.

Биохимия гликогенеза
В организм регулярно поступает пища. В процессе переваривания поглощенных продуктов из пищеварительного тракта в кровь всасываются углеводы. Второй этап – расщепление углеводов под действием катализатора гексокиназы до глюкозо-6-фосфат. Уже молекулы этого полученного вещества принимают участие в первом этапе синтеза гликогена.
В отдельных случаях при потреблении «сложных» углеводов, цепочка биохимических реакций до получения глюкозо-6-фосфата, оказывается длиннее. В данном случае при попадании в кровь глюкозы происходит связывание ее молекул с эритроцитами. После этого путем гликолитических реакций глюкоза превращается в лактат. Затем в печени лактат преобразуется в исходное для гликогенеза вещество – глюкозо-6-фосфат.
После получения глюкозо-6-фосфата происходит его превращение в глюкозо-1-фосфат под влиянием фермента фосфоглюкометазы. Полученное вещество расщепляется до UPD-глюкозы, а она, в свою очередь, переносит глюкозные остатки для формирования молекул гликогена.
Что такое гликоген и зачем он нужен
Гликоген (C6h20O6)n – это полисахарид, получаемый организмом из глюкозы под воздействием особых ферментов и гормонов. По своему строению этот полисахарид животного происхождения напоминает молекулы растительного крахмала, но при этом отличается химическим составом. Гликоген накапливается непосредственно в клетках в кристаллической форме, непосредственно в цитоплазме. Основные запасы этого полисахарида в человеческом организме находятся в таких клетках:
- мышечные структуры;
- печень.
Синтез гликогена протекает главным образом в клетках печени. Там накапливается этот полисахарид и служит резервным источником энергии. В среднем печень может вмещать гликогена до 5-6% от общего объема органа. У взрослых это около 100 грамм, а у детей – до 50-60 грамм.
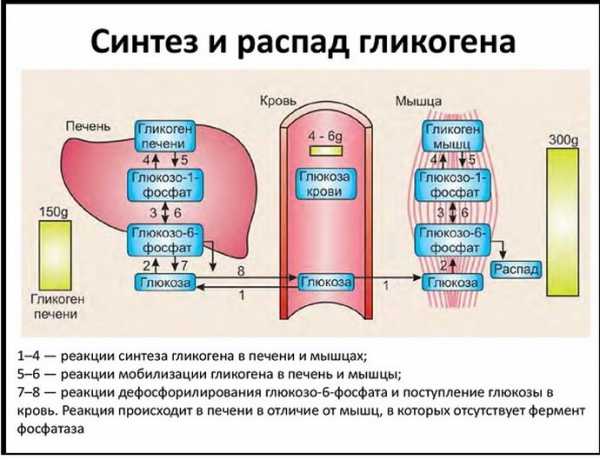
Гликоген в печени расходуется после того, как исчерпываются запасы этого полисахарида в мышечной ткани. Объем полисахарида в мышцах – не более 1%, при этом расходуется он локально, непосредственно в месте накопления. Мышечный гликоген служит для энергетического обеспечения процесса сокращения мышц.
Роль в спорте
Особое значение процесс синтеза гликогена имеет для людей, которые ведут активный образ жизни и занимаются спортом. Еще в 50-х годах прошлого века ученые стали изучать влияние кристаллического полисахарида на спортивные результаты. Это привело к тому, что сегодня уровень подготовленности спортсменов, достижений и количество рекордов в разы выше, чем ранее. Хороший запас гликогена обеспечивает следующие эффекты:
- повышает выносливость на тренировках;
- улучшает спортивные результаты;
- снижает утомляемость;
- ускоряет восстановление мышечной ткани после силовых нагрузок.

То есть спортсменам, желающим добиться высоких показателей на тренировках и в соревнованиях, следует особое внимание уделять углеводной пище. В результате дефицита глюкозы в организме, спортсмен не сможет выдерживать большие нагрузки. В долгосрочной перспективе это может привести к снижению производительности, повышенной утомляемости и в целом негативно сказаться на состоянии здоровья.
Спортсмены, которые вынуждены заниматься продолжительное время без перерывов, обязательно включают в свой рацион кроме углеводной пищи еще и соответствующие добавки.
Спортивные гейнеры – это порошки, которые на 80-90% состоят из углеводов. Они быстро усваиваются, принимаются непосредственно перед тренировками для того, чтобы обеспечить организм достаточным количеством глюкозы, необходимой для протекания гликогенеза.
Роль в похудении
Гликогенез играет не последнюю роль в похудении, так как незнание особенностей протекания этого процесса может привести к низким результатам в борьбе с лишним весом. Дело в том, что гликогенез – это процесс, который не может в полной мере обеспечить организм необходимой ему энергией. Более мощный энергетический резерв представляют триглицериды, то есть жировая ткань.
Но последовательность расходования энергии такова – изначально клетки потребляют гликоген, а лишь тогда, когда он заканчивается, организм приступает к расщеплению жиров. Вот как нужно использовать знания о гликогенезе.

Как стимулировать гликогенез
Чтобы не страдать от дефицита энергии и недостатка физической выносливости, важно поддерживать синтез необходимых полисахаридов. В норме у здорового человека гликогенез протекает самостоятельно даже в тех случаях, когда в организм поступает недостаточно углеводов. Но для людей, деятельность которых связана с повышенными физическими нагрузками, необходимо знать, как стимулировать процесс накопления энергии. Вот основные правила:
- Необходимо поддерживать здоровый баланс жидкостей в организме. Проще говоря, необходимо пить больше воды. Без жидкости все биохимические реакции в организме протекают в разы медленнее.
- Важно обогатить рацион продуктами, которые содержат простые и сложные углеводы.
- Следует придерживаться здорового режима питания. Для того чтобы своевременно восполнять потраченные запасы энергии, необходимо выдерживать промежуток между приемами пищи не более 4 часов.
- Крайне важно поддержание здоровья печени, отказ от вредных привычек и периодические осмотры у гепатолога. Так как частично образование полисахаридов происходит в клетках печени, проблемы с этим органом приводят к замедлению скорости протекания биохимических реакций.
- Не менее важна регулярность в тренировках. Организм подстраивается под энергетические потребности и при постепенном и регулярном увеличении нагрузки он начинает накапливать больше энергии.
- Важно не употреблять бесконтрольно различные спортивные препараты, так как они влияют на биохимические реакции и могут привести к серьезным изменениям в организме.
- Нельзя забывать о полноценном отдыхе и стабильном режиме сна, особенно если приходится регулярно подвергаться изнуряющим физическим нагрузкам.

Эти советы актуальны только для здоровых людей. В тех случаях, когда причиной расстройства гликогенеза являются врожденные или приобретенные патологии, поможет только медикаментозная терапия под контролем лечащего врача.
Расстройства углеводного обмена
Существуют редкие заболевания, которые приводят к появлению серьезных нарушений в процессе гликогенеза. Ученые и классификаторы выделили метаболические расстройства такого типа в отдельную группу. Гликогенозы – это комплексное название различных тяжелых расстройств в синтезе гликогена в печени. Все они связаны с наследственными факторами и являются результатом врожденных патологий. Согласно современной классификации выделяют такие заболевания:
- Болезнь Гирке – гликогеноз первой степени, развивается в результате неспособности клеток организма к синтезу начального продукта реакций синтеза – глюкозо-6-фосфата.
- Второй тип – болезнь Помпе. Это расстройство связано с дефектом мальтазы, сложно поддается диагностике и требует дорогостоящего лечения. Без своевременной диагностики и лечения болезнь Помпе дает высокий процент летальных исходов.
- Третий тип – болезнь Форбса, характеризующаяся ферментной недостаточностью. При правильно выстроенной терапевтической тактике ребенок с этим расстройством восстановится после завершения пубертатного периода.
- Четвертый тип – болезнь Андерсена, приводящая к генетически обусловленному циррозу печени. Причина – дефект фермента амило-трансглюкозилазы.
- Пятый тип – болезнь Мак-Ардля. Это патология связана с чрезмерным накоплением гликогена в клетках мышечной ткани, из-за чего развиваются осложнения. Заболевание поддается лечению, но успешный исход зависит от того, насколько рано было диагностировано расстройство.
- Шестой тип – болезнь Герса. Развивается в результате недостаточной выработки фермента фосфорилазы. Приводит к чрезмерному накоплению энергетических полисахаридов в печени, из-за чего нарушаются основные функции этого органа.
- Седьмой тип – болезнь Таруи, развивающаяся в результате дефицита ферментов в мышечной ткани. Для диагностики используется методика биопсии. Эффективной терапии не существует – больным показана кетогенная диета и ограничение физической активности.
- Восьмой тип — болезнь Хага. Патология развивается по причине недостатка фермента киназы фосфорилазы и характеризуется развитием выраженной гепатомегалии. Для поддержания хорошего самочувствия больным показана безуглеводная диета.

Для каждого типа расстройства используются отличающиеся диагностические мероприятия. Диагностика проводится не только при наличии симптомов непосредственно у новорожденного. Показано комплексное обследование тем детям, у которых в роду уже наблюдались случаи развития подобных расстройств.
Как можно увидеть, гликогенез – это важное звено цепочки обмена веществ, без которой невозможно полноценное функционирование всех органов и систем. Существуют различные способы стимуляции этих реакций, актуальные для здоровых людей. В случае если нарушения вызваны генетическими факторами, важно своевременно диагностировать проблему и строго придерживаться рекомендаций врача для ее устранения.
zdravpechen.ru
Синтез гликогена (гликогенез). «БИОЛОГИЧЕСКАЯ ХИМИЯ», Березов Т.Т., Коровкин Б.Ф.
Прежде всего глюкоза подвергается фосфорилированию при участии фермента гексокиназы, а в печени – и глюкокиназы. Далее глюкозо-6-фосфат под влиянием фермента фосфоглюкомутазы переходит в глюкозо-1-фос-фат:
Образовавшийся глюкозо-1-фосфат уже непосредственно вовлекается в синтез гликогена. На первой стадии синтеза глюкозо-1-фосфат вступает во взаимодействие с УТФ (уридинтрифосфат), образуя уридиндифосфатглюкозу (УДФ-глюкоза) и пирофосфат. Данная реакция катализируется ферментом глюкозо-1-фосфат-уридилилтрансферазой (УДФГ-пирофосфорилаза):
Глюкозо-1-фосфат + УТФ < = > УДФ-глюкоза + Пирофосфат.
Приводим структурную формулу УДФ-глюкозы:
На второй стадии – стадии образования гликогена – происходит перенос глюкозного остатка, входящего в состав УДФ-глюкозы, на глюкозидную цепь гликогена («затравочное» количество). При этом образуется α-(1–>4)-связь между первым атомом углерода добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозы цепи. Эта реакция катализируется ферментом гликогенсинтазой. Необходимо еще раз подчеркнуть, что реакция, катализируемая гликогенсинтазой, возможна только при условии, что полисахаридная цепь уже содержит более 4 остатков D-глю-козы.
Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ, и таким образом весь цикл превращений глюкозо-1-фосфата начинается сначала.
Установлено, что гликогенсинтаза неспособна катализировать образование α-(1–>6)-связи, имеющейся в точках ветвления гликогена. Этот процесс катализирует специальный фермент, получивший название гли-когенветвящего фермента, или амило-(1–>4)–>(1–>6)-трансглюкозидазы. Последний катализирует перенос концевого олигосахаридного фрагмента, состоящего из 6 или 7 остатков глюкозы, с нередуцирующего конца одной из боковых цепей, насчитывающей не менее 11 остатков, на 6-гидроксиль-ную группу остатка глюкозы той же или другой цепи гликогена. В результате образуется новая боковая цепь.
Ветвление повышает растворимость гликогена. Кроме того, благодаря ветвлению создается большое количество невосстанавливающих концевых остатков, которые являются местами действия гликогенфосфорилазы и гликогенсинтазы.
Таким образом, ветвление увеличивает скорость синтеза и расщепления гликогена.
Благодаря способности к отложению гликогена (главным образом в печени и мышцах и в меньшей степени в других органах и тканях) создаются условия для накопления в норме некоторого резерва углеводов. При повышении энерготрат в организме в результате возбуждения ЦНС обычно происходят усиление распада гликогена и образование глюкозы.
Помимо непосредственной передачи нервных импульсов к эффекторным органам и тканям, при возбуждении ЦНС повышаются функции ряда желез внутренней секреции (мозговое вещество надпочечников, щитовидная железа, гипофиз и др.), гормоны которых активируют распад гликогена, прежде всего в печени и мышцах (см. главу 8).
Как отмечалось, эффект катехоламинов в значительной мере опосредован действием цАМФ, который активирует протеинкиназы тканей. При участии последних происходит фосфорилирование ряда белков, в том числе гликогенсинтазы и фосфорилазы b – ферментов, участвующих в обмене углеводов. Фосфорилированный фермент гликогенсинтаза сам по себе малоактивен или полностью неактивен, но в значительной мере активируется положительным модулятором глюкозо-6-фосфатом, который увеличивает Vmaxфермента. Эта форма гликогенсинтазы называется D-формой, или зависимой (dependent) формой, поскольку ее активность зависит от глюкозо-6-фосфата. Дефосфорилированная форма гликоген-синтазы, называемая также I-формой, или независимой (independent) формой, активна и в отсутствие глюкозо-6-фосфата.
Таким образом, адреналин оказывает двойное действие на обмен углеводов: ингибирует синтез гликогена из УДФ-глюкозы, поскольку для проявления максимальной активности D-формы гликогенсинтазы нужны очень высокие концентрации глюкозо-6-фосфата, и ускоряет распад гликогена, так как способствует образованию активной фосфорилазы а. В целом суммарный результат действия адреналина состоит в ускорении превращения гликогена в глюкозу.
Предыдущая страница | Следующая страница
СОДЕРЖАНИЕ
www.xumuk.ru
Гликогенолиз — Википедия
Материал из Википедии — свободной энциклопедии
Гликогено́лиз — биохимический процесс расщепления гликогена до глюкозы, осуществляется главным образом в печени и мышцах[1] и не требует затрат энергии[2]. Основная задача гликогенолиза — поддержание постоянного уровня глюкозы в крови[3]. Регуляция гликогенолиза осуществляется совместно с регуляцией гликогеногенеза по типу переключения одного на другое. Важнейшими гормонами, участвующими в регуляции гликогеногенеза, являются инсулин, глюкагон и адреналин[4].
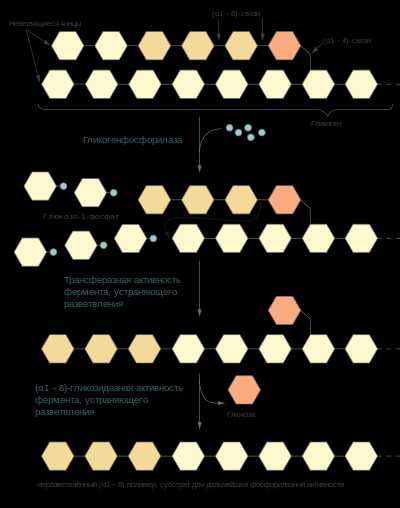 Схема гликогенолиза
Схема гликогенолизаГликоген, запасаемый в тканях животных, и крахмал, запасаемый растениями, могут быть мобилизованы клеткой для получения энергии при помощи гликогенолиза — фосфоролитической реакции, осуществляемой, прежде всего, ферментами гликогенфосфорилазой (или крахмалфосфорилазой[en] у растений). Эти ферменты катализируют атаку неорганическим фосфатом (α1→4) гликозидной связи, соединяющей два крайних остатка глюкозы на неветвящемся конце, в результате чего образуется глюкозо-1-фосфат и глюкозный полимер, содержащий на 1 глюкозный остаток меньше исходного (к расщеплению (α1→6)-гликозидных связей они неспособны). Часть энергии гликозидной связи при этом запасается эфирной связи, соединяющей фосфат с глюкозой в глюкозо-1-фосфате. Гликогенфосфорилаза (или крахмалфосфорилаза) продолжает отщеплять по одному глюкозному остатку до тех пор, пока она не дойдёт до последних четырёх глюкозных остатков на пути к точке ветвления полисахарида (т. е. гликозидной связи (α1→6)), где она останавливается. Далее в работу вступает олигосахарилтрансфераза[en], которая переносит три глюкозных остатка, ближних к концу неветвящегося участка, на нередуцирующий конец цепи и таким образом удлиняет её. Оставшийся глюкозный остаток, соединённый с основной неветвящейся цепью (α1→6)-гликозидной связью, отщепляется (α1→6)-гликозидазой в виде свободной глюкозы[2].
Образовавшийся при отщеплении глюкозных остатков глюкозо-1-фосфат переводится в глюкозо-6-фосфат ферментом фосфоглюкомутазой, катализирующим обратимую реакцию:
- Глюкозо-1-фосфат ⇌ глюкозо-6-фосфат.
Механизм действия этого фермента такой же, как у фосфоглицератмутазы[5]. Образующийся в ходе этой реакции глюкозо-6-фосфат в печени под действием глюкозо-6-фосфатазы распадается на фосфат и глюкозу, которая поступает в кровь. Так обеспечивается главная функция гликогена печени — поддержание постоянного уровня глюкозы (3,3—3,5 ммоль) в крови в интервалах между приёмами пищи для использования её другими органами, прежде всего мозгом. По прошествии 10—18 часов после приёма пищи запасы гликогена в печени значительно истощаются, а голодание в течение 24 часов приводит к полному их исчерпанию. В мышцах глюкозо-6-фосфатаза отсутствует, а для фосфорилированной глюкозы клеточная мембрана непроницаема, поэтому она используется только в мышечных клетках и гликоген мышц обеспечивает энергией только сами мышцы. В мышцах глюкозо-6-фосфат вовлекается в катаболизм (гликолиз или пентозофосфатный путь[5]) или превращается в лактат[3].
Описанная выше ситуация характерна лишь для гликогена и крахмала, запасённых внутри клетки. Фосфоролиз[en] в пищеварительном тракте гликогена и крахмала, поступающих в организм с пищей, не имеет никаких преимуществ перед обычным гидролизом: так как клеточные мембраны непроницаемы для фосфатов сахаров, образующийся при фосфоролизе глюкозо-6-фосфат необходимо сначала превратить в обычный сахар[5]. При гидролизе, осуществляемым, например, пищеварительным ферментом α-амилазой, частицей, атакующей гликозидную связь, является вода, а не неорганический фосфат[6].
Регуляция гликогенолиза осуществляется совместно с гликогеногенезом (образованием гликогена) по типу переключения. Это переключение происходит при переходе из абсорбтивного состояния в постабсортивное, а также при смене состояния покоя на режим физической работы. В печени оно осуществляется при участии гормонов инсулина, глюкагона и адреналина, а в мышцах — инсулина и адреналина. Их действие на синтез и распад гликогена опосредовано изменением в противоположном направлении активности двух ключевых ферментов: гликогенсинтазы[en] (гликогеногенез) и гликогенфосфорилазы (гликогенолиз) при помощи их фосфорилирования/дефосфорилирования[4].
- ↑ Гликогенолиз — статья из Толкового словаря по медицине
- ↑ 1 2 Северин, 2011, с. 244.
- ↑ 1 2 Северин, 2011, с. 243.
- ↑ 1 2 Северин, 2011, с. 245.
- ↑ 1 2 3 Nelson, Cox, 2008, p. 544.
- ↑ Nelson, Cox, 2008, p. 543.
- David L. Nelson, Michael M. Cox. Lehninger Principles of biochemistry. — Fifth edition. — New York: W. H. Freeman and company, 2008. — 1158 p. — ISBN 978-0-7167-7108-1.
- Биологическая химия с упражнениями и задачами / Под ред. С. Е. Северина. — М.: Издательская группа «ГЭОТАР-Медиа», 2011. — 624 с.
ru.wikipedia.org
Гликогенез — словарь ветеринарных терминов — ВЦ Зоовет
Гликогенез — биохимическая реакция протекающая в основном в печени и мышцах в результате которой глюкоза превращается в гликоген. Это очень важная биологическая реакция так как глюкоза является основным источником энергии в организме, а гликоген это форма хранения глюкозы в клетке на случай энергетических затрат между приемами пищи. Гликогенез это только один из этапов сложного превращения углеводов в организме. В целом это происходит следующим образом: Во время приема пищи углеводы, к которым в первую очередь относится крахмал, а также дисахариды сахароза, лактоза и мальтоза, под действием фермента слюны амилазы расщепляются на менее крупные чем крахмал молекулы. Далее в тонком кишечнике уже другие ферменты (панкреатическая амилаза, сахараза, мальтаза и лактаза) гидролизируют углеводные остатки до моносахаридов, одним из которых является глюкоза. Затем половина всосавшейся глюкозы поступает в печень, а остальная часть транспортируется в остальные ткани. Поступление глюкозы в клетки во многих органах регулируется инсулином, за исключением печени и мозга где скорость диффузии зависит только от концентрации глюкозы. В клетках происходит распад глюкозы — гликолиз. Гликолиз может происходить с участием кислорода (аэробный процесс), тогда в результате образуется две молекулы пирувата, и без участия кислорода (анаэробный процесс), в этом случае образуются две молекулы лактата. В случае аэробного процесса пируват в конечном итоге окисляется до углекислого газа и воды. А анаэробный процесс включает те же реакции что и аэробный, только в конце пируват превращается в лактат. В результате распада глюкозы с участием кислорода образуется 38 молекул АТФ — источника энергии в живых организмах, а после анаэробного гликолиза всего 2 молекулы АТФ. Смысл этого заключается в том, что анаэробный процесс протекает в мышцах в начале интенсивной физической нагрузки когда снабжение кислородом ограничено.
Часть попадающей с пищей глюкозы не идет на образование АТФ, а откладывается про запас в виде гликогена у животных и в виде крахмала у растений. Гликоген и крахмал это разветвленные цепочки из молекул глюкозы. Процесс гликогенеза, т.е. образование гликогена из глюкозы представляет собой процесс полимеризации, т.е происходит последовательное присоединение друг к другу мономеров глюкозы и образование полисахаридной цепи гликогена. Мышечный гликоген является источником глюкозы для самой мышечной клетки, а печеночный поддерживает физиологическую концентрацию глюкозы в крови.
Здоровья Вам и Вашим питомцам!
Возврат к списку
www.zoovet.ru
— обмен гликогена — Биохимия
Мобилизация гликогена (гликогенолиз)
Резервы гликогена используются по-разному в зависимости от функциональных особенностей клетки.
Гликоген печени расщепляется при снижении концентрации глюкозы в крови, прежде всего между приемами пищи. Через 12-18 часов голодания запасы гликогена в печени полностью истощаются.
В мышцах количество гликогена снижается обычно только во время физической нагрузки – длительной и/или напряженной. Гликоген здесь используется для обеспечения глюкозой работы самих миоцитов. Таким образом, мышцы, как впрочем и остальные органы, используют гликоген только для собственных нужд.
Мобилизация (распад) гликогена или гликогенолиз активируется при недостатке свободной глюкозы в клетке, а значит и в крови (голодание, мышечная работа). При этом уровень глюкозы крови «целенаправленно» поддерживает только печень, в которой имеется глюкозо-6-фосфатаза, гидролизующая фосфатный эфир глюкозы. Образуемая в гепатоците свободная глюкоза выходит через плазматическую мембрану в кровь.
В гликогенолизе непосредственно участвуют три фермента:
1. Фосфорилаза гликогена (кофермент пиридоксальфосфат) – расщепляет α-1,4-гликозидные связи с образованием глюкозо-1-фосфата. Фермент работает до тех пор, пока до точки ветвления (α1,6-связи) не останется 4 остатка глюкозы.
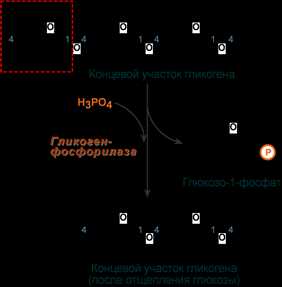
Роль фосфорилазы при мобилизации гликогена
2. α(1,4)-α(1,4)-Глюкантрансфераза – фермент, переносящий фрагмент из трех остатков глюкозы на другую цепь с образованием новой α1,4-гликозидной связи. При этом на прежнем месте остается один остаток глюкозы и «открытая» доступная α1,6-гликозидная связь.
3. Амило-α1,6-глюкозидаза, («деветвящий» фермент) – гидролизует α1,6-гликозидную связь с высвобождением свободной (нефосфорилированной) глюкозы. В результате образуется цепь без ветвлений, вновь служащая субстратом для фосфорилазы.
Роль ферментов в расщеплении гликогена
Синтез гликогена
Гликоген способен синтезироваться почти во всех тканях, но наибольшие запасы гликогена находятся в печени и скелетных мышцах. Накопление гликогена в мышцах отмечается в период восстановления после нагрузки, особенно при приеме богатой углеводами пищи. В печени синтез гликогена происходит только после еды, при гипергликемии. Это объясняется особенностями печеночной гексокиназы (глюкокиназы), которая имеет низкое сродство к глюкозе и может работать только при ее высоких концентрациях, при нормальных концентрациях глюкозы в крови ее захват печенью не производится.
Непосредственно синтез гликогена осуществляют следующие ферменты:
1. Фосфоглюкомутаза – превращает глюкозо-6-фосфат в глюкозо-1-фосфат;
2. Глюкозо-1-фосфат-уридилтрансфераза – фермент, осуществляющий ключевую реакцию синтеза. Необратимость этой реакции обеспечивается гидролизом образующегося дифосфата;

Реакции синтеза УДФ-глюкозы
3. Гликогенсинтаза – образует α1,4-гликозидные связи и удлиняет гликогеновую цепочку, присоединяя активированный С1 УДФ-глюкозы к С4 концевого остатка гликогена;
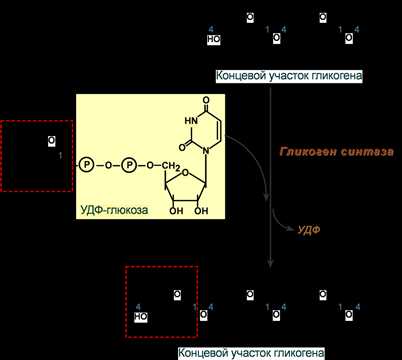
Химизм реакции гликогенсинтазы
4. Амило-α1,4-α1,6-гликозилтрансфераза,»гликоген-ветвящий» фермент – переносит фрагмент с минимальной длиной в 6 остатков глюкозы на соседнюю цепь с образованием α1,6-гликозидной связи.
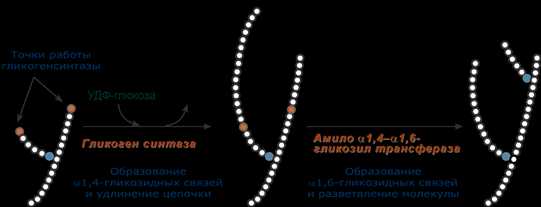
Роль гликогенсинтазы и гликозилтрансферазы в синтезе гликогена
biokhimija.ru
причины, симптомы, диагностика и лечение
Гликогенозы – наследственные болезни, в основе которых лежит генетический дефект производства ферментов, принимающих участие в метаболизме углеводов. Характерный общий признак – чрезмерное отложение гликогена в миоцитах, гепатоцитах и других клетках организма. Гликогенозы проявляются симптомами гипогликемии, гепатомегалии, мышечной слабости, печеночной, сердечной, дыхательной и почечной недостаточности. Диагностика включает биохимический анализ крови, морфологическое исследование биопсийного материала мышц и печени, определение активности ферментов, молекулярно-генетические тесты. Лечение основано на лечебном питании, медикаментозной коррекции метаболических расстройств, в ряде случаев требуются операции.
Общие сведения
Исследование гликогенозов ведется с 1910 года. В 1928-29 годах была описана симптоматика гликогеноза I типа – «болезни накопления гликогена». Лишь в 1952 году удалось выявить ферментный дефект и установить его связь с развитием симптомов. Патогенетические механизмы и способы лечения до сих пор остаются не до конца изученными. К настоящему времени выделено 12 типов гликогенозов, наиболее полно исследовано 9. Распространенность низкая, в среднем составляет 1 случай на 40-68 тысяч населения. Эпидемиологические показатели одинаковы среди представителей обоих полов, но при X-рецессивном наследовании мужчины болеют чаще. Симптомы проявляются в период новорожденности или в раннем детстве, течение чаще непрерывно прогрессирующее.
Гликогенозы
Причины гликогенозов
Единственным фактором, провоцирующим развитие гликогеновых болезней, является генетический дефект, в результате которого возникает недостаточность определенного фермента, участвующего в обмене глюкозы. Все гликогенозы за исключением IX типа наследуются по аутосомно-рецессивному принципу. Это означает, что мутационный ген расположен на хромосоме, не сцепленной с полом, проявление заболевания возможно только при наследовании мутаций от каждого из родителей – при наличии двух рецессивных измененных генов в аллели. Если дефектным является один ген из пары, то другой – доминантный, нормальный – обеспечивает организм достаточным количеством фермента. Человек при этом становится носителем гликогеноза, но не болеет. В парах, где оба партнера – носители, вероятность рождения больного ребенка составляет 25%. При гликогенозе типа IX патологический ген локализован в половой X-хромосоме. Гемизиготные мужчины имеют пару XY, всегда больны гликогенозом, передают дефект всем своим дочерям. Вероятность передачи мутации от женщины-носительницы детям обоих полов составляет 50%.
Патогенез
Патогенетическая основа всех гликогенозов – невозможность процесса синтеза и распада гликогена, его накопление в тканях. Гликоген является единственным резервным полисахаридом организма, своеобразным энергетическим «депо» – после приема пищи излишек глюкозы превращается в гликоген печени и мышц, затем постепенно расщепляется обратно до глюкозы. Благодаря этому механизму поддерживается стабильный уровень сахара в плазме крови, клетки и ткани организма непрерывно обеспечиваются энергией. При агликогенозе (0 тип) – отсутствует фермент гликогенсинтетаза, ответственная за производство гликогена. Пациенты страдают от тяжелой гипогликемии.
При гликогеновых болезнях типов 1-11 возникает генетически обусловленная недостаточность какого-либо фермента, катализирующего цепочку глюкоза-гликоген-глюкоза. 1 тип характеризуется дефектом глюкозо-6-фосфатазы и глюкозо-6-фосфаттранслоказы, 2 тип – альфа-1,4-глюкозидазы, 3 тип – амило-1,6-глюкозидазы, 4 тип – D-1,4-глюкано-α-глюкозилтрансферазы, 5 тип – гликогенфосфорилазы миоцитов, 6 тип – крахмалфосфорилазы гепатоцитов, 7 тип – фосфоглюкомутазы, 8 тип – фосфофруктомутазы, 9 тип – киназы фосфорилазы гепатоцитов. Из-за сниженной активности или полного отсутствия фермента гликоген накапливается в мышцах, печени, редко – в других тканях. Изменяется структура и функциональность органов, развиваются различные формы органной недостаточности.
Классификация
С учетом ферментативного дефекта и особенностей клинических проявлений выделяют 12 вариантов гликогенозов, от 0 до XI. Кроме того, описаны случаи комбинированных типов, когда определяется дефицит двух ферментов, а также случаи неидентифицируемых типов, при которых выделить ферментный дефект не удается. Согласно ведущему патогенетическому механизму гликогеновые болезни подразделяются на три больших группы:
- Печеночные. Включают гликогенозы всех типов, кроме II, V и VII. Гликоген откладывается преимущественно в гепатоцитах. Характерна гепатомегалия, гипогликемия через 2 часа после поступления углеводов. При I типе заболевания также поражаются почки, при III и IV типах развиваются миопатии.
- Мышечные. В данную группу входят болезни типов VII и V. Изменена ферментативная активность в мышечной ткани, нарушено энергообеспечение мышц. Типичные симптомы – миалгии, судороги.
- Смешанные. Гликогеноз II типа отличается тем, что в патологический процесс вовлекаются все гликогенсодержащие ткани. Гликоген скапливается в лизосомах и цитоплазме клеток. Страдают многие органы, возрастает риск смерти по причине сердечной или дыхательной недостаточности.
Симптомы гликогенозов
Агликогеноз развивается в периоде новорожденности либо раннего детства. Низкое содержание гликогена в печени проявляется резко выраженной гипогликемией натощак. Наблюдается заторможенность, глубокий сон, потеря сознания, бледность кожи, тошнота, рвота, судороги ночью и в утренние часы. Внешне пациенты низкорослые, имеют пониженную плотность костной ткани, повышенный риск переломов. При болезни Гирке (I тип) симптомы дебютируют в первые 4 месяца жизни. Характерен плохой аппетит, приступы рвоты, недостаток веса, увеличение печени, диспропорциональность строения тела – круглое лицо, большой живот, тонкие конечности.
Клинические признаки болезни Помпе (II тип) определяются в течение нескольких недель после рождения. Дети вялые, малоподвижные, с ослабленным сосательным рефлексом, сниженным аппетитом. Гепатомегалия изменяет пропорции тела – живот увеличивается, руки и ноги остаются тонкими. Поражается сердце, легкие, нервная система. Высок риск сердечной и легочной недостаточности. У пациентов с болезнью Форбса (III тип) симптомы слабой и умеренной выраженности. На первый план выходит гипогликемия постабсорбционного периода, гепатомегалия, накопление подкожного жира в области туловища. Ведущие симптомы болезни Андерсена (IV тип)– мышечная слабость, плохая переносимость физической нагрузки, судороги.
Болезнь Томсона представлена гепатомегалией, нистагмом, атаксией, прогрессирующими неврологическими нарушениями с мышечной гипертонией, децеребрацией. Типичные проявления болезни Мак-Ардля (V тип) – боли, спазматические сокращения, чрезмерная утомляемость и слабость мышц даже после незначительной нагрузки. Иногда тонические судороги переходят в генерализованные, что сопровождается общей скованностью. Проявления болезни Герса (VI тип) менее выраженные, пациенты способны переносить легкие и умеренные физические нагрузки, не испытывая дискомфорта. Дополнительно обнаруживаются признаки поражения печени – угнетение аппетита, рвота, тошнота, боли в правом боку.
Течение болезни Таруи (VII тип) включает непереносимость физической нагрузки, сопровождающуюся тошнотой и рвотой, болезненными спазмами мышц. Поступление глюкозы не повышает способность совершать физические действия. После употребления пищи симптомы обостряются. Наиболее мягкое течение свойственно болезни Хага (IX тип). У больных детей увеличивается печень, задерживается моторное развитие и рост, формируется мышечная гипотония. С возрастом симптомы самостоятельно редуцируются. Гликогеноз X типа крайне редок, характеризуется гепатомегалией, при длительном течении снижается переносимость физических нагрузок. Гликогеноз XI типа сопровождается значительным увеличением печени, задержкой роста и физического развития, рахитом. У подростков нередко наблюдается сокращение объема печени, ускорение роста.
Осложнения
При разновидностях гликогенозов, сопровождающихся гипогликемией, существует риск развития гипогликемической комы. Как правило, выраженное снижение уровня глюкозы в крови происходит при пропуске приемов пищи, особенно после ночного сна (пропуск завтрака). Пациенты испытывают головокружение и судороги, теряют сознание. Тяжелые формы мышечных гликогенозов при продолжительном течении и отсутствии терапии приводят к дистрофии скелетных мышц, сердечной недостаточности. Осложнением некоторых печеночных гликогенозов является цирроз печени.
Диагностика
При подозрении на гликогеноз ребенку рекомендуется консультация врача-генетика, педиатра, гастроэнтеролога, гепатолога. В первую очередь специалист собирает анамнез, проводит клинический опрос и осмотр. Поскольку заболевание передается аутосомно-рецессивным способом, семейные случаи выявляют редко. Распространены жалобы на слабость, апатичность ребенка, бледность и желтушность кожи, отказ от еды или повышенный аппетит, трудности пробуждения утром, тремор, судороги. При осмотре врач отмечает увеличение размера печени, выпирание живота, задержку роста, мышечную гипотрофию, специфическое отложение подкожной жировой клетчатки, ксантомы. Лабораторные и инструментальные методы позволяют подтвердить диагноз гликогеноза, исключить врожденный сифилис, токсоплазмоз, цитомегалию, патологии печени, болезнь Гоше, миотонию, прогрессирующую мышечную дистрофию, амиотрофии. К обязательным методам исследований относят:
- Биохимическое исследование крови. По результатам анализа обнаруживается гипогликемия с уровнем глюкозы натощак 0,6-3 ммоль/л, лактатацидоз с концентрацией молочной кислоты 3-10 ммоль/л (кроме гликогеноза 4 типа). Дополнительно выявляется увеличение показателей триглицеридов, общего холестерина, ЛПНП, ЛПОНП, мочевой кислоты, печеночных ферментов.
- Исследование биоптата печени, мышц. При изучении ткани печени наиболее распространенными характеристиками являются повышенное количество гликогена и его глыбчатое распределение в цитоплазме гепатоцитов, иногда – в вакуолизированных ядрах. Определяется выраженная белковая и/или крупно- и мелкокапельная жировая дистрофия гепатоцитов, их некроз, ограниченные очаги фиброза в местах гибели клеток. Возможны признаки цирроза. При мышечных типах болезней исследуется мышечный биоптат, в котором просматриваются субсарколеммальные накопления структурно нормального гликогена.
- Исследование ферментов. Активность ферментов изучается в культуре кожных фибробластов, биоптате мышечной и печеночной ткани, лейкоцитах. При гликогенозах с хроническим медленно прогрессирующим течением снижение функциональности фермента легкое или умеренное. При тяжелом течении фермент отсутствует либо его активность минимальна.
- УЗИ брюшной полости. Отмечается выраженное увеличение печени, особенно левой ее доли. Характерна гиперэхогенность и структурная диффузная неоднородность паренхимы (множественные мелкие гиперэхогенные эхосигналы, распределенные равномерно). В дистальных отделах паренхимы прохождение ультразвука ослаблено. Возможно обнаружение структурно разнообразных печеночных аденом, увеличение размеров почек, селезенки и поджелудочной железы.
Комплекс диагностических исследований подбирается индивидуально в зависимости от возраста пациента и предполагаемого типа гликогеновой болезни. Может потребоваться молекулярно-генетическая диагностика (секвенирование генов с целью выявления мутации), электромиография, ЭХО-КГ, ОАК, коагулограмма.
Лечение гликогенозов
Специфические методы терапии не разработаны. Патогенетическое лечение проводится консервативно, направлено на устранение гипогликемии, метаболического ацидоза, кетоза, гиперлипидемии, коррекцию дисфункции гепатобилиарного комплекса и желудочно-кишечного тракта. При развитии осложнений (серьезном поражении внутренних органов) выполняются хирургические операции. Медицинская помощь пациентам включает следующие направления:
- Диетотерапию. Для минимизации метаболических нарушений составляется индивидуальный план питания. Больным рекомендуется снизить количество жиров, сахарозы, фруктозы и галактозы для уменьшения гиперлипидемии и ацидоза. При первом типе гликогеноза назначается диета с увеличенным потреблением углеводов. В частности, показано употребление сырого кукурузного крахмала с медленной усвояемостью, позволяющей предупредить гипогликемию. При типах 3, 4 и 9 вводится рацион с преобладанием животного белка и дробным питанием.
- Лекарственную коррекцию симптомов. В рамках комплексного лечения применяется кокарбоксилаза для увеличения производства ацетилкофермента А, кортикостероидов и глюкагона для стимуляции глюконеогенеза. Дефицит карнитина компенсируется левокарнитином. При вторичных тубулопатиях, печеночных и билиарных дисфункциях используются желчегонные препараты, гепатопротекторы, липотропные вещества. При признаках ацидоза показаны щелочные растворы внутривенно. При почечной дисфункции, протеинурии – ингибиторы АПФ. При гиперурикемии – аллопуринол. При нейтропении – гранулоцитарный колониестимулирующий фактор.
- Хирургическое лечение. Пациентам с тяжелыми фатальными поражениями печени может потребоваться ортотопическая трансплантация органа. Показанием к операции является цирроз с осложнениями, часто развивающийся при третьем и четвертом типе патологии. В отдельных случаях хирургическое вмешательство целесообразно при аденомах печени с высоким риском трансформации в злокачественную опухоль. Трансплантация почек иногда выполняется больным с хронической почечной недостаточностью.
Прогноз и профилактика
Эффективность терапии, вероятность осложнений и летального исхода зависят от типа патологии. Одни гликогенозы незначительно ухудшают качество жизни больных, компенсируются по мере взросления, другие – не поддаются лечению и неизбежно завершаются смертью. Для снижения риска рождения ребенка с гликогенозом супружеским парам из группы риска – имеющим семейный отягощенный анамнез, детей с подтвержденным диагнозом – требуется медико-генетическое консультирование, пренатальная диагностика.
www.krasotaimedicina.ru
